淋巴细胞体外增殖性反应是衡量机体细胞免疫能力的一个重要测定指标,对研究免疫机理、诊断及药物选择方面具有重要作用[1]。分离获得有活力的淋巴细胞是进行此项研究的先决条件。不同物种淋巴细胞的增殖条件不尽相同,影响淋巴细胞增殖的主要因素有细胞培养时间、培养温度、细胞培养初始密度、胎牛血清浓度及丝裂原的种类和浓度等。目前,关于鲟鱼外周血淋巴细胞的分离和体外增殖条件的研究尚未见报道。
本研究探索了不同浓度Percoll分离液对鲟鱼外周血淋巴细胞的分离效果。分别以植物血凝素(Phytohaemagglutinin,PHA)、刀豆蛋白A(Concanavalin A,ConA)和脂多糖(Lipopolysaccharide,LPS)作为淋巴细胞增殖丝裂原,采用L25(56)五因素五水平正交试验设计[2],用Cell Counting Kit-8法(CCK-8或WST-8)对鲟鱼外周血淋巴细胞的培养时间、培养温度、细胞密度、胎牛血清(Fetal bovine serum,FBS)浓度及丝裂原浓度等因素进行探索性研究,以探讨鲟鱼外周血淋巴细胞增殖性反应的最佳条件,为进行鲟鱼免疫功能的检测及染色体分析等研究奠定基础。
1 材料与方法 1.1 材料健康的小体鲟(Acipenser ruthenus),由北京市水产科学研究所房山十渡国家级鲟鱼良种场提供。
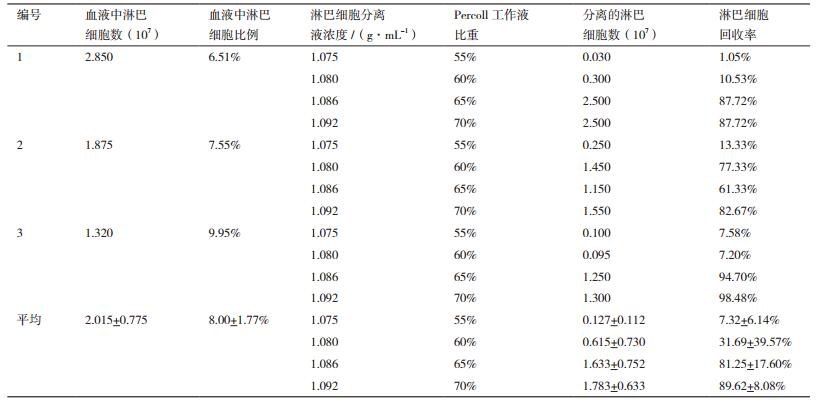
1.2 方法 1.2.1 鲟鱼外周血淋巴细胞的分离用无菌注射器吸取1%灭菌肝素钠溶液,实验鱼尾部消毒后,尾静脉抽血(血液:肝素钠溶液=1:1),将注射器针头灼烧灭菌后,套上针帽,颠倒混匀。分别取55%、60%、65%和70%的Percoll液(比重分别为1.075、1.080、1.086和1.092 g/mL)2 mL于15 mL无菌离心管中,在上面小心加入各4 mL抗凝血(血液:肝素钠溶液=1:1),使用水平转子500×g离心30 min。取中间浑浊含淋巴细胞层加入适量RMPI-1640培养液(含10 000 IU/mL青霉素+10 000 μg/mL链霉素)中。0.4%台盼蓝染色观察细胞活性,吉姆萨染色检测淋巴细胞纯度,光学显微镜下观察并计数。
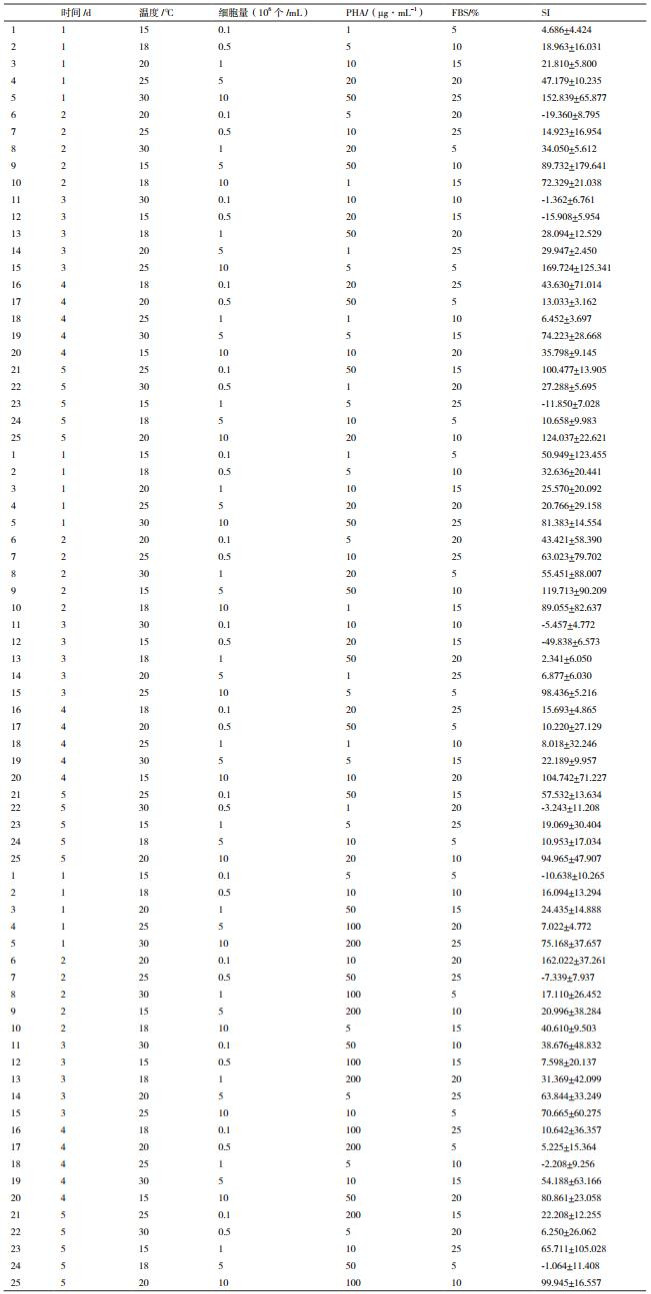
1.2.2 正交试验设计分别选用PHA、ConA、LPS作为淋巴细胞增殖丝裂原,对培养时间、培养温度、细胞密度、胎牛血清浓度及丝裂原浓度这5个水平进行正交试验,采用L25(56)正交试验设计表,具体试验设置见表 1。
按照正交试验设计,在96孔细胞培养板(康宁)中加入100 μL不同的细胞培养液,每个试验组设置4个重复,同时设置空白对照组,置于不同温度的培养箱中进行培养。依照增强型CCK-8试剂盒(碧云天,批号:C0043)使用说明,在每孔中加入10 μL增强型CCK-8溶液,继续孵育2 h,用酶标仪在450 nm测定吸光度(OD值)。
1.2.4 数据处理依据下列公式计算细胞刺激指数(Stimulating index,SI),用来评价淋巴细胞的增殖能力。使用软件Excel和SPSS 19进行数据处理。
SI=(OD试验组-OD对照组)/OD对照组×100%
2 结果 2.1 鲟鱼外周血淋巴细胞的分离水平离心后离心管内液体明显分为4层,包括最上层略偏黄色的血浆层,第2层灰白呈膜状的淋巴细胞富集层,第3层无色透明的淋巴细胞分离液层,以及最下层红色的红细胞堆积层。通过比较不同浓度Percoll液对小体鲟外周血淋巴细胞的分离效果(表 2)发现,70%的Percoll液(比重为1.092 g/mL)的分离效果最佳,淋巴细胞富集层分界面明显,且淋巴细胞回收率最高,平均回收率为89.62±8.08%。
使用70%的Percoll液分离小体鲟外周血淋巴细胞,并用适量RMPI-1640进行稀释,细胞浓度为1.45×107个/mL。0.4%台盼蓝染色观察其中活细胞数为99%以上,吉姆萨染色检测淋巴细胞纯度为98%以上。
2.3 鲟鱼外周血淋巴细胞增殖反应条件的确定分别选用PHA、ConA、LPS作为淋巴细胞增殖丝裂原,对培养时间、培养温度、细胞密度、胎牛血清浓度及丝裂原浓度进行5因素5水平的正交试验,结果见表 3。
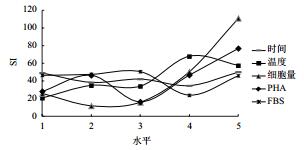
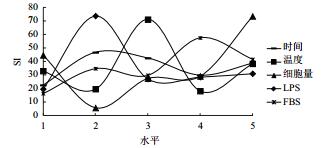
对上述结果进行直观和方差分析,表明PHA、ConA、LPS这3种淋巴细胞增殖丝裂原对鲟鱼外周血淋巴细胞的增殖反应差异不显著。F检验表明细胞量与试验误差之间的差异极显著(P < 0.01)。经极差分析可知,PHA作为丝裂原时,各因素对试验结果影响的主次顺序依次为:细胞量 > PHA > 温度 > FBS > 时间(图 1);ConA作为丝裂原时,各因素对试验结果影响的主次顺序依次为:细胞量 > 时间 > ConA > FBS > 温度(图 2);LPS作为丝裂原时,各因素对试验结果影响的主次顺序依次为:细胞量 > LPS > 温度 > FBS > 时间(图 3)。
|
| 图 1 鲟鱼外周血淋巴细胞在PHA作用下的正交试验结果 |

|
| 图 2 鲟鱼外周血淋巴细胞在ConA作用下的正交试验结果 |
|
| 图 3 鲟鱼外周血淋巴细胞在LPS作用下的正交试验结果 |
综合上述结果,筛选出鲟鱼外周血淋巴细胞体外增殖反应最佳条件为:3.625×106初始细胞量、20 μg/mL的PHA或50 μg/mL的ConA或10 μg/mL的LPS作为丝裂原、10%-20% FBS、20-25℃培养2 d。
3 讨论淋巴细胞参与特异性免疫反应,在免疫应答中起主要作用。鱼类的淋巴细胞是白细胞中数量最多的一类,通常占白细胞总量的90%左右[3]。常见的外周血淋巴细胞分离方法包括自然沉降法和密度梯度离心法,前者具有操作简便、不受仪器设备的限制等优点,但其分离速度慢且获得的淋巴细胞纯度较低;而后者可获得高纯度的淋巴细胞,但需要水平离心机等设备及相应试剂。分离不同物种外周血中的淋巴细胞需要使用不同比重的分离液,如人类为1.077 g/mL、小鼠为1.092 g/mL、猪为1.110 g/mL[4]。陈全震等[5]的研究表明使用1.080-1.085 g/mL的Ficoll-Urografin分离液可将草鱼外周血中的淋巴细胞全部分离出来。谢昆等[6]的研究表明使用1.085 g/mL的淋巴细胞分离液可有效分离鲫鱼、鲤鱼和草鱼的外周血淋巴细胞。本研究发现70% Percoll液(比重1.092 g/mL)具有更好的分离效果,淋巴细胞富集层分界面明显,且淋巴细胞回收率最高,是进行鲟鱼外周血淋巴细胞分离的理想介质。
用于检测淋巴细胞增殖的方法主要有形态学方法、H-胸腺嘧啶核苷(3H-TdR)掺入法、MTT法和CCK-8法等。形态学方法简便易行,但其重复性和客观性较差,不适用于大量样本的检测;3H-TdR掺入法虽然灵敏度高、特异性强、稳定性好,但操作步骤多,且存在放射性危害;MTT法因具有简便、经济、安全等特点而被广泛使用,但其操作较繁琐,需加入DMSO溶解甲臜晶体,可能遇到颗粒不完全溶解且在吸取上清的操作中也极易带走部分细胞,导致结果稳定性和重复性较差[7]。CCK-8法(Cell counting Kit-8)是一种基于WST-8而广泛应用于细胞增殖和细胞毒性的快速、高灵敏度检测的试剂盒[8]。该方法已经成功用于鸡[9]、小鼠[10]和人[11]等的淋巴细胞增殖试验中,但在鱼类淋巴细胞增殖研究中的应用还比较少见。本研究表明增强型CCK-8试剂盒同样适用于对鲟鱼淋巴细胞增殖进行测定。
与哺乳动物类似,鱼类淋巴细胞有T淋巴细胞和B淋巴细胞等类型,其中T淋巴细胞主要介导细胞免疫并在免疫应答中起调节作用,而B淋巴细胞在体液免疫中参与抗体的合成[3]。常用的引起淋巴细胞增殖性反应的有丝分裂原有PHA、ConA和LPS等,其中PHA和ConA可促进T淋巴细胞分裂,LPS可促进B淋巴细胞分裂[12]。大量研究表明,不同丝裂原对不同鱼类淋巴细胞体外增殖的刺激效果不同,如PHA适用于鲤鱼[13]和罗非鱼[14]等的淋巴细胞增殖,ConA适用于虹鳟[15]、牙鲆[16]和石鲽[17]等的淋巴细胞增殖,LPS适用于半滑舌鳎[18]等的淋巴细胞增殖。本研究中分别使用PHA、ConA和LPS作为丝裂原,并采用了3个L25(56)正交试验表对3种丝裂原的培养浓度、细胞培养时间、培养温度、细胞培养初始密度和胎牛血清浓度这5个对淋巴细胞体外培养影响较大的因素进行分析,获得了鲟鱼外周血淋巴细胞体外增殖的最佳条件为:3.625×106初始细胞量、20 μg/mL的PHA或50 μg/mL的ConA或10 μg/mL的LPS作为丝裂原、10%-20%胎牛血清(FBS)、20-25℃培养2 d。
4 结论本研究以小体鲟为研究对象,以70%的Percoll液(比重为1.092 g/mL)作为淋巴细胞分离液的分离效果最佳。分别使用PHA、ConA和LPS作为丝裂原,获得鲟鱼外周血淋巴细胞体外增殖的最佳条件为:3.625×106初始细胞量、20 μg/mL的PHA或50 μg/mL的ConA或10 μg/mL的LPS作为丝裂原、10%-20%胎牛血清(FBS)、20-25℃培养2 d。
| [1] |
杨汉春. 动物免疫学[M]. 第2版. 北京: 中国农业出版社, 2004.
|
| [2] |
刘瑞江, 张业旺, 闻崇炜, 等. 正交试验设计和分析方法研究[J]. 实验技术与管理, 2010, 27(9): 52-55. |
| [3] |
林浩然. 鱼类生理学[M]. 第1版. 广州: 中山大学出版社, 2011.
|
| [4] |
张素华, 林丹丹, 张美娟, 等. Ficoll密度梯度离心法分离猪外周血单个核细胞条件的探讨[J]. 中国血吸虫病防治杂志, 2007, 19(3): 192-195. |
| [5] |
陈全震, 李亚南, 邵健忠. 鱼类外周血淋巴细胞的分离技术[J]. 中国水产科学, 1999, 6(4): 10-12. |
| [6] |
谢昆, 黄民昆. 鱼类外周血淋巴细胞的分离和体外培养[J]. 黑龙江畜牧兽医, 2011(3): 138-142. |
| [7] |
Mosmann T. Rapid colorimetric assay for cellular growth and survival: Application to proliferation and cytotoxicity assays[J]. Journal of Immunological Methods, 1983, 65(1-2): 55-63. DOI:10.1016/0022-1759(83)90303-4 |
| [8] |
Tominaga H, Ishiyama M, Ohseto F, et al. A water-soluble tetrazolium salt useful for colorimetric cell viability assay[J]. Analytical Communications, 1999, 36(2): 47-50. DOI:10.1039/a809656b |
| [9] |
刘素贞, 曹晓敏, 等. 应用CCK8法检测鸡淋巴细胞活性的检测最佳条件研究[J]. 黑龙江畜牧兽医, 2017(13): 212-214. |
| [10] |
王园园, 谭小燕, 胡明华, 等. CCK-8法检测小鼠淋巴细胞增殖的条件探讨[J]. 药物评价研究, 2017, 40(2): 206-209. |
| [11] |
张娜, 封颖璐. 刀豆球蛋白A刺激对人外周血T淋巴细胞的增殖作用[J]. 临床医学工程, 2016, 23(2): 155-157. |
| [12] |
肖克宇. 水产动物免疫与应用[M]. 第1版. 北京: 科学出版社, 2007.
|
| [13] |
耿波, 梁利群, 孙效文. 鲤鱼血淋巴细胞培养及染色体制备条件探索[J]. 水产学杂志, 2003, 16(2): 32-34. |
| [14] |
曹丽萍, 丁炜东. 半微量全血培养法制备罗非鱼染色体标本的条件探索[J]. 上海海洋大学学报, 2005, 14(4): 457-459. |
| [15] |
Tillitt DE, Giesy JP, Fromm P O. In vitro mitogenesis of peripheral blood lymphocytes from rainbow trout(Salmo gairdneri)[J]. Comparative Biochemistry & Physiology A Comparative Physiology, 1988, 89(1): 25-35. |
| [16] |
朱香萍, 林明敏, 李桢, 等. 牙鲆外周血淋巴细胞的培养及染色体制备条件的探讨[J]. 青岛农业大学学报:自然科学版, 2007, 24(4): 253-256. |
| [17] |
林明敏, 朱香萍, 李美玉, 等. 石鲽外周血细胞的培养及染色体制备条件的探讨[J]. 青岛农业大学学报:自然科学版, 2009, 26(4): 325-329. |
| [18] |
张博, 王贤丽, 杨长庚, 等. 半滑舌鳎血淋巴细胞体外培养及其染色体制备在性别鉴定中的应用[J]. 水生生物学报, 2011, 35(3): 430-435. |