2. 西南民族大学生命科学与技术学院,成都 610041
2. College of Life Science and Technology, Southwest Minzu University, Chengdu 610041
牦牛主要分布于青藏高原及其毗邻地区,因其对高寒、低氧条件的独特适应性而闻名于世。由于其他畜种不能适应这样极端的气候条件,牦牛成为青藏高原不可替代的主导畜种,提供的乳、肉、毛和皮等畜产品,是青藏高原人民赖以生存的生活资料和生产资料。牦牛为季节性繁殖的动物,发情季节主要集中在6-10月,繁育性能低下,多介于两年一胎和五年两胎之间,年均0.45胎[1],而黄牛是全年发情的家畜,其发情配种繁殖基本不受季节影响[2]。目前,对牦牛季节性繁殖的分子调控机制知之甚少。
转移抑制素(Kisspeptin)是肿瘤转移抑制基因(KISS-1)编码的多肽,是Lee等[3]在1996年应用消减杂交和差异显示技术对人黑色素瘤细胞株不同转移能力进行研究时发现的,具有抑制肿瘤转移的作用。KISS-1与其同源受体KISS-1R组成的KISS-1/ KISS-1R系统在人、羊及鼠等在下丘脑-垂体-性腺轴(Hypothalamic-pituitary-gonadal axis,HPGA)繁殖机制中调节下丘脑促性腺激素释放激素(GnRH)的释放[4],从而影响促性腺激素促性腺激素(Follicle-stimulating hormone,FSH)与促黄体素(Luteinizing hormone,LH)的分泌和释放,对哺乳动物生殖内分泌起到枢纽作用[5]。卵巢作为促性腺激素的靶器官,其影响雌激素的合成及卵子的发生,从而调控动物的繁殖行为[6]。对季节性休情期的母绵羊用Kisspeptins处理,可以引发LH峰,促进其排卵[7-8],证明Kisspeptins是母绵羊季节性繁殖的关键性因子。在仓鼠[9-10]、欧洲黑鲈[11]等季节性繁殖的生物上的研究也证明Kisspeptins参与其季节性繁殖活动的调节。大脑腹内侧视周核(Anteroventral periventricular nucleus,AVPV)和弓状核(Arcuate nucleus,ARC)是Kisspeptins调节动物繁殖活动的主要作用位点,但目前的研究证明Kisspeptins也能作用于脑垂体、卵巢、输卵管、子宫及胎盘等其他组织器官发挥调控作用[12-13]。因此,本研究以季节性发情的牦牛和常年发情的黄牛为实验对象,通过对KISS-1基因的cDNA克隆、序列分析、组织表达比较分析,旨为探索牦牛KISS-1在其季节性繁殖中的调控作用奠定基础。
1 材料与方法 1.1 材料 1.1.1 实验材料从四川省德阳市向阳屠宰场购得健康成年母牦牛与黄牛各5头,取其下丘脑、垂体、卵巢、输卵管、子宫组织,迅速放入液氮中保存。
1.1.2 主要试剂DNA Marker DL2000、2×Taq PCR Master Mix、DNA凝胶回收试剂盒为上海天根生物科技有限公司产品;Trizol Reagent为Invitrogen产品;大肠杆菌DH5α感受态细胞为康迪生物技术有限公司产品;反转录试剂盒、克隆载体pMD-19 Vector、IPTG、X-Gal、氨苄青霉素(Amp)均为大连宝TaKaRa生物工程有限公司产品;SsoAdvancedTMSYBRGreen Supermix为DBI Bioscience公司产品。
1.1.3 引物设计和合成根据NCBI上已发表的普通牛KISS-1基因序列(XM_867473.4),利用Primer Premier 5设计牦牛KISS-1基因的克隆引物,引物序列见表 1。引物由成都擎科梓熙生物技术有限公司合成。
取牦牛和黄牛的下丘脑、垂体、卵巢、输卵管、子宫组织各0.6 g放入预先用液氮冷却的研钵内,研磨成粉,然后加入Trizol Reagent分别提取总RNA。采用TaKaRa的PrimeScript® RT reagent Kit With gDNA Eraser(DRR047A)试剂盒进行反转录反应,以Oligo dT为引物,合成第一链cDNA,反转录反应程序为37℃ 15 min;85℃ 5 s,然后4℃保存。反转录后,得到的cDNA作为qPCR实验的模板,置于-80℃冰箱备用。
1.2.2 牦牛KISS-1基因的克隆和测序用2%琼脂糖凝胶电泳对PCR产物进行检测并用DNA胶回收试剂盒进行回收。将4.5 μL纯化回收产物、0.5 μL pMD-19Vector和5 μL Solution在16℃的条件下连接2 h。连接后的产物再转化100 μL宿主菌E. coli DH5α感受态细胞过夜,再涂布于含有0.1%的氨苄青霉素(Amp)的LB固体培养基上,涂布至干后于37℃恒温培养12-16 h。最后,用灭菌枪头挑取白色单克隆菌落于含有Amp(浓度为0.1%)的LB液体培养基中震荡培养6-8 h,挑选含目的基因片段的阳性单克隆菌液送至公司进行测序。
1.2.3 实时荧光定量PCR根据已测序得到的牦牛KISS-1的基因序列设计定量引物,引物序列见表 1。对牦牛及黄牛的下丘脑、垂体、卵巢、输卵管和子宫中的KISS-1基因的mRNA表达量进行RT-PCR检测,以GAPDH作为内参基因。反应条件为:95℃预变性2 min;95℃变性10 s,68.5℃退火30 s,65℃延伸5 s;95℃ 5 s;共40个循环。每个样品设置3个重复,并设置阴性对照,取平均值,用2-△△Ct法计算各基因表达量。定量结果用SPSS16.0软件t检验进行物种间差异显著性检验,用方差分析进行组织间差异显著性检验。
1.2.4 KISS-1基因的生物信息学分析利用NCBI(http://www.ncbi.nlm.nih.gov)的BLAST在线工具进行同源性比对分析;利用ORF finder在线软件对牦牛KISS-1基因进行开放阅读框分析并翻译;利用DNAstar、DNAMAN软件对相应物种的KISS-1基因序列进行序列对比和同源性比对;利用MEGA6.0采用邻接(Neighbor joining,NJ)法构建基于KISS-1氨基酸序列的分子系统发育树;利用在线软件ExPASyProtParam(http://web.expasy.org/protparam/)分析推导蛋白质的基本理化性质;利用TMHMM2.0(http://www.cbs.dtu.dk/services/TMHMM/)预测跨膜结构域;利用SignalP 4.0(http://www.cbs.dtu.dk/services/SignalP/)预测信号肽序列。
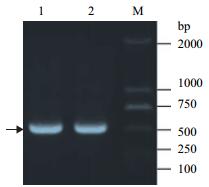
2 结果 2.1 RT-PCR利用RT-PCR方法对KISS-1基因进行扩增,经2%琼脂糖凝胶电泳检测,结果(图 1)显示得到的克隆产物条带(583 bp)与预期目的片段大小相符。
|
| 图 1 KISS-1基因PCR产物电泳检测 M:DNA Marker DL2000;1:牦牛KISS-1基因;2:黄牛KISS-1基因(黑色箭头所指为目的条带) |
利用DNAman对测序结果进行拼接得到与预期相符的片段。序列分析结果显示,KISS-1序列大小为583 bp,其中ORF为408 bp,编码135个氨基酸,5'非翻译区(UTR)为59 bp,3'非编码区UTR为116 bp。推测氨基酸序列(图 2)。并用DNAMAN对其碱基组成进行分析,碱基分析结果显示A=20.00%,C=30.00%,G=32.2%,T=17.80%,X=0.0%,(C+G) > (A+T)。并与NCBI所提供的黄牛KISS-1基因(登录号为xm_867473.4)用DNAMAN进行比较,发现有7个突变位点(表 2)。经分析发现,牦牛的KISS-1与黄牛基因序列的同源性为98.28%,氨基酸的同源性为97.04%。

|
| 图 2 牦牛KISS-1克隆序列及推测氨基酸序列 阴影部分为信号肽 |
Blast发现,牦牛KISS-1基因核苷酸序列与其他物种的同源性较高,其中,与黄牛(XM_867473)KISS-1基因的核苷酸序列同源性最高,为98.3%,但仍有7处碱基差异;其次是与藏山羊(NM_001285710)、绵羊(NM_001306104)的同源性为94.6%、93.1%,有28处碱基差异;再次是与野猪(NM_001134964)的同源性为80.9%;而与褐家鼠(NM_181692)、人(NM_002256)的同源性相对较小,分别为77.5%和70.8%(图 3)。由核苷酸序列推导的氨基酸序列比较可知(图 4),牦牛KISS-1编码的氨基酸序列与黄牛、藏山羊、绵羊、野猪、人、褐家鼠的同源性分别为97.0%、89.6%、85.0%、65.0%、55.0%和51.5%。

|
| 图 3 牦牛及其他6个物种KISS-1基因编码区核苷酸序列比较分析 |

|
| 图 4 牦牛及其他6个物种KISS-1基因氨基酸序列比较分析 |
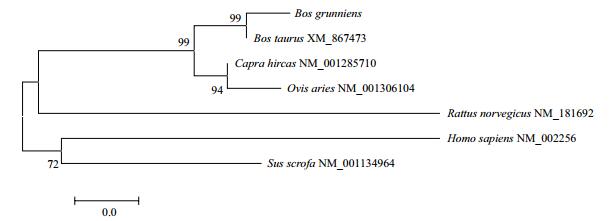
利用Mega6.0对相应物种的KISS-1氨基酸序列进行多序列一致性对比,计算出遗传距离,并构建基因Neighbor-joining(NJ)系统发生树(图 5)。结果表明,在氨基酸进化树中,牦牛与黄牛先聚为一类,再依次与绵羊、藏山羊、褐家鼠聚为一类,最后与野猪、人聚为一类。系统发生树的构建结果与核苷酸、氨基酸同源性比对结果一致,表明牦牛的KISS-1基因与黄牛最为接近。
|
| 图 5 不同物种间基于KISS-1氨基酸序列构建的进化树 |
利用软件ExPASyProtParam分析推导牦牛KISS-1蛋白质的结果显示,其分子质量为47 365.40;理论等电点PI=5.09,说明为酸性蛋白;分子式为C1623H2665N583O667S198,原子总数为573 6;不稳定指数为50.39,属不稳定蛋白;在哺乳动物红细胞中的半衰期为30 h;脂肪系数为15.95,平均亲水系数均为0.893;该蛋白由丙氨酸(Ala)、半胱氨酸(Cys)、甘氨酸(Gly)和苏氨酸(Thr)构成,因此推测为亲水蛋白,且整体不带电。TMHMM2.0 Server程序进行跨膜区预测,结果表明不存在跨膜区域;SignalP 4.0 Server程序预测信号肽,KISS-1含有17个氨基酸的信号肽,位于序列的上游。
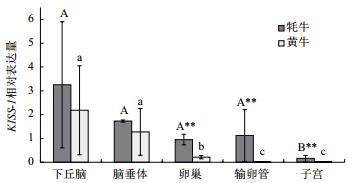
2.6 目的基因组织表达量分析本实验通过实时荧光定量PCR技术,以GAPDH基因为参照(引物序列见表 1),检测KISS-1基因在牦牛和黄牛不同组织间的mRNA表达量,结果(图 6)发现KISS-1基因在两物种的下丘脑、脑垂体、卵巢、输卵管、子宫中均有表达,且在下丘脑中和脑垂体中的表达丰度高。KISS-1基因在下丘脑中和脑垂体中的表达量在两个物种间无显著差异(P > 0.05),但在输卵管、卵巢、子宫中的表达量在两物种间存在极显著差异(P < 0.01)。
|
| 图 6 kiss-1基因在牦牛和黄牛不同组织中的相对表达量 A、B表示牦牛不同组织的表达量差异显著(P < 0.05);a、b、c表示黄牛不同组织的表达量差异显著(P < 0.05);**表示同一组织两物种间表达量差异极显著(P < 0.01) |
本实验选取处于发情期的牦牛和黄牛为研究对象,克隆得到了包含完整编码区KISS-1基因cDNA序列。KISS-1基因编码区长度为408 bp,编码135个氨基酸。与普通牛相比,牦牛存在7处突变位点,其中5个位点的氨基酸发生改变。分子质量为47 365.40,平均亲水系数均为0.893,推测该蛋白具有亲水性,不稳定指数为47.81,属于不稳定蛋白,SignalP 4.0 Server程序预测信号肽,KISS-1含有17个氨基酸的信号肽,位于序列的上游。这些特性与在其它物种的研究结果基本一致[14-16]。本研究中,牦牛的KISS-1基因编码区在核苷酸序列上同源性都在70%以上,而在氨基酸序列上牦牛与黄牛的亲缘关系最近,达97%;其次是藏山羊、野猪等,与褐家鼠的亲缘关系最远。同时通过对KISS-1氨基酸序列构建系统发生树聚类分析也发现,牦牛和黄牛先聚为一支;其次是与绵羊、藏山羊和褐家鼠聚为一支;最后与野猪、人聚为一支。
本研究通过RT-PCR检测KISS-1基因在牦牛和黄牛不同组织的表达水平,结果显示其在下丘脑、垂体、卵巢、输卵管及子宫均有表达,在下丘脑和脑垂体中的表达量最高,而在子宫中表达量最低。KISS-1基因的组织表达特性与KISS-1主要调节下丘脑GnRH[4]及脑垂体FSH和LH的分泌与释放的生理功能相吻合[5]。在绵羊、仓鼠、欧洲黑鲈等物种都已证明,KISS-1基因的表达对季节性繁殖活动具有重要调控作用[7-11]。虽然本研究发现季节性发情的母牦牛与全年发情的黄牛在下丘脑、脑垂体中KISS-1基因表达量无显著差异,但是牦牛样品均采自发情季节,因此,牦牛KISS-1基因表达量在季节性乏情期与发情季节的差异值得进一步研究。目前,已有足够的证据认为kisspeptins作为GnRH脉冲分泌中央调制器,在青春期启动和在人类两性生殖中起着重要的调控作用。研究发现,Kisspeptin与临床上引起不孕的疾病密切相关,如多囊卵巢综合症(PCOS),这是一种代谢异常及内分泌异常的疾病,Jeon等[17]研究发现PCOS患者血清中Kisspeptin水平明显升高;再比如高泌乳素血症,其影响了排卵,导致月经失调和不孕,Charlotte等[18]发现在小鼠中,高泌乳素血症不仅直接抑制Kisspeptin分泌,同时通过阻止GnRH的分泌而有效地阻断卵巢周期性。此外Kisspeptin与其他生殖内分泌疾病也存在相关联系,如KISS-1r基因敲除的小鼠表现出特发性低促性腺激素性腺功能减退症[19],推测Kisspeptin与卵巢功能存在潜在联系。同时,An等[20]在2013年研究发现,KISS-1基因的多态性与山羊的多胎性相关;El-Tarabany等[21]的研究进一步证明,KISS-1基因的多态性通过影响山羊的雌二醇、孕酮等激素的分泌水平而影响山羊的产羔率。但牦牛属于季节性繁殖,而黄牛繁殖则没有明显的季节限制,所以KISS-1基因是否引起牦牛季节性繁育的原因还有待进一步研究。
4 结论本研究首次克隆出牦牛KISS-1基因,编码区长408 bp,编码135个氨基酸;与黄牛KISS-1核苷酸序列有7个位点的差异,其中5个导致氨基酸差异。KISS-1基因在牦牛和黄牛的下丘脑、垂体、卵巢、输卵管和子宫中均有表达,但在下丘脑和脑垂体的表达量高。
| [1] |
张君, 余四九. 高原型牦牛繁育状况及繁殖母牛体况调查[J]. 畜牧与兽医, 2005, 37(8): 21-22. |
| [2] |
杨效民, 张喜忠, 李迎光, 等. 黄牛发情规律观察[J]. 中国牛业科学, 2006, 32(4): 12-15. |
| [3] |
Lee JH, Miele ME, Hicks DJ, et al. KISS-1, a novel human malignant melanoma metastasis-suppressor gene[J]. The Journal of the National Cancer Institute, 1996, 88(23): 1731-1737. DOI:10.1093/jnci/88.23.1731 |
| [4] |
Choe HK, Kim HD, Park SH, et al. Synchronous activation of gonadotropin-releasing hormone gene transcription and secretion by pulsatile kisspeptin stimulation[J]. Proceedings of the National Academy of Sciences of the United States of America, 2013, 110(14): 5677-5682. DOI:10.1073/pnas.1213594110 |
| [5] |
Papaoiconomou E, Msaouel P, Makri A, et al. The role of kisspeptin/GPR54 in the reproductive system[J]. In Vivo, 2011, 25(3): 343-354. |
| [6] |
赖平, 王凭青, 张宝云, 等. 哺乳动物季节性繁殖的神经内分泌调节机制[J]. 遗传, 2012, 34(3): 281-288. |
| [7] |
Caraty A, Smith JT, Lomet D, et al. Kisspeptin synchronizes preovulatory surges in cyclical ewes and causes ovulation in seasonally acyclic ewes[J]. Endocrinology, 2007, 148(11): 5258-5267. DOI:10.1210/en.2007-0554 |
| [8] |
Sebert ME, Lomet D, Said SB, et al. Insights into the mechanism by which kisspeptin stimulates a preovulatory LH surge and ovulation in seasonally acyclic ewes: potential role of estradiol[J]. Domestic Animal Endocrinology, 2010, 38(4): 289-298. DOI:10.1016/j.domaniend.2010.01.001 |
| [9] |
Revel FG, Ansel L, Klosen P, et al. Kisspeptin: a key link to seasonal breeding[J]. Reviews in Endocrine and Metabolic Disorders, 2007, 8(1): 57-65. DOI:10.1007/s11154-007-9031-7 |
| [10] |
Xu L, Xue H, Li S, et al. Seasonal differential expression of KISS-1/GPR54 in the striped hamsters among different tissues[J]. Integrative Zoology, 2017, 12(3): 260-268. DOI:10.1111/inz2.2017.12.issue-3 |
| [11] |
Espigares F, Rocha A, Gómez A, et al. Photoperiod modulates the reproductive axis of European sea bass through regulation of kiss1 and gnrh2 neuronal expression[J]. General and Comparative Endocrinology, 2017, 240: 35-45. DOI:10.1016/j.ygcen.2016.09.007 |
| [12] |
Uenoyam Y, Pheng V, Tsukamura H, et al. The roles of kisspeptin revisited: inside and outside the hypothalamus[J]. Journal of Reproduction and Development, 2016, 62(6): 537-544. DOI:10.1262/jrd.2016-083 |
| [13] |
Cielesh ME, McGrath BM, Scott CJ, et al. The localization of kisspeptin and kisspeptin receptor in the canine ovary during different stages of the reproductive cycle[J]. Reproduction in Domestic Animals, 2017, 52(Suppl. 2): 24-28. |
| [14] |
Cao GL, Chu MX, Fang L, et al. Analysis on DNA sequence of KISS-1 gene and its association with litter size in goats[J]. Molecular Biology Reports, 2011, 38(6): 3839-3848. DOI:10.1007/s11033-010-0499-y |
| [15] |
Chen Y, Liu L, Li Z, et al. Molecular cloning and characterization of kiss1 in Brandt's voles(Lasiopodomys brandtii)[J]. Comparative Biochemistry and Physiology, Part B, 2017, 208-209: 68-74. DOI:10.1016/j.cbpb.2017.04.006 |
| [16] |
Shahi N, Singh AK, Sahoo M, et al. Molecular cloning, characterization and expression profile of kisspeptin1 and kisspeptin1 receptor at brain-pituitary-gonad(BPG)axis of golden mahseer, Tor putitora(Hamilton, 1822)during gonadal development[J]. Comparative Biochemistry & Physiology Part B Biochemistry & Molecular Biology, 2017, 205: 13-29. |
| [17] |
Jeon YE, Lee KE, Jung JA, et al. Kisspeptin, leptin, and retinol-binding protein 4 in women with polycystic ovary syndrome[J]. Gynecol Obstet Invest, 2013, 75(4): 268-274. DOI:10.1159/000350217 |
| [18] |
Sonigo C, Bouilly J, Carré N, et al. Hyperprolactinemia-induced ovarian acyclicity is reversed by kisspeptin administration[J]. The Journal of Clinical Investigation, 2012, 122(10): 3791-3795. DOI:10.1172/JCI63937 |
| [19] |
Wahab F, Atika B, Shahab M. Kisspeptin as a link between metabolism and reproduction: evidences from rodent and primate studies[J]. Metabolism, 2013, 62(7): 898-910. DOI:10.1016/j.metabol.2013.01.015 |
| [20] |
An XP, Ma T, Hou JX, et al. Association analysis between variants in KISS1 gene and litter size in goats[J]. BMC Genetics, 2013, 14(1): 63. DOI:10.1186/1471-2156-14-63 |
| [21] |
El-Tarabany MS, Zaglool AW, El-Tarabany AA, et al. Association analysis of polymorphism in KiSS1 gene with reproductive traits in goats[J]. Animal Reproduction Science, 2017, 180: 92-99. DOI:10.1016/j.anireprosci.2017.03.006 |






