草莓是全世界范围内种植的最重要的水果作物之一。近年来,我国的草莓产业发展十分迅速,随之而来的就是草莓病害,尤其是连续种植所带来的土传病害,对草莓产量影响大,严重时几乎绝产[1]。草莓根腐病是一类土传根部病害的统称,可以导致严重的经济损失。从草莓根腐病的患病根部可以分离出多达20个属的真菌,包括镰刀菌属(Fusarium sp.)、炭疽菌属(Colletotrichum sp.)、丝核菌属(Rhizoctonia sp.)、疫霉菌属(Phytophthora sp.)和拟盘多毛孢菌属(Pestalotiopsis sp.)等[2-3]。由于病原菌多种多样,防治根腐病就是一个难以解决问题,至今没有强有效的方法手段。传统的土壤轮作方法已被证明能有效的控制许多土传疾病,但这种方法很难适应集约化种植系统; 而化学试剂熏蒸的方法出于人类健康及环境的考虑,也逐渐被取代。因此,以微生物制剂为主的生物防治方法将会成为预防草莓根腐病的一种常见手段[4-5]。
目前报道过的根腐病生防菌包括芽孢杆菌(Bacillus)[6]、木霉菌(Trichoderma)[7]、链霉菌(Streptomyces)[8]等,梁银等[9]研究发现利用生防菌与有机肥复配制成生物有机肥,既可以提高土壤肥力,又可以调节土壤微生物区系,减少病原菌数量。越来越多的人将目光聚焦到生防菌的开发利用,具有拮抗功能的菌种资源越丰富,挑选出优良菌株的几率也就越大,而且随着研究的发展,人们更愿意筛选具有多种作用的功能性菌株去制备菌剂,例如同时具备抗病和促生两种作用的菌株[10]。
本文针对当地温室常见的草莓根腐病,从发病草莓根部中分离出两株病原菌-尖孢镰刀菌,并研究前期筛选到的解淀粉芽孢杆菌CM3[11-12]对此病原菌的抑制作用,同时通过盆栽实验探索菌株CM3对根腐病的防治效果,旨在为草莓根腐病的防治提供菌种资源和理论依据。
1 材料与方法 1.1 材料 1.1.1 试验材料供试拮抗菌CM3由山西省农业科学院生物技术研究中心微生物课题组自行鉴定并保存。供试病原真菌炭疽病菌、灰霉病菌、西瓜枯萎病菌、西葫芦枯萎病菌、西葫芦根腐病菌由山西省农业科学院生物技术研究中心微生物课题组保存。
1.1.2 培养基PDA培养基:马铃薯200 g,葡萄糖20 g,琼脂15-20 g,自来水1 000 mL,自然pH。
1.2 方法 1.2.1 病原菌分离鉴定 1.2.1.1 病原菌的分离将发病草莓植株的根部洗净,沥干水分备用。在超净台内选取带有病健交界处的根部,在病变组织处用手术刀切取长度约为5 mm的根段,用75%的酒精浸30 s,再用0.1%升汞水溶液处理3-5 min,而后用无菌水冲洗3次,置于PDA培养基中,28℃条件下培养3-4 d; 菌落直径约为1 cm时,在无菌的条件下用消毒的接种钩挑取菌落边缘的菌丝体,再次接到PDA培养基中央,进行多次的分离纯化,直至菌落生长整齐一致没有杂菌出现。
1.2.1.2 病原菌的鉴定形态鉴定:将分离菌株接种在PDA平板上25℃下培养,观察气生菌丝生长状况、菌落颜色和质地,是否产生孢子和菌核等培养性状。分子生物学鉴定:将分离纯化到的菌株进行18S rDNA、EF-1α(Translation elongation factor 1 alpha)、IGS(Nuclear ribosomal intergenic spacer region)和mtSSU(Mitochondrial small subunit)基因序列测序,其中18S rDNA鉴定是真菌鉴定中常用的方法,后三者则都是镰刀菌分类鉴定中常用基因手段[13-14]。测序后获得的DNA序列在NCBI网站用Blast进行序列比对分析,最后使用软件MEGA 6.0构建系统发育树。
1.2.2 解淀粉芽孢杆菌CM3对尖刀镰孢菌的抑制作用研究 1.2.2.1 解淀粉芽孢杆菌CM3的抑菌谱测定采用平板对峙法,在PDA平板中心接种直径为8 mm的病原菌(包括分离的根腐病病菌FC2016-3和FC2016-7、草莓炭疽病菌、草莓灰霉病菌、西瓜枯萎病菌、西葫芦枯萎病菌和西葫芦根腐病菌),在距菌块3 cm处接种菌株CM3,对照为只接种病原菌的平板,28℃培养3-5 d,重复3次,观察实验结果。
1.2.2.2 解淀粉芽孢杆菌CM3对尖刀镰孢菌的预防效果选择草莓进行盆栽防治实验。盆栽实验使用无菌土,将蛭石和土以1:1比例(w:w)混合,160℃干热灭菌5 h。选取生长一致的草莓匍匐茎幼苗,移栽于处理好的营养钵(10 cm×10 cm)中,缓苗15 d后,对幼苗进行刀片伤根处理(同时设置无伤处理),然后开始进行实验[15]。
实验设置4个处理组,处理组1:接种拮抗菌CM3(浓度为1×108 CFU/mL),48 h后接种病原菌孢子悬液(浓度为1×106 CFU/mL)。处理组2:接种病原菌孢子悬液(浓度为1×106 CFU/mL),48 h后接种拮抗菌CM3(浓度为1×108 CFU/mL)。处理组3:只接种病原菌孢子悬液(浓度为1×106个/mL)。处理组4:只接种拮抗菌CM3(浓度为1×108 CFU/mL)。处理组5:同样量的无菌水。每组10株草莓苗,重复3次。
移栽后对每种作物进行正常的栽培管理,10 d后开始进行病害观察,30 d后进行病害调查以及指标检测。检测指标包括病情指数和防治效果,还有植株的株高、叶片面积、叶柄长和鲜重,其中叶片面积和叶柄长度统计选择草莓心叶外第三片叶子。
草莓根腐病发病程度参考Vestberg等[16]的方法,分为6级:0级为根系未发病; 1级为根系发病率≤30%,叶片正常; 2级为30% < 根系发病率≤60%,叶片正常; 3级为60% < 根系发病率≤80%,叶片变黄; 4级为根系发病率80%以上,叶片枯萎; 5级为整株死亡,叶片干枯。
病情指数计算公式为:
病情指数(DSI)=100×∑(病害的级别×该级别的植株数)/(总株数×病害的最高级别)
防治效果= 100% ×(对照发病指数-处理发病指数)/对照发病指数
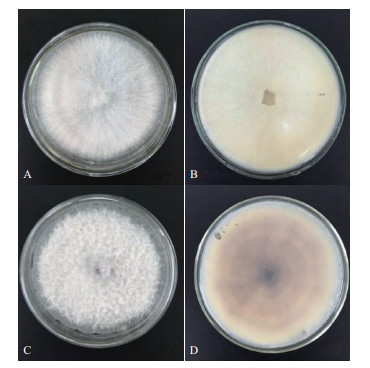
2 结果 2.1 草莓根腐病的病原菌分离与鉴定 2.1.1 病原菌分离及形态鉴定在发病草莓的根部(图 1)分离纯化到了2株病原菌,将其命名为FC2016-3和FC2016-7。菌株FC2016-3在28℃的PDA培养基上,菌落为白色,平均日生长量为12 mm,气生菌细丝绒毛状,为白色,培养基不变色(图 2-A、B)。菌株FC2016-7,菌落为白色,中心处渐渐变为紫色,平均日生长量为11 mm,气生菌丝絮状茂密,培养基背面会变深紫色(图 2-C、D)。

|
| 图 1 发病草莓根部横切图 |
|
| 图 2 菌株FC2016-3和FC2016-7在PDA培养基上生长状态 A、B:菌株FC2016-3正面、背面;C、D:菌株FC2016-7正面、背面 |
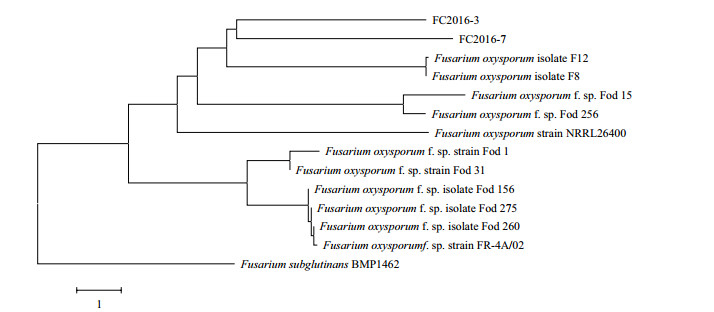
菌株FC2016-3和FC2016-7的18S rDNA、EF-1α、IGS和mtSSU基因序列在GenBank数据库GenBank中分别进行比对发现,两个菌株与尖孢镰刀菌的基因序列同源性都达99%以上,说明分离到的菌株FC2016-3和FC2016-7均为尖孢镰刀菌。每个基因序列分别构建系统发育树(图 3-图 6)。

|
| 图 3 根据2株病原菌18S rDNA基因序列同源性构建的系统发育树 |

|
| 图 4 根据2株病原菌EF-1α基因序列同源性构建的系统发育树 |
|
| 图 5 根据2株病原菌IGS基因序列同源性构建的系统发育树 |

|
| 图 6 根据2株病原菌mtSSU基因序列同源性构建的系统发育树 |
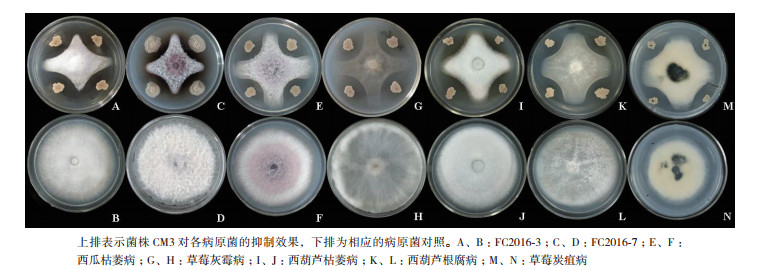
菌株CM3对于根腐病病原菌的抑菌效果见图 7,明显看出CM3对多种常见的土传病害均有良好的效果,尤其是对草莓和瓜类的病害。同时,针对灰霉病这种既可以通过土壤传播又可以通过水、空气等途径传播的病害,菌株CM3同样有抑制作用。说明菌株CM3不仅能防治土壤中的病害,还能制备成喷施微生物制剂进行病害防治。
|
| 图 7 拮抗菌CM3对多种病原菌的抑制效果 上排表示菌株CM3对各病原菌的抑制效果,下排为相应的病原菌对照。A、B:FC2016-3;C、D:FC2016-7;E、F:西瓜枯萎病;G、H:草莓灰霉病;I、J:西葫芦枯萎病;K、L:西葫芦根腐病;M、N:草莓炭疽病 |
根据分离病原菌的出现频率及生长状态,选择病原菌FC2016-7进行盆栽防治实验,在接种7 d后草莓叶片边缘开始变色,15 d地上茎部开始变色,逐渐干枯,30 d后地上植株完全干枯。此时将草莓根部小心拨出,洗去附着在根系的泥土,发现有70%的根系完全变黑,剩余没有完全变黑的根上存在黑褐色的病斑; 切开根茎部发现其内部变色明显(图 8),与健康根部比较几乎全部变色,有1/3的部分已经变成了深红褐色,病情与在大田中发现的病株一致。对此病根进行分离,仍可分离出病原菌FC2016-7。

|
| 图 8 盆栽实验草莓根部图 A:健康根部和发病根部的对比;B:健康根部的横切图;C:发病根部的横切图 |
从表 1中看出,尖孢镰刀菌FC2016-7对于草莓的致病性较强,处理组3的病情指数达到了58.57%,各项指标均显著低于对照水平。先接种病原菌后接种CM3的处理组1的病情指数为44.33%,防治效果达到了37.14%,但是植株生长状态明显受到了抑制,各项指标均低于对照组,但是仍好于只接种病原菌的处理组3;而先接种CM3后接种病原菌的处理组2,病情指数则降低到了26.09%,防治效果可以达到64.86%,草莓的生长状态要优于处理1,几乎和对照组持平。说明只要预先用菌株CM3对栽培基质进行处理,就能够达到预防病原菌FC2016-7的效果,否则会影响其防治效果。
从促进生长的角度来看,只用菌株CM3处理的处理组4可以促进草莓生长。株高、根部鲜重和地上鲜重比对照组有显著提高,分别提高了17.51%、16.08%、9.06%;叶柄长度和叶面积的增加则不显著。说明解淀粉芽孢杆菌CM3不仅有防治病原菌的能力,还有一定的促生长能力,十分适合作为微生物制剂进行开发利用。
3 讨论研究植物病害首先就要进行病原菌的分离鉴定,使用分子技术对病原菌进行鉴定已经成为一种常用、快速、灵敏且准确可靠的手段[17-18]。本研究根据2个菌株的18S rDNA、EF-1α、IGS和mtSSU 4个基因序列的分析结果,再结合病原菌的形态特征,将分离到的菌株FC2016-3和FC2016-7确定为尖孢镰刀菌,结果准确可信。盆栽实验显示,菌株FC2016-7的致病性较强,发病率能够达到80%,病情指数也高达58.57%。张阳等[19]从草莓根腐病株中分离到41个菌株,通过形态学、分子生物学手段对菌株的分类地位进行了鉴定发现,尖孢镰刀菌占菌株总量的9.75%,并且其致病力较强,可达90%。比较蛋白质组学分析发现[20],不同毒力的尖孢镰刀菌株的蛋白质组是有显著性差异的,部分蛋白仅仅存在于高毒力菌株中,还有一些蛋白质在高毒力菌株中的含量较高,这些蛋白质主要与菌株的代谢、抗氧化、电子传递、细胞周期和转录活动有关。
解淀粉芽孢杆菌CM3本实验室在前期研究中筛选到的一株有抑菌效果的菌株,可以有效的预防草莓灰霉病和番茄灰霉病的发生,抑菌成分有稳定的性能及较强的环境适应性。本研究发现菌株CM3同样可以抑制土传病害的病原菌,如根腐病、枯萎病和炭疽病; 盆栽实验也显示其能够有效的防治尖孢镰刀菌引起的根腐病的发生,防治效果达到了64.86%,而且越早加入,防治的效果会越好; 同时也发现菌株CM3可以促进草莓植株的生长发育,株高、根鲜重以及地上鲜重分别提高了17.51%、16.08%、9.06%。Shen等[4]证实吸水链霉菌BOF-B04可以显著增加草莓植物的鲜重并且降低根腐病的发生率,盆栽防治效果达到了63.35%;同时菌株也改变了微生物根际土壤的群落结构,土壤中的真菌数量显著减少,比对照组降低了82.43%。
在整个植物发育阶段,由于土壤环境的复杂性,只具有单一功能的微生物已经无法满足实际生产的需求,所以许多学者开始关注具有多种功能的有益微生物。这类微生物会产生抗生素,通过与病原菌竞争营养物质或诱导宿主植物的系统性抗性来抵抗病原菌; 还可能生产植物激素,通过促进植物根部对养分的吸收而达到促进植物生长的能力[21]。Mukta等[22]发现两株植物益生菌链霉菌Stenotrophomonas Bph-4和苍白杆菌Ochrobacterum BTLK6a均可以显著增加草莓果实产量,与对照组相比分别增加了56%和43%,进一步研究揭示了它们不仅可以分泌生长激素吲哚乙酸,同时也能分析抗生素抑制致病微生物的生长。梁晓琳等[23]将Bacillus amyloliquefaciens SQR9制成了复合微生物肥料进行实验发现,复合微生物肥料集化肥速效、有机肥长效和生物肥增效等优势为一体,能明显促进番茄的生长,在总养分100 g/kg和140 g/kg施肥水平下,番茄增产幅度分别达37.73%和44.77%。
本实验中解淀粉芽孢杆菌CM3不仅可以防治草莓根腐病的发生,也促进了草莓植株的生长,综合前期研究积累,可以说菌株CM3是一株多功能微生物菌株,满足了开发微生物制剂的条件,可以将其应用于草莓土传病害的生物防治中。若能将其开发成新型微生物复合肥料,不仅可以提供作物生长所需的全面营养,促进植物生长,提高其抗逆性,免受病原菌的侵害,还能改善土壤结构,增加肥力,改善农产品的品质,提高产量。同时,能达到减少化肥用量,保护生态环境的效果。
4 结论本研究从草莓根腐病根部分离到了2株病原菌,根据18S rDNA、EF-1α、IGS和mtSSU 4个基因序列的分析结果和菌株形态特征,将这两株菌株鉴定为尖孢镰刀菌,分别命名为FC2016-3和FC2016-7。解淀粉芽孢杆菌CM3对菌株FC2016-3和FC2016-3在内的多株土传病害病原菌有明显的抑制作用。盆栽实验结果显示,菌株CM3对尖孢镰刀菌FC2016-7引起的草莓根腐病有良好的生物防治效果,防治效果分别为64.86%,同时也发现菌株CM3可以促进草莓植株的生长发育,株高、根鲜重以及地上鲜重分别提高了17.51%、16.08%、9.06%。
| [1] |
钟珊, 张涛, 杨俊, 等. 草莓丝核菌根腐病的病原菌鉴定[J]. 植物病理学报, 2016, 46(3): 289-293. |
| [2] |
Mass JL. Compendium of strawberry diseases(in Chinese)[M]. Second Edition. Beijing: China Agricultural Press, 2012.
|
| [3] |
陈哲, 黄静, 赵佳, 等. 草莓红中柱根腐病的研究进展[J]. 生物技术通报, 2017, 33(3): 37-44. |
| [4] |
Shen T, Wang C, Yang H, et al. Identification, solid-state fermentation and biocontrol effects of Streptomyces hygroscopicus B04 on strawberry root rot[J]. Appl Soil Ecol, 2016, 103: 36-43. DOI:10.1016/j.apsoil.2016.02.016 |
| [5] |
陈皓, 徐野. 草莓炭疽病和根腐病的综合防治措施[J]. 吉林蔬菜, 2015(12): 32-32. |
| [6] |
雷白时, 王笑颖, 姜军坡, 等. 草莓根腐病生防芽孢杆菌的筛选鉴定与盆栽防效试验[J]. 河北农业大学学报, 2016, 39(3): 19-22. |
| [7] |
张鹤, 杜国栋, 宋亚楠, 等. 防治草莓根腐病的木霉菌筛选、鉴定及其防病效果[J]. 沈阳农业大学学报, 2015(6): 654-660. |
| [8] |
沈婷, 张园园, 王辰, 等. 白刺链霉菌(Streptomyces albospinus)CT205菌株固体发酵及防控草莓根腐病的研究[J]. 南京农业大学学报, 2015, 38(4): 596-601. DOI:10.7685/j.issn.1000-2030.2015.04.011 |
| [9] |
梁银, 张谷月, 王辰, 等. 一株拮抗放线菌的鉴定及其对黄瓜枯萎病的生防效应研究[J]. 土壤学报, 2013, 50(4): 174-181. |
| [10] |
孙广正, 姚拓, 侯栋, 等. 西葫芦根腐病菌拮抗细菌的防病促生作用[J]. 微生物学通报, 2017, 44(5): 1121-1130. |
| [11] |
黄静, 赵佳, 陈哲, 等. 抗草莓灰霉病的芽孢杆菌CM3的分离与筛选[J]. 北方园艺, 2016(11): 113-116. |
| [12] |
陈哲, 梁宏, 黄静, 等. 解淀粉芽孢杆菌CM3培养基及发酵条件优化[J]. 山西农业科学, 2016, 44(11): 1577-1583. DOI:10.3969/j.issn.1002-2481.2016.11.01 |
| [13] |
曾莉莎, 郑芝波, 吕顺, 等. 荷花腐败病病原菌的形态学与多基因分子系统学鉴定[J]. 植物病理学报, 2017, 47(2): 162-173. |
| [14] |
Zhu Z, Zheng L, Pan L, et al. Identification and characterization of Fusarium species associated with wilt of Eleocharis dulcis(Chinese water chestnut)in China[J]. Plant Disease, 2014, 98(7): 977-987. DOI:10.1094/PDIS-08-13-0805-RE |
| [15] |
方中达. 植病研究方法[M]. 北京: 中国农业出版社, 2007, 124-125.
|
| [16] |
Vestberg M, Kukkonen S, Saari K, et al. Microbial inoculation for improving the growth and health of micropropagated strawberry[J]. Appl Soil Ecol, 2004, 27(3): 243-258. DOI:10.1016/j.apsoil.2004.05.006 |
| [17] |
陈哲, 黄静, 赵佳, 等. 番茄灰霉病病原菌分离鉴定及拮抗菌筛选[J]. 生物技术通报, 2017, 33(8): 81-87. |
| [18] |
Aviles M, Bascón J, Gallardo MA, et al. New foci of strawberry Fusarium wilt in Huelva(Spain)and susceptibility of the most commonly used cultivars[J]. Sci Hortic, 2017, 226: 85-90. DOI:10.1016/j.scienta.2017.08.034 |
| [19] |
张阳, 刘正坪, 魏艳敏, 等. 北京昌平地区草莓根腐病菌种类鉴定[J]. 中国农学通报, 2015, 31(18): 278-284. DOI:10.11924/j.issn.1000-6850.casb15010243 |
| [20] |
Fang X, Barbetti MJ. Differential protein accumulations in isolates of the strawberry wilt pathogen Fusarium oxysporum f. sp. fragariae differing in virulence.[J]. J Proteomics, 2014, 108: 223-237. DOI:10.1016/j.jprot.2014.05.023 |
| [21] |
Tabassum B, Khan A, Tariq M, et al. Bottlenecks in commercialisa-tion and future prospects of PGPR[J]. Appl Soil Ecol, 2017, 121: 102-117. DOI:10.1016/j.apsoil.2017.09.030 |
| [22] |
Mukta JA, Rahman M, Sabir AA, et al. Chitosan and plant probiotics application enhance growth and yield of strawberry[J]. Biocatalysis & Agricultural Biotechnology, 2017, 11: 9-18. |
| [23] |
梁晓琳, 孙莉, 张娟, 等. 利用Bacillus amyloliquefaciens SQR9研制复合微生物肥料[J]. 土壤, 2015, 47(3): 558-563. |





