玉米褪绿斑驳病毒(Maize chlorotic mottle virus,Mcmv)是我国重要的对外检疫性病毒[1],隶属番茄丛矮病毒科(Tombusviridae)玉米褪绿斑驳病毒属(Machlomovirus),是该科属的唯一成员[2]。Mcmv于1974年首次在秘鲁被报道[3],目前在阿根廷、巴西、墨西哥、美国等美洲国家,泰国、中国等亚洲国家以及肯尼亚、刚果等非洲国家均有分布,对玉米产业构成严重威胁[4-6]。Mcmv单独侵染会导致玉米产量降低10%-15%[7]。当它与玉米矮花叶病毒(Maize dwarf mosaic virus,Mdmv)、甘蔗花叶病毒(Sugarcane mosaic virus,Scmv)或小麦线条花叶病毒(Wheat streak mosaic virus,Wsmv)等马铃薯Y病毒科(Potyviridae)病毒复合侵染时发生协生作用,引起严重的玉米病毒病害——玉米致死性坏死病(Maize lethal necrosis disease,Mlnd),致使玉米产量损失高达90%[8-9]。本文综述了Mcmv的生物学特性、分布与危害、鉴定与检测、基因组结构与功能等方面的研究进展,并对其防治策略进行探讨,以期为Mcmv的深入研究和综合防治提供理论指导。
1 Mcmv的生物学特性 1.1 形态特征Mcmv病毒粒子由外壳蛋白(Capsid protein,CP)及其包裹的单链正义RNA(Single-stranded positive-sense RNA,ssRNA)构成[10]。病毒粒子呈二十面体结构,其外壳由180个蛋白结构亚基组成[11-12]。病毒粒子直径约30 nm,相对分子质量6.1×106,其中核酸占18%[11-12]。标准沉降系数S20W=109 S,在氯化铯溶液中的浮力密度为1.365 kg/L,在从感病玉米分离的汁液中钝化温度为85-90℃[12]。
1.2 寄主及致病症状玉米[13]、甘蔗(Saccharum officinarum)[14]和石茅(Sorghum halepense)[13]等是Mcmv的自然寄主。Mcmv不能侵染双子叶植物,但能侵染多种单子叶(仅限于禾本科)植物[4]。Bockelman等[15]对44种禾本科植物的测试结果显示,大麦(Hordeum vulgare)、小麦(Triticum aestivum)、粟(Setaria italica(L.)Beauvois)、黍(Panicum miliaceum)、高粱(Sorghum bicolor)等19种植物可被Mcmv侵染,是Mcmv的实验寄主。
Mcmv单独侵染玉米主要导致叶片褪绿斑驳和植株生长略微缓慢等轻微症状[16]。当它与Mdmv、Scmv或Wsmv等马铃薯Y病毒科病毒复合侵染时可导致严重的玉米病害Mlnd[8-9]。Mlnd在玉米的不同生长时期发生,表现症状也不一样。当Mlnd在玉米幼苗期发生时,会引起叶片褪绿斑驳,植株矮化,叶片从边缘向内逐渐坏死,最终导致整株植物死亡; 当Mlnd在玉米茎秆伸长期发生时,会导致叶片褪绿斑驳并从边缘开始坏死,植株不能抽穗,玉米棒畸形或不结籽粒; 当Mlnd在玉米生长后期发生时,会导致叶片边缘部分坏死,包叶较早干枯,玉米籽粒不饱满[8, 17]。可见,Mcmv与马铃薯Y病毒科病毒复合侵染比Mcmv单独侵染所引起的症状要严重很多。这是因为Mcmv与马铃薯Y病毒科病毒发生协生作用,而协生作用的主要特点就是加重病害,导致病毒含量发生改变[18]。据报道,Mcmv和Wsmv复合侵染时,两者的病毒积累量较单独侵染时均增加[19]。Mcmv和Scmv复合侵染时,Mcmv的病毒积累量比单独侵染时提高1.7-5.4倍,而Scmv的病毒积累量没有显著变化[20]。对Mcmv致病机理初步研究表明,Mcmv单独侵染及其与Scmv复合侵染都能引起宿主转录组水平和细胞学水平的变化,且复合侵染所引起的变化更为显著。在转录组水平,复合侵染比单独侵染造成更多的基因差异表达,在这些差异表达的基因中,参与生长素合成、水杨酸合成、羟脂合成等与植物防御反应相关的基因都出现了较为显著的变化。在细胞学水平,复合侵染造成的破坏比单独侵染更为严重,其中以叶绿体和线粒体最为明显。单独侵染植株维管束鞘细胞叶绿体中的淀粉粒与健康植株中的无显著差别,而复合侵染植株中的这类淀粉粒明显变小,暗示其光合作用受到影响。单独侵染和复合侵染植株的线粒体中均出现丝状结晶样物质,线粒体结构均被破坏,且复合侵染植株的线粒体被破坏的更早更严重,推测可能是病毒引起的结晶类物质破坏了线粒体的完整结构。线粒体是植物进行呼吸作用的主要场所,其结构被破坏导致呼吸作用受阻。光合作用和呼吸作用同时受阻对植物来说可能是致命的,这可能是复合侵染导致植株系统性坏死的直接原因[8]。
1.3 传播途径Mcmv可通过机械、种子和昆虫介体传播。它易通过根或叶机械接种传播[12]。玉米种子可传播Mcmv,尽管其传播效率仅为0.04%,但种子传播是Mcmv远距离传播的主要方式[21]。MCMV的昆虫介体包括叶甲和蓟马,目前已报道的能够传播Mcmv的叶甲包括跳甲(Systena frontalis)、玉米跳甲(Chaetocnema pulicaria)、黑角负泥虫(Oulema melanopa)、南方玉米根虫(Diabrotica undecimpunc-tata)、北方玉米根虫(D. longicornis)和西方玉米根虫(D. virgifera)等6种[22],能够传播Mcmv的蓟马包括威廉期花蓟马(Frankliniella williamsi)[4]和西花蓟马(Frankliniella occidentalis)[11]2种。6种叶甲和威廉期花蓟马的幼虫和成虫均能传播Mcmv,传播方式为半持久型,无潜伏期[8]。西花蓟马的传毒特性目前尚未清楚。
1.4 Mcmv的分布与危害Mcmv于1974年首次在秘鲁被报道[3],之后在阿根廷、巴西、墨西哥、美国等美洲国家迅速传播[4]。在较长的一段时间里Mcmv仅分布在美洲,直到2005年才在泰国发现该病毒[8]。近年Mcmv在非洲流行爆发,最先于2011年在肯尼亚被发现[5]。在肯尼亚Mcmv常与马铃薯Y病毒科病毒复合侵染引起Mlnd,2012年肯尼亚Mlnd发生率为22.1%,造成玉米减产12.6万t,产量损失高达90%,折合经济损失5 200万美元[9, 16]。随后,Mcmv迅速传播到卢旺达[23]、刚果[6]、埃塞俄比亚[24]等非洲国家,给当地玉米产业造成严重打击。2016年报道在西班牙的玉米样品上检测到Mcmv,说明Mcmv已扩散到欧洲。我国于2009年首次在进境玉米种子中检测到Mcmv[7],同年在云南省元谋县的玉米田间发现该病毒[25],随后发现四川玉米样品也感染Mcmv[8]。我国是仅次于美国的世界第二大玉米种植国,播种面积为3 066-3 333万hm2,Mcmv一旦爆发将会对我国造成巨大经济损失,据估算,Mcmv爆发将造成我国直接经济损失高达140.95亿人民币[12, 26]。
2 Mcmv的鉴定与检测目前用于鉴定和检测Mcmv的方法主要包括血清学方法和分子生物学技术。酶联免疫吸附反应法(Enzyme-linked immunosorbent assay,ELISA)作为最常用的血清学方法被广泛用于Mcmv的检测。Stenger等[27]利用商业化双抗体夹心ELISA(Double antibody sandwich-ELISA,DAS-ELISA)试剂盒检测玉米叶片样品中Mcmv的相对滴度。Wu等[28]利用纯化的Mcmv病毒粒子作为抗原制备了抵抗Mcmv的单克隆抗体和多克隆抗体,再利用这些抗体建立了三抗体夹心ELISA(Triple antibody sandwich-ELISA,TAS-ELISA),该方法可灵敏、特异、快速地检测Mcmv,对纯化Mcmv的最低检出浓度为25 pg/mL。
聚合酶链式反应(Polymerase chain reaction,PCR)、环介导等温扩增技术(Loop-mediated isothermal amplification,LAMP)和下代测序(Next generation sequencing,NGS)等分子生物学方法被用于检测Mcmv。张露茜等[29]建立并比较了Mcmv的普通反转录PCR(Reverse transcription PCR,RT-PCR)、SYBR Green I real-time RT-PCR及TaqMan real-time RT-PCR 3种检测方法发现,TaqMan real-time RT-PCR灵敏度最高,SYBR Green I real-time RT-PCR次之,普通RT-PCR最差,其RNA最低检出量依次为1.61、7.86和161.40 fg。Chen等[30]建立了检测Mcmv的RT-LAMP方法,该方法仅需恒温孵育60 min即可完成反应,特异性强,灵敏度比普通RT-PCR高10倍,且结果可视化,是检测Mcmv简易、快速、有效、灵敏的手段,可用于Mcmv的日常检测。NGS技术克服ELISA和PCR只能针对一些特定病毒或一种病毒的某些株系的缺陷,是病毒检测的强大工具。Adams等[31]利用NGS技术鉴定并表征了导致肯尼亚Mlnd发生的两种病毒——Mcmv和Scmv。
此外,还有一些检测Mcmv的新方法。Wang等[32]利用未修饰的金纳米粒子(Gold nanoparticles,AuNPs)作为比色探针,结合不对称PCR方法检测Mcmv,该方法物种专一性高,操作简单,且结果可视化,无需任何昂贵的仪器设备和生化试剂,是Mcmv中小规模检测的潜在有用工具。曾倡[33]利用表面等离子共振生物传感器技术对Mcmv进行检测,发现该方法特异性好、灵敏度高、耗时短,最低检测限为1 ng/mL,检测时间仅需15 min。Huang等[34]利用石英晶体微天平生物传感器技术同样可以快速检测Mcmv,但该方法灵敏度低于表面等离子共振生物传感器技术,最低检测限为250 ng/mL。
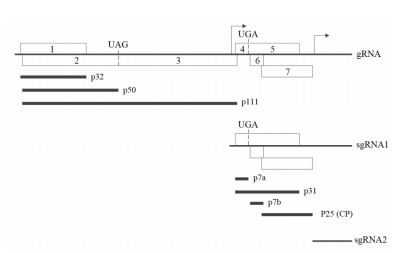
3 Mcmv的基因组结构与功能Mcmv含有一条长4.4 kb的基因组RNA(genomic RNA,gRNA),此外还能在寄主细胞中合成两条亚基因组RNA(subgenomic RNA,sgRNA),分别是1.47 kb的sgRNA1和0.34 kb的sgRNA2。基因组5' 端含有帽子结构,3' 端无poly(A)尾巴,共具7个开放读框(Open read frame,ORF),分别编码大小为32、50、111、7、31、7和25 kD的蛋白,将这些蛋白依次命名为p32、p50、p111、p7a、p31、p7b和p25,其中,p32、p50和p111直接由gRNA翻译得到,而p7a、p31、p7b和p25的合成则依赖于sgRNA1(图 1)[8, 17]。
P32由Mcmv gRNA 5' 端的第一个ORF编码,为Mcmv特有,在NCBI(National Center for Biotechnology Information)中找不到与其序列相似的同源蛋白[35]。在病毒复制和移动过程中P32不是必须的,但其缺失会导致病毒积累量显著下降,病毒扩散速度明显变慢,宿主症状明显减轻,推测它可能具有辅助病毒复制、加强病毒移动及干扰植物防御的作用[36]。p50位于p32下游19 nt的位置,由ORF2编码,当其终止密码子被通读时翻译得到蛋白p111[37]。p50和p111与Mcmv同科代表种番茄丛矮病毒(Tomato bushy stunt virus,TBSV)的对应蛋白p33和p92具有较高相似性,猜测它们与p33、p92功能相似,亦是分别作为病毒的复制辅助蛋白和RNA依赖的RNA聚合酶(RNA-dependent RNA polymerase,RdRP)[8]。与预测相符,在缺失突变体中的研究结果表明p50和p111是Mcmv复制过程中唯一必需的两种蛋白[36],生物信息学分析显示p111含有在RNA病毒RdRP中高度保守的“GDD”模体[37]。sgRNA1编码的4个蛋白均与病毒的胞间移动或长距离运输相关。p7a的C端与tombusvirid病毒编码的运动蛋白1(Movement protein1,MP1)在序列上具有很高相似性,p7b与panicoviruses编码的MP2相似性高,MP1和MP2是很多病毒胞间移动所必需的[36, 38-39],在缺失突变体中的研究结果表明p7a和p7b亦是Mcmv胞间移动所必需的两个运动蛋白[36]。p31是p7a终止密码子被通读后的产物,在NCBI中找不到其同源蛋白,为Mcmv所特有。在病毒胞间移动过程中p31不是必需的。p31参与病毒的长距离运输,它直接或间接加强病毒的系统移动,是病毒实现有效系统侵染所必需的[36]。Mcmv基因组体外翻译得到的蛋白中只有大小在25 kD的蛋白能被病毒粒子CP的抗血清检测到,表明p25为Mcmv的CP[10]。作为唯一的结构蛋白,CP具有包裹并保护病毒基因组的作用。此外,与天竺葵线型病毒(Pelargonium line pattern virus,PLPV)一样,Mcmv的CP也是病毒胞间移动所必需的[36]。目前尚未发现sgRNA2编码的蛋白,sgRNA2是否是真的sgRNA,其有何功能仍有待进一步研究。
4 Mcmv的防治策略 4.1 加强检验检疫Mcmv主要通过带毒种子进行远距离传播,因此势必要加强对玉米种子的检验检疫工作,以防止Mcmv的远距离扩散。作为全球主要玉米消费大国,我国每年需从国外进口大量玉米,加强对玉米种子的检验检疫可在很大程度上防止Mcmv的入侵[40]。目前,Mcmv仅在我国云南、四川和台湾发生,尚未蔓延到全国,因此必须要加强产区间玉米种子调运的管理并严格执行检疫措施,以防止该病毒在全国范围内扩散[40-41]。
4.2 培育及选用抗病品种培育及选用抗病品种是最经济、有效、环保的Mcmv防治措施。培育抗病品种的主要手段包括常规杂交育种和转基因分子育种,而对现有种质资源进行抗性分析是常规杂交育种工作的基础。在夏威夷的抗性实验结果显示,几乎所有的温带自交系和杂交系对Mcmv都高度易感,很多热带自交系和品种对Mcmv表现高抗,但没有观察到完全免疫的株系或品种,甜玉米对Mcmv高度易感[42]。Mahuku等[9]在美国俄亥俄州对63个玉米自交系进行了抗性评价,其中50个株系在初次筛选阶段因与易感对照(自交系Oh28)表现相似而被淘汰,剩余13个株系经历了3轮实验评价,结果显示所有株系在接种4周后均出现症状,但N211和KS23-6仅在后期出现轻微症状,Oh1VI自交系和6个Oh1VI ⅹ Oh28重组自交系症状发生明显推迟。这些在俄亥俄州表现抗性的株系在肯尼亚田间接种实验中也表现出Mcmv抗性,表明它们是Mcmv抗性育种的潜在种质资源[9]。初步遗传性状研究表明玉米抗Mcmv性状是由多基因控制的,抗性为部分显性,因此在抗Mcmv杂交育种时选择的亲本都应该具有抗性[42]。转基因分子育种亦是植物抗病育种的常用手段,但目前未见抗Mcmv转基因的报道。
4.3 化学防治Mcmv本身不能通过化学药剂控制,但可利用化学药剂杀死其介体昆虫来达到防治Mcmv的目的[43]。利用靶向叶甲和蓟马的化学药剂对玉米种子进行包衣处理,可以有效防治苗期叶甲和蓟马,减轻Mcmv的发生与危害[44]。在植株发病初期或介体昆虫开始迁往田间时,喷施适当杀虫剂消灭叶甲和蓟马或使其虫口密度降低,能有效控制Mcmv的传播和扩散[44]。为了达到良好的杀虫效果,杀虫剂应每1-2周喷施1次,且每月轮换使用不同类型杀虫剂,以免产生耐药性[43]。
4.4 栽培管理加强栽培管理主要是通过减少病源传播及增强植株抗病能力两个方面防治Mcmv。具体措施包括:(1)建立无病留种田,使用无毒或脱毒种子,降低种子传播的危险; (2)及时发现并拔除染病植株,对染病植株集中深埋或烧毁,减少侵染源; (3)及时清除田间地头杂草,防止Mcmv通过一些禾本科杂草作为中间寄主传播,同时可减少介体昆虫数量并防止介体昆虫在杂草上越冬; (4)调整播期,避免介体昆虫发生高峰期与玉米感病敏感期重合; (5)与非禾本科作物轮作,并严格控制轮休期; (6)合理布局,避免品种单一化; (7)农耕器具消毒,防止Mcmv通过摩擦接种传播; (8)合理施肥和灌溉,增强植株抗病能力; (9)做好介体昆虫流行的预报和防治,减少虫源和毒源[18, 44-45]。
5 结语Mcmv是影响玉米产量的重要病原之一,在世界范围广泛分布。它单独侵染玉米仅能引起轻微症状,造成玉米产量小幅下降; 而当它与Mdmv、Scmv和Wsmv等马铃薯Y病毒科病毒复合侵染时会引起严重的玉米病害Mlnd,造成玉米产量大幅下降,对玉米产业构成严重威胁。目前对Mcmv的研究已经取得了初步成果,但仍存在一些问题尚未得到解决。例如,Mcmv除了通过机械、种子和昆虫介体传播是否还存在其它传播途径,除了目前已知的6种叶甲和两种蓟马,是否存在其它昆虫介体,在这些昆虫介体中,哪种是当地主要的传毒介体,如何真正有效地控制这些介体。西花蓟马在我国适生范围广泛,且其寄主多,繁殖能力强,可能会导致Mcmv的大范围扩散[12],但其传毒特性如何,气候等环境因素对Mcmv的发生危害有何影响,尚未发现Mcmv sgRNA2编码的蛋白,sgRNA2是否是真的sgRNA,其有何功能,这些问题有待进一步研究。
我国是玉米种植大国,且Mdmv、Scmv和Wsmv在我国分布较为广泛[18],Mcmv已在我国云南、四川和台湾发生,若其大规模爆发,很可能会和Mdmv、Scmv或Wsmv复合侵染导致Mlnd,造成巨大经济损失,因此势必要加强Mcmv的防治工作,严防其进一步扩散。这就要求我国有关部门尽快建立Mcmv快速、简便和准确的检测方法,以保障我国农业生产安全。转基因分子育种是植物抗病育种的常用手段,目前未见抗Mcmv转基因的报道,培育抗Mcmv转基因植株亦是今后研究的主要任务。
| [1] |
Zhang YJ, Zhao WJ, Li MF, et al. Real-time TaqMan RT-PCR for detection of maize chlorotic mottle virus in maize seeds[J]. Journal of Virological Methods, 2011, 171(1): 292-294. DOI:10.1016/j.jviromet.2010.11.002 |
| [2] |
King AM, Adams MJ, Lefkowitz EJ, et al. Virus taxonomy:classification and nomenclature of viruses:ninth report of the International Committee on Taxonomy of Viruses[M]. Amsterdam: Academic Press, 2012.
|
| [3] |
Castillo J, Hebert TT. A new virus disease of maize in Peru[J]. Fitopatologia, 1974, 9: 79-84. |
| [4] |
Cabanas D, Watanabe S, Higashi CHV, et al. Dissecting the mode of Maize chlorotic mottle virus transmission(Tombusviridae:Machlomovirus)by Frankliniella williamsi(Thysanoptera:Thripidae)[J]. Journal of Economic Entomology, 2013, 106(1): 16-24. DOI:10.1603/EC12056 |
| [5] |
Wangai AW, Redinbaugh MG, Kinyua ZM, et al. First report of Maize chlorotic mottle virus and maize lethal necrosis in Kenya[J]. Plant Disease, 2012, 96(10): 1582. |
| [6] |
Lukanda M, Owati A, Ogunsanya P, et al. First report of Maize chlorotic mottle virus infecting maize in the Democratic Republic of the Congo[J]. Plant Disease, 2014, 98(10): 1448. |
| [7] |
龚海燕, 张永江, 张治宇, 等. 进境玉米种子携带玉米褪绿斑驳病毒的检测与鉴定[J]. 植物病理学报, 2010, 40(4): 426-429. |
| [8] |
王强. 玉米褪绿斑驳病毒侵染性克隆构建及致病机理初步研究[D]. 杭州: 浙江大学, 2015.
|
| [9] |
Mahuku G, Lockhart BE, Wanjala B, et al. Maize lethal necrosis(MLN), an emerging threat to maize-based food security in sub-Saharan Africa[J]. Phytopathology, 2015, 105(7): 956. DOI:10.1094/PHYTO-12-14-0367-FI |
| [10] |
Lommel SA, Kendall TL, Siu NF, et al. Characterization of maize chlorotic mottle virus[J]. Phytopathology, 1991, 81(8): 819-823. DOI:10.1094/Phyto-81-819 |
| [11] |
Zhao MF, Ho HH, Wu YX, et al. Western flower thrips(Franklin-iella occidentalis)transmits Maize chlorotic mottle virus[J]. Journal of Phytopathology, 2014, 162(7-8): 532-536. DOI:10.1111/jph.2014.162.issue-7-8 |
| [12] |
赵明富, 黄菁, 吴毅歆, 等. 玉米褪绿斑驳病毒及传播介体研究进展[J]. 中国农业科技导报, 2014, 16(5): 78-82. |
| [13] |
Achon MA, Serrano L, Clemente-Orta GM, et al. First report of Maize chlorotic mottle virus on a perennial host, Sorghum halepense, and maize in Spain[J]. Plant Disease, 2016, 101(2): 393. |
| [14] |
Wang Q, Zhou XP, Wu JX. First report of Maize chlorotic mottle virus infecting sugarcane(Saccharum officinarum)[J]. Plant Disease, 2014, 98(4): 572. |
| [15] |
Bockelman DL, Claflin LE, Uyemoto JK. Host range and seed-transmission studies of maize chlorotic mottle virus in grasses and corn[J]. Plant Disease, 1982, 66(3): 216-218. |
| [16] |
Makone SM, Menge D, Basweti E. Impact of maize lethal necrosis disease on maize yield:a case of Kisii, Kenya[J]. International Journal of Agricultural Extension, 2014, 2(3): 211-218. |
| [17] |
Scheets K. Machlomovirus[J]. Encyclopedia of Virology, 2008, 5(3): 259-263. |
| [18] |
于洋, 何月秋, 李旻, 等. 玉米致死性坏死病研究进展[J]. 安徽农业科学, 2011, 39(20): 12192-12194. DOI:10.3969/j.issn.0517-6611.2011.20.084 |
| [19] |
Scheets K. Maize chlorotic mottle machlomovirus and wheat streak mosaic rymovirus concentrations increase in the synergistic disease corn lethal necrosis[J]. Virology, 1998, 242(1): 28-38. DOI:10.1006/viro.1997.8989 |
| [20] |
Goldberg KB, Brakke MK. Concentration of maize chlorotic mottle virus increased in mixed infections with maize dwarf mosaic virus, strain B[J]. Phytopathology, 1987, 77(2): 162-167. DOI:10.1094/Phyto-77-162 |
| [21] |
Jensen SG, Wysong DS, Ball EM, et al. Seed transmission of maize chlorotic mottle virus[J]. Plant Disease, 1991, 75(5): 497. DOI:10.1094/PD-75-0497 |
| [22] |
Nault LR, Styer WE, Coffey ME, et al. Transmission of maize chlorotic mottle virus by chrysomelid beetles[J]. Phytopathology, 1978, 68(7): 1071-1074. DOI:10.1094/Phyto-68-1071 |
| [23] |
Adams IP, Harju VA, Hodges T, et al. First report of maize lethal necrosis disease in Rwanda[J]. New Disease Reports, 2014, 29: 22. DOI:10.5197/j.2044-0588.2014.029 |
| [24] |
Mahuku G, Wangai A, Sadessa K, et al. First report of Maize chlorotic mottle virus and maize lethal necrosis on maize in Ethiopia[J]. Plant Disease, 2015, 99(12): 1870. |
| [25] |
Xie L, Zhang JZ, Wang Q, et al. Characterization of Maize chlorotic mottle virus associated with maize lethal necrosis disease in China[J]. Journal of Phytopathology, 2011, 159(3): 191-193. DOI:10.1111/jph.2011.159.issue-3 |
| [26] |
饶玉燕, 尤扬, 朱水芳, 等. 玉米褪绿斑驳病毒入侵损失指标体系及直接经济损失评估[J]. 植物检疫, 2010, 24(2): 5-8. |
| [27] |
Stenger DC, Young BA, Qu F, et al. Wheat streak mosaic virus lacking helper component-proteinase is competent to produce disease synergism in double infections with Maize chlorotic mottle virus[J]. Phytopathology, 2007, 97(10): 1213-1221. DOI:10.1094/PHYTO-97-10-1213 |
| [28] |
Wu JX, Wang Q, Liu H, et al. Monoclonal antibody-based serological methods for maize chlorotic mottle virus detection in China[J]. Journal of Zhejiang University-SCIENCE B, 2013, 14(7): 555-562. DOI:10.1631/jzus.B1200275 |
| [29] |
张露茜, 刘战民, 夏雪影, 等. 玉米褪绿斑驳病毒3种PCR检测方法的建立与比较[J]. 植物病理学报, 2016, 46(4): 507-513. |
| [30] |
Chen L, Jiao Z, Liu D, et al. One-step reverse transcription loop-mediated isothermal amplification for the detection of Maize chlorotic mottle virus in maize[J]. Journal of Virological Methods, 2017, 240: 49-53. DOI:10.1016/j.jviromet.2016.11.012 |
| [31] |
Adams IP, Miano DW, Kinyua ZM, et al. Use of next-generation sequencing for the identification and characterization of Maize chlorotic mottle virus and Sugarcane mosaic virus causing maize lethal necrosis in Kenya[J]. Plant Pathology, 2013, 62(4): 741-749. DOI:10.1111/ppa.2013.62.issue-4 |
| [32] |
Wang L, Liu Z, Xia X, et al. Visual detection of Maize chlorotic mottle virus by asymmetric polymerase chain reaction with unmodified gold nanoparticles as the colorimetric probe[J]. Analytical Methods, 2016, 8(38): 1-15. |
| [33] |
曾倡. 利用表面等离子共振生物传感器检测玉米褪绿斑驳病毒和Cry1F蛋白的研究[D]. 北京: 北京化工大学, 2012.
|
| [34] |
Huang X, Xu J, Ji HF, et al. Quartz crystal microbalance based biosensor for rapid and sensitive detection of maize chlorotic mottle virus[J]. Analytical Methods, 2014, 6(13): 4530-4536. DOI:10.1039/C4AY00292J |
| [35] |
Scheets K. Maize chlorotic mottle machlomovirus expresses its coat protein from a 1. 47-kb subgenomic RNA and makes a 0. 34-kb subgenomic RNA[J]. Virology, 2000, 267(1): 90-101. DOI:10.1006/viro.1999.0107 |
| [36] |
Scheets K. Analysis of gene functions in Maize chlorotic mottle virus[J]. Virus Research, 2016, 222: 71-79. DOI:10.1016/j.virusres.2016.04.024 |
| [37] |
Nutter RC, Scheets K, Panganiban LC, et al. The complete nucleotide sequence of the maize chlorotic mottle virus genome[J]. Nucleic Acids Research, 1989, 17(8): 3163. DOI:10.1093/nar/17.8.3163 |
| [38] |
Genovés A, Navarro JA, Pallás V. Functional analysis of the five melon necrotic spot virus genome-encoded proteins[J]. J Gen Virol, 2006, 87(8): 2371-2380. DOI:10.1099/vir.0.81793-0 |
| [39] |
Yuan X, Ca oY, Xi D, et al. Analysis of the subgenomic RNAs and the small open reading frames of Beet black scorch virus[J]. J Gen Virol, 2006, 87(10): 3077-3086. DOI:10.1099/vir.0.81928-0 |
| [40] |
李帅, 朱敏, 夏子豪, 等. 云南省玉溪市玉米致死性坏死病毒原的分子鉴定[J]. 植物保护, 2015, 41(3): 110-114. |
| [41] |
Deng TC, Chou CM, Chen CT, et al. First report of Maize chlorotic mottle virus on sweet corn in Taiwan[J]. Plant Disease, 2014, 98(12): 1748. |
| [42] |
Nelson S, Brewbaker J, Hu J. Maize chlorotic mottle[J]. Plant Disease, 2011, 95(11): 79-84. |
| [43] |
李耀发, 高占林, 党志红, 等. 玉米致死性坏死病研究进展[J]. 河北农业科学, 2016, 20(5): 45-50. |
| [44] |
孙艳会, 王远路. 玉米病毒病的发生及综合防治[J]. 现代农业科技, 2016(5): 145, 148. |
| [45] |
何国梁. 玉米病毒病的发生与防治[J]. 河北农业科技, 2008(11): 23. |