2. 云南省芒市植保植检站,芒市 678400;
3. 农业部马铃薯生物学与生物技术重点实验室 华中农业大学,武汉 430070
2. Yunnan Mangshi City Plant Protection Station, Mangshi 678400;
3. Key Laboratory of Potato Biology and Biotechnology, Ministry of Agriculture, Huazhong Agricultural University, Wuhan 430070
马铃薯(Solanum tuberosum L.)是继水稻、小麦、玉米之后全球第四大重要粮食作物,在全世界158个国家广泛种植(http://www.fao.org/statistics/zh/)。由致病疫霉菌(Phytophthora infestans(Mont.)de Bary)引起的马铃薯晚疫病严重威胁着全球马铃薯生产安全[1]。在长期自然进化中,马铃薯形成了一套有效的免疫体系来抵挡各种病原菌人侵。同时病原菌为了侵染寄主,也形成了多种机制来克服马铃薯的防御反应。P. infestans能够在马铃薯中成功侵染并繁衍的一个关键因素就是通过吸器组织向植物细胞内分泌一类具有“RXLR”保守结构的效应蛋白,抑制由病原菌的病原相关分子模式分子(Pathogen-associated molecular patterns,PAMPs)激发的免疫反应(PAMP-triggered immunity,PTI),促使植物更易感病[2-6]。然而马铃薯则进化出NB-LRR类抗病基因(Resistance gene to P. infestans,Rpi),其编码蛋白直接或间接特异识别P. infestans中RXLR效应蛋白,产生效应子激发免疫反应(Effector-triggered immunity,ETI)[7-8]。这些被Rpi蛋白特异识别的RXLR效应蛋白称为无毒蛋白(Avirulence protein,AVR)。在马铃薯与P. infestans这一复杂的防御与侵染互作过程中,RXLR效应蛋白起着关键的作用。本文以RXLR效应蛋白为切入点,综述了P. infestans的RXLR效应子相关研究进展,以期为RXLR效应蛋白今后研究及P. infestans与马铃薯的互作机制研究提供较为系统而全面的参考信息。
1 致病疫霉RXLR效应蛋白结构及基本功能病原菌效应蛋白及其功能研究是寄主与病原菌互作研究领域的热点。真核病原菌分泌效应蛋白途径不同于原核细菌的Ⅲ型分泌系统,可能主要是通过内质网-高尔基(ER-Golgi)的蛋白分泌系统[9]。病原菌效应子必须被分泌并转运到寄主细胞的特定区域才能发挥致病作用。根据效应子在植物细胞的不同作用位置,效应子一般分为胞质效应蛋白(Cytoplasmic effector)和质外体效应蛋白(Apoplastic effector)。致病疫霉RXLR胞质效应蛋白既可以作为致病因子促进寄主植物感病,又可以作为无毒因子被抗病基因编码蛋白识别激发寄主防御反应[7]。RXLR效应蛋白的主要特征是其N端含有一个15-25个疏水性氨基酸残基组成的信号肽,信号肽后是保守的Arg-X-Leu-Arg(RXLR,X代表任意氨基酸)结构域,以及多态性的C端效应子功能域[10]。N端信号肽和RXLR结构域与效应子分泌和转运进入寄主细胞有关,而多态性的C端功能域则是病原菌用来调控寄主防御反应和通过快速进化从而躲避寄主抗病蛋白识别的关键区域[11]。
随着基因组测序技术的飞快发展,2009年完成了P. infestans菌株T30-4全基因组的测序和组装,研究发现P. infestans全基因组有240 Mb,预测有17 797个编码基因,其中包含563个RXLR效应子基因[12]。Raffaele等[13]对P. infestans的基因组骨架和基因表达谱进行分析发现,P. infestans基因组中有540个RXLR效应子基因,且其中有97.4%都位于基因组转座子区,变异率非常高,这些快速变异的RXLR效应子有助于P. infestans快速的适应寄主植物。Cooke等[14]对P. infestans的A2交配型的生理小种06_3928A进行了全基因组测序,并与参考菌株T30-4全基因组比较分析发现,405个RXLR效应子基因SNP标记中存在278个(69%)非同义替换,作者认为这些多态型的RXLR效应蛋白可能是导致P. infestans基因型13_A2菌株快速发展成为英国优势致病菌株的原因。RXLR效应蛋白的快速进化对P. infestans克服已有马铃薯抗病基因起着十分重要的作用。
2 RXLR效应蛋白的毒性功能已有研究显示P. infestans能够分泌RXLR效应子到寄主细胞内以干扰植物免疫反应,RXLR效应子扮演着毒性因子的角色,但是目前绝大多数效应子如何发挥其毒性功能还不清楚。通过转录组分析,研究者发现至少79个RXLR效应子基因在P. infestans接种寄主后2-3 d内表达量显著增高[12]。这些效应子理论上在抑制植物PTI免疫、调控转录因子、蛋白降解、信号传导、泛素化等方面发挥着重要功能。
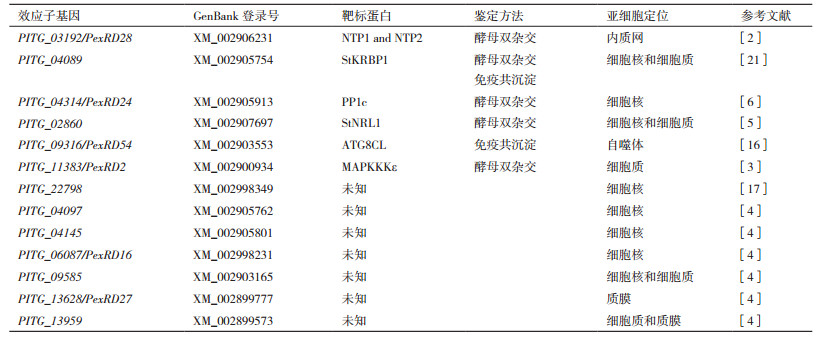
目前,部分P. infestans侵染前期上调表达的RXLR效应子基因亚细胞定位、寄主标靶及其功能已有研究报道(表 1)。McLellan等[2]研究发现,效应子PITG_03192的寄主靶标是马铃薯转录因子StNTP1和StNTP2,PITG_03192抑制StNTP1和StNTP2从内质网向细胞核的转运,从而促进P. infestans侵染。丝裂原活化蛋白激酶在植物免疫信号传导途径中起着重要作用[15]。King等[3]报道效应子PexRD2可以特异结合并抑制植物丝裂原活化蛋白激酶MAPKKKε的激酶活性,进而干扰植物免疫相关信号传导,致使植物更容易感病[3]。P. infestans基因组中存在数百个RXLR效应子基因,研究发现RXLR效应子具有功能冗余性,一部分RXLR效应子执行同样的功能。Zheng等[4]通过在番茄原生质体中表达33个致病疫霉RXLR效应子,结果发现PITG_04097、PITG_04145、PITG_06087、PITG_09585、PITG_13628、PITG_13959、PITG_18215和PITG_20303等8个效应子可以抑制病原相关分子模式flg22激发的早期PTI免疫反应,同样在番茄上有3个RXLR效应子(PITG_13628,PITG_13959,PITG_18215)能够抑制番茄中MAP激酶活性,干扰植物抗病信号传导。Dagdas等[16]利用免疫共沉淀技术在本式烟草上筛选到RXLR效应子PexRD54(PITG_09316)的互作蛋白,发现PexRD54与植物自噬蛋白ATG8CL互作并加速细胞内自噬体的形成,同时大大减弱了自噬运输受体Joka2介导的免疫反应。Wang等[17]发现在本氏烟草中瞬时表达细胞核(nucleus)定位RXLR效应子PITG_22798可以激发细胞死亡,核定位突变后PITG_22798不能诱导产生细胞死亡。该细胞死亡依赖SGT1介导的信号传导途径,并可以被P. infestans无毒蛋白AVR3b抑制。
植物体内存在一类蛋白,能够被病原菌利用并促进病原菌侵染,即感病因子(Susceptibility factor,S factor)。在寄主植物中沉默或突变感病因子有助于增强植物抗病性[18-20]。Wang等[21]研究首次发现P. infestans细胞核定位效应子PITG_04089可以通过与感病因子RNA结合蛋白StKRBP1互作并调控StKRBP1的积累来促进P. infestans侵染。另外作者还发现细胞核定位对于效应子PITG_04089发挥毒性功能至关重要。Boevink等[6]发现RXLR效应子PITG_04314虽然可以与植物蛋白磷酸酶PP1c催化亚基产生互作,并促进PP1c从核仁转运到核质,但是PITG_04314并没有影响PP1c的磷酸酶活性。研究者推测效应子PITG_04314是通过与PP1c发生互作形成PITG_04314-PP1c复合体全酶形式负调控植物防御反应。在马铃薯中超量表达PITG_04314基因,JA-和SA-响应报告基因明显表达下调。同样效应子PITG_04314发挥毒性功能与其细胞核定位关联。Yang等[5]研究发现RXLR效应子PITG_02860可以与感病因子StNRL1互作调控植物免疫反应,另外只有当PITG_02860基因在细胞质(cytoplasm)中表达时,PITG_02860才能抑制INF1(P. infestans的PAMP)介导的HR反应和促进植物感病。
3 无毒蛋白目前报道的所有P. infestans无毒蛋白(AVR)均属于RXLR类效应蛋白,同样具有N端信号肽、RXLR结构域和C-端功能域,无毒基因具有在P. infestans侵染前期上调表达的特点[10]。P. infestans的AVR基因与马铃薯Rpi基因间的互作识别符合“基因对基因”模型[22]。当这些AVR蛋白进入细胞内后,会抑制病原菌PAMP激发的PTI免疫途径,然而当寄主细胞内有对应的Rpi基因存在时,Rpi蛋白会特异识别这些AVR蛋白,从而激发ETI免疫途径,使马铃薯产生抗病性。近年来,关于P. infestans的AVR基因的克隆、亚细胞定位、寄主靶标及功能等方面的研究已有很好的进展(表 2)。
目前,已被克隆的P. infestans的AVR基因已有10个,即AVR1[23]、AVR2[24]、AVR3a[25]、AVR3-b[26]、AVR4[27]、AVR-blb1[28]、AVR-blb2[29]、AVR-vnt1[30]、AVRSmira1[31]和AVRSmira2/AVR8[31-32]。
AVR3a是第一个从P. infestans中克隆到的RXLR类无毒基因[25]。研究发现AVR3a可以与植物E3泛素连接酶CMPG1和GTP酶DRP2互作,从而抑制INF1和flg22介导的PTI免疫反应,促进P. infestans侵染植物[33-34]。Rpi-R3a和AVR3a的识别互作模式目前尚不清楚。虽然AVR3a和Rpi-R3a可以共定位在植物细胞质内涵体中激发HR反应,但是酵母双杂交和免疫共沉淀均不能证明AVR3a和Rpi-R3a直接互作[35]。另外沉默CMPG1不影响Rpi-R3a识别AVR3a激发HR反应,说明CMPG1不是Rpi-R3a识别AVR3a信号途径中的关键因子[36]。
研究发现,只有当AVR1和Rpi-R1均在细胞核中表达时,Rpi-R1才能识别AVR1并激发HR反应。当AVR1在细胞质中表达时,可以抑制效应子CRN2介导的细胞死亡反应[23]。通过酵母双杂交和免疫共沉淀发现AVR1与蛋白复合体exocyst的一个亚基Sec5互作,可能干扰植物防御中细胞囊泡运输途径。AVR1通过抑制Sec5从而导致病程相关蛋白PR-1分泌减少和降低P. infestans接种点处胼胝质积累,使植物免疫能力下降。Sec5是否在Rpi-R1识别AVR1反应途径中扮演重要角色有待进一步研究[37]。
AVR2和AVR-blb2主要在植物细胞质膜(Plasma membrane,PM)和P. infestans侵染点处吸器组织内表达[24, 38-39]。AVR-blb2可通过与植物防御相关木瓜蛋白酶C14互作,抑制其在质外体内积累,从而干扰植物防御反应[38]。另外,研究发现Rpi-blb2识别AVR-blb2激发的HR反应依赖SGT1,不需要水杨酸、茉莉酸或者乙烯介导的信号传导途径[40]。马铃薯磷酸酶StBSL1蛋白参与油菜素内脂信号传导,调控生长和发育。研究发现P. infestans无毒蛋白AVR2与StBSL1形成复合体进而被抗病蛋白Rpi-R2识别、激发HR反应,Rpi-R2和AVR2识别免疫反应符合“警戒”假说[24]。基因芯片分析发现,表达AVR2的转基因马铃薯中参与油菜素内酯信号传导的转录因子StCHL1组成型表达,瞬时超量表达StCHL1和AVR2促进植物感病,沉默StCHL1基因则增强马铃薯对P. infestans的抵抗能力。研究者指出,AVR2是通过激活植物油菜素内酯信号传导间接抑制INF1介导植物PTI免疫反应,促进植物感病[41]。
AVR3b定位在植物细胞质和质膜上,可以抑制flg22介导的早期PTI免疫反应和番茄中MAP激酶活性,干扰植物抗病信号传导,促进P. infestans侵染[4]。目前尚未发现AVR3b在植物体内的寄主靶标蛋白,其致病分子机理有待进一步研究。PVX-agroinfection分析发现AVR4可以被含有Rpi-R4的马铃薯材料识别并激发HR反应,其C-端W基序是蛋白识别的关键区域[42]。同样有关AVR4的寄主靶标蛋白未见有报道。
在P. infestans无毒蛋白(AVR)和马铃薯抗晚疫病蛋白(Rpi)互作识别模式研究中,AVR-blb1(IPI-O1)与Rpi-blb1符合直接互作识别模式。研究发现Rpi-blb1中CC结构域是与AVR-blb1互作的重要结构域。AVR-blb1蛋白结构中第129位亮氨酸对Rpi-blb1识别AVR-blb1激发HR起到关键作用,突变第129位亮氨酸(L129P)则导致Rpi-blb1不能与AVR-blb1互作,也不能产生HR。另外AVR-blb1的毒性蛋白形式IPI-O4也可以与Rpi-blb1直接互作。研究者指出P. infestans的AVR-blb1毒性形式IPI-O4通过与IPI-O1竞争互作Rpi-blb1,使Rpi-blb1处于非激活状态,进而大大减弱植物ETI免疫反应[43]。另外,研究发现,AVR-blb1还可以通过细胞黏附基序RGD与拟南芥中的凝集素受体激酶LecRK-I.9发生互作。超量表达LecRK-I.9增强拟南芥对P. brassicae的抗性,突变LecRK-I.9和超量表达AVR-blb1导致病原菌接种点处胼胝质的积累减弱,促使拟南芥感病[44]。
AVR-vnt1可以被Rpi-vnt1和Rpi-phu1识别并激发抗性反应[30, 45]。研究发现P. infestans毒性生理小种(MP324x和MP1580)在无Rpi-phu1的马铃薯中侵染时还是会表达AVR-vnt1,只是在含Rpi-phu1的马铃薯上会通过基因沉默等方式不表达AVR-vnt1以躲避Rpi-phu1等抗病蛋白的识别以达到致病目的[45]。另外,通过效应子组学策略研究发现,部分RXLR效应子可以作为候选无毒蛋白被辣椒、龙葵识别并激发HR反应,参与了P. infestans的非寄主抗性免疫途径[46-47]。
3.2 无毒基因的进化与变异P. infestans生理小种的变化和区域分布是影响马铃薯品种抗病性能否持久的主要因素之一,了解AVR基因在小种间的变化不仅有助于揭示AVR基因进化变异的过程,同时也可以检测生理小种的变化,为选育抗病品种以及生产中抗病品种/抗源合理利用提供依据。P. infestans数百个RXLR效应子基因中,AVR基因可以通过基因缺失、序列多态性或者转录调控表达等变异机制来帮助P. infestans躲避对应抗病蛋白的识别(表 3)。
AVR基因缺失,主要表现在基因编码序列的全部与部分缺失,基因上下游序列的全部与部分缺失[51]。通过与参考菌株T30-4基因组比对,Pais等[52]发现P. infestans菌株P13527中有62个基因缺失,菌株P13626中有60个基因缺失。AVR1、AVR2、AVR3b和AVR-blb1在P. infestans不同生理小种中均存在基因缺失[23, 53-55]。研究发现,能够克服Rpi-R1的一个P. infestans毒性菌株中缺失AVR1基因,但是在相同位置上存在一个AVR1-like基因。AVR1-like蛋白同样是RXLR效应子,AVR1-like的C端缺失38个氨基酸,导致了AVR1-like不能被Rpi-R1识别[23]。通过在29个P. infestans生理小种中扩增AVR2基因,测序分析发现12个克服Rpi-R2的毒性菌株中有9个菌株缺失AVR2,在剩余3株毒性菌株和17株无毒菌株中AVR2存在序列多态性变异。另外在毒性菌株中克隆出AVR2-like,经氨基酸序列比对发现AVR2-like与AVR2存在13个氨基酸差异,且AVR2-like不能被Rpi-R2识别。研究者指出毒性P. infestans菌株中AVR2主要通过缺失、差异表达及序列多态性变异逃避Rpi-R2识别致使植物感病[53]。对多个P. infestans菌株中编码的AVR-blb1(IPI-O)基因家族进行测序与分析,发现16种IPI-O蛋白变异型。根据氨基酸序列差异比对,将这16个差异蛋白可分成3组,其中第一组和第二组的变异型可以被Rpi-blb1识别,第三组的IPI-O4不能被Rpi-blb1识别,而且还与IPI-O1竞争互作Rpi-blb1,从而阻断Rpi-blb1介导的抗病免疫反应[43, 54, 56]。
基因序列多态性包括碱基序列多态性、点突变等。AVR3a在P. infestans毒性菌株主要通过氨基酸点突变变异成毒性基因,毒性基因和无毒基因序列的差异主要在3个氨基酸位点,其中一个位于信号肽,另外两个位于C端功能域。携带Avr3aC19K80I103的P. infestans菌株对于含有Rpi-R3a马铃薯表现无毒性,而携带Avr3aS19E80M103菌株表现为毒性。研究表明AVR3a蛋白序列中第80位、103位的氨基酸对Rpi-R3a识别AVR3a具有重要作用[25]。目前发现AVR4的毒性形态主要是发生了移码突变,导致基因短截,从而逃避了抗病蛋白的识别[27]。利用基于SNP策略对来自23个马铃薯主产国家采集的352株P. infestans菌株进行分析,研究发现AVR-blb2基因家族的多态性很高,且第69位氨基酸的点突变(F69I)对Rpi-blb2识别激活具有关键作用[57]。Stefańczyk等[45]对4个P. infestans强致病生理小种中AVR-smira1基因进行扩增和测序,结果发现AVR-smira1在这4个小种中均有非同义突变。
病原菌中无毒基因选择性表达也是毒性变异的一种策略[58]。Pais等[52]通过对P. infestans基因组和基因表达差异分析发现,17个基因在P13626菌株中不表达,AVR-vnt1是其中之一,在含有Rpi-vnt1.1的转基因马铃薯上接种P13626表现感病。研究者认为菌株P13626中AVR-vnt1未转录表达避开了寄主Rpi-vnt1.1的识别而促进植物感病。
4 展望RXLR效应蛋白在致病疫霉与寄主互作中起着关键作用。一方面,RXLR效应蛋白作为无毒蛋白被寄主抗病蛋白识别激发植物免疫反应; 另一方面,RXLR效应蛋白作为致病疫霉抑制寄主免疫应答的关键武器,促进植物感病[60]。通过对RXLR效应蛋白功能及其作用机制的研究有助于进一步深入了解致病疫霉与寄主间互作机制,从理论上指导探索晚疫病防治的新策略和技术。
4.1 RXLR效应蛋白的转运机制卵菌分泌效应蛋白途径不同于原核细菌的Ⅲ型分泌系统,可能主要是通过内质网-高尔基(ER-Golgi)的蛋白分泌系统[9]。基于卵菌基因组的研究表明,卵菌基因组中有一类数目众多的编码带保守RXLR序列的分泌蛋白基因[12]。RXLR效应子如何被分泌转运到植物细胞内从而调节寄主代谢和免疫反应呢?Kale等[61]研究RXLR效应子转运机制主要是通过RXLR或RXLR-like基序与植物细胞膜3-磷酸磷脂酰肌醇分子(PI3P)结合而进入植物细胞内。但这一结论并不能适用于所有RXLR效应蛋白,如效应子AVR3a和AVR1d均是C端效应子功能域与磷脂类分子结合,而不是RXLR结构域[62-63]。Wawra等[64]发现AVR3a在被分泌、转运到植物细胞前,其RXLR基序就已经被切除,研究表明RXLR基序在AVR3a蛋白修饰和分泌方面起到一定作用,但并没有直接参与AVR3a转运到植物细胞的过程。Ve等[65]证明亚麻锈菌的无毒蛋白AVR-M转运进入细胞内需要N-疏水区域,而不需要可以与3-磷酸磷脂酰肌醇分子结合的C-端CC结构域。Wang等[66]发现RXLR效应子PITG_04314与质外体效应子EPIC1在P. infestans体内的分泌途径不同,即质外体效应子EPIC1是通过内质网-高尔基(ER-Golgi)的蛋白分泌系统,而RXLR效应子PITG_04314则是通过另外一种特殊分泌系统。另外,有的RXLR效应子不依赖病原菌编码机制也可以自主地进入植物细胞内,如AVR1b[67]。RXLR效应子的转运过程非常复杂,还需要更多的研究来揭示RXLR效应蛋白是如何被转运到寄主细胞中的。
4.2 RXLR效应蛋白的靶标蛋白功能解析致病疫霉基因组中存在数百个编码RXLR效应子的基因,这些效应子进入寄主细胞后通过与寄主靶标蛋白结合来调控寄主免疫应答反应[39]。有些RXLR效应子靶标蛋白对寄主抗性起正调控作用,如Sec5[37],C14[38],LecRK-I.9[44]等,在寄主中增强此类基因的表达会提高抗性; 有些靶标对寄主抗性起负调控作用,如StNRL1[5],PP1c[6],StKRBP1[21]等,这些基因在寄主中增强表达会导致寄主抗性下降。靶标蛋白对解析效应子调控寄主免疫应答机制和如何提高马铃薯抗性具有重要作用。但是,绝大多数RXLR效应子在寄主植物中的互作靶标仍然不清楚。系统解析晚疫病菌核心效应子如何通过操控寄主靶标蛋白抑制寄主免疫应答反应,可为将来通过在寄主中加强被效应子抑制的正调控因子,同时抑制负调控因子作用来提高马铃薯持久抗性提供新思路。
4.3 P. infestans中AVR蛋白与马铃薯Rpi蛋白间的互作机制近年来,由于效应子组学策略的发展和应用,大大加速了P. infestans的AVR和马铃薯Rpi基因的克隆[68],但是P. infestans中的AVR蛋白与马铃薯Rpi蛋白之间的精细互作机制报道很少。迄今为止只有两篇相关报道,即Rpi-blb1直接互作识别AVR-blb1,Rpi-R2间接识别AVR2[24, 43]。另外有关RXLR效应子直接或间接抑制效应子激发免疫反应(ETI)的研究报道也不多[7, 39]。因此,对已克隆的AVR和对应Rpi的互作机制还需要更深入研究。同时,如何将P. infestans与马铃薯互作机理的研究成果应用于P. infestans群体组成、小种变化动态监测、指导抗病品种选育,抗源合理布局及延长抗性品种使用年限等,还有待更深入系统的研究。
| [1] |
谢从华. 马铃薯产业的现状与发展[J]. 华中农业大学学报:社会科学版, 2012(1): 1-4. |
| [2] |
McLellan H, Boevink PC, Armstrong MR, et al. An RxLR effector from Phytophthora infestans prevents re-localisation of two plant NAC transcription factors from the endoplasmic reticulum to the nucleus[J]. PLoS Pathog, 2013, 9(10): e1003670. DOI:10.1371/journal.ppat.1003670 |
| [3] |
King SR, McLellan H, Boevink PC, et al. Phytophthora infestans RXLR effector PexRD2 interacts with host MAPKKK epsilon to suppress plant immune signaling[J]. Plant Cell, 2014, 26(3): 1345-1359. DOI:10.1105/tpc.113.120055 |
| [4] |
Zheng X, McLellan H, Fraiture M, et al. Functionally redundant RXLR effectors from Phytophthora infestans act at different steps to suppress early flg22-triggered immunity[J]. PLoS Pathog, 10(4): e1004057. DOI:10.1371/journal.ppat.1004057 |
| [5] |
Yang L, McLellan H, Naqvi S, et al. Potato NPH3/RPT2-Like protein StNRL1, targeted by a Phytophthora infestans RXLR effector, is a susceptibility factor[J]. Plant Physiol, 2016, 171(1): 645-657. DOI:10.1104/pp.16.00178 |
| [6] |
Boevink PC, Wang X, McLellan H, et al. A Phytophthora infestans RXLR effector targets plant PP1c isoforms that promote late blight disease[J]. Nat Commun, 2016, 7: 10311. DOI:10.1038/ncomms10311 |
| [7] |
Hein I, Gilroy EM, Armstrong MR, et al. The zig-zag-zig in oomycete-plant interactions[J]. Mol Plant Pathol, 2009, 10(4): 547-562. DOI:10.1111/mpp.2009.10.issue-4 |
| [8] |
Franceschetti M, Maqbool A, Jimenez-Dalmaroni MJ, et al. Effectors of filamentous plant pathogens:commonalities amid diversity[J]. Microbiol Mol Biol Rev, 2017, 81(2): e00066-16. |
| [9] |
Petre B, Kamoun S. How do filamentous pathogens deliver effector proteins into Plant Cells?[J]. PLoS Biol, 2014, 12(2): e1001801. DOI:10.1371/journal.pbio.1001801 |
| [10] |
Vleeshouwers VG, Raffaele S, Vossen JH, et al. Understanding and exploiting late blight resistance in the age of effectors[J]. Annu Rev Phytopathol, 2011, 49: 507-531. DOI:10.1146/annurev-phyto-072910-095326 |
| [11] |
Birch PR, Boevink PC, Gilroy EM, et al. Oomycete RXLR effectors:delivery, functional redundancy and durable disease resistance[J]. Curr Opin Plant Biol, 2008, 11(4): 373-379. DOI:10.1016/j.pbi.2008.04.005 |
| [12] |
Haas BJ, Kamoun S, Zody MC, et al. Genome sequence and analysis of the Irish potato famine pathogen Phytophthora infestans[J]. Nature, 2009, 461(7262): 393-398. DOI:10.1038/nature08358 |
| [13] |
Raffaele S, Win J, Cano LM, et al. Analyses of genome architecture and gene expression reveal novel candidate virulence factors in the secretome of Phytophthora infestans[J]. BMC genomics, 2010, 11: 637. DOI:10.1186/1471-2164-11-637 |
| [14] |
Cooke DE, Cano LM, Raffaele S, et al. Genome analyses of an aggressive and invasive lineage of the Irish potato famine pathogen[J]. PLoS Pathog, 2012, 8(10): e1002940. DOI:10.1371/journal.ppat.1002940 |
| [15] |
Segonzac C, Feike D, Gimenez-Ibanez S, et al. Hierarchy and roles of pathogen-associated molecular pattern-induced responses in Nicotiana benthamiana[J]. Plant Physiol, 2011, 156(2): 687-699. DOI:10.1104/pp.110.171249 |
| [16] |
Dagdas YF, Belhaj K, Maqbool A, et al. An effector of the Irish potato famine pathogen antagonizes a host autophagy cargo receptor[J]. Elife, 2016, 5: e10856. |
| [17] |
Wang H, Ren Y, Zhou J, et al. The cell death triggered by the nuclear localized RxLR effector PITG_22798 from Phytophthora infestans is suppressed by the effector AVR3b[J]. Int J Mol Sci, 2017, 18(2): E409. |
| [18] |
Boevink PC, McLellan H, Gilroy EM, et al. Oomycetes seek help from the plant:Phytophthora infestans effectors target host susceptibility factors[J]. Mol Plant, 2016, 9(5): 636-638. DOI:10.1016/j.molp.2016.04.005 |
| [19] |
Sun K, Wolters AM, Loonen AE, et al. Down-regulation of Arabidopsis DND1 orthologs in potato and tomato leads to broad-spectrum resistance to late blight and powdery mildew[J]. Transgenic Res, 2016, 25(2): 123-138. DOI:10.1007/s11248-015-9921-5 |
| [20] |
Sun K, Wolters AM, Vossen JH, et al. Silencing of six susceptibility genes results in potato late blight resistance[J]. Transgenic Res, 2016, 25(5): 731-742. DOI:10.1007/s11248-016-9964-2 |
| [21] |
Wang X, Boevink P, McLellan H, et al. A Host KH RNA-binding protein is a susceptibility factor targeted by an RXLR effector to promote late blight disease[J]. Mol Plant, 2015, 8(9): 1385-1395. DOI:10.1016/j.molp.2015.04.012 |
| [22] |
Flor H. Current status of the gene-for-gene concept[J]. Annu Rev Phytopathol, 1971, 9: 275-296. DOI:10.1146/annurev.py.09.090171.001423 |
| [23] |
Du Y, Berg J, Govers F, et al. Immune activation mediated by the late blight resistance protein R1 requires nuclear localization of R1 and the effector AVR1[J]. New Phytol, 2015, 207(3): 735-747. DOI:10.1111/nph.13355 |
| [24] |
Saunders DG, Breen S, Win J, et al. Host protein BSL1 associates with Phytophthora infestans RXLR effector AVR2 and the Solanum demissum immune receptor R2 to mediate disease resistance[J]. Plant Cell, 2012, 24(8): 3420-3434. DOI:10.1105/tpc.112.099861 |
| [25] |
Armstrong MR, Whisson SC, Pritchard L, et al. An ancestral oomycete locus contains late blight avirulence gene Avr3a, encoding a protein that is recognized in the host cytoplasm[J]. Proc Natl Academy of Sciences, 2005, 102(21): 7766-7771. DOI:10.1073/pnas.0500113102 |
| [26] |
Li G, Huang S, Guo X, et al. Cloning and characterization of R3b;members of the r3 superfamily of late blight resistance genes show sequence and functional divergence[J]. Mol Plant Microbe Interact, 2011, 24(10): 1132-1142. DOI:10.1094/MPMI-11-10-0276 |
| [27] |
van Poppel PM, Guo J, van de Vondervoort PJ, et al. The Phytophthora infestans avirulence gene Avr4 encodes an RXLR-dEER effector[J]. Mol Plant Microbe Interact, 2008, 21(11): 1460-1470. DOI:10.1094/MPMI-21-11-1460 |
| [28] |
Vleeshouwers VG, Rietman H, Krenek P, et al. Effector genomics accelerates discovery and functional profiling of potato disease resistance and Phytophthora infestans avirulence genes[J]. PLoS One, 2008, 3(8): e2875. DOI:10.1371/journal.pone.0002875 |
| [29] |
Oh SK, Young C, Lee M, et al. In planta expression screens of Phytophthora infestans RXLR effectors reveal diverse phenotypes, including activation of the Solanum bulbocastanum disease resistance protein Rpi-blb2[J]. Plant Cell, 2009, 21(9): 2928-2947. DOI:10.1105/tpc.109.068247 |
| [30] |
Pel M. Mapping, isolation and characterization of genes responsible for late blight resistance in potato[D]. Wageningen: Wageningen University, 2010.
|
| [31] |
Rietman H, Bijsterbosch G, Cano LM, et al. Qualitative and quantitative late blight resistance in the potato cultivar Sarpo Mira is determined by the perception of five distinct RXLR effectors[J]. Mol Plant Microbe Interact, 2012, 25(7): 910-919. DOI:10.1094/MPMI-01-12-0010-R |
| [32] |
Vossen JH, van Arkel G, Bergervoet M, et al. The Solanum demissum R8 late blight resistance gene is an Sw-5 homologue that has been deployed worldwide in late blight resistant varieties[J]. Theor Appl Genet, 2016, 129(9): 1785-1796. DOI:10.1007/s00122-016-2740-0 |
| [33] |
Bos JI, Armstrong MR, Gilroy EM, et al. Phytophthora infestans effector AVR3a is essential for virulence and manipulates plant immunity by stabilizing host E3 ligase CMPG1[J]. Proc Natl Academy of Sciences, 2010, 107(21): 9909-9914. DOI:10.1073/pnas.0914408107 |
| [34] |
Chaparro-Garcia A, Schwizer S, Sklenar J, et al. Phytophthora infestans RXLR-WY effector AVR3a associates with Dynamin-related protein 2 required for endocytosis of the plant pattern recognition receptor FLS2[J]. PLoS One, 2015, 10(9): e0137071. DOI:10.1371/journal.pone.0137071 |
| [35] |
Engelhardt S, Boevink PC, Armstrong MR, et al. Relocalization of late blight resistance protein R3a to endosomal compartments is associated with effector recognition and required for the immune response[J]. Plant Cell, 2012, 24(12): 5142-5158. DOI:10.1105/tpc.112.104992 |
| [36] |
Gilroy EM, Taylor RM, Hein I, et al. CMPG1-dependent cell death follows perception of diverse pathogen elicitors at the host plasma membrane and is suppressed by Phytophthora infestans RXLR effector AVR3a[J]. New Phytol, 2011, 190(3): 653-666. DOI:10.1111/nph.2011.190.issue-3 |
| [37] |
Du Y, Mpina MH, Birch PR, et al. Phytophthora infestans RXLR effector AVR1 interacts with exocyst component Sec5 to manipulate plant immunity[J]. Plant Physiol, 2015, 169(3): 1975-1990. |
| [38] |
Bozkurt TO, Schornack S, Win J, et al. Phytophthora infestans effector AVRblb2 prevents secretion of a plant immune protease at the haustorial interface[J]. Proc Natl Academy of Sci, 2011, 108(51): 20832-20837. DOI:10.1073/pnas.1112708109 |
| [39] |
Whisson SC, Boevink PC, Wang S, et al. The cell biology of late blight disease[J]. Curr Opin Microbiol, 2016, 34: 127-135. DOI:10.1016/j.mib.2016.09.002 |
| [40] |
Oh SK, Kwon SY, Choi D. Rpi-blb2-mediated hypersensitive cell death caused by Phytophthora infestans AVRblb2 requires SGT1, but not EDS1, NDR1, salicylic acid-, jasmonic Acid-, or ethylene-mediated signaling[J]. Plant Pathol J, 2014, 30(3): 254-260. DOI:10.5423/PPJ.OA.03.2014.0027 |
| [41] |
Turnbull D, Yang L, Naqvi S, et al. RXLR effector AVR2 up-regulates a brassinosteroid-responsive bHLH transcription factor to suppress immunity[J]. Plant Physiol, 2017, 174(1): 356-369. DOI:10.1104/pp.16.01804 |
| [42] |
VAN Poppel PM, Jiang RH, Sliwka J, et al. Recognition of Phytophthora infestans Avr4 by potato R4 is triggered by C-terminal domains comprising W motifs[J]. Mol Plant Pathol, 2009, 10(5): 611-620. DOI:10.1111/mpp.2009.10.issue-5 |
| [43] |
Chen Y, Liu Z, Halterman DA. Molecular determinants of resistance activation and suppression by Phytophthora infestans effector IPI-O[J]. PLoS Pathog, 2012, 8(3): e1002595. DOI:10.1371/journal.ppat.1002595 |
| [44] |
Bouwmeester K, de Sain M, Weide R, et al. The lectin receptor kinase LecRK-I. 9 is a novel Phytophthora resistance component and a potential host target for a RXLR effector[J]. PLoS Pathog, 2011, 7(3): e1001327. DOI:10.1371/journal.ppat.1001327 |
| [45] |
Stefańczyk E, Sobkowiak S, Brylinska M, et al. Expression of the potato late blight resistance gene Rpi-phu1 and Phytophthora infestans effectors in the compatible and incompatible interactions in potato[J]. Phytopathology, 2017, 107(6): 740-748. DOI:10.1094/PHYTO-09-16-0328-R |
| [46] |
Lee HA, Kim SY, Oh SK, et al. Multiple recognition of RXLR effectors is associated with nonhost resistance of pepper against Phytophthora infestans[J]. New Phytol, 2014, 203(3): 926-938. DOI:10.1111/nph.12861 |
| [47] |
董冉. 马铃薯晚疫病菌四个RxLR基因的功能鉴定[D]. 泰安: 山东农业大学, 2016.
|
| [48] |
Guo J. Phytophthora infestans avirulence genes; mapping, cloning and diversity in field isolates[D]. Wageningen, The Netherlands: Wageningen University, 2008.
|
| [49] |
Lokossou AA, Park TH, van Arkel G, et al. Exploiting knowledge of R/Avr genes to rapidly clone a new LZ-NBS-LRR family of late blight resistance genes from potato linkage group Ⅳ[J]. Mol Plant Microbe Interact, 2009, 22(6): 630-641. DOI:10.1094/MPMI-22-6-0630 |
| [50] |
Lenman M, Ali A, Muhlenbock P, et al. Effector-driven marker development and cloning of resistance genes against Phytophthora infestans in potato breeding clone SW93-1015[J]. Theor Appl Genet, 2016, 129(1): 105-115. DOI:10.1007/s00122-015-2613-y |
| [51] |
姜华, 余欢, 王艳丽, 等. 稻瘟病菌无毒基因序列变异研究进展[J]. 浙江农业学报, 2015, 27(3): 512-520. |
| [52] |
Pais M, Yoshida K, Giannakopoulou A, et al. Gene expression polymorphism underpins evasion of host immunity in an asexual lineage of the Irish potato famine pathogen[J]. BioRxiv, 2017, 116012. |
| [53] |
Gilroy EM, Breen S, Whisson SC, et al. Presence/absence, differential expression and sequence polymorphisms between PiAVR2 and PiAVR2-like in Phytophthora infestans determine virulence on R2 plants[J]. New Phytol, 2011, 191(3): 763-776. DOI:10.1111/nph.2011.191.issue-3 |
| [54] |
Champouret N, Bouwmeester K, Rietman H, et al. Phytophthora infestans isolates lacking class I ipiO variants are virulent on Rpi-blb1 potato[J]. Mol Plant Microbe Interact, 2009, 22(12): 1535-1545. DOI:10.1094/MPMI-22-12-1535 |
| [55] |
Yoshida K, Schuenemann VJ, Cano LM, et al. The rise and fall of the Phytophthora infestans lineage that triggered the Irish potato famine[J]. Elife, 2013, 2: e00731. |
| [56] |
Halterman DA, Chen Y, Sopee J, et al. Competition between Phytophthora infestans effectors leads to increased aggressiveness on plants containing broad-spectrum late blight resistance[J]. PLoS One, 2010, 5(5): e10536. DOI:10.1371/journal.pone.0010536 |
| [57] |
Oliva RF, Cano LM, Raffaele S, et al. A recent expansion of the RXLR effector gene Avrblb2 is maintained in global populations of Phytophthora infestans indicating different contributions to virulence[J]. Mol Plant Microbe Interact, 2015, 28(8): 901-912. DOI:10.1094/MPMI-12-14-0393-R |
| [58] |
Qutob D, Tedman-Jones J, Dong S, et al. Copy number variation and transcriptional polymorphisms of Phytophthora sojae RXLR effector genes Avr1a and Avr3a[J]. PLoS One, 2009, 4(4): e5066. DOI:10.1371/journal.pone.0005066 |
| [59] |
Bos JI, Kanneganti TD, Young C, et al. The C-terminal half of Phytophthora infestans RXLR effector AVR3a is sufficient to trigger R3a-mediated hypersensitivity and suppress INF1-induced cell death in Nicotiana benthamiana[J]. Plant J, 2006, 48(2): 165-176. DOI:10.1111/tpj.2006.48.issue-2 |
| [60] |
Birch PR, Armstrong M, Bos J, et al. Towards understanding the virulence functions of RXLR effectors of the oomycete plant pathogen Phytophthora infestans[J]. J Exp Bot, 2009, 60(4): 1133-1140. DOI:10.1093/jxb/ern353 |
| [61] |
Kale SD, Gu B, Capelluto DG, et al. External lipid PI3P mediates entry of eukaryotic pathogen effectors into plant and animal host cells[J]. Cell, 2010, 142(2): 284-295. DOI:10.1016/j.cell.2010.06.008 |
| [62] |
Wawra S, Agacan M, Boddey JA, et al. Avirulence protein 3a(AVR3a)from the potato pathogen Phytophthora infestans forms homodimers through its predicted translocation region and does not specifically bind phospholipids[J]. J Biol Chem, 2012, 287(45): 38101-38109. DOI:10.1074/jbc.M112.395129 |
| [63] |
Na R, Yu D, Qutob D, et al. Deletion of the Phytophthora sojae avirulence gene Avr1d causes gain of virulence on Rps1d[J]. Mol Plant Microbe Interact, 2013, 26(8): 969-976. DOI:10.1094/MPMI-02-13-0036-R |
| [64] |
Wawra S, Trusch F, Matena A, et al. The RxLR Motif of the host targeting effector AVR3a of Phytophthora infestans is cleaved before secretion[J]. Plant Cell, 2017, 29(6): 1184-1195. |
| [65] |
Ve T, Williams SJ, Catanzariti AM, et al. Structures of the flax-rust effector AvrM reveal insights into the molecular basis of plant-cell entry and effector-triggered immunity[J]. Proc Natl Academy of Sci, 2013, 110(43): 17594-17599. DOI:10.1073/pnas.1307614110 |
| [66] |
Wang S, Boevink PC, Welsh L, et al. Delivery of cytoplasmic and apoplastic effectors from Phytophthora infestans haustoria by distinct secretion pathways[J]. New Phytol, 2017, 216(1): 205-215. DOI:10.1111/nph.14696 |
| [67] |
Dou D, Kale SD, Wang X, et al. RXLR-mediated entry of Phytophthora sojae effector Avr1b into soybean cells does not require pathogen-encoded machinery[J]. Plant Cell, 2008, 20(7): 1930-1947. DOI:10.1105/tpc.107.056093 |
| [68] |
Vleeshouwers VG, Oliver RP. Effectors as tools in disease resistance breeding against biotrophic, hemibiotrophic, and necrotrophic plant pathogens[J]. Mol Plant Microbe Interact, 2014, 27(3): 196-206. DOI:10.1094/MPMI-10-13-0313-IA |