先天性心脏缺陷是人类死亡率最高的疾病之一,影响约1%的新生儿[1]。30%的人类先天性心脏缺陷是由流出道(Outflow tract,OFT)发育异常引起的[2-3]。OFT和右室(Right ventricle,RV)是由第二心场(Second heart field,SHF)祖细胞发育而来的[4-5]。哺乳动物心脏主要是由第一心场(First heart field,FHF)和SHF组成的[6]。在心脏发育过程中,位于咽中胚层(Pharyngeal mesoderm,PM)和内脏中胚层(Splanchnic Mesoderm,SpM)的SHF细胞通过动脉极向OFT和RV迁移部署,通过静脉极贡献于心房心肌细胞[5, 7]。SHF祖细胞向OFT贡献不足会使OFT延长受损,在人和小鼠中导致心室分割、动脉排列的缺陷,如双出口右心室(Double outlet right ventricle,DORV),主动脉骑跨,大动脉转位,肺动脉闭锁和永存动脉干(Persistent truncus arteriosus,PTA)等[3, 8-9]。迄今,许多学者在进行SHF祖细胞迁移部署的研究,并取得了一定的研究成果和进展,但是SHF祖细胞迁移部署的细胞生物学过程尚不清楚。因此,研究追踪SHF细胞迁移部署的细胞生物学过程对于阐明哺乳动物心脏发育过程具有重要意义,将会为SHF发育缺陷提供新的视角。
现有标记追踪SHF迁移部署的方法主要有胚胎显微注射染料标记[3, 10-11]和孕鼠注射染料标记[12-13],前者对实验者的操作及实验条件要求相对较高。5-乙炔基-2’-脱氧尿嘧啶核苷(5-ethynyl-2’-deoxyuridine,EDU)是一种胸腺嘧啶核苷类似物,在细胞增殖时能够插入正在复制的DNA分子中,基于EDU与染料的共轭反应可以进行高效快速的细胞增殖检测分析。SHF祖细胞在SpM处具有很强的增殖能力并不断的向远端OFT迁移,而远端OFT的SHF细胞并不具有增殖的能力[14]。根据SHF祖细胞增殖和迁移的特性,在特定的时期通过向孕鼠脉冲注射EDU就能够将胚胎SpM中处于增殖期的SHF细胞进行有效的标记,而经过一段时间的迁移,在SpM处被EDU脉冲标记的SHF细胞将迁移到达远端OFT,因此,根据EDU标记细胞在OFT处的距离就可以追踪SHF的迁移情况。Li[13]研究团队报道,在胚胎发育的9.25 d(E 9.25)采用250 mg(相当于10 mg/kg剂量)EDU的剂量腹腔注射孕鼠,在注射EDU 2 h后,采用腹腔注射EDU的类似物胸苷嘧啶核苷(Thymidine)终止EDU的作用,于15 h后检测被EDU标记的SHF细胞的迁移情况。本研究采用该报道的剂量进行EDU标记和追踪发现,大部分胚胎不能被EDU有效的标记。
在文献报道的基础上,通过优化剂量和标记时间来改良EDU脉冲标记追踪SHF细胞迁移部署的实验方法。结果显示,采用40 mg/kg剂量和2 h的标记时间,在所有检测的胚胎中,SHF细胞都被有效标记,且与10 mg/kg剂量相比,在SpM处EDU标记细胞的数量明显增加。在此条件下,通过19 h的追踪,EDU标记的SHF细胞迁移进入远端OFT。统计结果显示,与10 mg/kg的剂量相比,采用40 mg/kg剂量显著地增加远端OFT处EDU阳性细胞的百分率; 而在两种剂量下,EDU阳性细胞迁移进入远端OFT的距离并没有差异。同时发现,在40 mg/kg剂量条件下,2 h和4 h的标记时间对EDU标记效率以及EDU标记细胞向OFT的迁移距离并没有差异。总之,通过优化EDU的剂量和标记时间,本研究拟提供一种有效、方便的追踪SHF迁移部署的方法。
1 材料与方法 1.1 材料C57BL/6J小鼠购自南京大学模式动物研究所,EDU及染色试剂盒购于Invitrogen公司(C10338),DAPI购于生工生物工程(上海)有限公司(6584)。
1.2 方法 1.2.1 EDU和胸苷嘧啶核苷腹腔注射实验前1 d将成年雄鼠和雌鼠合笼,第2天上午检栓,将该天见栓受孕的孕鼠标记为E 0.5(胚胎发育第0.5 d)。按照文献报道,在E 9.25时,腹腔注射给予孕鼠一定剂量的EDU,在注射EDU 2 h后,给予孕鼠10倍剂量的EDU类似物胸苷嘧啶核苷终止EDU作用。追踪19 h后处死孕鼠,收获胚胎(约为E 10.0)。将收获的胚胎进行连续石蜡切片和后续的EDU检测。EDU粉末用灭菌的PBS配成浓度为2.5 mg/mL(10 mmol/L)的原液,原液用PBS稀释为1 mg/mL的工作浓度使用; 胸苷嘧啶核苷用灭菌的双蒸水配成48.5 mg/mL原液,原液用双蒸水稀释使用。所有操作均在遵守并符合实验动物福利及动物管理等相关条例的条件下进行,本研究得到了南京大学模式动物研究所伦理委员会的批准。
1.2.2 胚胎的固定、脱水、包埋、切片(1)颈椎脱臼处死孕鼠,于预冷PBS中小心分离胚胎; (2)4%多聚甲醛固定胚胎2 h; (3)PBS清洗2次,每次5 min; (4)梯度乙醇脱水:30%乙醇,15 min→50%乙醇,15 min→70%乙醇,15 min→85%乙醇,15 min→95%乙醇,15 min; (5)正丁醇透明3次,每次10 min; (6)65℃透蜡1 h,中间换蜡2-3次; (7)将胚胎组织进行石蜡包埋; (8)石蜡包埋胚胎进行连续切片,厚度5 µm; (9)胚胎石蜡切片进行EDU染色。
1.2.3 EDU检测(1)石蜡组织切片复水:二甲苯3次,每次10 min→梯度乙醇复水(100%乙醇,2 min→95%乙醇,2 min→85%乙醇,2 min→70%乙醇,2 min→50%乙醇,2 min→H2O,2 min); (2)2 mg/mL甘氨酸清洗10 min; (3)0.5% TritonX-100(PBST)通透20 min; (4)PBS清洗5 min; (5)EDU染色混合液室温避光孵育1 h,染色混合液成分如下:1×Click-iT EdU reaction buffer:430 µL,10×Click-iT EdU buffer additive:50 µL,CuSO4(10 mmol/L):20 µL,Alexa Fluor 555 azide:1.2 µL; (6)0.5% Tritonx-100 in 1×PBS清洗2-3次,每次10 min; (7)甲醇清洗1-2次,每次5 min; (8)PBS清洗5 min; (9)DAPI工作液室温避光孵育30 min; (10)封片,leica激光共聚焦显微镜下荧光成像。
1.2.4 结果统计分析使用ImageJ软件统计分析EDU迁移的距离以及EDU阳性细胞的百分率,将胚胎中包含OFT及SpM的部位进行石蜡切片,对每只胚胎OFT及SpM连续切片的染色结果进行测量。使用Graphpad 6.0对测量结果进行统计分析。*代表P < 0.05,**代表P < 0.01,***代表P < 0.001。
2 结果 2.1 10 mg/kg剂量EDU显示较差的标记效果首先给予孕鼠10 mg/kg的EDU(文献报道的剂量),2 h后注射100 mg/kg的胸苷嘧啶核苷终止EDU作用; 19 h后处死孕鼠,收获E 10.0胚胎并进行连续石蜡切片和后续的EDU检测。同时为了更好的分析EDU标记结果,选取孕鼠的小肠组织检测EDU的标记情况(存在大量增殖的细胞)。
结果(图 1)发现,所有孕鼠的小肠组织都能被EDU有效的标记; 在我们由4只孕鼠获得的22枚胚胎中,只有10枚(50%)胚胎被EDU有效标记,在另外超过50%的胚胎中,大部分胚胎没有EDU标记的细胞,一部分胚胎有极少量的细胞被EDU标记; 且由同一孕鼠获取的胚胎中,有些胚胎能被EDU标记,有些却未被标记。以上结果显示,采用文献报道10 mg/kg剂量的EDU,可以对孕鼠组织进行有效的标记,但对胚胎的标记效果较差。
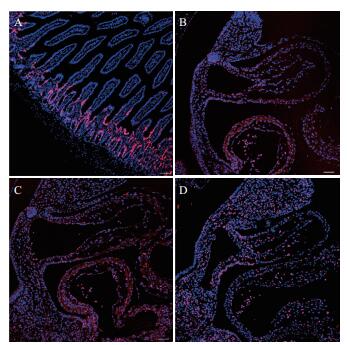
|
| 图 1 10 mg/kg剂量EDU在胚胎中的标记效果 A:孕鼠小肠中EDU标记情况; B-D:E 10.0,胚胎中EDU的标记情况。标尺= 50 µm |
10 mg/kg剂量的EDU可对孕鼠组织进行有效标记,而胚胎则不能进行有效标记。我们推测可能因为胚胎存在胎盘屏障,相对于孕鼠自身的组织,剂量过小的EDU较难渗透到胚胎组织中。因此,我们将EDU剂量增加至40 mg/kg,并采用400 mg/kg剂量的胸苷嘧啶核苷终止EDU标记。
为了检测该剂量的EDU和胸苷嘧啶核苷是否对孕鼠及胚胎产生毒性,将注射EDU和胸苷嘧啶核苷的孕鼠继续饲养,发现这些孕鼠是可以正常产仔,且产下的小崽与正常小崽并没有区别。在分离胚胎过程中分析观察孕鼠的形态、内脏器官,以及胚胎的发育情况。结果(图 2)显示,该剂量的EDU和胸苷嘧啶核苷没有影响孕鼠和胚胎的正常机能和发育,不会对孕鼠和胚胎造成毒性; 且由6只孕鼠获取的31只胚胎均被EDU有效标记,在胚胎中出现大量EDU阳性的SHF细胞,且EDU标记的SHF细胞已经迁移进入远端OFT。
|
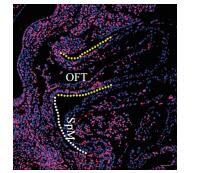
| 图 2 E 10.0,胚胎中EDU的标记情况 白色虚线标识的是SpM部位,黄色虚线标识的是OFT部位。标尺= 50 µm |
检测EDU在SpM处对SHF祖细胞的标记区域及标记百分率(在SpM处,EDU阳性细胞占SpM处所有细胞的百分率)。结果(图 3)显示,EDU标记的SHF细胞只存在于SpM,没有出现在OFT区域; 胚胎连续切片EDU检测和统计分析结果表明,SpM处EDU阳性细胞约占整个SpM细胞的53%。以上结果说明,采用40 mg/kg的剂量属于安全剂量,且对胚胎的SHF细胞能够进行有效的标记。
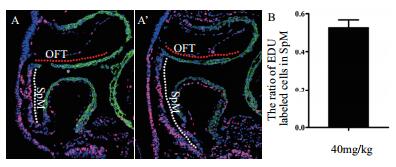
|
| 图 3 40 mg/kg剂量EDU对SHF细胞的标记情况 A-A’:E 9.25,胚胎中EDU标记SHF细胞的分布; B:E 9.25,SpM处EDU阳性细胞的百分率。白色虚线标识的是SpM部位,红色虚线标识的是OFT部位。标尺= 50 µm |
为评估剂量对追踪SHF细胞迁移的效果,我们将40 mg/kg和10 mg/kg两种剂量的效果进行对比分析。由于采用10 mg/kg剂量对胚胎的标记效率较低,通过增加孕鼠数量来增加被有效标记的胚胎数量。
统计分析EDU阳性细胞迁移进入OFT处的距离,以及EDU阳性细胞在远端OFT迁移距离中EDU阳性细胞的百分率(以下简称OFT处EDU阳性细胞百分率)。结果(图 4)显示,两种剂量对EDU阳性SHF细胞在远端OFT的迁移距离没有差别; 相比10 mg/kg剂量(OFT处EDU阳性细胞百分率为31%),40 mg/kg剂量标记的胚胎中,OFT处EDU阳性细胞的百分率有了显著性提高(54%),且OFT处EDU阳性细胞的百分率与E 9.25时SpM处EDU阳性细胞百分率一致。
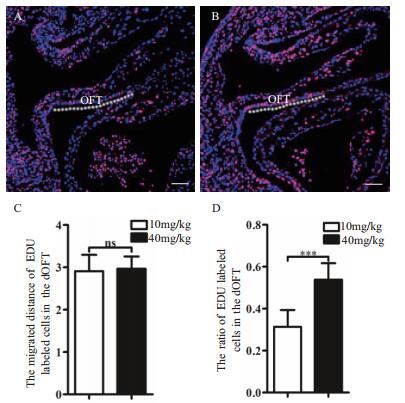
|
| 图 4 剂量对追踪SHF细胞迁移的影响 A:E 10.0,10 mg/kg剂量EDU追踪SHF细胞向OFT迁移; B:E 10.0,40 mg/kg剂量EDU追踪SHF细胞向OFT迁移; C:统计分析10 mg/kg与40 mg/kg剂量,EDU阳性细胞在远端OFT的迁移距离; D:统计分析10 mg/kg与40 mg/kg剂量,OFT处EDU阳性细胞的百分率。白色虚线标识的是EDU阳性细胞迁移到达远端OFT的距离。标尺= 50 µm |
以上结果表明,采用40 mg/kg剂量的EDU脉冲标记能够真实、有效地追踪SHF细胞向OFT迁移。
2.4 评估EDU脉冲标记时间的影响为了检测EDU标记时间对标记效率及细胞迁移的影响,在40 mg/kg EDU剂量条件下,分析比较2 h和4 h的标记效率。由于E 10.0时OFT处EDU阳性细胞的百分率与E 9.25时SpM处EDU阳性细胞百分率一致,这里用E 10.0处EDU阳性细胞的百分率分析EDU的标记效率。
注射EDU,分别在2 h和4 h给予400 mg/kg胸苷嘧啶核苷终止标记,19 h后收获E 10.0胚胎,分析统计OFT处EDU阳性SHF细胞的百分率和迁移距离。结果(图 5)显示,4 h EDU标记时间与2 h EDU标记时间,在OFT处EDU阳性SHF细胞的百分率和迁移距离中没有表现出差异。说明2 h标记时间即可将SpM处增殖的SHF进行充分有效的标记。考虑到4 h的标记可能会对细胞迁移产生一定的影响,采用2 h的EDU标记时间具有一定的优势。
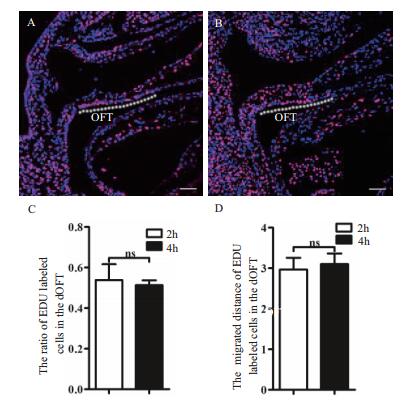
|
| 图 5 EDU标记时间的影响 A:E 10.0,40 mg/kg剂量EDU作用2 h,追踪SHF细胞迁移; B:E 10.0,40 mg/kg剂量EDU 4 h,追踪SHF细胞迁移; C:统计分析2 h和4 h作用时间,OFT处EDU阳性细胞的百分率; D:统计分析2 h和4 h作用时间,EDU阳性细胞在远端OFT的迁移距离。白色虚线标识的是EDU阳性细胞迁移到达远端OFT的距离。标尺= 50 µm |
先天性心脏缺陷中约有30%是由于OFT发育缺陷引起的。OFT和RV是由第二心场祖细胞贡献发育而来的,SHF祖细胞发育缺陷将引起动脉及对应心室排列、动脉分隔的缺陷,在人和小鼠中导致DORV、大动脉转位、PTA等心脏发育的异常。迄今为止,SHF祖细胞向OFT迁移、部署的细胞生物学过程仍是尚未阐明清楚的问题,也是目前很多科学工作者正在研究攻克的方向。目前,研究SHF迁移、部署过程所采用的实验方法有胚胎显微注射染料并结合胚胎体外培养[3, 10]、胚胎厚切片培养结合双光子显微成像系统[15]、孕鼠腹腔注射EDU脉冲标记结合石蜡切片免疫荧光染色技术[12-13]等。前两种方法对实验条件、操作环境、仪器设备及实验人员的操作等均有很高的要求和难度,需要配套有相应的实验条件和设备,给实验的实施带来了很大的挑战。而EDU脉冲标记是通过将EDU腹腔注射孕鼠,EDU掺入处于细胞增殖S期正在复制的DNA分子中,基于EDU与染料的共轭反应可以对EDU进行简单、快速、准确的检测,实验操作简单,对操作人员的技术、实验设备和条件要求不高。因此,EDU脉冲标记追踪SHF细胞的迁移部署过程具有很强的实施性和操作性。
本研究在使用文献报道的方法进行EDU脉冲标记追踪SHF细胞的迁移过程中发现,EDU不能将胚胎中处于增殖期的细胞进行有效的标记。在此基础上,通过调整EDU的剂量及标记时间,我们探索并优化出标记追踪SHF细胞迁移的有效方法:给予孕鼠腹腔注射40 mg/kg剂量的EDU,标记2 h后,腹腔注射给予400 mg/kg的胸苷嘧啶核苷终止EDU标记,继续追踪19 h可在远端OFT处观察到大量EDU阳性的细胞。
4 结论本实验优化了EDU脉冲标记追踪SHF细胞迁移部署的方法,在对孕鼠和胚胎不产生毒性的前提下,显著提高EDU在胚胎中的标记效果以及在SHF细胞的标记效率,提供了一种有效、方便的追踪SHF迁移部署的方法。
| [1] |
Vincent SD, Mayeuf-Louchart A, Watanabe Y, et al. Prdm1 functions in the mesoderm of the second heart field, where it interacts genetically with Tbx1, during outflow tract morphogenesis in the mouse embryo[J]. Hum Mol Genet, 2014, 23(19): 5087-5101. DOI:10.1093/hmg/ddu232 |
| [2] |
Bruneau BG. The Developmental Genetics of Congenital Heart Disease[J]. Nature, 2008, 451(7181): 943-948. DOI:10.1038/nature06801 |
| [3] |
Sinha T, Li D, Theveniau-Ruissy M, et al. Loss of Wnt5a disrupts second heart field cell deployment and may contribute to Oft malformations in digeorge syndrome[J]. Hum Mol Genet, 2015, 24(6): 1704-1716. DOI:10.1093/hmg/ddu584 |
| [4] |
Buckingham M, Meilhac S, Zaffran S. Building the mammalian heart from two sources of myocardial cells[J]. Nat Rev Genet, 2005, 6(11): 826-835. DOI:10.1038/nrg1710 |
| [5] |
Dyer LA, Kirby ML. The Role of secondary heart field in cardiac development[J]. Dev Biol, 2009, 336(2): 137-144. DOI:10.1016/j.ydbio.2009.10.009 |
| [6] |
Vincent SD, Buckingham ME. How to make a heart:the origin and regulation of cardiac progenitor cells[J]. Curr Top Dev Biol, 2010, 90: 1-41. DOI:10.1016/S0070-2153(10)90001-X |
| [7] |
Kelly RG, Brown NA, Buckingham ME. The arterial pole of the mouse heart forms from Fgf10-Expressing cells in pharyngeal mesoderm[J]. Dev Cell, 2001, 1(3): 435-440. DOI:10.1016/S1534-5807(01)00040-5 |
| [8] |
Mesbah K, Harrelson Z, Theveniau-Ruissy M, et al. Tbx3 is required for outflow tract development[J]. Circ Res, 2008, 103(7): 743-750. DOI:10.1161/CIRCRESAHA.108.172858 |
| [9] |
Li P, Pashmforoush M, Sucov HM. Retinoic acid regulates differentiation of the secondary heart field and Tgfbeta-mediated outflow tract septation[J]. Dev Cell, 2010, 18(3): 480-485. DOI:10.1016/j.devcel.2009.12.019 |
| [10] |
Uribe V, Badia-Careaga C, Casanova JC, et al. Arid3b is essential for second heart field cell deployment and heart patterning[J]. Development, 2014, 141(21): 4168-4181. DOI:10.1242/dev.109918 |
| [11] |
Rana MS, Theveniau-Ruissy M, De Bono C, et al. Tbx1 coordinates addition of posterior second heart field progenitor cells to the arterial and venous poles of the heart[J]. Circ Res, 2014, 115(9): 790-799. DOI:10.1161/CIRCRESAHA.115.305020 |
| [12] |
Shenje LT, Andersen P, Uosaki H, et al. Precardiac deletion of numb and numblike reveals renewal of cardiac progenitors[J]. Elife, 2014, 3: e02164. DOI:10.7554/eLife.02164 |
| [13] |
Li D, Sinha T, Ajima R, et al. Spatial regulation of cell cohesion by Wnt5a during second heart field progenitor deployment[J]. Dev Biol, 2016, 412(1): 18-31. DOI:10.1016/j.ydbio.2016.02.017 |
| [14] |
van den Berg G, Abu-Issa R, de Boer BA, et al. A caudal proliferating growth center contributes to both poles of the forming heart tube[J]. Circ Res, 2009, 104(2): 179-188. DOI:10.1161/CIRCRESAHA.108.185843 |
| [15] |
Francou A, Saint-Michel E, Mesbah K, et al. Tbx1 regulates epithelial polarity and dynamic basal filopodia in the second heart field[J]. Development, 2014, 141(22): 4320-4331. DOI:10.1242/dev.115022 |



