尽管心血管疾病的预防、诊断和治疗方面取得了重大进展,但其仍为全球范围内主要的死亡原因[1]。动脉粥样硬化是动脉粥样斑块积聚引起的以动脉管腔狭窄为主要特征的一类疾病,是大多数心血管疾病的表现并可导致心肌梗塞或中风[2]。平滑肌细胞(Vascular smooth muscle cells,VSMC)构成了血管的主要细胞组成,也是血管病理过程的重要参与者,在动脉粥样硬化过程中伴随着平滑肌细胞的增殖、迁移等过程,且平滑肌细胞和巨噬细胞会吞噬脂质进而变成泡沫细胞[3]。有研究表明血管平滑肌细胞的增殖和迁移是内膜增生的关键[4],内膜增生是导致动脉硬化[5]、血管成形术后再狭窄等病理生理过程的重要因素。在正常情况下,VSMCs在动脉中膜保持非增殖状态;在受伤或其他刺激作用下,例如缺氧等,中层VSMCs发生表型转换[6-7],迁移至内膜[8-9],开始增殖并分泌细胞外基质,导致动脉内膜增生,血管腔狭窄,即新内膜形成[4],并进一步导致严重的心血管疾病,如高血压,缺血性疾病和随后的心肌梗塞、中风和充血性心力衰竭[10-11]。这些病理生理过程都表明,平滑肌细胞对心血管疾病的发生发展都有着重要作用。因此,研究VSMCs增殖、迁移以及内膜形成的病理生理学特征和分子机制将对临床上心血管疾病的治疗有一定指导意义。
细胞的增殖、迁移等过程离不开细胞骨架的重构[12],该过程主要涉及肌动蛋白(Actin)解聚和加聚的动态平衡过程,在其解聚的过程中有众多的解聚因子参与,如ADF/cofilin、WDR1等;ADF/cofilin是actin切割和解聚的主要因子,在肌动蛋白动力学(Actin dynamics)过程中起着至关重要的作用。Wdr1是果蝇中AIP1(肌动蛋白相互作用蛋白1)的哺乳动物同系物,位于人4号染色体上,是ADF/cofilin的主要辅助因子[13];WDR1能促进ADF/cofilin介导的对肌动蛋白丝(F-actin)的解聚作用[14-15],从而调控细胞内actin解聚和加聚的平衡[16]。WDR1调控的actin dynamics直接影响细胞迁移、细胞连接[17]、细胞增殖等生物学过程[16]。有报道表明在乳腺癌中Wdr1的高表达能够促进癌细胞的迁移以及增殖[18-19]。我们之前的研究发现:Wdr1的缺失严重影响肺癌细胞的增殖与迁移(未发表数据);在胚胎发育过程中,Wdr1的缺失导致致死表型[20]。然而,迄今为止WDR1在平滑肌细胞中的作用还未见报道。
平滑肌细胞迁移和增殖在血管内膜损伤修复过程中起重要作用,WDR1介导的肌动蛋白解聚是细胞增殖和迁移所必需的。基于以上两点,我们推测WDR1可能在血管平滑肌细胞介导的血管损伤修复过程中发挥重要作用。本研究拟利用条件性诱导敲除小鼠在主动脉血管平滑肌细胞中敲除Wdr1,以研究WDR1对平滑肌细胞迁移和增殖的影响,为血管损伤修复的机制提供新的方向。将带有tamoxifen诱导表达的ERT2Cre小鼠与Wdr1f/f小鼠[21]交配后得到Wdr1条件性诱导敲除小鼠,并分离出原代平滑肌细胞。通过tamoxifen诱导得到敲除Wdr1的原代平滑肌细胞,研究结果表明Wdr1敲除后抑制平滑肌细胞的增殖和迁移能力。
1 材料与方法 1.1 材料 1.1.1 小鼠购自南京大学模式动物研究所。所有的动物实验均经武汉科技大学动物伦理委员会批准,实验过程中对动物的处理均符合动物伦理学标准。
1.1.2 主要试剂鼠单抗肌动蛋白SMA(abcam公司,ab7817);兔多抗WDR1(proteintech,13676-1-AP);DAPI购自生工生物工程(上海)有限公司(6584);羊抗鼠荧光二抗(488)购自武汉博士德生物工程有限公司(BA1126);0.1%明胶(100 mL ddH2O中加入0.1 g明胶,高压灭菌,冷却备用);75%乙醇(用ddH2O配制);无菌PBS;4%的多聚甲醛购自武汉博士德生物工程有限公司(AR1068);4-羟基他莫昔芬(Sigma,H7904)。
1.1.3 培养基高糖DMEM细胞培养基,使用高糖DMEM干粉(GIBCO)配制,加入800 mL超纯水,加入碳酸氢钠3.7 g,HEPES(Sigma)2.383 g,调节pH至7.4,并定容至1 L,0.22 μm滤膜过滤除菌。使用时加入10%的胎牛血清(FBS,hyclone),100 U/mL青霉素和100 mg/mL链霉素。
1.1.4 细胞分离消化液Ⅱ型胶原酶(Invitrogen)溶于DMEM高糖培养基,使其浓度为1 mg/mL(含10%胎牛血清和双抗),0.22 μm滤器过滤除菌即用。
1.1.5 小鼠基因组提取液及引物小鼠组织裂解液配置如表 1,使用时按照300 μL裂解液中加入5 μL浓度为20 mg/mL的蛋白酶K。基因型鉴定引物见表 2。
ERT2Cre小鼠与Wdr1f/f小鼠交配得到的子代基因型为Wdr1f/+;ERT2Cre杂合子小鼠,回交得到纯合子小鼠Wdr1f/f;ERT2Cre。
1.2.2 基因型鉴定在小鼠出生后7 d,剪小鼠脚趾编号,用小鼠组织裂解液消化剪掉的脚趾(每个样品加入300 μL裂解液以及5 μL浓度为20 mg/mL的蛋白酶K),放在55℃水浴锅中过夜,第2天加入700 μL的无水乙醇,12 000 r/min离心2 min,去掉上清加入600 μL的70%的乙醇重悬沉淀,12 000 r/min离心2 min后弃掉乙醇加200 μL的无菌水溶解沉淀。通过Wdr1 Flox特异性引物以及Cre特异性引物以提取的基因组为模板做PCR,基因型鉴定结果确定回交后代基因型为Wdr1f/f;ERT2Cre,即Wdr1条件性诱导敲除小鼠构建成功。
1.2.3 血管平滑肌的分离取4-8周条件性诱导敲除小鼠,颈椎脱臼处死后,置于75%乙醇中浸泡1 min,打开胸腔和腹腔,用5 mL注射器穿刺左心室,PBS缓冲液冲洗主动脉,游离并且完整分离出主动脉;在35 mm平皿中加入2 mL PBS,将分离出的主动脉放入皿中,在解剖镜下剥离主动脉上附着的脂肪等组织,将血管转移到另一个35 mm平皿中,加入2 mL消化液,在培养箱中消化10 min;加入2 mL正常的DMEM高糖培养基终止消化,在解剖镜下剥离主动脉外膜,消化后外膜更好剥离;将处理好的血管转移到另一干净的35 mm平皿,迅速用眼科剪剪成1 mm3大小的块状,加入消化液消化2 h,期间用0.1%的明胶包被35 mm平皿1 h,弃掉明胶在操作台中自然风干;消化期间每隔0.5 h观察一下小块,并且用枪稍加吹打,约2 h后小块基本消化完全,加入等体积的DMEM培养基终止消化,1 000 r/min离心5 min,弃掉上清,用1 mL正常DMEM培养基重悬,将悬液接种于35 mm包被过的平皿,补足培养基到4 mL,静止培养3 d,按照2条血管一个平皿,3 d可以长满,这时细胞可以正常传代。
1.2.4 免疫荧光鉴定分离细胞将干净盖玻片放入12孔板,包被方法同前。0.25%胰酶消化,将细胞接种到附有盖玻片的12孔板中,第2天待细胞伸展后,弃掉培养基,用PBS清洗5 min,加入1 mL 4%多聚甲醛室温固定20 min,弃掉多聚甲醛,加PBS洗3次,每次5 min;加入PBST(0.2% Triton X-100 in PBS)1 mL室温通透5 min,加PBS洗3次,每次5 min;用5%的山羊血清室温封闭1 h;用5%的山羊血清稀释α-SMA(1:200)4℃孵育过夜。用PBS清洗3次,每次5 min;用PBS稀释DAPI(1mg/mL,1:1 000)和羊抗鼠荧光二抗(1:200)室温孵育2 h(避光),用PBS清洗3次,每次5 min,50%甘油封片,激光共聚焦显微镜观察。
1.2.5 平滑肌中Wdr1的诱导敲除将分离的SMCs接种于6孔板,正常培养1 d,待细胞密度接近于80%时,实验组加入4-羟基他莫昔芬(10 mmol/L)按照1:10 000与培养基混合加入6孔板,对照组加入相同体积的DMSO作为对照;混合培养2 d;每天都换含有4-羟基他莫昔芬的新鲜培养基。
1.2.6 Western blotting检测敲除效率取6孔板中收集的细胞提取蛋白,上样量为60 µg,经10%分离胶分离,采用PVDF膜转膜,5%脱脂牛奶室温封闭1 h;一抗WDRl抗体(1:1 000稀释液稀释),4℃孵育过夜;二抗HRP标记的羊抗兔IgG(1:5 000,5%脱脂牛奶稀释)室温孵育1 h。用ECL显色试剂对膜进行显色,通过显影成像分析系统(Biorad)对条带进行显影、成像和保存,分析以GAPDH(1:3 000,5%脱脂牛奶稀释)蛋白表达作为参照,应用ImageJ软件对条带进行定量分析。测定目的显影条带和内参照GAPDH的灰度值,结果以比值(目的条带灰度值/内参照条带灰度值)表示。
1.2.7 细胞划痕实验取原代诱导2 d的细胞接种于6孔板,接种密度为1×106个/孔,24 h后用200 μL的无菌枪头垂直于6孔板底水平画出直线,确保画出的直线宽度一致。用无菌PBS清洗细胞3次,换新鲜培养基培养,分别于0 h、12 h、24 h对同一位置进行观察拍照。计算划痕的面积,结果以12 h、24 h面积/相对应0 h面积来表示。
1.2.8 CCK8检测增殖取诱导的原代细胞按照1×103个/孔接种96孔板,每组4个复孔,在接种细胞的孔周围每孔补上100 μL的无菌PBS;12 h后加入10 μL的CCK8溶液,在37℃培养箱培养1 h,通过多功能酶标仪检测OD450处的吸光值,每隔24 h测一次,连续测3 d,绘制细胞增殖曲线。
1.2.9 统计学分析统计学分析采用不对称双边t检验,数据采用x±s来表示,P<0.05表示有统计学意义。
2 结果 2.1 成功构建出Wdr1f/f;ERT2Cre小鼠模型将构建的Wdr1f/f雌性小鼠与ERT2Cre雄性小鼠交配得到基因型为Wdr1f/+;ERT2Cre小鼠;将基因型为Wdr1f/+;ERT2Cre雄性小鼠与Wdr1f/f雌性小鼠交配(图 1),得到基因型为Wdr1f/f;ERT2Cre的小鼠(图 2)。
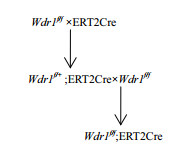
|
| 图 1 Wdr1f/f;ERT2Cre小鼠构建策略 |
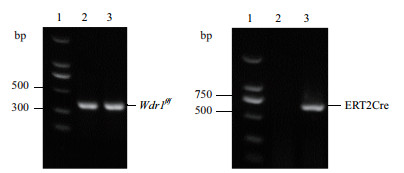
|
| 图 2 小鼠基因型鉴定 1:marker;2:Wdr1f/f;3:Wdr1f/f;ERT2Cre |
取4-8周龄小鼠的主动脉分离出的SMCs经过3 d静置培养后能够铺满35 mm皿底。将分离的SMCs接种于含有载玻片的培养皿中,通过免疫荧光实验检测分离的SMCs。结果(图 3)显示,分离的平滑肌标志性marker α-SMA都呈现阳性信号,说明该分离方法能够得到高纯度的平滑肌细胞。
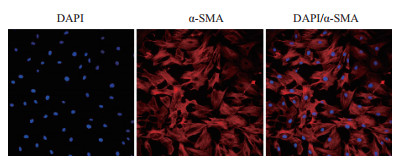
|
| 图 3 免疫荧光鉴定分离的SMCs |
为了在分离的SMCs中敲除Wdr1,将分别由基因型为Wdr1f/f;ERT2Cre和Wdr1f/f的小鼠中分离的SMCs,接种于6孔板,待细胞密度达到80%,加入4-羟基他莫昔芬诱导2 d后,提取蛋白进行Western blotting检测WDR1的表达水平。结果(图 4)表明,和Wdr1f/f对照组SMCs相比,Wdr1f/f;ERT2Cre实验组SMCs中WDR1的表达水平显著下降。
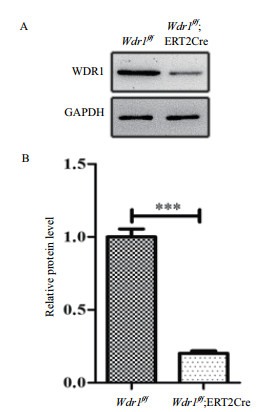
|
| 图 4 Western blotting检测Wdr1敲除效率 A:4-羟基他莫昔芬诱导后,Western blotting检测SMC中WDR1的表达水平。B:统计结果表明:4-羟基他莫昔芬诱导后,在Wdr1f/f;ERT2Cre组SMC中WDR1水平显著下调,*** P<0.001 |
WDR1是ADF/cofilin的主要辅助因子,ADF/cofilin是介导肌动蛋白解聚的主要因子,肌动蛋白是细胞骨架构成的关键,因此我们推测Wdr1敲除后将会对细胞形态有影响。为了验证这个设想,将分离的SMCs接种于6孔板中,经4-羟基他莫昔芬诱导敲除Wdr1后,显微镜下观察细胞形态。形态及统计结果(图 5)显示,和对照组细胞相比,敲除Wdr1后SMCs形态有明显的改变,细胞变小、变圆。

|
| 图 5 4-羟基他莫昔芬诱导后的细胞形态 A:箭头显示基因型为Wdr1f/f;ERT2Cre的实验组细胞诱导敲除Wdr1后细胞形态发生显著性改变;B/C:统计结果显示,实验组Wdr1f/f;ERT2Cre细胞横截面积以及长宽比均小于对照组Wdr1f/f |
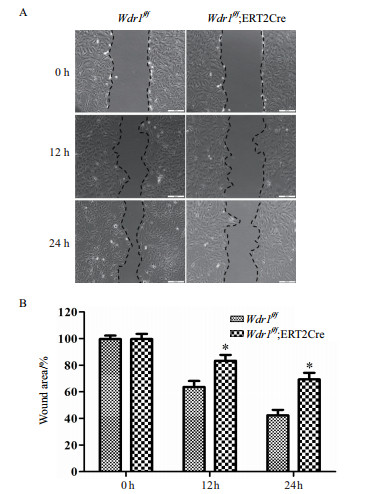
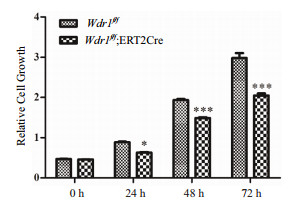
细胞的增殖、迁移等过程离不开细胞骨架的重构,该过程主要涉及肌动蛋白(Actin)解聚和加聚的动态平衡过程,在其解聚的过程中有众多的解聚因子参与,其中包括WDR1。为了进一步研究WDR1对平滑肌细胞生物学功能的影响,分别通过划痕实验和CCK8实验进行细胞迁移和增殖能力的检测。结果(图 6)显示,Wdr1敲除组细胞的迁移能力明显弱于对照组;Wdr1敲除组细胞的增殖能力也明显减弱(图 7)。
|
| 图 6 划痕实验检测细胞迁移能力 A:划痕-伤口愈合实验检测Wdr1敲除后迁移能力的变化;B:统计结果显示,与对照组相比实验组敲除Wdr1后,细胞迁移能力明显受到抑制。*:P<0.05;**:P<0.01;***:P<0.001 |
|
| 图 7 CCK8实验检测细胞增殖能力 细胞增殖实验检测Wdr1敲除后的增殖能力,与对照组相比,实验组敲除Wdr1后增殖能力明显受到抑制。*:P<0.05;**:P<0.01;***:P<0.001 |
平滑肌细胞的分离一直都是研究其功能的基础,我们在前人的基础上改进方法[22],在主动脉取出后通过胶原酶消化10 min使得外膜更好剥离,能够较好保证动脉的完整性,在剪块的操作过程中更方便,该方法在较短的时间内能大量的获得高纯度的平滑肌细胞,能满足后续的实验。平滑肌细胞的标志物有多种,α-SMA是最为广泛使用的一种,还有SM22α[23-24]、SM-MHC[25]、calponin等[26-27],这些标志物不仅可以用来显示分离平滑肌的纯度,还可以用来指示平滑肌细胞的分化程度。有研究表明,成纤维细胞在一定条件下去分化形成肌成纤维细胞也可表达α-SMA[28],因此本实验仅用SMA验证分离细胞的纯度有一定的局限性。
为研究WDR1在平滑肌中的作用,我们将Wdr1f/f小鼠[21]与ERT2Cre小鼠交配,并成功繁育出Wdr1条件性诱导敲除小鼠模型Wdr1f/f;ERT2Cre;将条件性敲除模型和动脉平滑肌细胞分离相结合,成功分离出大量的条件性敲除平滑肌细胞。结合体外4-羟基他莫昔芬诱导[29],在分离的平滑肌细胞中敲除Wdr1。敲除Wdr1后细胞形态发生明显改变,细胞增殖和细胞迁移能力被明显抑制,该结果与在乳腺癌细胞中报道的敲除WDR1影响癌细胞的迁移和增殖结果一致[15];但是WDR1在细胞增殖和迁移过程中的调控机制还有待进一步的研究。本研究构建的Wdr1条件性诱导敲除模型也为在体内研究WDR1对平滑肌细胞的影响提供了良好的模型基础。有文章报道[30]小鼠颈动脉结扎可诱导血管损伤以及内膜形成;后续的研究将根据该模型在Wdr1条件性诱导敲除小鼠的基础上构建内膜损伤修复模型,在体内研究WDR1对血管内膜形成的影响。
总之,本研究利用条件性敲除小鼠为工具,分离出SMCs并且体外诱导Wdr1的敲除,从细胞的功能及形态上研究了WDR1对平滑肌细胞的影响,这为后续血管损伤修复机制的研究提供了一定的基础。至于WDR1在分子水平如何调控平滑肌细胞的迁移和增殖,这将是我们后续研究的方向。
4 结论本研究通过构建Wdr1条件性诱导敲除小鼠以及SMCs的分离,成功分离并诱导出Wdr1敲除的原代血管平滑肌细胞。敲除Wdr1后,细胞的形态发生了明显的改变,并且细胞增殖和迁移受到显著抑制;该细胞模型和Wdr1条件性诱导敲除小鼠的构建对于研究Wdr1在平滑肌中的作用提供了有力的基础,为揭示血管损伤修复的病理机制提供了新方向。
| [1] |
Lakatta EG. Arterial and cardiac aging:major shareholders in cardiovascular disease enterprises:Part Ⅲ:cellular and molecular clues to heart and arterial aging[J]. Circulation, 2003, 107(3): 490-497. DOI:10.1161/01.CIR.0000048894.99865.02 |
| [2] |
Hamczyk MR, Villa-Bellosta R, Gonzalo P, et al. Vascular smooth muscle-specific progerin expression accelerates atherosclerosis and death in a mouse model of hutchinson-gilford progeria syndrome[J]. Circulation, 2018, 138(3): 266-282. DOI:10.1161/CIRCULATIONAHA.117.030856 |
| [3] |
Allahverdian S, Chaabane C, Boukais K, et al. Smooth muscle cell fate and plasticity in atherosclerosis[J]. Cardiovasc Res, 2018, 114(4): 540-550. DOI:10.1093/cvr/cvy022 |
| [4] |
Xie N, Chen M, Dai R, et al. SRSF1 promotes vascular smooth muscle cell proliferation through a Delta133p53/EGR1/KLF5 pathway[J]. Nat Commun, 2017, 8: 16016. DOI:10.1038/ncomms16016 |
| [5] |
Marchand A, Atassi F, Gaaya A, et al. The Wnt/beta-catenin pathway is activated during advanced arterial aging in humans[J]. Aging Cell, 2011, 10(2): 220-232. DOI:10.1111/acel.2011.10.issue-2 |
| [6] |
Owens GK, Kumar MS, Wamhoff BR. Molecular regulation of vascular smooth muscle cell differentiation in development and disease[J]. Physiol Rev, 2004, 84(3): 767-801. DOI:10.1152/physrev.00041.2003 |
| [7] |
Gomez D, Owens GK. Smooth muscle cell phenotypic switching in atherosclerosis[J]. Cardiovasc Res, 2012, 95(2): 156-164. DOI:10.1093/cvr/cvs115 |
| [8] |
Schwartz SM, Deblois D, O'brien ER. The intima. Soil for atherosclerosis and restenosis[J]. Circ Res, 1995, 77(3): 445-465. DOI:10.1161/01.RES.77.3.445 |
| [9] |
Wallitt EJ, Jevon M, Hornick PI. Therapeutics of vein graft intimal hyperplasia:100 years on[J]. Ann Thorac Surg, 2007, 84(1): 317-323. DOI:10.1016/j.athoracsur.2007.02.035 |
| [10] |
Liang M, Liang A, Wang Y, et al. Smooth muscle cells from the anastomosed artery are the major precursors for neointima formation in both artery and vein grafts[J]. Basic Res Cardiol, 2014, 109(5): 431. DOI:10.1007/s00395-014-0431-z |
| [11] |
Moran AE, Roth GA, Narula J, et al. 1990-2010 global cardiovascular disease atlas[J]. Glob Heart, 2014, 9(1): 3-16. DOI:10.1016/j.gheart.2014.03.1220 |
| [12] |
Bravo-Cordero JJ, Magalhaes MA, Eddy RJ, et al. Functions of cofilin in cell locomotion and invasion[J]. Nat Rev Mol Cell Biol, 2013, 14(7): 405-415. DOI:10.1038/nrm3609 |
| [13] |
Pruyne D, Evangelista M, Yang C, et al. Role of formins in actin assembly:nucleation and barbed-end association[J]. Science, 2002, 297(5581): 612-615. DOI:10.1126/science.1072309 |
| [14] |
Bamburg JR. Proteins of the ADF/cofilin family:essential regulators of actin dynamics[J]. Annu Rev Cell Dev Biol, 1999, 15: 185-230. DOI:10.1146/annurev.cellbio.15.1.185 |
| [15] |
Ono S. Functions of actin-interacting protein 1(AIP1)/WD repeat protein 1(WDR1) in actin filament dynamics and cytoskeletal regulation[J]. Biochem Biophys Res Commun, 2018, 506(2): 315-322. DOI:10.1016/j.bbrc.2017.10.096 |
| [16] |
Ono S. Regulation of actin filament dynamics by actin depolymerizing factor/cofilin and actin-interacting protein 1:new blades for twisted filaments[J]. Biochemistry, 2003, 42(46): 13363-13370. DOI:10.1021/bi034600x |
| [17] |
Chu D, Pan H, Wan P, et al. AIP1 acts with cofilin to control actin dynamics during epithelial morphogenesis[J]. Development, 2012, 139(19): 3561-3571. DOI:10.1242/dev.079491 |
| [18] |
Lee JH, Kim JE, Kim BG, et al. STAT3-induced WDR1 overexpression promotes breast cancer cell migration[J]. Cell Signal, 2016, 28(11): 1753-1760. DOI:10.1016/j.cellsig.2016.08.006 |
| [19] |
Xiang Y, Liao XH, Yao A, et al. MRTF-A-miR-206-WDR1 form feedback loop to regulate breast cancer cell migration[J]. Exp Cell Res, 2017, 359(2): 394-404. DOI:10.1016/j.yexcr.2017.08.023 |
| [20] |
Hu J, Shi Y, Xia M, et al. WDR1-regulated actin dynamics is required for outflow tract and right ventricle development[J]. Dev Biol, 2018, 438(2): 124-137. DOI:10.1016/j.ydbio.2018.04.004 |
| [21] |
Yuan B, Wan P, Chu D, et al. A cardiomyocyte-specific Wdr1 knockout demonstrates essential functional roles for actin disassembly during myocardial growth and maintenance in mice[J]. Am J Pathol, 2014, 184(7): 1967-1980. DOI:10.1016/j.ajpath.2014.04.007 |
| [22] |
Ray JL, Leach R, Herbert JM, et al. Isolation of vascular smooth muscle cells from a single murine aorta[J]. Methods Cell Sci, 2001, 23(4): 185-188. DOI:10.1023/A:1016357510143 |
| [23] |
Yang X, Dong M, Wen H, et al. MiR-26a contributes to the PDGF-BB-induced phenotypic switch of vascular smooth muscle cells by suppressing Smad1[J]. Oncotarget, 2017, 8(44): 75844-75853. |
| [24] |
Sun H, Cai S, Zhang M, et al. MicroRNA-206 regulates vascular smooth muscle cell phenotypic switch and vascular neointimal formation[J]. Cell Biol Int, 2017, 41(7): 739-748. DOI:10.1002/cbin.v41.7 |
| [25] |
Rensen SS, Doevendans PA, Van Eys GJ. Regulation and characteristics of vascular smooth muscle cell phenotypic diversity[J]. Neth Heart J, 2007, 15(3): 100-108. DOI:10.1007/BF03085963 |
| [26] |
Jalali S, Ramanathan GK, Parthasarathy PT, et al. Mir-206 regulates pulmonary artery smooth muscle cell proliferation and differentiation[J]. PLoS One, 2012, 7(10): e46808. DOI:10.1371/journal.pone.0046808 |
| [27] |
Carta L, Smaldone S, Zilberberg L, et al. p38 MAPK is an early determinant of promiscuous Smad2/3 signaling in the aortas of fibrillin-1(Fbn1)-null mice[J]. J Biol Chem, 2009, 284(9): 5630-5636. DOI:10.1074/jbc.M806962200 |
| [28] |
Sartore S, Chiavegato A, Faggin E, et al. Contribution of adventitial fibroblasts to neointima formation and vascular remodeling:from innocent bystander to active participant[J]. Circ Res, 2001, 89(12): 1111-1121. DOI:10.1161/hh2401.100844 |
| [29] |
Yang W, Lee YH, Jones AE, et al. The histone H2A deubiquitinase Usp16 regulates embryonic stem cell gene expression and lineage commitment[J]. Nat Commun, 2014, 5: 3818. DOI:10.1038/ncomms4818 |
| [30] |
Brown BA, Williams H, Bond AR, et al. Carotid artery ligation induced intimal thickening and proliferation is unaffected by ageing[J]. J Cell Commun Signal, 2017. |






