酿酒酵母(Saccharomyces cerevisiae)作为第一个完成基因组测序的真核生物[1],在现代分子生物学中作为重要的真核模式生物,具有重要的科研应用价值。酿酒酵母具有稳定的单倍体和二倍体细胞,基因组小,生命周期短,繁殖迅速,再加上其大部分基因功能都已得到验证且又与植物和动物细胞具有很多相同结构,因此往往被用于基因功能鉴定。理论上,和酵母任何一种遗传学特征相对应的不同生物的结构基因都能通过互补作用在酿酒酵母缺失突变体内得到鉴定[2-5]。单细胞真核生物酿酒酵母作为一种在实验系统研究方面具有许多内在优势的模式生物,为高等真核生物提供一个检测系统。
Na+,K+/H+反向转运体(Na+,K+/H+ exchanger,NHXs)是一类跨膜反向转运蛋白,属于一价阳离子/H+反向转运体(Cation/proton antiporter,CPA)基因家族中的CPA1亚家族,它们的生化活力是将Na+或K+与质子(H+)进行跨膜反向转运[6-8]。NHXs在细菌、酵母、植物和动物等生物体内广泛存在,并且一般具有多个家族成员,其在逆境响应、膜微囊运输、蛋白存储、细胞生长、pH调节、渗透调节、离子平衡及生长发育等生理生化过程中起着重要的作用[9-15]。根据进化分析和亚细胞定位,一般将NHXs分为三类:一类是定位于质膜上的成员,如拟南芥和胡杨的AtNHX7/SOS1、AtNHX8、PeSOS1;一类为定位于液胞膜上的成员,如拟南芥的AtNHX1-4;还有一类是定位于内膜(Endosomal NHXs)上的成员,如拟南芥和番茄的AtNHX5-6、LeNHX2[6, 9-11]。模式植物拟南芥中质膜上的AtNHX7/SOS1的作用及机制研究的比较清楚,液胞膜上的4个反向转运体在抗逆中的作用也得到了广泛研究,而内膜成员的研究近几年才获得实质性的进展[16-26]。人们通过转基因技术,将获得鉴定的NHX基因转到作物及树木中,得到了抗盐、抗旱及高产的改良品种[27-35]。因此,鉴定检测新的NHX基因尤其抗逆性强的生物体内的NHX基因,将对进一步深入了解它们的功能及创制新种质都具有重要的意义。
酿酒酵母NHX1基因编码的Na+,K+/H+反向转运体是酵母CPA家族的重要成员,定位于液胞膜和内膜系统,对维持离子动态平衡、调节pH及液胞融合起着重要的作用[36-37]。因此,建立酿酒酵母NHX1基因缺失突变菌株以用于植物或动物NHX基因的鉴定及功能研究具有重要意义。本研究利用侧翼同源PCR构建含有KanMX选择标记基因及与酿酒酵母NHX1基因序列上下游同源的基因敲除组件,通过同源重组的方式成功敲除酵母NHX1基因,构建了具有G418抗性的BJ3505 NHX1基因缺陷型突变株,并通过互补试验对酵母NHX1基因的功能及突变菌株进行了验证。
1 材料与方法 1.1 材料 1.1.1 菌株与质粒酿酒酵母BJ3505(Saccharomyces cerevisiae BJ3505)、大肠杆菌(Escherichia coli)DH5α、质粒pFA6a-kanMX6、pDR196。
1.1.2 主要试剂与仪器Taq DNA Polymerase(Fer-mentas)用于突变株鉴定;高保真PrimeSTARTMHS DNA Polymerase(TaKaRa)用于基因克隆和敲除组建克隆;DNA分子标准marker、质粒提取试剂盒、胶回收试剂盒、酵母DNA提取试剂盒均购自天根试剂公司产品;G418和FM4-64购自索莱宝公司;PCR仪和电泳仪设备为Bio-Rad;摇床、培养箱购自上海一恒;激光共聚焦显微镜(Olympus)。
1.1.3 培养基及培养条件大肠杆菌培养基为LB(1.0%胰化蛋白胨,1.0%氯化钠,0.5%酵母提取物,pH 7.0,固体培养基需加入1.5%的琼脂)培养基,37℃培养。BJ3505酵母菌基突变株培养基为YPD(1.0%酵母提取物,2.0%蛋白胨,2.0%葡萄糖,固体培养基需加入2.0%琼脂)和YPD+G418培养基,30℃培养。互补菌株筛选及生长培养基为SC-URA+G418选择培养基。部分酵母生长实验在AP(10 mmol/L精氨酸,8.0 mmol/L磷酸,2.0 mmol/L硫酸镁,1.0 mmol/L氯化钾,0.2 mmol/L氯化钙,2.0%的葡萄糖,微量元素及维生素)培养基上进行。
1.1.4 引物本研究所用各引物序列见表 1,根据质粒和基因已知序列利用Primer5.0软件设计,由华大基因公司合成。
以质粒pFA6a-kanMX6为模板,用Ko-F和Ko-R引物扩增获得敲除组件[38-39]。PCR反应条件:98℃5 min;98℃ 10 s、69℃ 15 s、72℃ 100 s,30个循环;72℃ 10 min。PCR产物经核酸电泳,胶回收纯化。回收获得的目的产物利用醋酸锂法转入感受态细胞BJ3505,利用G418抗性筛选阳性菌落,获得单菌落进一步在含有200 μg/mL G418的YPD培养板上筛选。对获得具有抗性的菌株进行扩增培养并提取DNA,利用酵母NHX1基因上游引物NHX-F与NHX1基因序列内引物NHX-R或KanMX序列内引物KanMX-R进一步鉴定验证。
1.2.2 互补菌株(BJ3505Δnhx1-C)的构建及筛选验证为了确定BJ3505Δnhx1的缺陷表型是由NHX1基因缺失引起的,本实验构建了功能互补菌株,以验证其表型能否恢复。提取BJ3505基因组DNA作为模板,用带有酶切位点的引物ScNHX1-Sal1-F和ScNHX1-Xho1-R进行PCR扩增,得到NHX1基因的开放阅读框,经酶切胶回收后与相同内切酶双酶切的pDR196载体酶连,构建得到转化载体pDR196-NHX1,经测序正确后利用醋酸锂法转入BJ3505Δnhx1突变株中,在含有G418的SC-URA选择培养板上筛选,获得的阳性菌株扩增培养并提取酵母总DNA,以此为模板,利用引物pDR96-F和pDR96-R进行PCR扩增验证。同时,空载质粒pDR196作为对照也转入BJ3505Δnhx1突变株中并筛选获得阳性菌株。
1.2.3 BJ3505Δnhx1和互补菌株的抗逆能力测定为了研究抗逆耐受,将用于实验的菌株先在相应的筛选板上划线培养。挑取单菌落接到AP培养基中震荡过夜培养,5 000×g离心后用无菌去离子水悬浮,再次离心,重复漂洗3次。用酶标仪测定菌液OD600值,调整起始浓度为0.12,10倍梯度稀释后取样4 μL点在含有NaCl、LiCl或潮霉素的YPD板或含有KCl的AP板上,培养板倒置于30℃培养箱内培养3 d,根据菌落生长情况鉴定抗逆能力。
1.2.4 BJ3505Δnhx1和互补菌株的液胞形态观察试验菌株在筛选板上划板培养,挑取单菌落接种到液体筛选培养基内震荡过夜培养,取100 μL菌液加入到含有10 mmol/L FM4-64的YPD培养液中,置于摇床内30℃过夜培养。取1.0 mL菌液放于离心管内,4℃ 4 000 r/min离心2 min,用PBS漂洗,再次离心,重复3次后用150 μL PBS悬浮菌体,取悬浮菌液20 μL,已熔冷却至50℃的0.6%琼脂糖溶液20 μL,加入同一离心管内混匀,取15 μL滴于载玻片中央,盖好盖玻片,于荧光显微镜下观察液胞形态。
2 结果 2.1 突变菌株构建结果 2.1.1 敲除组件扩增结果以质粒pFA6a-kanMX6为模板,扩增大小为1 560 bp的敲除组件片段,核酸电泳结果(图 1)显示得到与预期大小相符的单一片段条带;胶回收测序鉴定与预期序列信息完全符合。

|
| 图 1 PCR扩增敲除组件 M:DNA marker;Ko:敲除组件 |
利用醋酸锂法将纯化的敲除组件导入酿酒酵母BJ3505,通过同源重组敲除酵母NHX1基因,经PCR鉴定转化结果。突变菌株可以用引物NHX1-F和KanMX-R扩增出1 220 bp的条带,而引物NHX1-F和NHX1-R不能扩增出条带。野生型酵母可以用引物NHX1-F和NHX1-R扩增出817 bp的条带,而用引物NHX1-F和KanMX-R不能扩出条带。由于引物NHX1-R和KanMX-R分别是位于酵母基因NHX1和敲除组件内的序列,与酵母NHX1基因上游的引物NHX1-F组合,扩增结果说明同源重组整合成功,得到NHX1基因敲除突变菌株(图 2)。
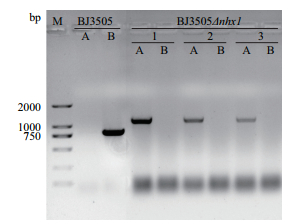
|
| 图 2 NHX1突变体验证 M:DNA marker;A:引物NHX1-F和KanMX-R;B:引物NHX1-F和NHX1-R |
以BJ3505总基因组DNA为模板,扩增包含酶切位点及保护碱基在内的NHX1基因完整的开放阅读框1 920 bp(图 3),经酶切后与相同双酶切的载体pDR196酶连构建互补载体pDR196-NHX1。将测序正确的pDR196-NHX1利用醋酸锂转化法导入酵母突变株BJ3505Δnhx1内,经含有G418的SC-URA筛选培养基筛选,利用引物pDR96-F和pDR96-R进行PCR鉴定。构建成功的互补菌株中可以扩增出2 353 bp的片段,而未导入互补载体的突变菌株扩增不出条带,证明互补菌株构建成功(图 4)。为进一步确定互补载体转入成功,我们提取酵母中的质粒,进行测序验证,结果表明酵母中存在的质粒为转入成功的互补质粒。
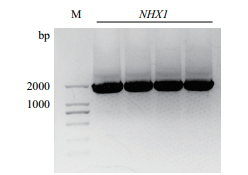
|
| 图 3 NHX1基因克隆 M:DNA marker;NHX1:酵母NHX1基因 |

|
| 图 4 互补菌株PCR鉴定 M:DNA marker;Δnhx1:BJ3505Δnhx1;Δnhx1-C:互补菌株 |
为了检测酵母ScNHX1的离子转运特性及突变菌株对逆境胁迫的响应能力,我们进行了胁迫条件下的酵母平板生长实验。酵母生长实验分别在含有潮霉素B、氯化钠或氯化锂的YPD培养基上或含有高浓度氯化钾的AP培养基上进行(图 5)。酵母突变体BJ3505Δnhx1在含有800 mmol/L KCl、150 mmol/L NaCl或12 mmol/L LiCl的培养基上生长受到严重抑制,而在同等条件下野生型酵母BJ3505可以正常生长(图 5-A-C)。酵母NHX1可以恢复突变株BJ3505Δnhx1对高钾、高盐或高锂的耐受能力,表达了ScNHX1的互补菌株的生长与野生型菌株生长相近,而转入空载pDR196质粒的突变菌株未恢复其耐受性。BJ3505Δnhx1酵母突变菌对潮霉素B(50 μg/mL)敏感,但互补菌株表现出与野生型接近的潮霉素B耐受性(图 5-D),这暗示ScNHX1可能参与膜微囊运输过程。这些结果表明,ScNHX1在酵母内调节K+、Na+及Li+的动态平衡,酵母NHX1基因的缺失导致突变株BJ3505Δnhx1抗逆能力降低,也从另一方面证明酵母突变株构建成功。
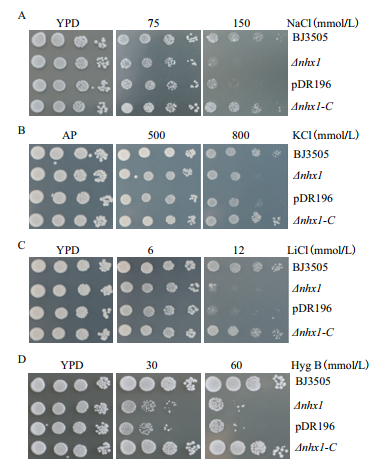
|
| 图 5 BJ3505Δnhx1和BJ3505Δnhx1-C抗逆性结果 Δnhx1:BJ3505Δnhx1;Δnhx1-C:互补菌株 |
荧光染料FM4-64染色的酵母在荧光显微镜下观察发现,酵母突变体BJ3505Δnhx1液胞形态异常,表现为一个酵母内存在多个液胞,而野生型及互补菌株表现为单液胞,同时发现在转入空载体的突变菌株中液胞也未恢复到野生型酵母水平(图 6)。这些现象说明,利用此法使酵母NHX1基因缺失导致液胞融合过程发生了改变,引起了液胞结构异常。
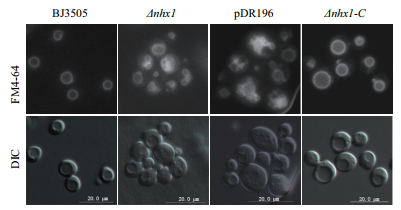
|
| 图 6 BJ3505Δnhx1和BJ3505Δnhx1-C液胞形态 Δnhx1:BJ3505Δnhx1;Δnhx1-C:互补菌株;标尺为20 μm |
酵母利用同源重组敲除基因的方法简单易行,可以在不影响基因组内其它功能基因的情况下对目的基因精准敲除。虞兰兰等[40]利用部分缺失的外源leu2片段取代了酵母染色体上的正常LEU2基因,构建了克鲁式乳酸酵母leu2突变体。Rothstein等[41]对一步中断法敲除基因的方法进行了研究,证明了该方法的可行性。Gaxiola等[42]利用筛选标记基因对酵母多个基因进行了同源重组敲除,通过功能互补对植物中相似基因进行了研究。Qiu等[43-44]也通过对酵母NHX1基因的敲除构建了nhx1突变株,发现酵母NHX1调节酵母液胞融合的起始过程。本文所用一步基因中断法具有突变位点明确,突变机制清楚,突变效率高及稳定性高等特点,通过已知选择基因KanMX序列与染色体上目的基因的同源重组与取代,成功敲除了NHX1基因,构建了稳定的酿酒酵母BJ3505的突变体(图 1,图 2),并成功克隆NHX1基因,得到互补菌株BJ3505Δnhx1-C(图 3,图 4),进一步通过互补试验对酵母NHX1基因的功能进行了验证(图 5,图 6)。构建获得的酿酒酵母BJ3505Δnhx1突变体将为新克隆的NHX基因的功能验证提供便利。
在植物中一般认为质膜NHXs负责向胞外排出Na+,液胞膜NHXs将Na+区域化到液胞中,而内膜NHXs在内膜系统内的Na+运输具有重要作用,且大部分NHXs具有K+转运功能。同时,在拟南芥内研究表明,不同的AtNHXs对离子的偏好性具有差异,AtNHX1偏好K+,AtSOS1/NHX7偏好Na+,AtNHX8偏好Li+,而AtNHX5和AtNHX6偏好Na+和K+[45]。虽然在酵母体内还有ENA、NHA、KHA等离子转运体的存在,但是NHX1基因的缺失,使NHX1蛋白不能在酵母体内合成,相应的功能缺失,导致突变菌株对逆境胁迫敏感,降低抗逆能力,液胞形态异常(图 5,图 6),本实验得到与相关报道相一致的结果[43, 46-48],说明酿酒酵母NHX1反向转运体在酵母体内具有不可替代的作用。实验结果还表明,酿酒酵母NHX1基因的缺失导致对Na+、K+和Li+的耐受性都降低,而互补NHX1可以恢复耐受能力,说明NHX1具有对这些离子的转运能力,这也预示酵母NHX1可能同时具有拟南芥各成员NHXs的偏好转运活性。
有研究表明,拟南芥内膜NHXs在囊泡运输和融合过程具有重要作用,酵母NHX1调节液胞融合的起始过程,说明二者在液胞融合中具有相似的功能。我们的实验结果也证明,敲除酵母NHX1基因导致液胞形态异常,出现多液胞现象,这再次证明酵母缺失NHX1会导致导致蛋白相应功能丧失,液胞融合活力降低(图 6)。酿酒酵母NHX1是具有12个跨膜区的离子反向转运体,其转运功能对调节液胞、细胞质及内膜系统内离子和pH的动态平衡具有决定性的作用,这也就会导致其缺失致使酵母表现出明显的特征,如抗逆性降低、液胞形态异常等。因此,利用酵母已知功能的NHX1的缺失突变体可以检测高等生物某一未知功能蛋白是否具有相似的功能,或对一些已知NHX进行互补试验也具有重要意义。拟南芥AtNHX1、AtSOS1的功能就在酵母nhx1突变体内得到了证实及验证。
4 结论本研究利用同源重组法成功的构建了NHX1基因缺失突变株,并通过实验证明酿酒酵母NHX1作为重要的离子反向转运体,在酿酒酵母BJ3505抵抗外界胁迫环境和液胞融合过程中发挥着重要的作用,同时,通过互补试验对酵母突变体构建的可行性进行了验证。
| [1] |
Wood V, Gwilliam R, et al. The genome sequence of Schizosaccharo-myces pombe[J]. Nature, 2002, 415(21): 871-880. |
| [2] |
崔东, 郑文岭, 马文丽, 等. 一种快速简便初步筛选酵母基因组文库的方法[J]. 广东医学, 2003(1): 19-20. DOI:10.3969/j.issn.1001-9448.2003.01.010 |
| [3] |
周佳, 康亚妮. 单细胞衰老研究的模式生物——酿酒酵母[J]. 生命科学, 2013(5): 504-510. |
| [4] |
唐香山, 张学文. 酿酒酵母表达系统[J]. 生命科学研究, 2004(S1): 106-109. |
| [5] |
周璐, 李越中, 李健. 酿酒酵母基因组学研究进展[J]. 生命科学, 1999(2): 87-91. |
| [6] |
Brett CL, Donowitz M, Rao R. Evolutionary origins of eukaryotic sodium/proton exchangers[J]. Am J Physiol Cell Physiol, 2005, 288(2): C223-C239. DOI:10.1152/ajpcell.00360.2004 |
| [7] |
Chang AB, Lin R, Keith SW, et al. Phylogeny as a guide to structure and function of membrane transport proteins[J]. Mol Membr Biol, 2004, 21(3): 171-181. DOI:10.1080/09687680410001720830 |
| [8] |
Maser P, Thomine S, Schroeder JI, et al. Phylogenetic relationships within cation transporter families of Arabidopsis[J]. Plant Physiol, 2001, 126(4): 1646-1667. DOI:10.1104/pp.126.4.1646 |
| [9] |
Bassil E, Coku A, Blumwald E. Cellular ion homeostasis: emerging roles of intracellular NHXNa+/H+ antiporters in plant growth and development[J]. J Exp Bot, 2012, 63(16): 5727-5740. DOI:10.1093/jxb/ers250 |
| [10] |
Chanroj S, Wang G, Venema K, et al. Conserved and diversified gene families of monovalent cation/H+ antiporters from algae to flowering plants[J]. Front Plant Sci, 2012, 3: 25. |
| [11] |
Pardo JM, Cubero B, Leidi EO, et al. Alkali cation exchangers: roles in cellular homeostasis and stress tolerance[J]. J Exp Bot, 2006, 57(5): 1181-1199. DOI:10.1093/jxb/erj114 |
| [12] |
Brett CL, Tukaye DN, Mukherjee S, et al. The yeast endosomal Na+(K+)/H+ exchanger Nhx1 regulates cellular pH to control vesicle trafficking[J]. Mol Biol Cell, 2005, 16(3): 1396-1405. DOI:10.1091/mbc.e04-11-0999 |
| [13] |
Blumwald E. Sodium transport and salt tolerance in plants[J]. Curr Opin Cell Biol, 2000, 12(4): 431-434. |
| [14] |
Dragwidge JM, Ford BA, Ashnest JR, et al. Two endosomal NHX-type Na+/ H+ antiporters are involved in auxin mediated development in Arabidopsis thaliana[J]. Plant Cell Physiol, 2018, 59(8): 1660-1669. DOI:10.1093/pcp/pcy090 |
| [15] |
Fan L, Zhao L, Hu W, et al. Na(+), K(+)/H(+)antiporters regulate the pH of endoplasmic reticulum and auxin-mediated development[J]. Plant Cell Environ, 2018, 41(4): 850-864. DOI:10.1111/pce.v41.4 |
| [16] |
Zeng Y, Li Q, et al. Two NHX-type transporters from Helianthus tu-berosus improve the tolerance of rice to salinity and nutrient defici-ency stress[J]. Plant Biotechnol J, 2018, 16(1): 310-321. DOI:10.1111/pbi.12773 |
| [17] |
Wu X, Ebine K, Ueda T, et al. AtNHX5 and AtNHX6 are required for the subcellular localization of the SNARE complex that mediates the trafficking of seed storage proteins in Arabidopsis[J]. 2016, 11(3): e151658. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4795774/
|
| [18] |
Qiu QS. AtNHX5 and AtNHX6: Roles in protein transport[J]. Plant Signal Behav, 2016, 11(6): e1184810. DOI:10.1080/15592324.2016.1184810 |
| [19] |
Wang L, Wu X, Liu Y, et al. AtNHX5 and AtNHX6 control cellular K+ and pH homeostasis in Arabidopsis: three conserved acidic residues are essential for K+ transport[J]. PLoS One, 2015, 10(12): e144716. |
| [20] |
Reguera M, Bassil E, et al. pH Regulation by NHX-Type antiporters is required for receptor-mediated protein trafficking to the vacuole in Arabidopsis[J]. Plant Cell, 2015, 27(4): 1200-1217. DOI:10.1105/tpc.114.135699 |
| [21] |
Venema K, Quintero FJ, Pardo JM, et al. The Arabidopsis Na+/H+ exchanger AtNHX1 catalyzes low affinity Na+ and K+ transport in Reconstituted Liposomes[J]. J Biol Chem, 2002, 277(4): 2413-2418. DOI:10.1074/jbc.M105043200 |
| [22] |
Shi H, Ishitani M, Kim C, et al. The Arabidopsis thaliana salt tolerance gene SOS1 encodes a putative Na+/H+ antiporter[J]. Proc Natl Acad Sci USA, 2000, 97(12): 6896-6901. DOI:10.1073/pnas.120170197 |
| [23] |
Wu SJ, Ding L, Zhu JK. SOS1, a genetic locus essential for salt tolerance and potassium acquisition[J]. Plant Cell, 1996, 8(4): 617-627. DOI:10.1105/tpc.8.4.617 |
| [24] |
An R, Chen QJ, Chai MF, et al. AtNHX8, a member of the monovalent cation: proton antiporter-1 family in Arabidopsis thaliana, encodes a putative Li+/H+ antiporter[J]. Plant J, 2007, 49(4): 718-728. DOI:10.1111/j.1365-313X.2006.02990.x |
| [25] |
Liu H, Tang R, Zhang Y, et al. AtNHX3 is a vacuolar K+/H+ antiporter required for low-potassium tolerance in Arabidopsis thaliana[J]. Plant Cell Environ, 2010, 33(11): 1989-1999. DOI:10.1111/pce.2010.33.issue-11 |
| [26] |
Li HT, Liu H, Gao XS, et al. Knock-out of Arabidopsis AtNHX4 gene enhances tolerance to salt stress[J]. Biochem Biophys Res Commun, 2009, 382(3): 637-641. DOI:10.1016/j.bbrc.2009.03.091 |
| [27] |
Hu DG, Ma QJ, Sun CH, et al. Overexpression of MdSOS2L1, a CIPK protein kinase, increases the antioxidant metabolites to enhance salt tolerance in apple and tomato[J]. 2016, 156(2): 201-214. https://www.ncbi.nlm.nih.gov/pubmed/26096498
|
| [28] |
Yang Y, Tang R, Jiang C, et al. Overexpression of the PtSOS2 gene improves tolerance to salt stress in transgenic poplar plants[J]. Plant Biotechnology Journal, 2015, n/a-n/a. |
| [29] |
Hassan MA, Daniso E, Boscaiu M, et al. Expression of the vacuolar Na+/H+ antiporter gene(NHX1)in three plantago species differing in salt tolerance[J]. Bulletion UASVM Horticulture, 2015, 72(2): 441-442. |
| [30] |
Lu W, Guo C, Li X, et al. Overexpression of TaNHX3, a vacuolar Na+ /H+ antiporter gene inwheat, enhances salt stress tolerance in tobacco by improving related physiological processes[J]. Plant Physiol Biochem, 2014, 76(5): 17-28. |
| [31] |
Yarra R, He SJ, Abbagani S, et al. Overex-pression of a wheat Na+/H+ antiporter gene(TaNHX2)enhances tolerance to salt stress in transgenic tomato plants(Solanum lycopersicum L.)[J]. Plant Cell Tissue and Organ Culture, 2012, 111(1): 49-57. DOI:10.1007/s11240-012-0169-y |
| [32] |
NT, JW, Q. XZ. Overexpression of Na+/H+ antiporter gene AtNHX1 from Arabidopsis thaliana improves the salt tolerance of kiwifruit(Actinidia deliciosa[J]. South African Journal of Botany,, 2011, 77(1): 160-169. DOI:10.1016/j.sajb.2010.07.010 |
| [33] |
Li M, Lin X, Li H, et al. Overexpression of AtNHX5 improves tolerance to both salt and water stress in rice(Oryza sativa L[J]. Plant Cell, Tissue and Organ Culture, 2011, 107(2): 283-293. DOI:10.1007/s11240-011-9979-6 |
| [34] |
Li M, Li Y, Li H, et al. Overexpression of AtNHX5 improves tolerance to both salt and drought stress in Broussonetia papyrifera(L.)Vent[J]. Tree Physiol, 2011, 31(3): 349-357. DOI:10.1093/treephys/tpr003 |
| [35] |
Shi. L, Li. H, Pan. X, et al. Improvement of Torenia fournieri salinity tolerance by expression of Arabidopsis AtNHX5[J]. Functional Plant Biology, 2008, 35(3): 185-192. DOI:10.1071/FP07269 |
| [36] |
Quintero FJ, Blatt MR, Pardo JM. Functional conservation between yeast and plant endosomal Na+/H+ antiporters[J]. FEBS Lett, 2000, 471(2-3): 224-228. DOI:10.1016/S0014-5793(00)01412-5 |
| [37] |
Qiu QS. V-ATPase, ScNhx1p and yeast vacuole fusion[J]. J Genet Genomics, 2012, 39(4): 167-171. DOI:10.1016/j.jgg.2012.02.001 |
| [38] |
Bahler J, Wu JQ, et al. Heterologous modules for efficient and versatile PCR-based gene targeting in Schizosaccharomyces pombe[J]. Yeast, 1998, 14(10): 943-951. DOI:10.1002/(ISSN)1097-0061 |
| [39] |
Longtine MS, Mckenzie AR, et al. Additional modules for versatile and economical PCR-based gene deletion and modification in Saccharomyces cerevisiae[J]. Yeast, 1998, 14(10): 953-961. DOI:10.1002/(SICI)1097-0061(199807)14:10<953::AID-YEA293>3.0.CO;2-U |
| [40] |
虞兰兰, 李育阳. 利用一步基因中断法构建克鲁氏乳酸酵母leu2突变体[J]. 遗传, 1994(3): 33-37. |
| [41] |
Rothstein RJ. One-step gene disruption in yeast[J]. Methods Enzymol, 1983, 101: 202-211. DOI:10.1016/0076-6879(83)01015-0 |
| [42] |
Gaxiola RA, Rao R, Sherman A, et al. The Arabidopsis thaliana proton transporters, AtNhx1 and Avp1, can function in cation detoxification in yeast[J]. Proc Natl Acad Sci USA, 1999, 96(4): 1480-1485. DOI:10.1073/pnas.96.4.1480 |
| [43] |
Qiu QS, Fratti RA. The Na+/H+ exchanger Nhx1p regulates the initiation of Saccharomyces cerevisiae vacuole fusion[J]. J Cell Sci, 2010, 123(Pt 19): 3266-3275. |
| [44] |
Qiu QS. Plant and yeast NHX antiporters: roles in membrane trafficking[J]. J Integr Plant Biol, 2012, 54(2): 66-72. DOI:10.1111/j.1744-7909.2012.01097.x |
| [45] |
Gierth M, Maser P. Potassium transporters in plants--involvement in K+ acquisition, redistribution and homeostasis[J]. FEBS Lett, 2007, 581(12): 2348-2356. DOI:10.1016/j.febslet.2007.03.035 |
| [46] |
Nass R, Rao R. The yeast endosomal Na+/H+ exchanger, Nhx1, confers osmotolerance following acute hypertonic shock[J]. Microbiology, 1999, 145(Pt 11): 3221-3228. |
| [47] |
Nass R, Cunningham KW, Rao R. Intracellular sequestration of sodium by a novel Na+/H+ exchanger in yeast is enhanced by mutations in the plasma membrane H+-ATPase. Insights into mechanisms of sodium tolerance[J]. J Biol Chem, 1997, 272(42): 26145-26152. DOI:10.1074/jbc.272.42.26145 |
| [48] |
Prior C, Potier S, Souciet JL, et al. Characterization of the NHA1 gene encoding a Na+/H+-antiporter of the yeast Saccharomyces cerevisiae[J]. FEBS Lett, 1996, 387(1): 89-93. DOI:10.1016/0014-5793(96)00470-X |




