美洲大蠊是中国传统中药材蜚蠊的代表性虫种,是一种世界性卫生害虫,可长期自由生活在污水管道和化粪池等充满大量病原微生物的环境中,具有超强的繁殖力和抗病能力,这可能与其肠道内存在大量正常菌群有很大关系[1-2]。汤历等[3]从德国小蠊肠道分离得到具有抗真菌活性的内生细菌,美洲大蠊和德国小蠊生活环境和生活习性相近似,提示美洲大蠊肠道也可能存在具有抗真菌活性的内生菌群。本课题组前期从蜚蠊(美洲大蠊)肠道分离得到159株放线菌[4],本文拟以白色念珠菌(Candida albicans ATCC10231)、红色毛癣菌(Trichophyton rubrum ATCC60836)、黑曲霉(Aspergillus niger ATCC16404)和烟曲霉(Aspergillus fumigatus ATCC96918)4种人体常见致病真菌为研究对象,采用牛津杯法和菌株对峙共培养法对这159株肠道内生放线菌进行体外抗真菌活性筛选,并采用分子生物学方法对目标菌株进行分类鉴定。
1 材料与方法 1.1 材料 1.1.1 放线菌来源和供试病原真菌159株受试放线菌均为课题组前期从蜚蠊肠道分离得到[4],-80℃甘油保存。供试病原真菌:白色念珠菌(Candida albicans ATCC10231)、红色毛癣菌(Trichophyton ru-brum ATCC60836)、黑曲霉(Aspergillus niger ATCC-16404)和烟曲霉(Aspergillus fumigatus ATCC96918)等人体常见致病真菌均购自广东省微生物研究所。
1.1.2 主要试剂与仪器Ezup柱式细菌基因组DNA抽取试剂盒和PCR相关试剂为上海生物工程股份有限公司产品,各种培养基成分和其他试剂均为国产分析纯。台式高速冷冻离心机为德国Eppendorf公司产品,PCR仪、电泳仪、电泳槽和GelDoc凝胶成像系统均为美国Bio-Rad公司产品。
1.2 方法 1.2.1 蜚蠊肠道159株内生放线菌的抗真菌活性筛选分别挑取各放线菌单菌落接种于发酵培养基,220 r/min、28℃条件下培养5-7 d,收集发酵液4 000 r/min离心30 min,取上清液备用[5]。采用牛津杯法[6]检测各菌株发酵液抗白色念球菌活性:将高压灭菌的PDA培养基自然冷却到45℃左右,加入适量新鲜制备的白色念珠菌混悬液,混匀后,采用双层倒板法均匀倒入平板上使白色念珠菌菌悬液终浓度为3-5×106 CFU/mL。待培养基冷却后,将牛津杯均匀放在平板上,分别加入200 μL不同菌株的发酵液上清,等量液体空白培养基作为空白对照。28℃培养3-5 d后,观察抑菌作用情况。采用菌株对峙共培养法[7]检测各菌株发酵液抗红色毛癣菌、黑曲霉、烟曲霉等真菌活性:分别将受试放线菌接种到经高压灭菌的PDA固体培养基的边缘,28℃条件下培养,待其在PDA固体培养基上产生足够量的孢子后,分别将受试真菌点接到培养基中央作为实验组,空白对照组不接种受试放线菌,28℃培养4-6 d后,观察抗真菌情况。所有实验重复3次。
1.2.2 采用16S rDNA PCR对具有抗真菌活性菌株进行分子生物学鉴定制备具有抗真菌活性的蜚蠊肠道内生放线菌基因组DNA,具体方法参照上海生物工程股份有限公司Ezup柱式细菌基因组DNA抽取试剂盒说明书进行。PCR扩增各菌株16S rDNA基因采用通用引物[8],正向引物27 f为AGA GTT TGA TCC TGG CTC AG,反向引物1492 r为TAC GGC TAC CTT GTT ACG ACT T。25 μL PCR反应体系:Master mix 12.5 μL,正向、反向引物各1.0 μL,模板1.0 μL,ddH2O 9.5 μL。反应条件:95℃ 5 min;94℃ 30 s,56℃ 30 s,72℃ 30 s,共30个循环;72℃ 5 min。PCR产物进行1.5%的琼脂糖凝胶电泳进行分析检测后,委托上海生物工程有限公司进行基因测序。
1.2.3 具有抗真菌活性菌株16S rDNA同源性比对和系统发育树分析具有抗真菌活性菌株16S rDNA PCR产物经测序后,将各菌株的16S rDNA基因序列结果提交至NCBI在线数据库,应用Blast程序和DNAMAN 6.0软件进行同源性比对分析。并运用MEGA 5.2软件采用Neighbor Joining方法构建系统发育树,根据菌株间的亲缘关系确定各菌株种属分类情况[9]。
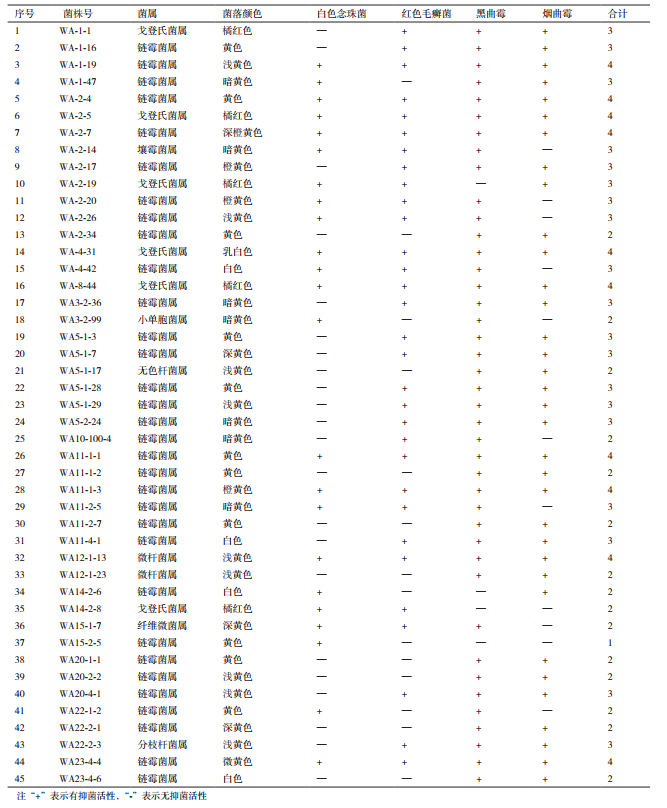
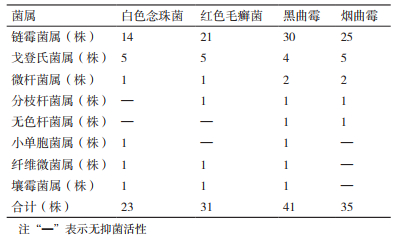
2 结果 2.1 抗真菌活性内生放线菌的筛选结果159株内生放线菌中有45株内生放线菌对4种真菌表现出不同程度的抑制作用,其中,对黑曲霉有抑制作用的内生放线菌有41株,其次抗烟曲霉的为35株,31株对红色毛癣菌有抑制作用,对白色念珠菌有抑制作用的内生放线菌最少,为23株。具抗真菌活性的45株内生放线菌中,10株内生放线菌对4种真菌均有拮抗作用,分别是WA-1-19、WA-2-4、WA-2-5、WA2-7、WA-4-31、WA-8-44、WA11-1-1、WA11-1-3、WA12-1-13和WA23-4-4。实验结果见图 1、表 1和表 2。
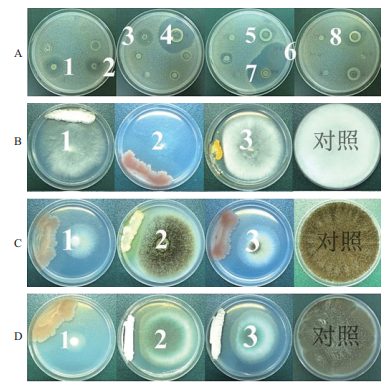
|
| 图 1 部分蜚蠊肠道内生放线菌体外抗真菌活性筛选实验结果 A:1-8分别为放线菌WA-1-47、WA-2-4、WA-2-7、WA-2-5、WA-2-26、WA-4-31、WA-8-44、WA15-2-5发酵液上清液对白色念珠菌的作用情况(牛津杯法);B:1-3分别为放线菌WA5-1-28、WA-8-44、WA11-2-5发酵液上清液对红色毛癣菌的作用情况(菌株共培养法);C:1-3分别为放线菌WA-1-1、WA5-1-7、WA-8-44发酵液上清液对黑曲霉菌的作用情况(菌株共培养法);D:1-3分别为放线菌WA-1-1、WA20-4-1、WA23-4-6发酵液上清液对烟曲霉菌的作用情况(菌株共培养法) |
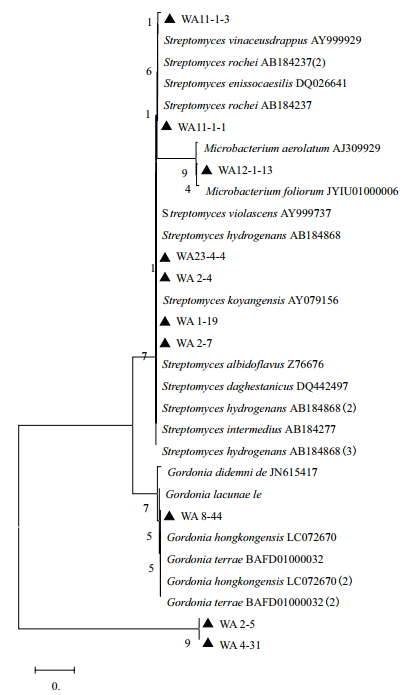
将各菌株16S rDNA基因序列利用NCBI在线数据库,经Blast程序、DNAMAN 6.0软件和MEGA 5.2软件进行同源性比对以及系统发育树分析。结果(表 2,图 2)发现,共有45株放线菌具有不同程度的抗真菌活性,分属于8个种属。其中,链霉菌属为优势菌属有32株,占71.11 %;其次,戈登氏菌属有6株,微杆菌属有2株,分枝杆菌属、无色杆菌属、小单孢菌属、纤维微菌属和壤霉菌属各有1株。
|
| 图 2 10株对4种真菌均具有抑制活性放线菌的16S rDNA基因序列系统发育树 |
近年来,真菌感染日趋严重,特别是深部真菌感染明显上升,已成为癌症、艾滋病等患者主要死亡原因之一,真菌药物研发是全球新药研发的热点之一[10]。昆虫肠道放线菌是一类特境微生物,在长期共生和协同进化过程中,可产生生物活性物质保护宿主防御外来病原菌感染[11]。美洲大蠊生命力非常顽强,存在地球已达3.5亿年之久[12]。美洲大蠊特殊的生活环境可能会使得其肠道内生放线菌在种类和功能上具有丰富的多样性,也许是良好的药用微生物资源。
放线菌,尤其是其中的链霉菌属,是临床抗菌药物的主要来源[13]。本研究发现159株蜚蠊肠道内生放线菌中有45株对白色念珠菌、红色毛癣菌、黑曲霉、烟曲霉等人体常见致病真菌具有拮抗作用,这些菌株隶属于链霉菌属、戈登氏菌属、微杆菌属、分枝杆菌属、无色杆菌属、小单胞菌属、纤维微菌属、壤霉菌属等8个种属。其中链霉菌属32株,占比达71.11 %,为优势菌属;链霉菌属是至今放线菌中种类最多、数量最大的一个属,是一类具有重要药用价值的微生物,早期发现的抗生素绝大多数是由该属的菌种产生,如抗细菌抗生素链霉素、红霉素、氯霉素、四环素等,抗真菌抗生素灰黄霉素、抗霉素等[14-15]。而且这些内生放线菌的抗真菌谱非常广,其中,对黑曲霉具有抑制作用的内生放线菌有41株,对烟曲霉、红色毛癣菌和白色念球菌具有抑制作用的菌株分别为35、31和23株。更有意义的是,菌株WA-1-19、WA-2-4、WA-2-5、WA2-7、WA-4-31、WA-8-44、WA11-1-1、WA11-1-3、WA12-1-13和WA23-4-4等10株内生放线菌同时对白色念珠菌、红色毛癣菌、黑曲霉、烟曲霉等4种致病真菌均有较强的拮抗作用。推测这些放线菌,特别是其中的链霉菌属可产生具有抗真菌活性的天然物质,从而有助于美洲大蠊抵御外来病原真菌的侵入和定植。下一步,我们拟采用生物活性追踪和化学分离相结合等技术方法分离抗真菌化合物,研究这些放线菌株抗真菌活性物质基础。
4 结论本研究发现159株蜚蠊肠道内生放线菌中有45株具有抗真菌活性,诸多菌株抗真菌谱较广,有10株内生放线菌对4种受试真菌均有拮抗作用。45株具有抗真菌活性的菌株分属于8个种属,提示蜚蠊肠道含有丰富的抗真菌活性放线菌资源。
| [1] |
Vicente CS, Ozawa S, Hasegawa K. Composition of the cockroach gut microbiome in the presence of parasitic nematodes[J]. Microbes Environ, 2016, 31(3): 314-320. |
| [2] |
徐毅. 蜚蠊病原体携带研究进展[J]. 实用预防医学, 2015, 22(5): 636-639. DOI:10.3969/j.issn.1006-3110.2015.05.043 |
| [3] |
汤历, 廉婕, 陆小军, 等. 德国小蠊肠道细菌抗真菌的初步研究[J]. 昆虫天敌, 2005, 27(3): 140-144. DOI:10.3969/j.issn.1674-0858.2005.03.007 |
| [4] |
方霞, 沈娟, 金小宝, 等. 药用昆虫美洲大蠊内生放线菌的分离和鉴定[J]. 中国病原生物学杂志, 2016, 11(6): 550-556. |
| [5] |
程亮, 罗明明, 吴继纲, 等. 海洋放线菌Y12-26中抗真菌活性代谢产物的分离纯化与结构鉴定[J]. 中国抗生素杂志, 2017, 42(8): 631-638. DOI:10.3969/j.issn.1001-8689.2017.08.002 |
| [6] |
佘之蕴, 黄宝莹, 刘海卿, 等. 牛津杯法测定食品添加剂对五种益生菌的抑菌活力[J]. 食品工业, 2016, 37(1): 171-173. |
| [7] |
武志江, 李业燕, 等. 百合枯萎病拮抗细菌的筛选、鉴定及其抑菌物质研究[J]. 微生物学通报, 2015, 42(7): 1307-1320. |
| [8] |
Ballav S, Kerkar S, Thomas S, et al. Halophilic and halotolerant actinomycetes from a marine saltern of goa, India producing anti-bacterial metabolites[J]. Journal of Bioscience & Bioengineering, 2014, 119(3): 323-330. |
| [9] |
程少军, 刘鸿雁, 龙云川, 等. 黔东北喀斯特土壤放线菌多样性研究[J]. 贵州大学学报:自然科学版, 2017, 34(3): 35-40. |
| [10] |
黄婷婷, 万小旭, 刘丹, 等. 住院患者真菌感染的菌群分布及耐药性分析[J]. 实用药物与临床, 2017, 20(1): 88-90. |
| [11] |
Arango RA, Carlson CM, Currie CR, et al. Antimicrobial activity of actinobacteria isolated from the guts of subterranean termites[J]. Environmental Entomology, 2016, 45(6): 1415-1423. DOI:10.1093/ee/nvw126 |
| [12] |
孙敏哲, 杜雯雯, 张成桂, 等. 美洲大蠊提取物Ento-B对实验动物血液系统的作用及其机理的初步研究[J]. 时珍国医国药, 2017, 28(6): 1318-1320. |
| [13] |
Savi DC, Shaaban KA, Vargas N, et al. Microbispora sp. LGMB259 endophytic actinomycete isolated from Vochysia divergens producing β-carbolines and indoles with biological activity[J]. Curr Microbiol, 2015, 70(3): 345-54. DOI:10.1007/s00284-014-0724-3 |
| [14] |
Abdelmohsen UR, Grkovic T, Balasubramanian S, et al. Elicitation of secondary metabolism in actinomycetes[J]. Biotechnology Advances, 2015, 33(6): 798-811. DOI:10.1016/j.biotechadv.2015.06.003 |
| [15] |
王帆, 陈芳, 郑新恒, 等. 抗生链霉菌200-09的抗真菌活性成分研究[J]. 中国抗生素杂志, 2017, 42(11): 932-939. DOI:10.3969/j.issn.1001-8689.2017.11.002 |