琼胶是从红藻中提取的亲水性海藻多糖,由琼胶糖和硫琼胶组成[1]。由于琼胶具有优良的凝胶、增稠和稳定性能,常被用于制作增稠剂、凝固剂、保鲜剂等,广泛应用于食品、日用化工、轻工、医药等领域中[2];但是,由于琼胶黏度高,水溶性差,难以被吸收,在应用方面也受到很大限制[3]。然而,由琼胶水解得到的琼胶寡糖(主要由琼二糖的重复单位连接而成,分为琼寡糖和新琼寡糖两个系列)却具有水溶性高,易被吸收的特点,具备良好的抑菌、增殖肠道益生菌、抗肿瘤、抗炎、抗氧化、抗病毒、增强免疫、吸湿保湿、美白和对植物病害防治等药理作用和生物活性,是一种新型海洋功能性低聚糖,已经成为国内外研究的热点,具有极大的开发潜力[4-6]。目前利用琼胶来获得低分子量的琼胶寡糖多采用生物酶法(琼胶酶)和化学法(酸水解),其中化学法处理无法精确控制水解度,而且后期的分离纯化过程非常繁琐,还会导致生成的琼胶寡糖丧失生物活性,具有很大的局限性;而生物酶法作用环境十分温和,降解过程易控制,产物专一且易于分离纯化,工艺环保高效[7-9]。因此,运用琼胶酶降解琼胶制备琼胶寡糖已成为琼胶工业高值化研究的重要方向。
琼胶酶是能够降解琼胶的水解酶,分为α-琼胶酶和β-琼胶酶。α-琼胶酶裂解琼脂糖的α-1,3糖苷键,生成以3,6-内醚-α-L半乳糖为还原性末端的的琼寡糖系列;β-琼胶酶裂解琼脂糖的β-1,4糖苷键,生成以β- D-半乳糖为还原性末端的新琼寡糖系列[10]。迄今为止,琼胶酶主要通过海洋微生物获得,因此,获得具有开发前景的菌株是开发微生物琼胶酶的前提,目前人们已经从海水系统中分离到了多种产琼胶酶菌株,包括假单胞菌属[11](Pseudomonas)、假别单胞菌属[12](Pseudoalteromonsa)、链霉菌属[13](Streptomyces)、别单胞菌属[14](Alteromonas)、不动杆菌属[15](Acinetobacter)、弧菌属[16](Vibrio)和船蛆杆菌属[17](Teredinibacter)等。但是普遍存在的问题是这些菌株所产琼胶酶活性低,多数报道的菌株产琼胶酶活力在10 U以下,降解琼胶能力普遍不高,远未能达到工业化生产琼胶寡糖的需求[18]。目前只有Sigma公司从大西洋假单胞菌中分离的β琼胶酶应用于生产,且价格十分昂贵,应用范围大多仅限于科研工作中,这严重阻碍了琼胶酶及琼胶寡糖的开发应用[19]。
广东省拥有丰富的海藻资源,近年来海藻养殖方面也取得了很大进展,但在开发利用方面还比较薄弱,存在很大的资源利用空间。因此,本研究选择富含琼胶的海洋龙须菜做为琼胶酶产生菌的分离对象,通过多种不同的筛选培养基,从龙须菜中分离产琼胶酶菌株,并对得到的菌株进行形态学、生理生化、16S rRNA基因序列分析及发酵产酶研究,旨在获得琼胶酶高产菌株,为琼胶酶及琼胶寡糖的开发利用奠定基础。
1 材料与方法 1.1 材料 1.1.1 样品龙须菜样品于2016年8月采自广东省南澳岛海域。
1.1.2 主要试剂和仪器K2HPO4,KCl,MgSO4·7H2O,牛肉膏,酵母浸膏,海盐,D半乳糖,碘化钾,3-5二硝基水杨酸,酒石酸钾钠(上海生工生物工程有限公司),α-pNPG和β-pNPG(Macklin公司)。
7230G紫外-可见分光光度计(上海诺科),SX-500高压蒸汽灭菌锅(Tomy公司),PB-10 pH计(Sartorius公司),BS423S天平(Sartorius公司),BCD-563WY-C对开门冰箱(Haier公司),SW-CJ-2FD洁净工作台(Airtech公司),ETC 811 PCR仪(北京东胜创新生物科技有限公司),弧菌科细菌生化鉴定盒(广东环凯微生物科技有限公司)。
1.1.3 培养基x半海水培养基[20](g/L):蛋白胨6,琼脂粉15,K2HPO4 1,KCL 0.5,MgSO4.7H2O 0.5,人工海水配制,pH 7.2左右;2216E培养基(g/L):蛋白胨5,酵母膏1,琼脂粉15,磷酸高铁0.01,人工海水配制,pH 7.6-7.8;改良培养基[21](g/L):MgSO4.7H2O 0.1,FeSO4 0.1,(NH4)2SO4 2,K2HPO4 7,KH2PO4 3,琼脂粉15,人工海水配制,pH 7.2;富集培养基(g/L):琼脂粉2,蛋白胨10,酵母膏10,NaCL 20,pH 6.5;斜面培养基:同x半海水培养基;种子培养基:蛋白胨6,琼脂粉10,K2HPO4 1,KCL 0.5,MgSO4.7H2O 0.5,人工海水配制,pH 7.2左右;发酵培养基:同种子培养基。
1.2 方法 1.2.1 产琼胶酶菌株分离和筛选在广东省南澳岛采集龙须菜样品,分别通过均质法和振荡法处理样品后,取悬液接入富集培养基进行富集培养,将富集培养的菌液进行10-1-10-4逐级稀释,取10-3、10-4两个稀释度的菌液涂布平板,27℃恒温培养18-24 h。用接种环挑取不同菌落进行平板分区划线,重复操作直至得到纯化菌株。滴加卢戈氏碘液,观察是否产透明圈,以此判断纯化菌株是否产琼胶酶。选取透明圈较大的菌株,挑取相应的菌苔3环,接入装有60 mL种子培养基的100 mL锥形瓶中,28℃、180 r/min振荡培养18 h后以3%的接种量接入装有100 mL发酵培养基的500 mL锥形瓶中,28℃、180 r/min振荡培养24 h后以5 000 r/min的转速离心15 min,取上清液即粗酶液进行酶活力的测定。
1.2.2 琼胶酶活力的测定(1) 标准曲线的制定:准确称取100 mg半乳糖,用少量蒸馏水溶解后转移到100 mL容量瓶定容,得到浓度为l mg/mL的半乳糖溶液。取9支25 mL具塞试管,按照表 1内容加入试剂,混合均匀后沸水浴5 min,冷却至室温,将其定容到25 mL,随后对混合液540 nm处的吸光值进行测定,然后根据吸光值制作标准曲线。(2)DNS法测酶活:参照朱慧文、孙延娜等的方法[22],采用DNS法测酶活:配制底物,加热煮沸,待琼脂全部溶解后取出置于50℃水浴锅中缓慢降温。将发酵液在5 000 r/min下离心20 min后分别取粗酶液1 mL加入4支25 mL具塞试管中,1支作为空白对照组,另外3支为实验重复组。在空白组中加入1.5 mL DNS溶液钝化琼胶酶,将全部试管置于50℃水浴锅中水浴保温10 min。各吸取底物溶液(0.3%琼脂配制)1 mL,加入4根试管中,充分混匀后于50℃水浴锅中反应30 min。DNS各1.5 mL,分别加入至实验组的3根试管中以终止反应,50℃水浴保温10 min。取出试管,沸水浴5 min后立即冷却至室温,,用蒸馏水定容至25 mL,充分混匀后,于540 nm处测吸光值。以煮沸灭活酶液为对照,用半乳糖制作标准曲线,根据标准曲线确定酶降解底物产生的还原糖的量。琼胶酶的活力定义为:在上述反应条件下,1 mL酶液1 min产生l μg还原糖作为一个酶活力单位(U/mL)。
琼胶酶活力(U/mL)=半乳糖含量(mg)×1 000×粗酶液(mL)×稀释倍数/反应体系中酶液加入量(mL)×时间(min)
1.2.3 菌株的形态学观察及生理生化鉴定将菌株在平板培养基上划线接种,采用肉眼观察菌落形态,参照《常见细菌系统鉴定手册》[23]进行染色,观察菌体的单染色、革兰氏染色、鞭毛染色、芽孢染色和荚膜染色等结果,利用弧菌科细菌生理生化鉴定盒(广东环凯微生物科技有限公司)鉴定菌株的生理生化特性。
1.2.4 16S rRNA基因序列的基因序列扩增、比对和系统发育分析采用煮沸处理法[24]对菌株进行破壁处理,使用通用引物27F(5'-AGAGTTTGATCCT-GGCTCAG-3')和1492R(5'-GGCTA CCTTGTTACG-ACTT-3')进行菌落PCR。PCR扩增程序为95℃ 2 min,94℃ 30 s,55℃ 30 s,72℃ 1 min,35个循环;72℃ 10 min。将PCR产物进行琼脂糖凝胶电泳检测,送至上海生工生物工程有限公司测序。使用Geneious软件对测序结果进行拼接,利用NCBI网站的BLAST程序在GenBank上对拼接结果进行相似性比对,分析比对结果,从比对结果中挑出相似性较高的菌株序列,使用MEGA7.0的Neighbor-Joining(NJ)方法构建系统发育进化树。
1.2.5 细菌生长曲线和产酶曲线的测定以6%的接种量将种子液接种到发酵培养基,180 r/min,28℃摇床发酵培养,定期取适量发酵液测定600 nm下稀释10倍的菌液的吸光度和发酵液的酶活力,绘制该菌的生长曲线和产酶曲线。
1.2.6 琼胶酶类型的鉴定参照Temuujin等[25]、马芮萍和朱艳冰等[26]的方法,取400 μL 4 mg/mL的α-pNPG(对硝基苯基-α-D-吡喃半乳糖苷)和β-pNPG(对硝基苯基-β-D-吡喃半乳糖苷)分别和1 mL 50 mmol/L的NaH2PO4-Na2HPO4缓冲液(pH 7.0)混合均匀,40℃水浴预热5 min,迅速加入1 mL粗酶液,混匀后40℃水浴加热反应1 h,加入1 mL 1 mol/L的Na2CO3终止反应,420 nm波长下测定吸光度。
2 结果 2.1 琼胶酶产生菌的分离筛选 2.1.1 初筛结果从采集到的龙须菜样品中共分离到18株产琼胶酶的海洋细菌。通过滴加卢戈氏碘液观察透明圈大小,测量比较透明圈内外径大小进行初筛,得到8株产琼胶酶能力较强的菌株。图 1是其中编号为D-5的菌株的卢戈氏碘液染色图片,其菌落周围形成较大的透明水解圈,说明该菌株具有较强的琼胶降解能力。
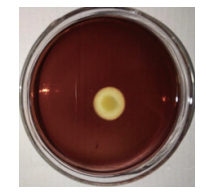
|
| 图 1 菌株D-5在琼脂平板上的碘液染色结果 |
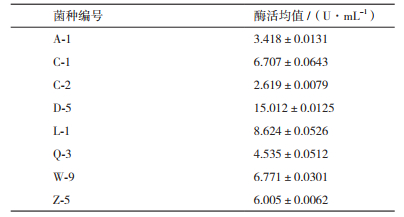
将初筛得到的8个菌株摇瓶发酵培养48 h,分别测定其发酵液的琼胶酶活力,测定结果见表 2。由复筛结果可知,编号D-5的菌株酶活最高,故确定D-5为研究对象,将其命名为ZQM2017。
如图 2所示,将PCR扩增产物进行琼脂糖凝胶电泳,在大约1 500 bp处得到一条单一、明亮的条带。将PCR产物送至上海生工生物工程有限公司测序,拼接得到1 453个碱基序列,将序列提交到GenBank数据库,获得登录号为MG772935。将测序所得基因序列在NCBI上通过BLAST与GenBank数据库的序列进行比对,菌株ZQM2017的16S rRNA基因序列与Vibrio alginolyticus、Vibrio natriegens、Vibrio azureus、Vibrio azureus和Vibrio parahaemolyticus等细菌的序列相似性达到99%,将这些相似性较高的序列,通过MEGA7.0软件构建系统发育树,结果如图 3。

|
| 图 2 菌株ZQM2017 16S rRNA PCR产物电泳图谱 |

|
| 图 3 菌株ZQM2017系统进化树 括号内的数字为GenBank登录号;比例尺为0.02%的序列差异 |
菌株ZQM2017的16S rRNA序列与NCBI数据库中52株弧菌(Vibrio)的16S rRNA序列相似度达到99%,可以鉴定ZQM2017为一株弧菌,但由于ZQM2017与这些菌株的相似性过高导致构建出的系统发育树的bootstrap太小,仍需结合形态学和生理生化指标将ZQM2017鉴定到种。
2.3 菌株的形态学观察及生理生化鉴定菌株平板分区划线结果和单染色镜检结果如图 4所示:该菌形成的菌落小,直径0.43-1.56 mm不等,圆形,乳白色,边缘整齐,质地湿润黏稠,表面光滑,可被挑起,不透明。点接培养24 h后滴加卢戈氏碘液染色,测量得到透明圈内径(菌落直径)约为3.6 mm,外径(透明圈直径)12.23-15.89 mm。
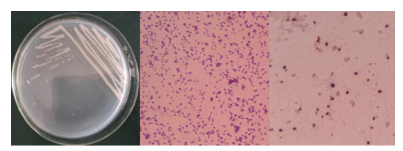
|
| 图 4 菌株ZQM2017形态学特征 镜检放大倍数:1 000× |
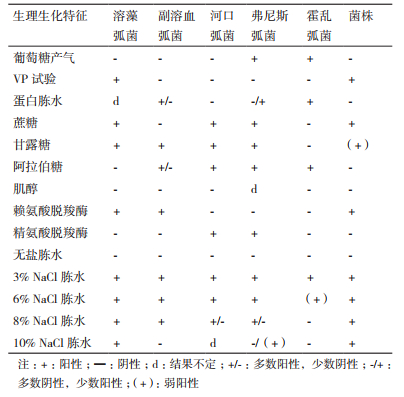
挑取少量菌苔染色制片,单染色结果显示该菌为短杆状;革兰氏染色结果显示菌体呈红色,判断为革兰氏阴性(G-)细菌;鞭毛染色结果显示该菌为周生鞭毛;荚膜染色结果显示该菌无荚膜;芽孢染色结果显示该菌无芽孢。使用弧菌科细菌生化鉴定盒,经培养观察,得到ZQM2017和弧菌科常见菌种的部分生理生化指标对照表(表 3)。菌株ZQM2017的部分生理生化指标和溶藻弧菌基本相符,结合形态学特征和16S rRNA序列比对结果,可将该菌鉴定为一株溶藻弧菌,命名为Vibrio alginolyticus ZQM2017。
半乳糖浓度在0-1.6 mg范围内,含量和反应液在540 nm处的吸光值具有良好的线性关系,线性方程为y=0.521 8x-0.025(图 5)。
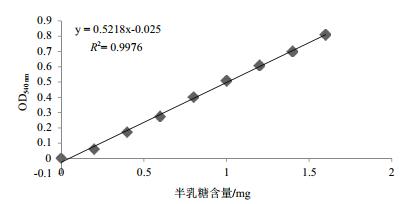
|
| 图 5 半乳糖标准曲线图 |
由图 6可以看出,菌株Vibrio alginolyticus ZQM-2017延滞期较短,在3 h时已经结束延滞期;3-9 h属于对数生长期,在该时期内生物量快速增加,相应的酶活逐步上升;在9-35 h期间,该菌生物量开始下降且相对稳定,进入相对稳定期,相应酶活仍保持持续上升;在35 h以后,该菌生物量总体呈下降趋势,可以判断为衰亡期;在46 h时,生物量最低,相应的酶活却达到最大值为109.87 U/mL,在46 h以后酶活开始下降。
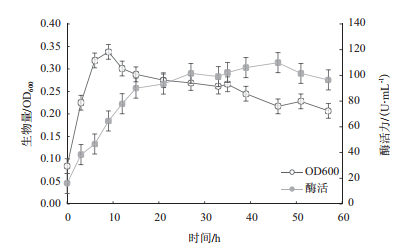
|
| 图 6 菌株ZQM2017生长曲线和产酶曲线 |
出现酶活峰值可能是因为在46 h时,生物量最低,细菌裂解量达到最大,胞内酶释放,增加了粗酶液的酶活,使得总体酶活达到最大。在46 h以后,菌体裂解量增大,胞内有机酸释放,代谢产物不断累积,导致酶活受到抑制,酶活性大小呈下降趋势。由此可判断,该菌株最佳发酵时间为46 h。
2.6 琼胶酶类型的鉴定利用Vibrio alginolyticus ZQM2017菌株发酵所得的粗酶液分别与α-pNPG和β-pNPG反应1 h,测定OD420,结果显示,粗酶液和α-pNPG反应后测得OD420为0.145,粗酶液和β-pNPG反应后测得OD420为0.136。实验结果表明,菌株Vibrio alginolyticus ZQM2017所产琼胶酶为混合型,同时含α-琼胶酶和β-琼胶酶,且前者含量略高于后者,可以水解琼胶得到琼寡糖和新琼寡糖。
3 讨论利用琼胶酶水解琼胶得到新型海洋功能性低聚糖——琼胶寡糖是开拓海藻深加工及琼胶寡糖开发利用的重要途径,目前已成为国内外研究的热点。分离筛选产琼胶酶的微生物是获取琼胶酶的主要方法,但目前分离得到的微生物所产琼胶酶活力普遍不高,远未能满足工业化生产琼胶寡糖的要求。如2014年,马芮萍等[27]分离的Stenotrophomonas sp.NTa.,优化后的发酵酶活仅为1.98 U/mL;2014年,刘丽莉等[28]分离的新型产琼胶酶海洋菌株Vibrio agarivorans ZGR-26所产酶活为32.1 U/mL;2016年,曾诚[29]分离的Thalassospira sp.fst-13007,发酵酶活最大仅达到2.76 U/mL;2016年,张林林等[30]分离的编号为A-001的海洋贝类肠道琼胶降解菌株,酶活达到13.01 U/mL;2017年,张建美等[31]对分离到的产琼胶酶弧菌Ag-1进行发酵优化,得到最高酶活为45.51 U/mL。迄今只有Sigma-Aldrich有限公司从大西洋假单胞菌(Pseudomonasatlantica)中分离的β琼胶酶应用于生产,且价格十分昂贵,纯度大于5 000 U/mg的产品,1 kU包装的价格为1 854.45元人民币,目前应用范围仅限于科研工作中,这严重阻碍琼胶酶及琼胶寡糖、琼胶低聚糖的开发应用。
本研究筛选得到的海洋细菌Vibrio alginolyticus ZQM2017在相同培养条件下的产酶能力处于较高水平,具有极大的开发潜力。若要进一步提高菌株Vibrio alginolyticus ZQM2017的产酶能力,可对该菌株进行多方面如碳源、氮源、接种量、接种时间和酶解温度等条件的综合优化,这将是后续实验开展的方向。相信经过进一步优化,菌株Vibrio alginolyticus ZQM2017的产酶能力会大大提高,为琼胶寡糖的开发利用奠定扎实的基础。
4 结论本研究从广东省南澳岛海域采集到的龙须菜(Gracilaria lemaneiformis)上分离得到18株琼胶酶产生菌,从中筛选得到1株酶活最高的琼胶酶产生菌ZQM2017。通过形态学特征、生理生化特性和分子鉴定等手段,确定ZQM2017是一株溶藻弧菌。利用底物显色法鉴定得到,该菌所产琼胶酶为混合酶,同时含有α-琼胶酶和β-琼胶酶,且前者含量略高于后者。通过初步优化测酶活方法,测定该菌的产酶曲线、生长曲线和pH曲线,初步了解该菌的生长特点,得到最佳发酵时间为46 h,初始酶活最高可达109.87 U/mL。
| [1] |
王静雪, 江晓路, 胡晓珂. 细菌降解琼胶的研究进展[J]. 中国水产科学, 2001(3): 94-96, 93. DOI:10.3321/j.issn:1005-8737.2001.03.021 |
| [2] |
吴湛霞, 董静静, 李思东, 等. 国内江蓠提取琼胶加工工艺的研究进展[J]. 广西轻工业, 2010(9): 19-20, 22. DOI:10.3969/j.issn.1003-2673.2010.09.010 |
| [3] |
刘美英, 梅建凤, 易喻, 等. 琼胶寡糖生物活性的研究进展[J]. 药物生物技术, 2008(6): 493-496. DOI:10.3969/j.issn.1005-8915.2008.06.019 |
| [4] |
问莉莉, 董静静, 李思东. 琼胶寡糖的制备及其应用研究进展[J]. 山东化工, 2011(5): 28-30. DOI:10.3969/j.issn.1008-021X.2011.05.010 |
| [5] |
缪伏荣, 李忠荣. 琼胶的降解及其产物的开发应用[J]. 现代农业科技, 2007(2): 125-128. DOI:10.3969/j.issn.1007-5739.2007.02.089 |
| [6] |
欧阳茜茜, 陈法锦, 李思东, 等. 琼胶及琼胶寡糖的加工与应用研究进展[J]. 山东化工, 2016, 45(23): 58-60, 62. DOI:10.3969/j.issn.1008-021X.2016.23.022 |
| [7] |
谢喜珍, 谢金盛, 杨捷, 等. 琼胶寡糖的生物酶解制备工艺研究[J]. 食品工业科技, 2017, 38(1): 208-213. |
| [8] |
马翠萍, 石超. 琼胶酶研究进展[J]. 微生物学通报, 2008, 35(1): 107-111. DOI:10.3969/j.issn.0253-2654.2008.01.024 |
| [9] |
傅晓妍.新琼寡糖的酶法制备和化妆品功效的初步评价[D].青岛: 中国海洋大学, 2006. http://cdmd.cnki.com.cn/Article/CDMD-10423-2006181297.htm
|
| [10] |
Sugano Y, Terada I, Arita M, et al. . Purification and characterization of a new agarase from a marine bacterium, Vibrio sp. strain JT0107[J]. Appl Environ Microbiol, 1993, 59(5): 1549-1554. |
| [11] |
Kang NY, Choi YL, et al. Cloning, expression and chara-cterization of a beta-agarase gene from a marine bacterium, Pseudo-monas sp. SK38[J]. Biotechnol Lett, 2003, 25(14): 1165-1170. DOI:10.1023/A:1024586207392 |
| [12] |
褚艳.海洋假别单胞菌CY24的琼胶酶基因的克隆、重组表达及酶学性质研究[D].青岛: 中国海洋大学, 2003. http://cdmd.cnki.com.cn/Article/CDMD-10423-2003093249.htm
|
| [13] |
Parro V, Mellado RP, Harwood CR. Effects of phosphate limitation on agarase production by Streptomyces lividans TK21[J]. FEMS Microbiology Letters, 1998, 158(1): 107-113. |
| [14] |
Chi WJ, Park DY, Seo YB, et al. Cloning, expression, and biochemical characterization of a novel GH16 β-agarase AgaG1 from Alteromonas sp. GNUM-1[J]. Applied Microbiology and Biotechnology, 2014, 98(10): 4545-4555. DOI:10.1007/s00253-014-5510-4 |
| [15] |
刘兴凯, 朱丹, 史晓娟, 等. 产琼胶酶细菌Acinetobacter sp. LXK的发酵条件优化[J]. 青岛农业大学学报:自然科学版, 2018, 35(1): 57-65. |
| [16] |
修爽, 贾馨媛, 祖国仁. 海洋细菌Vibrio agarivorans-1产琼胶酶培养基优化及其酶学性质[J]. 大连工业大学学报, 2016, 35(5): 328-331. |
| [17] |
牟宗娟, 李贵阳, 茅云翔, 等. 4株琼胶降解菌的分离、鉴定及产酶条件分析[J]. 海洋科学, 2013, 37(4): 13-20. |
| [18] |
解卉.产琼胶酶菌株Agarivorans albus QM38的发酵条件优化、酶的分离纯化及酶学性质研究[D].青岛: 中国海洋大学, 2009. http://www.wanfangdata.com.cn/details/detail.do?_type=degree&id=Y1501973
|
| [19] |
李能章, 邱荣蓉, 彭远义. 琼胶酶的研究进展[J]. 生命科学研究, 2006(S1): 62-66. |
| [20] |
尹群健, 陈潇骁, 杨宏胜, 等. 产琼胶酶菌株发酵条件优化及酶学特性[J]. 食品工业, 2014, 35(9): 83-87. |
| [21] |
王晓燕, 桑卫国, 章宗铭. 腐烂紫菜中琼胶酶高产菌株的筛选及鉴定[J]. 食品科技, 2009, 34(7): 2-5. |
| [22] |
朱慧文, 孙延娜, 周晓龙, 等. 产琼胶酶菌株NBRC102603发酵条件优化及酶的分离纯化[J]. 食品与发酵工业, 2011, 37(4): 120-124. |
| [23] |
东秀珠, 蔡妙英. 常见细菌系统鉴定手册[M]. 北京: 科学出版社, 2001.
|
| [24] |
陈忠翔, 房志家, 陈婷, 等. 一种简单高效的酵母单菌落PCR方法[J]. 生物技术通讯, 2013, 24(2): 225-229. |
| [25] |
Temuujin U, Chi WJ, Chang YK, et al. Identification ang biochemical characterization of Sco3487from Streptomyces coelicolor A3(2), an exo- and endo-type β-agarase-producing Neoagarobiose[J]. Journal of Bacteriology, 2012, 194(1): 142-149. DOI:10.1128/JB.05978-11 |
| [26] |
马芮萍, 朱艳冰, 等. 一株产琼胶酶细菌的分离、鉴定及其琼胶酶基本性质[J]. 微生物学报, 2014, 54(5): 543-551. |
| [27] |
马芮萍, 朱艳冰, 倪辉, 等. 海洋细菌NTa发酵产琼胶酶条件的初步优化[J]. 集美大学学报:自然科学版, 2014, 19(4): 259-265. |
| [28] |
刘丽莉, 祖国仁. 新型产琼胶酶海洋细菌的筛选和鉴定[J]. 湖北农业科学, 2014, 53(20): 4831-4834. |
| [29] |
曾诚.产琼胶酶菌株的筛选及其酶学性质[D].福州: 福建农林大学, 2016. http://cdmd.cnki.com.cn/Article/CDMD-10389-1016129196.htm
|
| [30] |
张林林, 江玉姬, 张龙涛, 等. 一株海洋贝类肠道琼胶降解菌的筛选与鉴定[J]. 福建农林大学学报:自然科学版, 2016, 45(1): 89-93. |
| [31] |
张建美, 韩尧跃, 王国增, 等. 海洋弧菌Ag-1产琼胶酶条件研究[J]. 中国食品学报, 2017, 17(3): 90-95. |