2. 大连医科大学基础医学院,大连 116044;
3. 韶关学院 英东生命科学学院 粤北生猪生产及疫病防控协同创新发展中心,韶关 512005
2. College of Basic Medical Science, Dalian Medical University, Dalian 116044;
3. North Guangdong Collaborative Innovation and Development Center for Swine Farming and Disease Control, Yingdong College of Life Sciences, Shaoguan University, Shaoguang 512005
主要组织相容性复合体(Major histocompatibility complex,MHC)是一类编码与免疫应答直接相关的基因群,在绝大部分脊椎动物中都有表达[1-2],MHC表达产物在抗原递呈和T细胞激活中起到关键作用[3]。不同动物MHC有不同的命名,猪的MHC也叫做猪白细胞抗原(Swin eleukuocyte antigen,SLA)[4]。SLA分为Ⅰ、Ⅱ、Ⅲ三个基因类型,其中SLA Ⅰ类分子表达于所有有核细胞表面,属于高度多态的糖蛋白,该类分子能够在细胞中特异性识别经蛋白酶体处理后的内源性抗原并可将其递呈到细胞膜表面,进而和CD8+T淋巴细胞表面的TCR受体特异性结合,激活CD8+T淋巴细胞并启动细胞免疫[5]。SLA Ⅰ类分子由重链和轻链组成,SLA Ⅰ重链基因包含3类基因即Ⅰa、Ⅰb、Ⅰc,共13个基因座。其中只有Ia包含3个功能基因,分别是SLA-1、SLA-2、SLA-3。SLA-2在信号肽起始端较SLA-1、SLA-3多3个氨基酸残基[4]。
近年来,针对多个品系猪的SLA-2基因进行了原核表达质粒的构建及体外表达,以及多肽结合等功能研究[6-12]。然而,原核表达的SLA-2多为包涵体形式,需要经过变性和复性等繁琐的过程才能使SLA-2形成正确的折叠[13]。由于原核细胞不具有高尔基体,所以不能进行糖基化等功能修饰。因此,相对于真核表达系统,经原核细胞表达的SLA-2其空间折叠及功能必然不如真核表达系统的效果。目前基于真核表达水平上对人HLA-A2基因,以及小鼠H-2基因的相关研究已经趋于成熟[14-16],但是针对猪SLA-2基因真核表达的研究鲜有报导。
PK15细胞(Porcine kidney epithelial cells)来源于猪肾,中文名为猪肾上皮细胞,属于真核表达系统常用的宿主细胞。该细胞也广泛应用于猪瘟病毒、猪伪狂犬病病毒和猪细小病毒等的分离、体外培养以及相关疫苗的生产[17]。将不同SLA-2基因构建真核表达质粒并转染至PK15细胞中,能够保证SLA-2分子形成正确的折叠,从而行使正确的功能。因此可以在PK15细胞系上研究任何SLA-2基因的表达、抗原递呈以及能够更高效地进行抗原表位的筛选等。
实验室前期已经成功克隆了荷包猪SLA-2-HB01全基因[18],本实验在此基础上拟将荷包猪SLA-2-HB01编码区基因构建到真核表达载体pEGFP N3上,并转染至PK15细胞,验证SLA-2分子在该细胞中的表达,为后期筛选猪烈性传染病病毒相应的抗原表位肽奠定基础。
1 材料与方法 1.1 材料 1.1.1 细胞和菌株猪肾细胞(PK15)购自中国兽医监测所微生物菌种保藏管理中心(CVCC)。
荷包猪SLA-2-pMD 18-T全基因(GenBank编号:AB602431.1)质粒由大连大学生命科学与技术学院基因和蛋白质工程实验室保存。pMD 19-T Simple Vector,Escherichia coli. Top10、Escherichia coli. DH5α菌种购自大连宝生物有限公司。pMD 19-T Simple Vector用于SLA-2-HB01基因的高效克隆。Escherichia coli. Top10感受态细胞用于扩增含有目的基因的重组质粒,以便进一步进行目的基因的克隆改造。pEGFP N3菌种购自于中国上海思享生物有限责任公司。
1.1.2 试剂胰蛋白胨(Tryptone)、酵母提取物(Yeast extract)、氯化钠(NaCl)、Tris、琼脂糖、牛血清白蛋白Ⅴ(Albu min Bovine Ⅴ)、丽春红、SanPrep柱式吸附柱小量质粒提取试剂盒、SanPrep柱式吸附柱DNA胶回收试剂盒、小鼠抗eGFP单克隆抗体(货号:D199989-0100)、小鼠抗GAPDH单克隆抗体(货号:D190636-0100)、HRP标记的山羊抗小鼠IgG(货号:D110087-0100)以及离心管、枪头等实验耗材均购自上海生工生物工程有限公司;寡核苷酸的合成和DNA测序由上海生工生物有限公司完成。Phanta®Super-Fidelity DNA Polymerase、1 kb DNA Ladder、核酸染料Ultra Gelred Nucleic Acid Stain(10000×)、Lipoectine2000脂质体转染试剂购自诺唯赞有限公司。T4 DNA Ligase、DL 2000 DNA Marker、EcoR Ⅰ限制性快速内切酶、Kpn Ⅰ限制性快速内切酶、10×上样缓冲液(loading buffer)均购自宝生物工程(大连)有限公司。胎牛血清、DMEM高糖培养基和0.25%胰蛋白酶消化液购自Gibco公司;25 cm2细胞培养瓶购自Corning公司,6孔、24孔、96孔培养板购自NEST公司。其他常见的分子生物学试剂以及化学试剂都来自天津化学试剂有限公司和北京化学试剂有限公司。超敏ECL化学发光试剂盒购自新赛美生物科技有限公司。
1.2 方法 1.2.1 引物的设计与合成根据引物设计原则,参考GenBank(AB602431.1)上猪SLA-2-HB01全基因序列,采用Vector NTI 11.2和Primer6.0软件相结合设计引物,根据载体pEGFP N3的结构特点,选择的限制性内切酶为:EcoR Ⅰ和Kpn Ⅰ。上游引物F:5'-GAATTCATGCGGGTCAGGGGCCCTCAAGCCA -3'(下划线为EcoR Ⅰ酶切位点);下游引物R:5'-GGTACCCACTCTAGGATCCTTGGTAAGG-3'(下划线为Kpn Ⅰ酶切位点)。由上海生工生物工程有限公司定制合成。
1.2.2 荷包猪SLA-2-HB01/ pMD 19-T Simple克隆以SLA-2-HB01/pMD 18-T质粒为模板,用Phanta®Super-Fidelity DNA Polymerase高保真酶系统进行PCR扩增,PCR体系为:5×SF buffer(with 10 mmol/L MgSO4),10 μL;dNTP Mix(10 mmol/L each),1 μL;DMSO,1.5 μL;SLA-2-HB01-F(10 μmol/L),2 μL;SLA-2-HB01-R(10 μmol/L),2 μL;SLA-2-HB01全基因质粒,2 μL;Phanta®Super-Fidelity DNA Polymerase(1 U/μL),1 μL;H2O,32.5 μL。
PCR条件为:92℃,预变性2 min;92℃,10 s;58℃,30 s;72℃,30 s,30个循环;最后72℃总延伸10 min。PCR产物用1.0%琼脂糖凝胶检测,凝胶成像仪成像。目的条带用DNA凝胶回收试剂盒进行回收。
将胶回收的目的条带与pMD 19 -T simple载体连接,转化Escherichia coli. Top10,筛选阳性克隆菌并送至生物公司测序,通过双向DNA测序确认插入完整性后,将测序正确的阳性克隆菌株命名为SLA-2-HB01/pMD 19-T Simple。
1.2.3 荷包猪SLA-2-HB01真核表达载体的构建分别对SLA-2-HB01/pMD19-T Simple以及真核表达载体pEGFP N3质粒进行EcoR Ⅰ和Kpn Ⅰ双酶切,然后经1.0%琼脂糖凝胶电泳检测,并经DNA回收试剂盒回收酶切产物。将两者回收产物进行连接、转化至Escherichia coli. DH5α感受态细胞中,在含有Kan+的LB平板中,37℃培养过夜。然后挑取单菌落至Kan+ LB液体培养基中,37℃,12 h振荡培养。培养的菌液利用限制性双酶切分析鉴定真核重组DNA载体中是否携带插入片段。最后,通过对DNA测序结果进行序列分析验证核苷酸序列的正确性。阳性重组质粒命名为SLA-2-HB01/pEGFP N3,重组质粒SLA-2-HB01/pEGFP N3图谱,见图 1。

|
| 图 1 SLA-2-HB01/pEGFP N3重组表达质粒示意图 |
在25 cm2的细胞培养瓶中培养PK15细胞,并将PK15细胞传代两次以上,加入1.5 mL 0.25%的胰蛋白酶消化液消化细胞并计数,在6孔板中每孔接种3×105个细胞,24 h之后细胞密度达到80%左右,用Lipoectine2000脂质体转染试剂转染SLA-2-HB01/pEGFP-N3真核重组质粒。转染30 min前,将细胞培养基换成1.5 mL Opti-MEM I培养基,分别用250 μL Opti-MEM I培养基稀释2 μg重组真核表达质粒和2 μL Lipoectine2000脂质体转染试剂,室温静置5 min。混合Lipoectine2000和质粒的稀释液共500 μL,轻轻混匀,室温静置20 min。向6孔细胞培养板中的每个孔中加入预混液500 μL,并前后轻轻摇动6孔细胞培养板使预混液与孔中的培养基混匀。细胞在CO2培养箱中37℃培养6 h后,将含有转染试剂的培养基去除,加入1.5 mL新鲜的DMEM培养基。转染24 h后,用500 μg/mL G418抗性筛选。
1.2.5 单克隆转染细胞系培养用含500 μg/ mL G418抗性培养基持续筛选已转染的细胞系15 d后,加入2 mL 1×PBS清洗细胞,重复一次,加入1.5 mL 0.25%胰蛋白酶消化液消化15 min,收集细胞,将细胞浓度稀释至7-8 cells/mL,共10 mL,接种至96孔板,每孔加入100 μL培养基。细胞在96孔板中培养3 d后,标记出96孔板中生长的单细胞,细胞在96孔板中培养8 d后,标记的单克隆细胞形成细胞团,100 μL 1×PBS清洗单克隆细胞,加入30 μL 0.25%胰蛋白酶消化液原孔消化10 min,并加入70 μL含10%血清DMEM培养基重悬细胞并转移至24孔板中培养。培养8 d左右,待细胞基本铺满孔板时用200 μL 0.25%胰蛋白酶消化液消化细胞15 min,重悬细胞,转入6孔板中继续扩大培养。3-4 d的细胞将铺满整个6孔板,转入100 mm细胞培养皿中继续扩大培养,随后一半细胞用于冻存,一半细胞继续培养。
1.2.6 单克隆转染细胞系鉴定待细胞生长状态稳定后,分别取正常PK15细胞、转染pEGFP N3空载质粒的PK15细胞以及转染SLA-2-HB01/pEGFP N3质粒PK15细胞,分别提取细胞全蛋白进行鉴定,具体操作如下:收集各种细胞于灭菌EP管中,利用1×PBS洗两遍后,根据细胞量加入100-500 μL裂解液,用枪吹打5-8次后,放在冰上并用摇床摇晃15 min,中间弹动2次,使细胞充分裂解。裂解完毕后,利用4℃离心机,12 000 r/min,离心10 min,使细胞碎片全部沉到离心管底部。将上清吸入到新的离心管中,利用BCA法[19]检测蛋白浓度后,将蛋白制成终浓度为10 μg/μL的溶液,取10 μL样品进行SDS-PAGE检测。
蛋白样品进一步转印到PVDF膜后,经1×丽春红染色后参考marker切割目的条带和内参GAPDH,5% BSA室温封闭1 h,含目的条带的膜加入1:5 000稀释的小鼠抗eGFP单克隆抗体,含GAPDH条带的膜加入1:8 000稀释的小鼠抗GAPDH单克隆抗体,4℃孵育过夜,去除一抗,经1×TBST洗涤4次后加入1:8 000稀释的HRP标记的山羊抗小鼠IgG,室温摇床上孵育1 h,1×TBST洗涤4次,采用ECL显色试剂盒进行显色,以检测EGFP及EGFP融合基因的表达。
1.2.7 统计学处理采用Image-Pro Plus 6.0软件分析Western杂交条带累积光密度值(IOD),并计算出目的蛋白相对光密度值(SLA-2-HB01-EGFP的IOD值与GAPDH的IOD值之比)然后采用GraphPad Prism 5分析软件对数据进行单因素方差分析。
2 结果 2.1 荷包猪SLA-2-HB01/pMD 19-T Simple克隆PCR产物用1.0%琼脂糖凝胶电泳后经凝胶成像仪成像,结果(图 2-A)显示目的条带大小约为1 100 bp,与理论值1 104 bp相符。经单菌落PCR后,琼脂糖电泳检测到扩增条带大小约1 100 bp(图 2-B),与理论设计值1 104 bp相符。
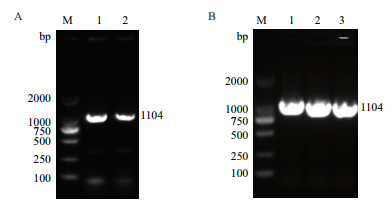
|
| 图 2 荷包猪SLA-2-HB01/pMD 19-T Simple克隆 A为PCR扩增SLA-2-HB01基因编码区,M:DNA分子量标准DL2000;1-2:SLA-2-HB01编码区扩增条带;B为单菌落PCR检测SLA-2-HB01插入pMD 19-T Simple Vector检测结果,M:DNA分子量标准DL2000;1-3:单菌落筛选阳性克隆,参照Marker目的条带大小约为1 100 bp(理论值为1 104 bp) |
利用EcoR Ⅰ和Kpn Ⅰ对重组表达质粒SLA-2-HB01/pEGFP N3进行双酶切鉴定,0.8%琼脂糖电泳检测,显示插入片段大约1 000 bp,与理论设计值1 092 bp相符(去掉部分酶切位点),见图 3。
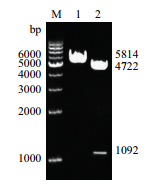
|
| 图 3 限制性双酶切鉴定SLA-2-HB01/pEGFP N3重组真核表达质粒 M:1 kb DNA Ladder;1:SLA-2-HB01/pEGFP N3质粒单酶切(EcoR Ⅰ);2:SLA-2-HB01/pEGFP N3质粒双酶切(EcoR Ⅰ和Kpn Ⅰ),目的片段大小1 092 bp,载体大小4 722 bp |
SLA-2-HB01/pEGFP N3经核酸序列测定后,通过NCBI网站进行了Blast,结果(图 4)显示,SLA-2-HB01/pEGFP N3重组真核表达质粒中SLA-2-HB01基因序列与原序列100%同源。

|
| 图 4 Blast分析SLA-2-HB01/pEGFP N3序列 Sbjct为SLA-2-HB01全基因原序列(Gene Bank编号:AB602431.1);Query为SLA-2-HB01/pEGFP N3重组真核表达质粒中SLA-2-HB01基因序列 |
SLA-2-HB01/pEGFP N3质粒转染PK15细胞48 h后,通过荧光倒置显微镜观察细胞内绿色荧光蛋白的表达情况,结果经Image-Pro Plus软件分析显示(图 5),大约40%的PK15细胞出现了绿色荧光,主要分布在细胞浆区域。
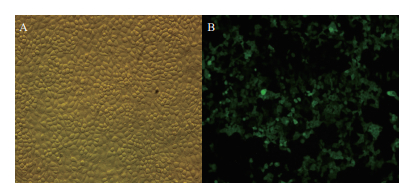
|
| 图 5 荧光倒置显微镜检测转染SLA-2-HB01/pEGFP N3质粒的PK15细胞(×200) A:转染SLA-2-HB01/pEGFP N3质粒的PK15细胞明场照片;B:转染SLA-2-HB01/pEGFP N3质粒的PK15细胞荧光照片 |
经G418筛选出的阳性单细胞扩大培养接种于6孔板中,荧光显微镜观察接种后第1、2、4天PK-15细胞荧光,结果(图 6)显示阳性单克隆细胞经扩大培养后表达有EGFP的PK-15细胞占到99%以上。

|
| 图 6 荧光鉴定阳性单克隆细胞系 A:接种1 d后明场照片(×100);B:接种1 d后荧光照片(×100);C:接种2 d后明场照片(×100);D:接种2 d后荧光照片(×100);E:接种4 d后明场照片(×200);F:接种4 d后荧光照片(×200);G:F的局部放大 |
分别提取正常PK15细胞、转染pEGFP N3空载质粒的PK15细胞以及转染SLA-2-HB01/pEGFP N3质粒PK15细胞总蛋白,以正常PK15细胞总蛋白作为空白对照,以转染pEGFP N3空载质粒的PK15细胞总蛋白作为阴性对照,通过Western blotting检测融合蛋白的表达,结果(图 7)显示转染SLA-2-HB01/pEGFP N3质粒PK15细胞中融合蛋白得到了高表达,分子量大小为70 kD。

|
| 图 7 Western Blotting检测SLA-2-HB01-EGFP融合蛋白在PK15细胞中的表达情况 A为Western Blotting结果,其中1:空白对照(PK15细胞);2:转染pEGFP N3空载质粒PK15细胞;3:转染SLA-2-HB01/pEGFP N3质粒PK15细胞。B为相对IOD值统计分析结果,其中1:空白对照(PK15细胞);2:转染pEGFP N3空载质粒PK15细胞;3:转染SLA-2-HB01/pEGFP N3质粒PK15细胞。以GAPDH(36 kD)作为内参衡量SLA-2-HB01-EGFP融合蛋白(70 kD,其中eGFP蛋白分子量为30 kD,SLA-2-HB01分子量为40 kD)的表达水平(n=3,**P < 0.01)。 |
近年来,猪源烈性传染病广泛存在,而且很难对其进行防治,原因是烈性传染病一般禁止用免疫效果较好但存在二次感染危险的活毒疫苗,而允许使用的灭活疫苗虽然能起到一定的免疫保护作用,但不能彻底消灭病毒感染[20]。以CTL多肽表位为基础的表位疫苗有助于对猪烈性传染病的预防及控制,目前大量实验室也开展了相关研[21-22]。在众多CTL多肽表位中,相较于MHC分子体外结合筛选以及MHC四聚体筛选的多肽而言,细胞自然递呈的多肽无疑是最理想的。
本实验将编码荷包猪MHCⅠ类分子重链的基因SLA-2-HB01编码区构建到了真核表达载体pEGFP N3上,并借助脂质体转染试剂成功地转染到PK15细胞中,使荷包猪的MHCⅠ类分子能够在PK15细胞中过表达,目的是建立外源SLA-2-HB01在PK15细胞上的抗原递呈研究体系,并为后续的抗原递呈及多肽表位筛选提供研究平台。
本次实验选择荷包猪SLA-2-HB01基因为研究对象,基于荷包猪品种特殊,具有耐粗饲、抗病能力强、肉质鲜美等特点,并且具有很好的科学研究价值[23]。前期研究发现荷包猪的SLAⅠ类基因进化较为原始,SLA-2-HB01重链基因编码区共1 095个碱基,编码364个氨基酸,相较于SLA-1-HB01以及SLA-3-HB01,SLA-2-HB01重链基因信号肽起始位置多3个氨基酸,鉴于基因的特殊性,课题组首先选取了SLA-2-HB01进行研究。
本次实验的一个关键之处在于能否成功构建SLA-2-HB01/pEGFP N3质粒,在构建的重组SLA-2-HB01/pEGFP N3质粒中,SLA-2-HB01与EGFP基因共用一个CMV启动子,最终表达为融合蛋白(EGFP在SLA-2-HB01分子重链的羧基端)。因此,在进行引物设计时需要将SLA-2-HB01中的终止密码子“UGA”去除以保证翻译到该位点时不发生终止,继续向下游的EGFP进行翻译。在测序结果中我们能够看到位于SLA-2-HB01编码区3'末端的“TGA”已经成功去除(图 4),同时也没有发生移码突变,保证了SLA-2-HB01-EGFP融合蛋白能够正确翻译。EGFP是能够增强荧光特性的绿色荧光蛋白,其空间结构较为紧密,呈桶状[24]。该结构特征一方面有助于保护EGFP的整体构象,使其荧光特性不受连接的其他大分子的影响,另一方面EGFP如此紧密的空间结构也保证了不影响与其连接的大分子(本实验中的SLA-2-HB01分子)的正确折叠以及在PK15细胞中的正常转运等[25]。
本次实验的另一个关键之处是能否检测到PK15细胞中外源的SLA-2-HB01分子重链的表达情况,实验选用的真核表达载体pEGFP N3自带编码绿色荧光蛋白的基因,通过荧光倒置显微镜可以初步观察到PK15细胞中表达了绿色荧光蛋白(图 5),跟踪检测阳性单克隆细胞在扩大培养过程中绿色荧光蛋白的表达情况,发现绿色荧光较筛选前覆盖率得到提升,达到99%(图 6-F),并且主要分布在细胞浆中(图 6-G),这与经典的MHC相关理论是相符的。我们进一步通过Western Blotting检测了PK15细胞中SLA-2-HB01-EGFP融合蛋白的表达情况,阴性对照组中EGFP蛋白条带位于30 kD附近(EGFP分子量为30 kD),而转染组中EGFP条带位于70 kD附近,又因为SLA-2-HB01分子量为40 kD,因此能够判断在转染组中EGFP融合着SLA-2-HB01分子表达。另外相较于空白组,转染组中目的基因有很强的阳性表达(P < 0.01),进一步验证了SLA-2-HB01基因在PK15细胞中得到表达。
4 结论本实验成功构建了SLA-2-HB01/pEGFP N3重组质粒,并在PK15细胞中表达,为研究外源性SLA-2-HB01在PK15细胞中的抗原递呈规律及表位筛选奠定基础。
| [1] |
亢孝珍, 额尔敦木图, 姜建强, 等. 主要组织相容性复合体(MHC)基因研究进展[J]. 中国畜牧兽医, 2014, 41(5): 28-33. |
| [2] |
Consortium TMS. Complete sequence and gene map of a human major histocompatibility complex[J]. Nature, 1999, 401(6756): 921-923. DOI:10.1038/44853 |
| [3] |
Pedersen LE, Harndahl M, Rasmussen M, et al. Porcine major histocompatibility complex(MHC)class I molecules and analysis of their peptide-binding specificities[J]. Immunogenetics, 2011, 63(12): 821-834. DOI:10.1007/s00251-011-0555-3 |
| [4] |
Ando A, Kawata H, Shigenari A, et al. Genetic polymorphism of the swine major histocompatibility complex(SLA)class I genes, SLA-1, -2 and -3[J]. Immunogenetics, 2003, 55(9): 583-593. DOI:10.1007/s00251-003-0619-0 |
| [5] |
冯磊, 赵德, 高凤山. 猪主要组织相容性复合体研究进展[J]. 生命科学, 2012, 24(7): 686-690. |
| [6] |
陈茜茜, 王京华, 张香春, 等. 荷包猪SLA -2原核表达系的建立及表达研究[J]. 生物技术, 2011, 21(5): 45-48. DOI:10.3969/j.issn.1004-311X.2011.05.123 |
| [7] |
陈兆华, 周巧妮, 刘昌华, 等. 托佩克猪SLA-2与β2m复合体的构建[J]. 动物医学进展, 2011, 32(11): 10-13. DOI:10.3969/j.issn.1007-5038.2011.11.003 |
| [8] |
白婧, 许崇波, 张强, 等. 托佩克猪SLA-2基因克隆及功能区生物信息学分析[J]. 生物技术通报, 2011, 8: 133-139. |
| [9] |
高凤山, 李新生, 李云岗, 等. 巴马小型猪SLA-2和β_2m复合体蛋白的构建及二级结构测定分析[J]. 畜牧兽医学报, 2007, 38(3): 263-270. DOI:10.3321/j.issn:0366-6964.2007.03.011 |
| [10] |
刘筏, 杨金刚, 翟晓鑫, 等. 烟台黑猪SLA-Ⅰ重链基因末端生物素修饰及表达[J]. 生物技术通报, 2014, 1: 191-195. |
| [11] |
刘腾飞, 冯磊, 田永发, 等. 托佩克猪SLA-2基因克隆与表达[J]. 动物医学进展, 2013, 34(1): 19-23. DOI:10.3969/j.issn.1007-5038.2013.01.005 |
| [12] |
张香春, 冯磊, 张鑫, 等. 荷包猪SLA-2重链基因偶合底物肽及表达研究[J]. 生物技术, 2012, 22(5): 17-20. DOI:10.3969/j.issn.1004-311X.2012.05.107 |
| [13] |
Gao FS, Zhai XX, Jiang P, et al. Identification of two novel foot-and-mouth disease virus cytotoxic T lymphocyte epitopes that can bind six SLA-I proteins[J]. Gene, 2018, 653: 91-101. DOI:10.1016/j.gene.2018.02.025 |
| [14] |
Sun L, Zhang Y, Zhao B, et al. A new unconventional HLA-A2-restricted epitope from HBV core protein elicits antiviral cytotoxic T lymphocytes[J]. Protein & Cell, 2014, 5(4): 317-327. |
| [15] |
Ternette N, Mjm ON, Muller J, et al. Immunopeptidomic profiling of HLA-A2-positive triple negative breast cancer identifies potential immunotherapy target antigens[J]. Proteomics, 2018, 18(12): e1700465. DOI:10.1002/pmic.v18.12 |
| [16] |
Wong GH, Bartlett PF, Clark-Lewis I, et al. Inducible expression of H-2 and Ia antigens on brain cells[J]. Nature, 1984, 310(5979): 688-691. DOI:10.1038/310688a0 |
| [17] |
魏园园, 马忠仁, 王家敏, 等. PK15细胞的生物学特性和质量评价研究[J]. 黑龙江农业科学, 2015(5): 61-66. |
| [18] |
Gao FS, Bai J, Zhang XH, et al. Molecular characteristics of the SLA-2 gene from Chinese Hebao pigs[J]. Russian Journal of Genetics, 2012, 48(2): 224-229. DOI:10.1134/S1022795412010073 |
| [19] |
王健, 王晓东, 唐冠杰, 等. pEGFP-N3-TFPI-2真核表达载体的构建和鉴定[J]. 中国普外基础与临床杂志, 2014, 21(3): 300-304. |
| [20] |
张元沛, 李彦芹, 王玲玲, 等. 口蹄疫疫苗研究进展[J]. 中国畜牧兽医, 2013, 40(7): 171-174. DOI:10.3969/j.issn.1671-7236.2013.07.040 |
| [21] |
李世芳, 邵军军, 常惠芸. 口蹄疫表位疫苗的研究进展[J]. 中国畜牧兽医, 2017, 44(2): 396-401. |
| [22] |
王新军, 张兆松. 表位疫苗:疫苗研制新策略[J]. 中国寄生虫学与寄生虫病杂志, 2004, 22(6): 365-367. DOI:10.3969/j.issn.1000-7423.2004.06.013 |
| [23] |
刘显军, 陈静, 武常胜, 等. 荷包猪种质特性研究[J]. 中国畜牧杂志, 2010, 46(3): 10-12. |
| [24] |
Spector DL. Applications of the green fluorescent protein in cell biology and biotechnology[J]. Nature Biotechnol, 1997, 15(10): 961-964. DOI:10.1038/nbt1097-961 |
| [25] |
何贤辉, 徐丽慧, 刘毅, 等. HLA-A*0201与EGFP融合蛋白表达载体的构建及其在K562细胞的表达和定位[J]. 中国病理生理杂志, 2004, 20(5): 705-710. DOI:10.3321/j.issn:1000-4718.2004.05.001 |




