植物中蔗糖转运蛋白(Sucrose transporter,SUT)是一种蔗糖/H+共转运体,具备典型的12跨膜结构域,属于易化扩散超家族(Major facilitator superfamily,MFS),利用H+-ATP泵在细胞内外建立质子浓度梯度,进行蔗糖跨膜转运[1]。植物中蔗糖转运蛋白基因首先从菠菜中分离得到[2],随后在多种植物中分离出蔗糖转运蛋白家族基因[3],并进一步通过爪蟾卵母细胞电生理或酵母功能缺失突变体验证SUTs蔗糖转运活性[4-6]。SUT基因家族可聚类为3个亚族:SUT1、SUT2和SUT4,并在植物体内碳同化物运输和积累中发挥重要作用[7-8]。
SUT1亚族分布于成熟叶的各级叶脉、茎及多种“库”器官,在韧皮部蔗糖的装载、卸载、运输途径中蔗糖分子的重吸收及维持浓度梯度等方面都可能发挥重要作用[9-11]。SUT2亚族受蔗糖诱导表达,结合SUT2低水平的密码子偏好性和独特的胞质结构等推测,其可能是质膜蔗糖信号感应元件,影响蔗糖积累[12];SUT4亚族是定位在液泡膜上的一种H+/蔗糖同向转运蛋白,主要进行液泡内的蔗糖输出,维持库端渗透压,有利于蔗糖的进一步积累[13-17]。不同类型蔗糖转运蛋白在植物生长发育和蔗糖积累的不同阶段所起作用不同,与植物的生物量形成和蔗糖含量的关系密切[6, 18]。
植物通过叶片光合作用生产的糖类分子是其自身代谢的物质基础。这些糖类分子部分用于植物生长发育,部分在不同器官间进行分配和储存。蔗糖是甘蔗叶光合作用的主要产物,也是碳水化合物运输的主要形式,同时也是甘蔗茎秆中糖分利用和积累的主要形式。由于蔗糖在长距离运输过程中涉及多次跨膜运输,因此,蔗糖转运蛋白在甘蔗蔗糖转运和积累中起重要作用。
甘蔗是多年生宿根无性繁殖作物,经多年连续宿根和无性留种生产后,多种病原物反复侵染并在甘蔗体内积累,抑制甘蔗正常生长,导致优良品种种性退化,造成甘蔗减产达10%,有的甚至高达50%[19-20]。目前脱毒健康种苗生产技术是恢复甘蔗优良种性最有效的技术措施,种植甘蔗脱毒健康种苗可以增产20%-40%[21-23]。从甘蔗农艺性状上对其增产增糖机理已开展较详细的研究[22, 24],但更进一步从蔗糖转运方面对其增产增糖的机理研究还未见报道。本研究利用已报道的3个甘蔗蔗糖转运蛋白基因SUT1、SUT4和SUT6为研究对象,分别从甘蔗整个生长期(苗期、分蘖期、拔节期和成熟期)对它们的表达量进行比较分析,探讨经过脱毒处理后蔗糖转运蛋白基因的表达量与增产增糖之间的相关性,从分子水平上揭示甘蔗脱毒健康种苗的增产增糖机理。
1 材料与方法 1.1 材料供试材料为甘蔗新台糖22号品种腋芽脱毒种苗二代种茎苗和普通新台糖22号种茎(对照),来源于中国热带农业科学院热带生物技术研究所甘蔗试验地。RNA提取试剂盒购自Aidlab(艾德莱)公司;反转录试剂盒购自TaKaRa公司;测序载体、T4连接酶购自生工生物工程(上海)股份有限公司;SYBR®Premix Ex TaqTM试剂盒购自TaKaRa公司;凝胶回收试剂盒购自购自康宁生命科学(吴江)有限公司;DNA Marker和核酸染料购于上海赛百盛基因技术有限公司;感受态细胞购自TaKaRa公司;其他生化试剂均为国产分析纯或进口分装。
1.2 方法 1.2.1 田间试验设计和管理田间试验地点在海南省临高县皇桐镇甘蔗试验基地进行。土壤为红壤、肥力中等。采用随机区组排列,设2个处理,分别种植脱毒种苗和普通种苗,每个处理设3次重复。株距为0.5 m,行距1.2 m,5行区,每行长10.0 m,小区试验面积60 m2,每行下种20段双芽苗,3面设保护行。田间管理参照文献[22]的方法进行。
1.2.2 样品采集分别选取10个生长一致的试验植株,在苗期、分蘖期、拔节期和成熟期进行取样,每个样品取3个重复,甘蔗未成熟叶片为0叶,成熟叶片为+3叶,茎秆节段的计算是生长点向下计算甘蔗茎节数,拔节期分别取(1-3、4-5和7-8、10-11、13-14、16-17、19-20和22-23茎节),成熟期分别取幼茎(1-3、4-5和7-8、10-11、13-14、16-17、19-20、22-23、29-30和36-37茎节)。
1.2.3 总RNA提取、检测与反转录参照王俊刚等[25]方法进行甘蔗总RNA提取和检测。cDNA合成按照反转录试剂盒说明书进行,各材料起始总RNA模板用量一致。
1.2.4 引物设计根据NCBI公布的甘蔗转运蛋白基因SUT1(GenBank登录号AY780256.1)和SUT4(GenBank登录号GQ485583.1)序列利用Primer5设计引物(SUT1-F:5'-GTTCCTGCTACCCAAGAT-3',SUT1-R:5'-CCTCTTCTTATTCTGTTCAA-3';SUT4-F:5'-GCCCAGACAACCCAGGAGAGAC-3',SUT4-R:5'-CAGAGGTGAATCCAAGGACGACAG-3');SUT6引物参照Zhang等[26]方法设计(SUT6-F:5'-CATGGTCGTCTGATCGATGTT-3',SUT6-R:5'-ACCACAAATCCGGCGATAG-3'),内参GADPH引物参考Iskandar等[27]方法设计(GAPDH-F:5'-CACGGCCACTGGAAGCA-3',GAPDH-R:5'-TCCTCAGGGTTCCTGATGCC-3')。
1.2.5 qPCR扩增参照SYBR®Premix Ex TaqTM试剂盒说明书配制PCR反应体系,每个处理设3个重复,qPCR反应体系:2×SYBR PremixExTaqTM 10 μL、上下游引物(浓度为4 μmol/L)各2 μL、50×ROX Reference Dye 0.4 μL、模板cDNA 1 μL,ddH2O补足20 μL。反应程序为试剂盒推荐程序,并在Mx3005PTM(Roche)上完成扩增。
1.2.6 数据分析用2-ΔΔCt法计算相对定量值[28]。内参基因为甘蔗GADPH。
2 结果 2.1 RNA纯度鉴定结果甘蔗总RNA经琼脂糖凝胶电泳检测,28S和18S条带清晰可见,无明显降解现象;A260/A280比值为1.8-1.9,RNA纯度与浓度均满足于下一步实验要求。
2.2 苗期甘蔗SUT的表达分析通过对甘蔗苗期SUT的Q-PCR检测分析,结果(图 1)显示,不同家族的SUT在未成熟和成熟叶片中都有表达。在未成熟叶片中,与对照相比,SUT1表达量提高2.7倍,SUT4表达量提高2.9倍,SUT6表达量提高2.3倍,而在成熟叶片中,SUT1表达量降低2倍左右,SUT4表达量降低2倍左右,SUT6表达量提高3.4倍。
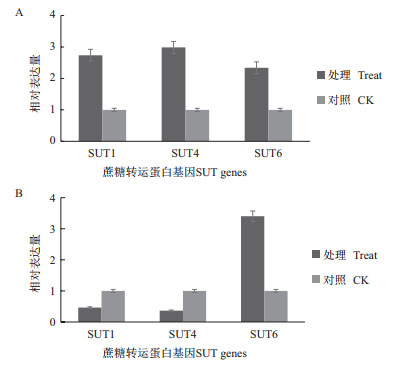
|
| 图 1 苗期甘蔗中蔗糖转运蛋白基因相对表达量 A:未成熟叶片;B:成熟叶片 |
通过对甘蔗分蘖期SUT的Q-PCR检测分析(图 2)。与对照相比,SUT1在分蘖期脱毒健康种苗未成熟和成熟叶片中表达量分别提高7.9倍和6.0倍;SUT4在分蘖期脱毒健康种苗未成熟和成熟叶片中表达量分别提高5.7倍和2.3倍;SUT6在分蘖期脱毒健康种苗未成熟和成熟叶片中表达量分别提高4.5倍和3.6倍。
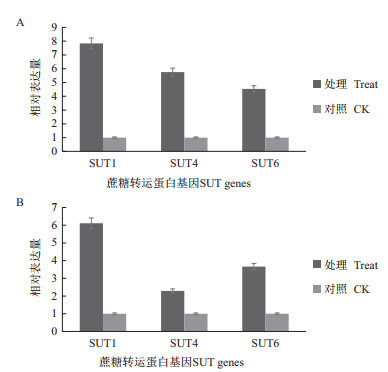
|
| 图 2 分蘖期甘蔗中蔗糖转运蛋白基因相对表达量 A:未成熟叶片;B:成熟叶片 |
通过对甘蔗拔节期SUT的Q-PCR检测分析(图 3)。与对照相比,SUT1在拔节期脱毒健康种苗叶片和茎秆中的相对表达量无明显差异,其中在19-23节中降低1倍,而在茎秆中随节间成熟度的增加其表达量有逐渐降低的趋势,但其表达量低于对照;SUT4在拔节期脱毒健康种苗未成熟叶片中的表达量略高于对照,在茎秆中随着茎节成熟度的增加其表达量逐渐降低,然而在1-11茎节中其表达量被上调,1-3茎节中表达量明显高于对照,达到6.5倍;SUT6在拔节期脱毒健康种苗未成熟叶片中的表达量比对照高3.8倍,但在成熟叶片中其表达量无明显差异,同样随着茎节成熟度的增加表达量逐渐降低,在1-11茎节中被上调表达,在1-3茎节中其表达量明显高于对照,达到8.5倍,在13茎节后其表达量与对照没有差异。
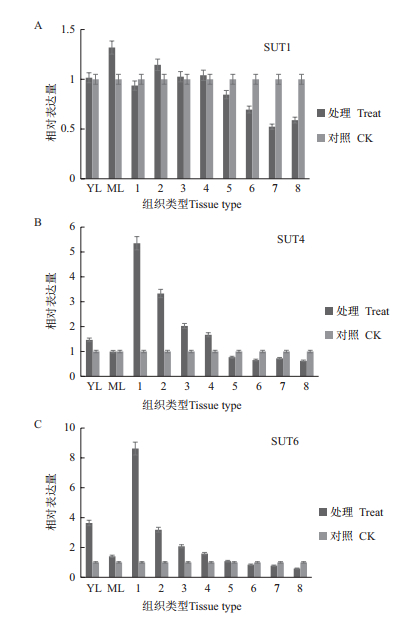
|
| 图 3 拔节期甘蔗中蔗糖转运蛋白基因相对表达量 YL:未成熟叶片;ML:成熟叶片;1:1-3节;2:4-5节;3:7-8节;4:10-11节;5:13-14节;6:16-17节;7:19-20节;8:22-23节。下同 |
通过对甘蔗成熟期SUT的Q-PCR检测分析(图 4)。成熟期脱毒健康种苗叶片中SUT1、SUT4和SUT6表达量高于对照,其中SUT1在未成熟叶片中相对表达量比对照高7.2倍,在成熟叶片中其相对表达量比对照高10.4倍,在1-3茎节中其相对表达量比对照高15.8倍,随茎杆节间成熟度增加,其相对表达量逐渐降低,在10-37茎节中无明显差异;其中SUT4在未成熟叶片中相对表达量比对照高8.3倍,在成熟叶片中其相对表达量比对照高10.0倍,在1-3茎节中其相对表达量比对照高10.2倍,4-5茎节中其相对表达量比对照高5.2倍,在之后的茎节中表达量无明显差异;SUT6在未成熟叶片中相对表达量比对照高7.1倍,在成熟叶片中其相对表达量比对照高10.2倍,在1-3茎节中其相对表达量比对照高15.4倍,4-5茎节中其相对表达量比对照高2.2倍,在之后的茎节中表达量无明显差异。
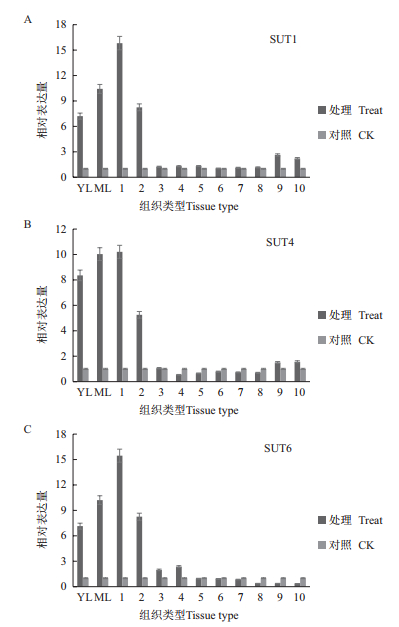
|
| 图 4 成熟期甘蔗中蔗糖转运蛋白基因相对表达量 9:29-30节;10:36-37节 |
甘蔗脱毒种苗比常规种苗出苗快、生长快、分蘖苗多,有效茎多,蔗株高,增产效益明显,同时还能够增加蔗株的蔗糖含量,提高单位面积的经济效益。目前,在基因水平上将脱毒健康种苗与为未脱毒苗进行比较的相关研究已有些报道[25, 29-31],但还没有蔗糖转运蛋白(SUT)方面的报道。SUT是蔗糖运输和积累过程中的关键转运蛋白,其转运活性对蔗糖的最终积累量起着重要的作用[32-34]。SUT亚族基因在不同植物中的时空表达模式存在差异,功能也不同[35-36]。甘蔗常用栽培品种是异源多倍体且遗传背景复杂,SUT家族基因在不同生长时期时空表达模式不同,推测它们对甘蔗产量形成和糖分积累的影响也不同[34, 36-37]。
已有研究表明不同类型SUT基因在甘蔗不同蔗糖积累阶段发挥不同作用[37-38]。本研究对甘蔗脱毒健康种苗中的3种蔗糖转运蛋白基因的表达进行分析发现与常规种苗相比SUT1、SUT4和SUT6均存在不同程度的上调表达,特别是在快速生长代谢旺盛部位,并且在成熟期叶片和蔗糖快速积累茎节中SUTs的大幅上调表达促进蔗糖的运输、分配、利用,并可能最终提高脱毒健康种苗的产量和糖含量。然而在甘蔗不同生长时期脱毒健康种苗中SUT1、SUT4和SUT6差异表达模式不同。
在脱毒健康种苗的苗期和分蘖期叶片中3种SUT表达存在差异,并且分别在成熟叶片和未成熟叶片的表达差异也不同,SUT1和SUT4在脱毒健康种苗苗期未成熟叶片、分蘖期未成熟叶片和成熟叶片中表达高于对照;SUT6在苗期和分蘖期叶片中的表达高于对照。表明不同SUT在这两个时期叶片蔗糖运输及分配中发挥不同作用,推测苗期成熟叶片中SUT1和SUT4下调表达,其叶片糖分积累减弱,有利于蔗糖运输,而未成熟叶片中上调表达,有利于蔗糖利用;SUT6上调表达,能够促进这两个时期叶片的快速生长和糖分的运输,推测SUT1和SUT4参与调控蔗糖积累,而SUT6可能调控蔗糖的运输,这在其他植物同源蔗糖转运蛋白研究中也得到类似的结果[39-40]。
同时在拔节期脱毒健康种苗中SUT1的表达没有变化,表明脱毒处理对拔节期SUT1的表达影响不大,而SUT4和SUT6在未成熟茎节中明显上调表达。幼嫩茎节中蔗糖运输和代谢最活跃,蔗糖的高效运输有利于茎节的快速生长和糖分积累,由此推测拔节期SUT4和SUT6的上调表达有利于促进甘蔗产量形成及糖分积累。赵婷婷等[37]也发现SUT4表达量与糖分的积累呈正相关,表明SUT4对甘蔗蔗糖的快速运输和积累起着重要的作用。
成熟期脱毒健康种苗叶片和茎秆中不同SUT表达模式基本一致,SUT1、SUT4和SUT6在叶片和未成熟茎节中上调表达,而在成熟茎节中表达量没有差异,表明蔗糖转运蛋白能够有效提高叶片中蔗糖的转运效率,促进叶片中蔗糖的输出和未成熟茎节中蔗糖的分配及利用,进而促进蔗糖的积累。茎秆的成熟主要体现在茎节蔗糖的含量的升高,此时,蔗糖转运蛋白表达量的增加,有利于蔗糖积累,促进茎秆的成熟,从而提高茎秆中的蔗糖含量。在水稻中通过提高蔗糖转运蛋白的表达量能够增加其产量[12, 41],进一步表明通过改变蔗糖转运蛋白的表达,能够影响碳的分配,从而提高作物的产量。甘蔗脱毒健康种苗能够有效提高甘蔗产量和糖分,本研究表明不同类型蔗糖转运蛋白基因的表达与其产量和糖分增加相关,对蔗糖转运蛋白基因功能的更进一步研究将有助于揭示脱毒健康种苗的增产增糖机理。
4 结论在甘蔗脱毒健康种苗中,SUT1、SUT4和SUT6在不同生长时期的组织中均上调表达,初步推测甘蔗进行脱毒处理能够上调叶片和未成熟茎节中SUT的表达,促进蔗糖利用及积累,进而提高蔗茎的产量和糖含量。
| [1] |
Sauer N. Molecular physiology of higher plant sucrose transporters[J]. FEBS Letters, 2007, 581: 2309-2317. DOI:10.1016/j.febslet.2007.03.048 |
| [2] |
Riesmeier JW, Willmitzer L, Frommer WB. Isolation and characterization of a sucrose carrier cdna from spinach by functional expression in yeast[J]. The EMBO Journal, 1992, 11: 4705-4713. DOI:10.1002/embj.1992.11.issue-13 |
| [3] |
Derrer C, Wittek A, Bamberg E, et al. Conformational changes represent the rate-limiting step in the transport cycle of maize sucrose transporter1[J]. The Plant Cell, 2013, 25: 3010-3021. DOI:10.1105/tpc.113.113621 |
| [4] |
Deol KK, Mukherjee S, Gao F, et al. Identification and characterization of the three homeologues of a new sucrose transporter in hexaploid wheat(Triticumaestivum L.)[J]. BMC Plant Biology, 2013, 13: 181. DOI:10.1186/1471-2229-13-181 |
| [5] |
Oner-Sieben S, Rappl C, Sauer N, et al. Characterization, localization, and seasonal changes of the sucrose transporter FeSUT1 in the phloem of Fraxinus excelsior[J]. Journal of Experimental Botany, 2015, 66: 4807-4819. DOI:10.1093/jxb/erv255 |
| [6] |
Zanon L, Falchi R, Hackel A, et al. Expression of peach sucrose transporters in heterologous systems points out their different physiological role[J]. Plant Science, 2015, 238: 262-272. DOI:10.1016/j.plantsci.2015.06.014 |
| [7] |
戚继艳, 阳江华, 唐朝荣. 植物蔗糖转运蛋白的基因与功能[J]. 植物学报, 2007, 24(4): 532-543. DOI:10.3969/j.issn.1674-3466.2007.04.016 |
| [8] |
Kühn C, Grof CP. Sucrose transporters of higher plants[J]. Current Opinion in Plant Biology, 2010, 13(3): 287-297. DOI:10.1016/j.pbi.2010.02.001 |
| [9] |
Hackel A, Schauer N, Carrari F, et al. Sucrose transporter LeSUT1 and LeSUT2 inhibition affects tomato fruit development in different ways[J]. The Plant Journal, 2005, 45: 180-192. |
| [10] |
张雅丽, 孟庆勇, 曲桂芹, 等. 葡萄蔗糖转运蛋白在烟草中的反义表达及其对转基因烟草的影响[J]. 生物化学与生物物理进展, 2006, 33(7): 699-705. DOI:10.3321/j.issn:1000-3282.2006.07.016 |
| [11] |
Rae AL, Perroux JM, Grof CPL. Sucrose partionning between vascular bundles and storage parenchyma in the sugarcane stem: a potential role for the ShSUT1 sucrose transporter[J]. Planta, 2005, 220: 817-825. DOI:10.1007/s00425-004-1399-y |
| [12] |
Sun A, Dai Y, Zhang X, et al. A transgenic study on affecting potato tuber yield by expressing the rice sucrose transporter genes OsSUT5Z and OsSUT2M[J]. JIPB, 2011, 53(7): 586-595. |
| [13] |
Endler A, Meyer S, Schelbert S, et al. Identification of a vacuolar sucrose transporter in barley and Arabidopsis mesophyll cells by a tonoplast proteomic approach[J]. Plant Physiology, 2006, 141(1): 196-207. DOI:10.1104/pp.106.079533 |
| [14] |
Schneider S, Hulpke S, Schulz A, et al. Vacuoles release sucrose via tonoplast-localised SUC4-type transporters[J]. Plant Biology, 2012, 14(2): 325-336. DOI:10.1111/plb.2012.14.issue-2 |
| [15] |
Chincinska IA, Liesche J, Krugel U, et al. Sucrose transporter StSUT4 from potato affects flowering, tuberization, and shadeavoidanceresponse[J]. Plant Physiology, 2008, 146(2): 515-528. |
| [16] |
Payyavula RS, Tay KH, Tsai CJ, et al. The sucrose transporter family in Populus: the importance of a tonoplast PtaSUT4 to biomass and carbon partitioning[J]. The Plant Journal, 2011, 65(5): 757-770. DOI:10.1111/tpj.2011.65.issue-5 |
| [17] |
Eom JS, Cho JI, Reinders A, et al. Impaired function of the tonoplast -localized sucrose transporter in rice, OsSUT2, limits the transport of vacuolar reserve sucrose and affects plant growth[J]. Plant Physiology, 2011, 157(1): 109-119. DOI:10.1104/pp.111.176982 |
| [18] |
赵婷婷, 王俊刚, 冯翠莲, 等. 甘蔗蔗糖转运蛋白ShSUT4基因克隆及表达分析[J]. 热带作物学报, 2012, 33(2): 310-315. DOI:10.3969/j.issn.1000-2561.2012.02.019 |
| [19] |
Flynn JL, Anderlini TA. Disease incidence and yield performance of tissue culture generated seedcane over the crop cycle in Louisiana[J]. Sugar Azucar, 1989, 80: 20. |
| [20] |
Hendre RA, Mascarenhas AF, Nadgir AL, et al. Growth of mosaic virus-free sugarcane plants from apical meristems[J]. Indian Pathology, 1975, 28: 185-198. |
| [21] |
Lee TSG. Micropropagation of sugarcane(Saccharum spp.)[J]. Plant Cell, Tissue and Organ Culture, 1991, 10: 47-55. |
| [22] |
杨本鹏, 张树珍, 蔡文伟, 等. 甘蔗健康种苗田间栽培主要农艺性状比较[J]. 热带作物学报, 2010, 2(31): 117-175. |
| [23] |
蔡文伟, 杨本鹏, 武媛丽, 等. 甘蔗脱毒健康种苗田间繁育技术研究[J]. 热带作物学报, 2016, 37(4): 653-659. DOI:10.3969/j.issn.1000-2561.2016.04.002 |
| [24] |
游建华, 曾慧, 李松, 等. 甘蔗脱毒健康种苗田间比较试验[J]. 中国糖料, 2005, 2: 12-15. DOI:10.3969/j.issn.1007-2624.2005.02.004 |
| [25] |
王俊刚, 赵婷婷, 杨本鹏, 等. 甘蔗脱毒健康种苗中蔗糖转化酶表达分析[J]. 江苏农业科学, 2017, 45(21): 35-39. |
| [26] |
Zhang Q, Hu W, Zhu F, et al. Structure, phylogeny, allelic haplotypes and expression of sucrose transporter gene families in saccharum[J]. BMC Genomics, 2016, 17(1): 88. DOI:10.1186/s12864-016-2419-6 |
| [27] |
Iskandar HM, Simpson SR, Casu RE, et al. Comparison of reference genes for quantitative real-time polymerase chain reaction analysis of gene expression in sugarcane[J]. Plant Molecular Biology Reporter, 2004, 2(22): 325-337. |
| [28] |
Livak KJ, Schmittgen TD. Analysis of relative gene expression data using real-time quantitative pcr and the 2(-delta deltac(t))method[J]. Methods, 2001, 25(4): 402-408. DOI:10.1006/meth.2001.1262 |
| [29] |
王俊刚, 赵婷婷, 杨本鹏, 等. 甘蔗脱毒健康种苗蔗糖磷酸合成酶基因差异表达分析[J]. 南方农业学报, 2017, 48(8): 1335-1342. DOI:10.3969/j.issn.2095-1191.2017.08.02 |
| [30] |
王俊刚, 赵婷婷, 杨本鹏, 等. 甘蔗脱毒健康种苗中蔗糖合成酶基因差异表达分析[J]. 中国糖料, 2017, 39(4): 1-4, 7. |
| [31] |
王俊刚, 赵婷婷, 杨本鹏, 等. 甘蔗脱毒健康种苗中单糖转运蛋白基因差异表达分析[J]. 生物技术通报, 2015, 31(3): 115-120. |
| [32] |
牛俊奇, 王震, 杨丽涛, 等. 甘蔗蔗糖转运蛋白SoSUT2基因克隆和表达分析[J]. 中国农业大学学报, 2017, 22(6): 32-40. |
| [33] |
涂文睿, 蔡昱萌, 颜婧, 等. 植物蔗糖转运蛋白及其生理功能的研究进展[J]. 生物技术通报, 2017, 33(4): 1-7. |
| [34] |
赵文慧.甘蔗蔗糖转运蛋白基因SoSUT5的遗传转化[D].南宁: 广西大学, 2016. http://cdmd.cnki.com.cn/Article/CDMD-10593-1016218705.htm
|
| [35] |
巩慧玲, 田泽, 徐进, 等. 茄科植物蔗糖转运蛋白研究进展[J]. 植物生理学报, 2017(10): 1819-1823. |
| [36] |
张清, 胡伟长, 张积森. 植物蔗糖转运蛋白研究进展[J]. 热带作物学报, 2016, 37(1): 193-202. DOI:10.3969/j.issn.1000-2561.2016.01.031 |
| [37] |
赵婷婷.甘蔗不同类型蔗糖转运蛋白基因克隆及功能分析[D].海口: 海南大学, 2012. http://cdmd.cnki.com.cn/Article/CDMD-10589-1015503037.htm
|
| [38] |
Rae AL, Perroux JM, Grof CPL. Sucrose partitioning between vascular bundles and storage parenchyma in the sugarcane stem: a potential role for the ShSUT1 sucrose transporter[J]. Planta, 2005, 220(6): 817-825. DOI:10.1007/s00425-004-1399-y |
| [39] |
Li F, Wu B, Qin X, et al. Molecular cloning and expression analysis of the sucrose transporter gene family from Theobroma cacao L.[J]. Gene, 2014, 546(2): 336-341. DOI:10.1016/j.gene.2014.05.056 |
| [40] |
Usha B, Bordoloi D, Parida A. Diverse expression of sucrose transporter gene family in Zea mays[J]. Journal of Genetics, 2015, 94(1): 151-154. DOI:10.1007/s12041-015-0491-3 |
| [41] |
洪海强.过表达OsSUT2和OsSUT5籼稻的灌浆生理[D].福州: 福建农林大学, 2008. http://www.wanfangdata.com.cn/details/detail.do?_type=degree&id=Y1322896
|




