真核生物的基因表达与调控是一系列顺式作用元件(Cis-acting element)与反式作用因子(Trans-acting factor)相互作用的结果。顺式作用元件本身不编码蛋白,只是基因组中一些特定的区域,它们需与反式作用因子结合才能发挥其生理作用,调控基因转录的精确起始和转录效率[1]。植物在应对逆境胁迫时,反式作用因子直接或间接结合在顺式作用元件上,能够调控生长发育、形态建成、次级代谢产物的合成,增强防御体制,在应对各种生物和非生物胁迫应答中起着至关重要的调节作用[2]。
近年来,反式作用因子与顺式作用元件互作的研究越来越多。有学者通过酵母单杂交以及凝胶电泳阻滞实验发现转录因子NAP受到ABA的调控并直接与其靶基因SAG113启动子上的一个特定区域进行专一性结合,SAG113与控制气孔运动和水分缺失有关,为适当延长植物的生育期,最终提高农作物产量发挥了重大的作用[3]。刘慧春等[4]运用酵母单杂交技术发现牡丹(Paeonia suffruticosa)的抗逆转录因子PsDREB与顺式作用元件DRE(干旱应答元件)可以特异性结合,从而提高了植株的抗逆性。Shi等[5]研究发现DOF转录因子可以与DOFCOREZM元件结合,在植物激素响应和逆境条件下调控植物的光合作用。刘缙等[6]运用凝胶阻滞实验结果表明,小麦(Triticum aestivum)的TaPBFB融合蛋白能与麦谷蛋白GluD-LMWGS基因启动子上的顺式元件Prolamin-box特异结合,从而增强小麦的储存蛋白功能,并为进一步在转录调控水平实现农作物的遗传改良奠定基础。由此可见,转录因子与顺式作用元件的相互作用在植物的生长发育中起到非常重要的作用。
植物转录因子MYB(v-myb avian myeloblastosis viral oncogene homolog)是近年来发现的与调控植物生长发育、生理代谢、细胞的形态和模式建成等生理过程有关的一类转录因子[7]。有学者通过研究发现通过研究发现小麦的TaMYB30-B基因可提高植株在发芽期和幼苗期的耐旱性[8]。高巍等[9]通过实验发现GbMYB60基因的过表达可以提高棉花(Gossypium spp.)幼苗对高盐胁迫的耐受性。Lotkowska等[10]发现拟南芥的AtMYB112受光照调节并调控花青素的积累,强光胁迫时,AtMYB112表达量增加,并能促进花青素合成过程中的关键因子—花青素贰的合成、降低黄酮醇的合成,从而使花青素合成积累。Campos等[11]发现番茄(Lycope-rsicon esculentum)中的ARS1基因有助于减少盐胁迫下的水分蒸腾损失,可以提高番茄胁迫耐受性而不会产生产量的损失。
白桦(Betula platyphylla)别名桦木、桦树。其木材可用于建筑,制作家具、造纸,叶可作染料或煤油,树皮可提桦皮油、栲胶,桦树汁液可祛痰止咳、清热消肿[12]。由于近年来环境恶化日益严重,白桦的生境越来越困难,因此对于白桦的遗传改良工作越来越迫切。前人研究发现,E-box的核心序列为CANNTG(N:A/G/C/T),参与光响应和苯丙氨酸生物合成途径[13]。前期研究通过以转录因子为中心的酵母单杂交技术发现白桦的BplMYB46转录因子能够与一个E-box顺式作用元件(CAAATG)结合[14]。有研究显示,E-box的核心序列中间两个碱基可能是DNA碱基里的任意一个。在本研究中,我们将E-box顺式作用元件核心序列中间的两个碱基进行了不同的组合,设计正反引物后进行双链DNA的复性并连接到pHIS2载体上,然后通过酵母单杂交技术筛选与BplMYB46转录因子能够特异结合的E-box顺式作用元件,确定中间的两个任意碱基的特异性序列,从而为下一步研究BplMYB46转录因子与下游基因的调控及为筛选优良下游基因改良白桦遗传性状奠定基础。
1 材料与方法 1.1 材料 1.1.1 菌株及载体酵母菌Y187,含有pHIS2质粒的大肠杆菌,pGADT7-Rec2-BplMYB46质粒,均由本实验室保存。
1.1.2 试剂大肠杆菌DH5α感受态细胞(本实验室制备)、TaKaRa公司产品(大连):Goldview,6×Loading Buffer,DL2000 DNA marker,rTaq聚合酶。EcoR Ⅰ和SacⅠ(NEB公司)、DNA纯化回收试剂盒(OMEGA生物技术有限公司),质粒提取试剂盒(OMEGA生物技术有限公司)。T4连接酶试剂盒(Promega公司),卡那霉素(kan,Sigma公司),3-氨基-1,2,4-三氮唑氨三唑(3-AT,Sigma公司)。
1.1.3 药品储存液及培养基制备药品储存液配制:(1)1.1×TE/LiAC:10×TE 1.1 mL,1 mol/L LiAC 1.1 mL,ddH2O定容至10.0 mL。(2)PEG/LiAC:50%PEG3350 8 mL,10×TE 1 mL,1 mol/L LiAC 1 mL。(3)3-AT溶液:3-AT粉末用去离子水溶解,储存浓度为2 mol/L,抽滤灭菌,工作浓度为50 mmol/L,4℃保存。(4)卡那霉素:称取卡那霉素1 g用无菌水定容至20 mL,用滤器过滤除菌,配制成50 mg/mL的溶液分装在灭菌的1.5 mL离心管中,-20℃保存备用。
培养基配制:(1)LB液体(固体)培养基:10 g/L蛋白胨,10 g/L NaCl,5 g/L酵母粉,8 g/L琼脂粉,调节pH为7.0;固体培养基另加琼脂粉10 g/L即可。(2)YPDA液体(固体)培养基:酵母提取物10 g/L,胰蛋白胨20 g/L,葡萄糖2%(W/V),腺嘌呤0.003%(W/V)(固体培养基另加琼脂粉20 g/L)。(3)SD/DO液体(固体)培养基:酵母氮源(无氨基酸)6.7 g/L,葡萄糖2%(W/V),相应缺陷型10×DO母液100 mL/L; 固体培养基另加琼脂粉20 g/L即可。缺陷型氨基酸营养包括:DDO:SD/-Leu/-Trp(缺少亮氨酸和色氨酸); TDO:SD/-His/-Leu/-Trp(缺少组氨酸、亮氨酸和色氨酸)。
1.2 方法 1.2.1 元件双链DNA的合成设计引物并在上下游引物的5'端分别引入核酸内切酶(Eco R Ⅰ)和(Sac Ⅰ)的酶切位点(表 1),然后将引物分别稀释为100 μmol/L将正反两条引物复性成双链DNA片段,反应体系,如表 2所示。
反应条件:95℃ 30s,72℃ 2 min,37℃ 2 min,25℃ 2 min。然后用灭菌水进行1/100的稀释。
1.2.2 提取pHIS2载体质粒挑取pHIS2的单个克隆接种于含有Kan(50 mg/L)的LB液体培养基中于37℃摇床中180 r/min过夜培养,用质粒小量提取试剂盒提取质粒后用Eco R Ⅰ和Sac Ⅰ进行双酶切,并纯化回收。
1.2.3 连接及转化将稀释后的复性双链DNA片段与切后的pHIS2进行连接,反应体系如表 3。利用42℃热激法将连接产物转入大肠杆菌DH5α感受态细胞中。
挑取大肠杆菌转化后的单菌落到加有Kan抗生素的LB液体培养基中,在37℃条件震荡培养6 h,培育结束后取10 μL菌液加入PCR小管中,98℃预变性10 min,冰浴2 min,离心1 min,取1 μL上清液作为模板,进行PCR鉴定,引物根据pHIS2载体上EcoR Ⅰ和Sac Ⅰ内切酶识别位点两侧设计,具体序列如表 4。
PCR反应条件:预变性95℃,1 min; 变性94℃,30 s; 退火55℃,30 s; 延伸72℃,30 s; 反应30个循环后,后延伸72℃,5 min。对产物进行电泳检测。照相保存。
对含有目标条带的菌液用质粒小量提取试剂盒提取质粒,并测序,测序成功的菌种进行保存。
1.2.5 酵母转化(1)首先用YPDA培养基活化Y187酵母菌,然后制备酵母感受态细胞。(2)每管加入50 μL酵母感受态细胞、500 μL PEG/LiAc、5 μL变性的鲑精DNA(10 μg/μL,98℃变性5 min)和5 μL pGADT7-Rec2-BplMYB46质粒。(3)分别加入构建好的含有E-box顺式作用元件的pHIS2载体质粒,轻柔混匀(加入5 μL pGADT7-Rec2-p53s质粒和5 μL pHIS2-p53s质粒作为阳性对照; 加入5 μL pHIS2- p53s质粒和5 μL pGADT7-Rec2-BplMYB46质粒作为阴性对照)。(4)30℃水浴30 min,加入23 μL DMSO,混匀。(5)42℃水浴15 min,冰预冷1-2 min; 14 000 r/min离心15 s。(6)弃上清,加入1 mLYPD Plus Medium重悬酵母细胞,30℃震荡培养30 min; 14 000 r/min离心15 s,沉淀酵母细胞。(7)弃上清,加入1 mL无菌去离子水重悬酵母细胞。(8)取100 μL菌液分别涂布于SD/-Leu/-Trp、SD/-His/-Leu/-Trp、SD/-His/-Leu/-Trp/3-AT固体培养基中30℃培养3-4 d。
1.2.6 酵母点点验证(1)挑取在SD/-His/-Leu/-Trp/3-AT平板中生长的单菌落接种在SD/-Leu/-Trp液体培养基中,220 r/min培养16 h。(2)分别测菌液的OD值,12 000 r/min离心15 s,加入无菌水重悬菌液至OD值为2,并稀释成1/10、1/100、1/1000在SD/-Leu/-Trp、SD/-His/-Leu/-Trp+3-AT固体培养基上进行点点复检。
2 结果 2.1 载体酶切结果使用EcoR Ⅰ和Sca Ⅰ将pHIS2载体进行酶切,酶切电泳结果如图 1。

|
| 图 1 酶切结果 M:DL15000 marker(分子量从上到下分别为:15000、10000,7500、5000、2500、1000、250);1:酶切后pHIS2质粒;2:酶切前pHIS2质粒 |
载体在酶切前是双螺旋闭合环状分子,酶切后变为线性分子,线性分子比环状分子的电泳迁移速率慢,从图 1中可以看出,酶切后的质粒比酶切前的质粒迁移速率慢,表明酶切成功。
2.2 PCR鉴定结果每个载体构建的大肠杆菌菌落各挑取3个单菌落摇菌活化,进行PCR检测。根据pHIS2载体上Eco R Ⅰ和Sac Ⅰ限制性内切酶识别位点的前后序列设计载体引物,进行PCR菌液检测,以阳性菌液为模板的PCR扩增的DNA条带要比以pHIS2空载体为模板的PCR扩增的条带分子量大20个碱基左右。
从图 2中可以看出,泳道1-13、15-18、19、21、23-26、28-30、32-37、40、41和43-48号的PCR扩增条带比对照分子量大,初步证明这些泳道对应的菌液为阳性结果,然后将其送到测序公司测序,结果发现,测序序列与已知构建的E-box元件序列具有100%的一致性,说明载体构建成功。

|
| 图 2 PCR鉴定结果 M:DL2000 marker;阳:pHIS2;1-48:将构建好的具有不同碱基类型的E-box载体,进行热激转化后,每个载体挑取3个单菌落进行检测 |
在前期研究中发现,白桦的BplMYB46转录因子能够与E-box顺式作用元件(CAAATG)结合。因此,我们将E-box顺式作用元件核心序列中间的两个碱基进行了不同的组合。从图 3中可以看出,E-box的核心序列第3个碱基为A/T/C时,酵母转化单菌落在缺陷性培养基TDO/3AT上生长; 第4个碱基为A/G/C时,酵母转化单菌落在缺陷性培养基TDO/3AT上生长。因此本实验结果说明,与BplMYB46转录因子结合的E-box顺式作用元件的特异性序列为CA(A/T/C)(A/G/C)TG。
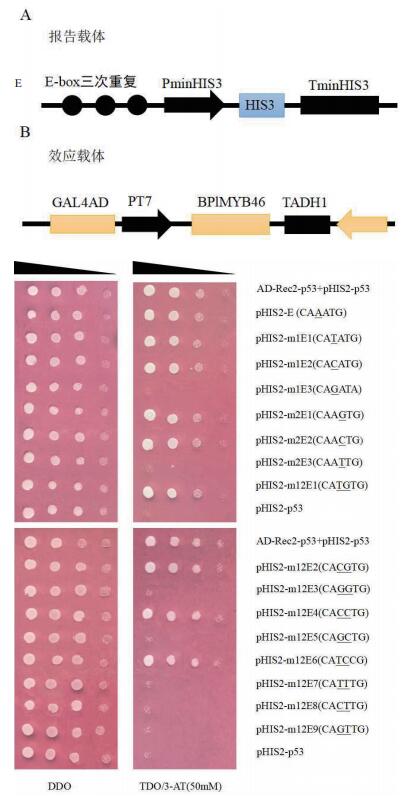
|
| 图 3 酵母单杂交结果分析 |
E-box元件是R2R3型MYB转录因子可能作用的元件,参与光响应和苯丙氨酸生物合成途径[13],该元件最初由Matern和Grimmig运用了足迹分析(Footprinting)和凝胶电泳阻滞实验(EMSA)从欧芹的咖啡酰辅酶A-O-甲基转移酶(CcoAOMT)基因启动子中鉴出来并加以命名。前期研究发现,白桦的BpIMYB46转录因子能够通过调控苯丙氨酸裂解酶(Phenylalanine ammonia-lyase,PAL)等与次生壁合成相关基因的表达增加木质素沉积和次生细胞壁厚度[15]。我们通过对BpIMYB46调控的下游基因启动子上的顺式作用元件分析发现,PAL基因启动子上含有多个重复的E-box元件,因此推测,E-box元件可能与次生壁合成相关。在后续的实验中,我们将利用实验手段对PAL基因在白桦中的功能进行更深入的分析,为后续筛选优良基因改良白桦遗传性状奠定基础。
4 结论本实验将E-box顺式作用元件的双链DNA复性后连接到pHIS2载体上,并利用酵母单杂交技术将E-box顺式作用元件与BplMYB46转录因子进行结合分析,结果显示,与BplMYB46转录因子特异性结合的E-box顺式作用元件的DNA序列为CA(A/T/C)(A/G/C)TG。
| [1] |
张韬, 杨足君. 植物基因组DNase Ⅰ超敏感位点的研究进展[J]. 遗传, 2013, 35(7): 867-874. |
| [2] |
杨鹏程. BrCHS1启动子光反应顺式作用元件结合蛋白的筛选和分析[D].哈尔滨: 东北林业大学, 2012. http://cdmd.cnki.com.cn/Article/CDMD-10225-1012445349.htm
|
| [3] |
Zhang K, Gan SS. An abscisic acid-AtNap transcription factorSAG113 protein phosphatase 2C regulatory chain for controlling dehydration in senescing Arabidopsis leaves[J]. Plant Physiology,, 2012, 158(2): 961-969. DOI:10.1104/pp.111.190876 |
| [4] |
刘慧春, 马广莹, 朱开元, 等. 牡丹抗逆转录因子基因PsDREB的功能解析[J]. 浙江大学学报:农业与生命科学版, 2016, 42(6): 679-686. |
| [5] |
Shi LY, Weng JF, Liu CL, et al. Identification of promoter motifs regulating ZmeIF4E expression level involved in maize rough dwarf disease resistance in maize(Zea Mays L.)[J]. Mol Genet Genomics, 2013, 288(3-4): 89-99. DOI:10.1007/s00438-013-0737-9 |
| [6] |
刘缙, 王亚红, 滕红梅, 等. 小麦TaPBFB蛋白的原核表达及与顺式元件的结合[J]. 植物生理学报, 2016, 52(7): 1081-1088. |
| [7] |
牛义岭, 姜秀明, 许向阳. 植物转录因子MYB基因家族的研究进展[J]. 分子植物育种, 2016, 14(8): 2050-2059. |
| [8] |
Zhang L, Zhao G, Xia C, et al. A wheat R2R3-MYB gene, TaMPB30-B, improves drought stress tolerance in transgenic Arabidopsis[J]. J Exp Bot, 2012, 63(16): 5873-5885. DOI:10.1093/jxb/ers237 |
| [9] |
高巍, 刘会利, 田新权, 等. 海岛棉转录因子基因GbMYB60的克隆、表达及其抗逆性分析[J]. 作物学报, 2013, 42(9): 1342-1351. |
| [10] |
Lotkowska ME, Tohge T, Fernie AR. The Arabidopsis transcription factor MYB112 promotes anthocyanin formation during salinity and under high light stress[J]. Plant Physiol, 2015, 169(3): 1862-1880. |
| [11] |
Campos JF, Cara B, Pérez-Martín F, et al. The tomato mutant ars1(altered response to salt stress identifies an R1-type MYB transcription factor involved in stomatal closure under salt acclimation[J]. Plant Biotechnol J, 2016, 14(6): 1345-1356. DOI:10.1111/pbi.12498 |
| [12] |
唐庆君. 白桦树的生长习性及幼苗养护要点[J]. 农民致富之友, 2016, 13: 298. |
| [13] |
Hartmann U, Sagasser M, Mehrtens F, et al. Differential combinatorial interactions of cis-acting elements recognized by R2R3-MYB, BZIP, and BHLH factors control light-responsive and tissue-specific activation of phenylpropanoid biosynthesis genes[J]. Plant Mol Biol, 2005, 52(2): 155-171. |
| [14] |
国会艳.白桦BplMYB46基因调控抗旱耐盐和次生壁形成的分子机理[D].哈尔滨: 东北林业大学, 2014. http://cdmd.cnki.com.cn/Article/CDMD-10225-1016303829.htm
|
| [15] |
Guo HY, Wang YC, Wang LQ, et al. Expression of the MYB transcription factor gene BplMYB4 affects abiotic stress tolerance and secondary cell wall deposition in Betula platyphylla[J]. Plant Biotechnol J, 2017, 15(1): 107-121. DOI:10.1111/pbi.2017.15.issue-1 |








