水是植物生长发育过程中不可缺少的重要因素。在农业生产中,水分亏缺引起的干旱胁迫是农作物受到的主要非生物胁迫之一,干旱直接导致农业生产产量下降,严重、长时间的干旱胁迫会使农业生产颗粒无收[1-2]。据不完全统计,世界上因干旱缺水导致农作物减产的总量高于其他农业灾害发生造成产量下降之和[3-4]。干旱对植物的影响主要表现在对外界水分和矿质元素的吸收能力下降,植物体自身营养物质、离子转运受阻,使植物出现萎蔫的现象,甚至死亡[5-7]。马铃薯(Solanum tuberosum L.)是世界上第四大粮食作物,由于其具有广泛的适应性和较高的应用价值在世界各地广泛栽培种植[8-9]。目前,我国是世界上马铃薯最大的生产国,产区主要分布在西北、内蒙古西部、东北等干旱少雨的地区,干旱缺水是影响我国马铃薯生产的重要因素之一。马铃薯在生育期内对水分亏缺非常敏感,尤其在块茎膨大期若遇到干旱胁迫产量会受到影响,其品质也会下降,严重干旱时可导致产量大幅度下降[10]。因此,展开马铃薯的抗旱研究十分必要。
研究表明,较深的根系可以明显提高雨养农业区作物在极端或者季节性干旱环境下的产量,且可作为耐旱作物育种评鉴与筛选指标之一[11]。因此我们从国际马铃薯中心(International potato center,CIP)引进的品种中选取了两个生育期相同、耐旱性不同的马铃薯品种C16和C119,打破传统的限制根系生长的盆栽方法,采用管栽方法进行研究。通过控水模拟干旱处理,研究了不同水分胁迫对马铃薯根系生长特性、根系抗逆相关生理生化指标、根尖显微结构和超微结构的影响,以期为人们了解马铃薯根系在干旱条件下的响应机制奠定基础,对筛选、培育抗旱性强的马铃薯品种具有指导意义[12-14]。
1 材料与方法 1.1 材料实验材料为国际马铃薯研究中心引进品种C16(CIP 397077.16)和C119(CIP 398098.119),由甘肃农业大学作物遗传改良与种质创新重点实验室提供(表 1)。实验所需的蛭石、营养土和纱网购于甘肃中瑞化工有限公司; 测量植物生理生化指标所用的直尺、量角器、酸性茚三酮、高锰酸钾、蒽酮、氯化三苯基四氮唑和做植物切片所需要的石蜡、戊二醛、磷酸漂洗液、锇酸、乙醇、树脂、铀酰乙酸酯和磷酸铅溶液购自甘肃艾尔维科学仪器有限公司。
采用体积约为60 L的PVC管种植马铃薯[15],如图 1所示。本试验中PVC管直径为25 cm,高为120 cm。在PVC管侧面和底座具有通气小孔,一方面保证管内气体能正常流通; 另一方面在马铃薯生长发育期内测定土壤水分。紧贴管内壁放置纱网,通过拉动纱网取出管内的土壤,从而获得完整的马铃薯根系。在试验地搭建遮雨棚,避免雨水进入到实验装置内。营养土和蛭石按1:1均匀混合后装入PVC管中。选择大小一致、表面光滑无病菌的脱毒种薯播种,每个PVC管中播种两个种薯,待出苗后保留一株。正常浇水至出苗后25 d开始进行干旱胁迫处理。本试验分两个处理,处理1(T1)为中度干旱胁迫(55%-70%),处理2(T2)为重度干旱胁迫(40%-55%),正常浇水为对照(70%-85%),各个处理的百分比分别为营养土和蛭石混合物最大持水量的百分数。每个处理设3个重复。本试验于2017年5月7日播种,5月26日出苗,干旱胁迫处理于6月21日开始,对照组正常灌溉。T1和T2处理开始后每隔15 d取样一次,共4次。每次取样在上午9点至10点间完成。
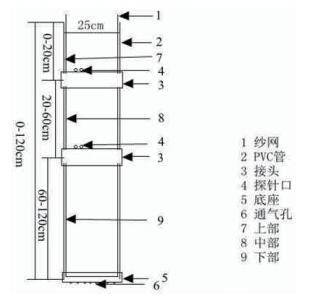
|
| 图 1 马铃薯管栽装置示意图 |
用直尺测量株高。用量角器测量叶片与茎秆的夹角,测量时选择植株从上到下的第三片叶进行测量。将马铃薯根系从PVC管中拉出,用水冲洗干净后,用直尺测量最长根长。根系含水量用烘干法测定,先将植物组织在105℃下杀青30 min,然后在85℃下烘干至恒重,根系含水量=(鲜重-烘干重)/烘干重。所有生理生化指标的测定组织均为根,脯氨酸的测定采用酸性茚三酮法[16];过氧化氢酶(Catalase,CAT)的测定采用高锰酸钾滴定法[17];可溶性糖含量的测定采用蒽酮法[18];根系活力的测定采用氯化三苯基四氮唑(TTC)还原法[19]。马铃薯根显微结构观察采用常规石蜡切片[20],超微结构观察采用超薄切片。根尖超微结构观测:选取马铃薯根尖,切成2 mm长浸泡于2%戊二醛(pH 7.4的磷酸缓冲液配制)中,在室温下固定3 h; 然后用0.1 mmol/L磷酸漂洗液漂洗3次,1%锇酸室温下固定6 h,再次用漂洗液漂洗1次; 再用不同浓度梯度的乙醇逐级脱水; 最后用树脂进行包埋,加热过夜。样品在LKBV超薄切片机上切片,获得的切片在铀酰乙酸酯和磷酸铅溶液中双染色。最后在电镜(JEM-1230JEOL,日本)下观察超微结构并拍照。
1.2.3 数据分析实验数据利用SPSS22.0数据分析软件,采用Duncan’s法进行相关性分析,用Origin 9.1作图。
2 结果 2.1 干旱胁迫对马铃薯地上部分生理指标的影响株高能直观表现出植物在逆境条件下的生长发育状况。由图 2可看出,在大部分时期,干旱胁迫处理后两个马铃薯品种株高均显著低于对照(P < 0.05),说明干旱胁迫处理抑制了马铃薯株高的增长。在T1处理下,C16的株高在15 d、30 d、45 d时较对照分别降低了20.24%、19.40%、25.78%,处理60 d时C16的株高与对照无显著差异; C119的株高在同时期较对照分别降低4.01%、12.50%、19.77%、14.05%。在T2处理下,C16的株高在15 d、30 d、45 d和60 d时较对照分别降低21.04%、22.98%、33.02%和29.09 %; C119的株高在同时期较对照分别降低19.06%、23.08%、29.95%和38.96%。说明,在不同时期进行干旱胁迫处理C119株高较对照的下降程度普遍低于C16,而且在相同处理时期和条件下C119的株高始终高于C16。
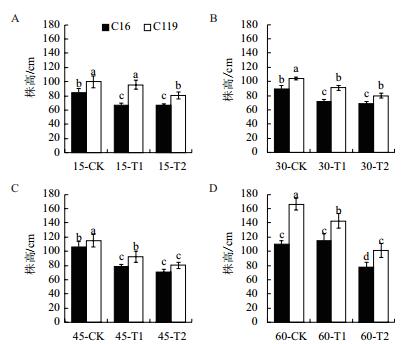
|
| 图 2 不同干旱胁迫条件下马铃薯不同生长时期株高的变化 15、30、45、60代表出苗后的生长天数; CK代表正常浇水,T1代表中度干旱胁迫,T2代表重度干旱胁迫; a、b、c代表显著性,P < 0.05,下同 |
由图 3可看出,干旱胁迫处理下两个马铃薯品种叶片与茎秆的夹角均有不同程度的下降。在大部分时期中,相同处理条件下C119叶片与茎秆的夹角都显著高于C16(P < 0.05),尤其后期60 d时在T1和T2处理下C119的叶片与茎秆的夹角分别达到75°、51.33°,而同时期C16的叶片与茎秆的夹角仅为46.67°、36.67°。
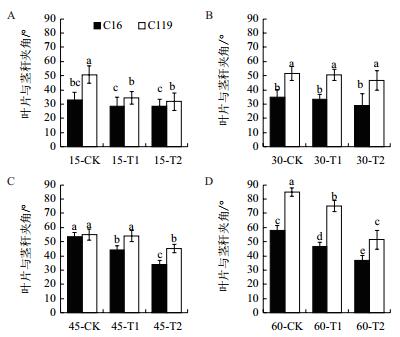
|
| 图 3 不同干旱胁迫条件下马铃薯不同生长时期叶片与茎秆夹角的变化 |
由图 4可知,在大部分时期中,干旱胁迫处理后两个马铃薯品种根长均显著高于对照(P < 0.05),说明干旱胁迫处理会促进马铃薯根长增加。在相同处理条件下C119根长都显著高于C16(P < 0.05)。在T1处理下,C16的根长在15 d和45 d时较对照分别增长36.00%、21.74%,而在30 d和60 d时差异不显著; C119的根长在15 d、30 d、45 d和60 d时较对照分别增长28.57%、25.49%、27.75%和24.58%。在T2处理下,C16的根长在15 d和45 d时较对照分别增长38.67%、22.07%,而在30 d和60 d时差异不显著; C119的根长在15 d、30 d、45 d和60 d时较对照分别增长41.81%、46.40%、46.59%和31.85%。说明在干旱胁迫下C119根系伸长程度远高于C16,以更好地适应干旱胁迫。
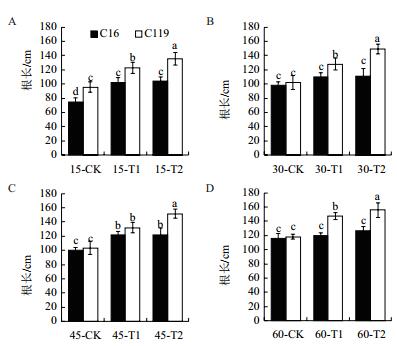
|
| 图 4 不同干旱胁迫条件下马铃薯不同生长时期根长的变化 |
由图 5可知,干旱胁迫处理后两个马铃薯品种根活力均显著高于对照(P < 0.05),说明干旱胁迫处理会促进马铃薯根活力的增加。在所有生长时期下,C119根系活力在对照、T1和T2处理下绝大部分均显著高于C16(P < 0.05),说明C119具有较高根系活力,在干旱胁迫条件下也能保持较高的适应性。
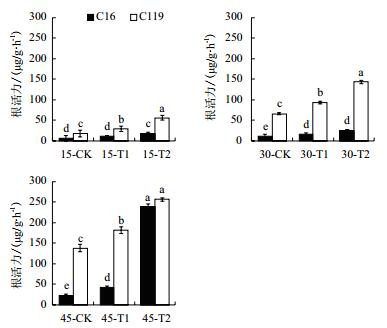
|
| 图 5 不同干旱胁迫条件下马铃薯不同生长时期根活力变化 |
由图 6可知,在大部分时期中,干旱胁迫处理后两个马铃薯品种根相对含水量显著低于对照(P < 0.05),说明干旱胁迫处理会造成根系含水量的降低。相同处理条件下C119根相对含水量都显著高于C16,(P < 0.05),尤其30 d时,在正常浇水、T1和T2处理下C119的根相对含水量分别达到1.77、0.82及0.5,而同时期C16则为0.35、0.25及0.21。说明C119在干旱胁迫条件下较之于C16能使根系保持一个较高的水势,以维持根系和自身地上部分正常的生命活动。
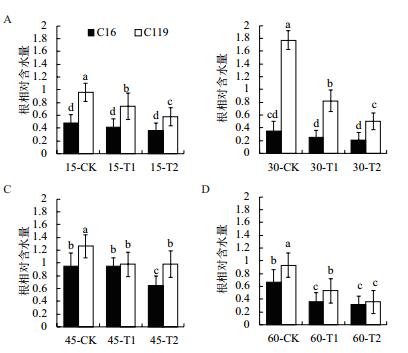
|
| 图 6 不同干旱胁迫条件下马铃薯不同生长时期根相对含水量的变化 |
由图 7可看出,在大部分时期,干旱胁迫处理后两个马铃薯品种的根系的3个生化指标CAT活性、可溶性糖、脯氨酸含量均显著高于对照(P < 0.05),说明干旱胁迫处理导致上述马铃薯生化指标含量的增高。
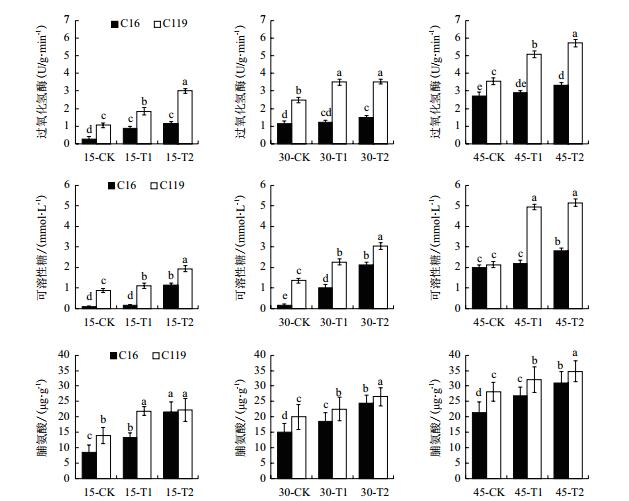
|
| 图 7 不同干旱胁迫条件下马铃薯不同生长时期不同生化指标的变化 |
在T1处理下,C16的CAT活性在15 d时较对照上升214.29%,而在30 d和45 d时较对照差异不显著; C119的CAT活性在15 d、30 d和45 d时较对照分别上升73.58%、41.53%和43.03%。在T2处理下,C16的CAT活性在15 d、30 d和45 d时较对照分别上升303.57%、31.58%和21.69%;C119的CAT活性在同时期较对照分别上升183.02%、41.77%、60.81%。说明,干旱胁迫处理下,C119的CAT活性较对照的升高程度在大部分时期普遍高于C16,而且在相同处理时期和条件下C119的CAT活性始终高于C16。
在T1处理下,C16的可溶性糖含量在30 d时较对照上升45.45%,而在15 d和45 d时较对照无显著差异。C119的可溶性糖含量在15 d、30 d和45 d时较对照分别上升26.39%、67.74%、131.31%。在T2处理下,C16的可溶性糖含量在15 d、30 d和45 d时较对照分别上升954.55%、1 225.00%和41.41%;C119的可溶性糖含量在同时期较对照分别上升120.89%、123.28%和140.65%。C16根系可溶性糖含量在正常浇水时显著低于C119,在干旱胁迫前期会迅速升高,但在本实验所测时期内其根系可溶性糖含量的绝对含量始终低于C119,说明C119本身具有较强的抗旱性。
在对照、T1和T2处理下,C119的根系脯氨酸含量在绝大部分时期均显著高于C16(P < 0.05),说明C119在干旱胁迫条件下更能使根系积累更多的脯氨酸,以维持细胞正常的渗透压,来提高马铃薯在干旱环境中的适应能力。
2.4 干旱胁迫对马铃薯根尖显微结构和超微结构的影响由图 8可看出,正常灌溉条件下两个马铃薯品种木质部导管呈圆形,导管数量多而密。而随着干旱处理程度的加强,在处理15 d、30 d、45 d和60 d时,两个马铃薯品种根系的中柱面积减小,木质部导管直径变小、数量逐渐减少,但相同处理时期和条件下C119的木质部导管数量均明显少于C16,且干旱胁迫处理后,C119的中柱结构对环境的响应性改变高于C16,说明C119的根系更能适应周围环境的变化。
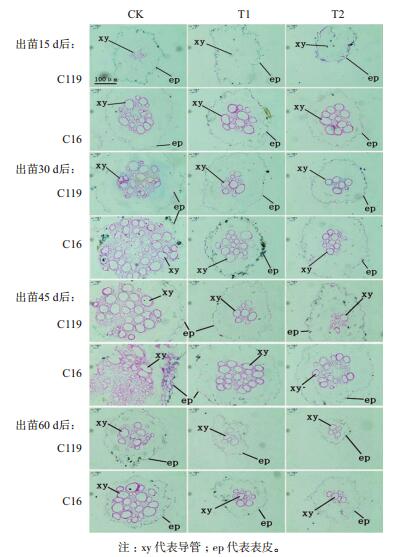
|
| 图 8 不同干旱胁迫条件下马铃薯不同生长时期根尖显微结构的变化(石蜡切片) 注:xy代表导管; ep代表表皮。 |
由图 9可看出,正常灌溉条件下两个马铃薯品种细胞内部结构变化不明显,在重度干旱胁迫处理下两个马铃薯品种都发生了质壁分离现象,胞内物质固缩为一团,细胞壁增厚,其中C16细胞壁加厚,局部地方出现了断裂现象,说明在严重干旱胁迫下,C16较C119更容易发生细胞壁断裂现象,导致细胞死亡。
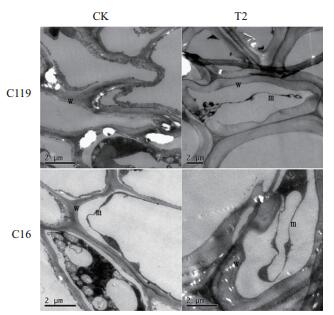
|
| 图 9 不同干旱胁迫条件下马铃薯出苗45 d的根尖超微结构变化(超薄切片) 注:w代表细胞壁; m代表细胞膜 |
植物根系是植物生长发育所需水分的主要来源,据报道抗旱性强的李氏禾(Leersi ahexandra Swartz)根系木质部导管较不抗旱品种直径更小[21],因此研究干旱胁迫对植物根系生长发育和解剖结构的影响具有重要意义[22-23]。经典的盆栽实验在马铃薯的抗旱研究中得到了广泛应用[24-25],但花盆深度有限,阻碍马铃薯根系生长,难以模拟大田中实际情况。因此,本实验采用管栽的方式,重点研究干旱胁迫对两个抗旱性不同的马铃薯品种根系的影响,从外部形态特征,抗逆生化指标到显微和超微结构进行了系统的分析。结果表明,在正常浇水和不同强度的干旱处理下,两个品种的绝大部分相关指标都有显著差异。说明管栽模式对马铃薯根系响应干旱胁迫的研究较为理想。
本文的实验材料属国际马铃薯中心的引进的两个品种,实验结果表明,在正常浇水和不同强度的干旱处理下,C119的绝大部分相关指标均优于C16。例如,60 d时,C119的株高在对照、中度干旱和重度干旱下,分别为166 cm、142.67 cm和101.33 cm,而C16只有110 cm、115cm和78 cm。C119的根长分别为118 cm、147 cm和155.58 cm,而C16只有115.67 cm、119.67 cm和126.57 cm。45 d时,C119的CAT活性在对照、中度干旱和重度干旱下,分别为3.55 U/g·min、5.08 U/g·min和5.72 U/g·min,而C16只有2.72 U/g·min、2.89 U/g·min和3.31 U/g·min。此外,在重度干旱处理下,C16的根长在15 d和45 d时较对照分别增长38.67%、22.07%,而在30 d和60 d时差异不显著; C119的根长在15 d、30 d、45 d和60 d时较对照分别增长41.81%、46.40%、46.59%和31.85%。C16的CAT活性在15 d、30 d和45 d时较对照分别上升303.57%、31.58%和21.69%;C119的CAT活性在同时期较对照分别上升183.02%、41.77%和60.81%。由此可见C119相比于C16对干旱胁迫表现出了更好的适应性。这与本课题组前期大田实验得出的C119的单株产量和商品率等指标高于C16的结果相一致[26],这些结果可为引进马铃薯品种的抗旱育种提供指导和参考。
Richards等[27]在李氏禾中的研究发现,根内木质部大导管的直径减小可使驱动水分流动的气压变化率降低,即增大导管运输水分的阻力,能增强其抗旱能力。本研究表明,在不同强度的干旱胁迫下,两个马铃薯品种的木质部导管直径变小、数量减少; 且相同处理时期和条件下,抗旱性更强的品种C119的木质部导管数量均明显少于C16。这说明马铃薯也可能通过类似的改变水分运输组织结构的策略来抵御干旱胁迫。
今后,在本研究结果的基础上,我们将进一步探讨这两个马铃薯品种产生抗旱性差异的原因,着重研究干旱胁迫下产生根系差异性状的分子机理,以期为马铃薯深根耐旱性状的机制解读提供更多理论依据,也为抗旱性马铃薯种质资源的利用提供更多参考。
4 结论耐旱品种C119和C16都通过根系伸长生长和提高自身根系活力、过氧化氢酶、可溶性糖和脯氨酸含量来抵御干旱胁迫。此外,C119和C16通过改变根系导管的数目、大小和根细胞壁的厚度来应对干旱胁迫。总体来说,C119相比于C16对干旱胁迫表现出了更好的适应性。
| [1] |
Fulda S, Mikkat S, Stegmann H, et al. Physiology and proteomics of drought stress acclimation in sunflower(Helianthus annuus L.)[J]. Plant Biol(Stuttg), 2011, 13(4): 632-642. |
| [2] |
范敏, 金黎平, 刘庆昌. 马铃薯抗旱机理及其相关研究进展[J]. 中国马铃薯, 2006(2): 101-107. DOI:10.3969/j.issn.1672-3635.2006.02.013 |
| [3] |
李磊, 贾志清, 朱雅娟. 我国干旱区植物抗旱机理研究进展[J]. 中国沙漠, 2010(5): 1053-1059. |
| [4] |
Liu J, Arend M, Yang W, et al. Effects of drought on leaf carbon source and growth of European beech are modulated by soil type[J]. Scientific Reports, 2017, 7: 42462. DOI:10.1038/srep42462 |
| [5] |
Xu X, Pan SK, Cheng SF, et al. Genome sequence and analysis of the tuber crop potato[J]. Nature, 2011, 475(7355): 189-195. DOI:10.1038/nature10158 |
| [6] |
Soltys-Kalina D, Plich J, Strzelczyk-Żyta D, et al. The effect of drought stress on the leaf relative water content and tuber yield of a half-sib family of 'Katahdin'-derived potato cultivars[J]. Breed Sci, 2016, 66(2): 328-331. DOI:10.1270/jsbbs.66.328 |
| [7] |
刘玲玲, 李军, 李长辉. 马铃薯可溶性蛋白、叶绿素及ATP含量变化与品种抗旱性关系的研究[J]. 中国马铃薯, 2004(4): 201-204. DOI:10.3969/j.issn.1672-3635.2004.04.003 |
| [8] |
娄艳, 白江平, 杨宏羽. 基于渗透胁迫的马铃薯试管苗抗旱评价体系的构建[J]. 干旱地区农业研究, 2016, 34(5): 15-26. |
| [9] |
Bakr EM. A new software for measuring leaf area, and area damaged by Tetranychus urticae Koch[J]. Journal of Applied Entomology, 2005, 129(3): 173-175. DOI:10.1111/jen.2005.129.issue-3 |
| [10] |
白莉萍, 隋方功, 孙朝晖. 土壤水分胁迫对玉米形态发育及产量的影响[J]. 生态学报, 2004, 24(7): 1556-1560. DOI:10.3321/j.issn:1000-0933.2004.07.034 |
| [11] |
张大勇, 姜新华, 赵松岭, 段舜山. 半干旱区作物根系生长冗余的生态学分析[J]. 西北植物学报, 1995(5): 110-114. DOI:10.3321/j.issn:1000-4025.1995.05.021 |
| [12] |
孙三杰, 李建明, 宗建伟. 亚低温与干旱胁迫对番茄幼苗根系形态及叶片结构的影响[J]. 应用生态学报, 2012, 23(11): 3027-3032. |
| [13] |
单长卷, 梁宗锁. 土壤干旱对冬小麦幼苗根系生长及生理特性的影响[J]. 中国生态农业学报, 2007, 15(5): 38-41. |
| [14] |
厉广辉, 张昆, 刘风珍. 不同抗旱性花生品种的叶片形态及生理特性[J]. 中国农业科学, 2014, 47(4): 644-654. DOI:10.3864/j.issn.0578-1752.2014.04.004 |
| [15] |
白江平, 胡开明, 王晓斌.一种模拟干旱条件下马铃薯根系生长发育观测装置: 中国, 201620231289. 2[P]. 2016-08-24.
|
| [16] |
朱广廉, 邓兴旺, 左卫能. 植物体内游离脯氨酸的测定[J]. 植物生理学通讯, 1983, 1(1): 35-37. |
| [17] |
王伟玲, 王展, 王晶英. 植物过氧化物酶活性测定方法优化[J]. 实验室研究与探索, 2010(4): 21-23. DOI:10.3969/j.issn.1006-7167.2010.04.007 |
| [18] |
刘海英, 王华华, 崔长海, 等. 可溶性糖含量测定(蒽酮法)实验的改进[J]. 实验室科学, 2013, 16(2): 19-20. DOI:10.3969/j.issn.1672-4305.2013.02.007 |
| [19] |
龚梅, 吕宁平. 作物根系活力活体测定方法[J]. 核农学报, 1982, 4: 014. |
| [20] |
李正理. 植物组织制片学[M]. 北京: 北京大学出版社, 1996: 88-138.
|
| [21] |
朱桂才, 杨中艺. 水分胁迫下李氏禾营养器官的解剖结构研究[J]. 长江大学学报自然科学版:农学卷, 2008, 5(3): 17-20. |
| [22] |
翁俊, 徐春和. 光合作用氧释放机理研究进展[J]. 植物生理与分子生物学学报, 2003, 29(2): 83-91. |
| [23] |
Tran LSP, Nakashima K, Sakuma Y, et al. Isolation and functional analysis of Arabidopsis stress-inducible NAC transcription factors that bind to a drought-responsive cis-element in the early responsive to dehydration stress 1 promoter[J]. The Plant Cell, 2004, 16(9): 2481-2498. DOI:10.1105/tpc.104.022699 |
| [24] |
张立成, 姚帮松, 肖卫华, 等. 盆栽与大田栽培水稻的生长及产量的比较研究[J]. 天津农业科学, 2016, 22(3): 102-106. DOI:10.3969/j.issn.1006-6500.2016.03.024 |
| [25] |
宋妮, 王景雷, 孙景生, 等. 水分胁迫对盆栽冬小麦叶片生理生化的影响研究[J]. 中国农村水利水电, 2011(10): 19-23. |
| [26] |
王晓斌, 王瀚, 胡开明, 等. 基于层次分析法和GGE双标图对引进马铃薯种质资源的综合评价[J]. 植物遗传资源学报, 2017, 18(6): 1067-1078. |
| [27] |
Richards RA, Passioura JB. Drought and drought tolerance[J]. Plant Growth Regulation, 1996, 2: 79-83. |





