由于全球气候骤变,天气条件不确定,霜冻造成了农作物的损失大幅度增加,而且变得越来越严重。据世界粮农组织统计,未来50年世界人口将增加9-12亿,这将需要多生产34%-70%的粮食。因此,食粮供求之间的矛盾将会越来越突出。为了减缓这一矛盾,培育出耐寒性强的作物品种至关重要。传统育种方法时间长、工作量大,转基因育种的优势逐渐体现。因此,了解植物体低温胁迫耐受机制,通过转基因等手段定向的改变植物抗寒能力具有很高的可行性。目前,植物抗寒相关研究主要集中在对抗寒转录因子的研究中[1],抗寒转录因子普遍具有较多的功能,转基因植物可能会产生新的性状。因此,利用抗寒转录因子来提高植株抗寒能力十分复杂,通过多年的研究,抗冻蛋白(antifreeze protein,AFP)的发现在一定水平上解决了这个问题。
抗冻蛋白可以通过降低体系冰点、改变冰晶形态、抑制冰晶生长来防止低温胁迫对生物体细胞造成损伤和致死,从而提高生物体对低温的适应能力,具备广阔的应用前景。抗冻蛋白的研究首先出现在鱼类和昆虫中,后来扩大到微生物、动物和植物中。目前,对于抗冻蛋白的研究主要集中在鱼类[2-5]和昆虫[6-9],而在植物中的研究则比较晚[10-12],也比较少,因此对于植物抗冻蛋白还需要深入研究,以提高植物抗寒能力,满足人们生产生活的需要。本文将从抗冻蛋白的发现、效应、活性的评价方式、作用机理、研究进展及应用等方面进行综述。
1 植物抗冻蛋白的发现1964年,最早从黄粉甲幼虫中发现的抗冻蛋白[13],1992年,Griffith等[14]从冬黑麦(Secale cereale)叶片质外体中得到并部分纯化了一种经过低温处理可以忍受细胞外结冰的蛋白,通过扫描电镜显示,冷驯化的冬黑麦通过形成这种蛋白,仅在细胞间隙中形成冰就使其可以忍受低温,这种蛋白修饰了正常蛋白质冰晶的生长模式和抑制低温时水分流失,是在植物中分离纯化的第一种抗冻蛋白。后来,Urrutia等[15]在对多种植物进行研究时发现,可以使水溶液的非平衡凝固点下降的蛋白质,即抗冻蛋白;1994年,费云标等[16]从抗冻植物沙冬青(Ammopiptanthus mongolicus)的叶片中分离纯化得到一种具有热稳定性的蛋白,这种蛋白的抗冻活性比之前在鱼类和黑麦中发现的高得多,并且在100-200倍显微镜下观察发现,其冰晶形态与经过冷驯化的黑麦和鱼类中的相似,呈多边形,表明沙冬青中存在着具有高活性的抗冻蛋白;1998年,美国纽约大学的Sidebottom等[17]发现胡萝卜的抗冻蛋白基因也是园艺植物中最早发现的抗冻蛋白基因,且具有重要意义,并于2000年,从多年生黑麦草(Lolium perenne)中发现了具有热稳定性的抗冻蛋白,提高了黑麦草对低温的适应能力,使其可以越冬。
目前,在鱼类中已经发现了5种类型的抗冻蛋白即抗冻糖蛋白、抗冻蛋白Ⅰ、抗冻蛋白Ⅱ、抗冻蛋白Ⅲ、抗冻蛋白Ⅳ。抗冻糖蛋白主要是由丙氨酸-丙氨酸-苏氨酸的三肽单位串联重复而成。抗冻蛋白Ⅰ无糖基,无三肽重复序列,具有最小的分子量和最简单的结构,一级结构是由11个氨基酸残基组成的多肽单元重复串联而成。抗冻蛋白Ⅱ分子量最大,与动物C型凝集素同源。抗冻蛋白Ⅲ的分子组成和顺序与其他的抗冻蛋白完全不同,没有占优势的非极性氨基酸,是一种球状蛋白。抗冻蛋白Ⅳ的谷氨酸(Glutamic acid,Glu)含量很高[18];在昆虫中发现的抗冻蛋白多存在于越冬的昆虫体内,以维持体液的过冷状态,以下4种昆虫抗冻蛋白的研究是最广泛的,即黄粉虫(Tenebrio molitor)、美洲脊胸长椿(Oncopeltus fasciatus)、枞色卷蛾(Choristoneura fumiferana)和甲虫(Dendroides canadensis)。昆虫抗冻蛋白含较多亲水性氨基酸,无糖基,有40%-50%的氨基酸残基能构成氢键,活性比鱼类抗冻蛋白高10-100倍,分子构造也有所区别[19];植物抗冻蛋白抑制冰晶形成能力较低,但通常含有多个亲水性冰晶结合域,能够防止冰晶增长从而对植物造成机械伤害。另外,还有许多植物的抗冻蛋白具备抗病的双重功能[20],与鱼类和昆虫抗冻蛋白相比,对植物抗冻蛋白的研究还不够深入。
2 抗冻蛋白的效应及抗冻活性的评价方法 2.1 抗冻蛋白的效应简介抗冻蛋白具有3种效应,即热滞效应(Thermal hysteresis activity,THA)、重结晶抑制效应(Recrystalization inhibition,RI)和冰晶形态效应。
热滞效应是指抗冻蛋白与冰晶结合,导致低于其熔点的水溶液的非平衡凝固点下降。1个大气压下,纯水在0℃时冻结,由于细胞液中各种溶质的存在,其在-3--4℃凝固,而在抗冻蛋白存在的情况下,细胞液的凝固点进一步降低,从而在一定水平上避免了植物中的冰晶的形成,提高了植物的抗寒能力。抗冻蛋白在降低冷冻温度方面比任何其他已知的溶质分子有效500倍[21-23]。具有较高热滞后活性的抗冻蛋白称为过度活跃的抗冻蛋白,中等活性的热滞后活性的抗冻蛋白称为中等抗冻蛋白,过度活跃的抗冻蛋白的过热现象与中等抗冻蛋白相比更为明显[24]。迄今为止,发现的抗冻蛋白均有热滞后活性,活性的大小与物种和抗冻蛋白的浓度有关。昆虫具有最高的热滞后活性,为3-5℃,然后是鱼,约为2℃[25],植物的热滞后值大约为0-2℃。对于各种昆虫和植物的抗冻蛋白,在浓度较低时,随着抗冻蛋白浓度的增加,热滞后活性急剧增加,当抗冻蛋白浓度较高时,由于所有抗冻蛋白结合位点都被占据,热滞后活性值没有进一步增加[26-28]。
重结晶抑制效应是抑制已经形成的冰晶颗粒中大的冰晶颗粒生长变得更大,而小的冰晶颗粒变小,大的冰晶取代小的冰晶,实现冰晶重新分配的过程。当温度降低到一定值时,冰结晶开始形成小的冰分子,由于范德华力、疏水相互作用及氢键作用[29],在冰核的表面会吸附抗冻蛋白分子,抗冻蛋白分子会抑制冰晶分子的生长而且同时降低冰点,使冰晶不能聚集增大,称为并再结晶抑制。较大的冰分子,对血浆膜造成物理压力并可能使细胞破裂,导致细胞死亡,对细胞具有致命的威胁,抗冻蛋白的冰晶再结晶抑制效应可以保护细胞免于机械性破裂死亡[30]。一般极低浓度的抗冻蛋白,大约低于0.1 μg/mL就可以抑制冰晶重结晶,使冰晶体积小且均匀,从而降低对植物的伤害[31]。另外,在保护机体不受伤害中,冰晶的重结晶抑制效应可能比热滞效应更加重要,尤其是在抗冻植物与昆虫中,因为抑制冰晶重结晶比抑制冰晶的生长更容易一些,对抗冻蛋白浓度的要求也更低一些[32]。
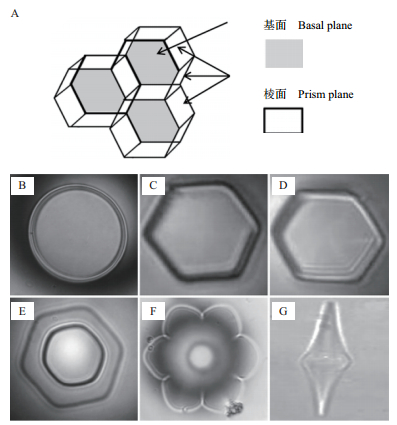
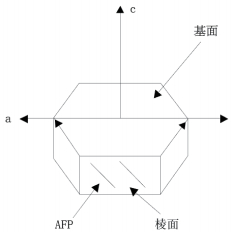
冰生长为一个六边形晶格,在这个晶格中水分子通过氢键连在一起。单个冰晶有2个不同的平面即基面和棱柱面(图 1-A)。不存在抗冻蛋白时冰晶形态呈宽大圆盘状(图 1-B),存在抗冻蛋白时,冰晶形态呈六角形,花形或针状(图 1-C-图 1-G)[33]。存在抗冻蛋白时冰晶形态发生改变是因为抗冻蛋白具有的冰晶形态效应从而能够抑制冰晶的生长,在不同的生长方向上,抑制作用的抑制程度有区别,从而导致冰晶的生长习惯发生改变。冰晶通常以平行于冰晶基面(a轴)的方式生长,在垂直于冰晶基面的方向(c轴)生长缓慢。抗冻蛋白浓度低时,首先,冰晶沿a轴的生长会受到抑制,冰晶格的六边柱表面变得明显;当抗冻蛋白浓度高时,冰晶主要以针形或者纤维状的形式沿c轴生长,形成六边双棱锥及针形晶体[13]。这种形状的冰晶对生物的伤害明显低于以平行于冰晶基面(a轴)的方式生长形成的树枝状的冰晶,从而防止冰晶对细胞造成机械性的损害。因为抗冻蛋白的这种特性,也被称为“冰结构蛋白”[32]冰晶生长方向示意如图 2。
|
| 图 1 正常冰晶形态及抗冻蛋白作用下的冰晶形态 A:冰晶结构;B:无防冻活性下冰晶生长形态;C-G:存在抗冻蛋白情况下冰晶生长的不同形态 |
|
| 图 2 冰晶生长方向示意图 |
对抗冻蛋白活性进行评价,以筛选出具有较高的适应低温能力的抗冻蛋白,从而满足人们需求。因此,对抗冻蛋白的抗冻活性进行准确的评价和比较具有重要意义。现有的抗冻蛋白活性评价方式主要是基于热滞活性和冰晶重结晶抑制原理衍生出的定性或者定量的评价方式。热滞活性的评价方式主要有冰晶形态图像法和差示扫描量热法(DSC)及两者的结合;纳升渗透压计测量热滞活性并提供冰晶形态;使用毛细管测定抗冻蛋白的冰晶重结晶抑制活性。不同方法测得的抗冻蛋白活性有时差异很大,主要是由于物种的来源、评价方式基于的原理及结果的表示方法的差异使得评价结果具有较大的不同,有的结果甚至是相互矛盾的,经过研究发现,有些具有相同来源的抗冻蛋白,由于结构、产地、测定方法的不同,所获得的结果有时差异也很大[34]。另外,Gupta等[33]和Yu等[35]对黄粉虫的抗冻蛋白活性进行了测定,将热滞活性高的称为过度活跃的抗冻蛋白,低热滞活性被称为中度抗冻蛋白或Ⅲ型抗冻蛋白,过度活跃的抗冻蛋白比Ⅲ型抗冻蛋白的热滞活性高10倍,而Ⅲ型抗冻蛋白的重结晶抑制活性比过度活跃的抗冻蛋白的高4倍,证明热滞活性和冰晶重结晶抑制活性是抗冻蛋白的2个独立的性质,两者之间没有相关性。迄今为止,还没有一种权威的、标准的抗冻蛋白活性评价方法,因此,限制了抗冻蛋白的研究与发展。
在试验中,使用最多的抗冻蛋白活性评价方式是DSC法。1988年,Hansen等[36]首次使用DSC法检测了黄粉虫抗冻蛋白的热滞值;巩子路[37]同时评价了新疆冷水鱼的抗冻蛋白活性的高低,也说明了通过DSC法测定抗冻蛋白的热滞值具有良好的可重复性、准确性和稳定性;田童童等[38]通过DSC法检测胡萝卜的热滞值,结果显示,DSC法测定抗冻蛋白的热滞值同样具备良好的稳定性、重复性与精密度。
另外,在最新的研究中发现,通过“冰亲和纯化”的技术,利用抗冻蛋白能吸附到冰上的性质,可以在蛋白质混合物中分离出抗冻蛋白。使用从植物提取物中收集的细胞裂解物,可以在黄铜探针上缓慢生长形成冰半球,使抗冻蛋白结合到冰结晶结构中,然后使用splat法测试提取物的冰重结晶抑制活性。该方法可以回收活性蛋白质,纯化的蛋白质可用于质谱法鉴定肽序列和天然蛋白质的生化分析,并且该测定只需要低的蛋白质浓度就能产生快速检测出抗冻蛋白的冰重结晶抑制活性[39]。
3 植物抗冻蛋白抗冻机理植物抗冻蛋白是一类具备亲水性的热稳定的冷诱导蛋白。北印第安纳州研究所对16种被子植物和常绿植物检测中发现,秋季和冬季均可检测到抗冻蛋白,但是在夏季却检测不到[40]。这表示低温胁迫是抗冻蛋白产生的条件,通过产生抗冻蛋白来提高植物对低温的适应性,因此它属于低温诱导蛋白。植物防冻活性的生物化学特征表明,它们的主要功能是抑制冰晶生长而不是降低冰冻温度。抗冻蛋白的热滞效应、冰晶形态效应、重结晶抑制效应表明,低温条件下,抗冻蛋白直接参与冰晶的形成过程,从而直接保护植物免受低温的胁迫,是一种直接调节方式,而增强细胞抗冰冻脱水能力的蛋白、通过调节酶活性、代谢或者稳定细胞膜来应对低温胁迫的蛋白、与细胞内信号转导有关的低温诱导蛋白及低温诱导的热激蛋白和脱水蛋白7种类型[18, 41]的蛋白都是通过间接的方式进行调节。
植物的抗冻蛋白被认为是双功能蛋白质[33]。一些抗冻蛋白与病程相关(Pathogenesis related,PR)蛋白同源而且同时具有防冻和水解活性。茉莉酸和乙烯在调控植物抗冻方面有重要作用,当植物在非寒冷胁迫的条件下,施加乙烯和茉莉酸也会造成抗冻活性物质的积累。因此推测它的作用机理如下:当受到寒冷胁迫时,在质外体中寒冷信号通过刺激钙离子或者是对PR蛋白进行翻译后修饰(post-translational modification,PTM),使其构象改变并转化为抗冻蛋白,可以防止冰晶的生长和嗜冷病原体的侵袭。同时,寒冷胁迫还会刺激细胞内的一系列反应。首先会刺激乙烯和茉莉酸的释放,这些激素通过调控基因表达来使抗冻蛋白积累。此外,WRKY转录因子(WRKY转录因子可以防止细胞内冰的形成)的表达也在冷胁迫时增加,这又调控了基因的表达,使抗冻蛋白积累。这些抗冻蛋白运输到质外体中发挥作用。WRKY转录因子和脱水蛋白能抑制细胞内冰核的形成,应该是抑制细胞内冰核形成剂从而防止细胞内冰形成的细胞内抗冻蛋白。那抗冻蛋白具体是怎么来发挥抗冻功能的呢。
不同的抗冻蛋白作用方式不同,抗冻蛋白是依靠结合在水冰交界面来抑制冰晶生成的,大概有以下几种方式:第一吸附抑制学说,是1977年由Raymond等[31]提出抗冻蛋白吸附在冰生长的表面,因为曲率增加,导致边缘的表面积增加,由于表面张力的影响,增加表面积使其平衡状态改变从而导致冰点降低。第二“偶极子—偶极子”学说,Yang等[42]认为抗冻蛋白具备明显平行于其螺旋轴亲水基团和疏水基团的偶极子,偶极子与冰晶周围水分子的偶极子相互作用,推动抗冻蛋白与冰晶结合,阻止冰晶的生长。第三氢原子结合模型,即认为抗冻蛋白分子可以分为疏水的一侧和亲水的一侧,而与冰相互作用的是亲水的一侧,疏水的一侧与水相互作用。抗冻蛋白分子中的氢原子与冰晶上的氧原子识别并结合,阻止了冰晶生长,从而发挥作用[18]。第四刚体能量学说,根据表面能最小原理,把抗冻蛋白看做小分子,抗冻蛋白与冰、水之间的表面能存在差别,使得抗冻蛋白能够强烈的吸附冰晶[43],从而发挥作用。第五即冰核抑制学说,即抗冻蛋白吸附于灰尘和冰核的表面,阻止了灰尘和冰核的联合,从而抑制新的冰核的形成。因为冰核是冰晶形成的基础,因此没有冰核的形成,就无法形成冰晶,从而抑制冰晶的形成,发挥抗冻功效[44]。以上是目前对抗冻蛋白发挥抗冻能力机理的5种学说。因为抗冻蛋白种类丰富,不同抗冻蛋白作用方式有所区别,可能还存在其他类型的抗冻蛋白和不同的作用机理,这都需要我们进一步的研究发现。
4 植物抗冻蛋白研究进展及应用迄今为止,已在60多个植物中检测到抗冻蛋白,15种已被纯化[33]。经研究发现,植物抗冻蛋白的热滞活性多数小于1℃,云杉的热滞活性相对较高,达到2.19℃,与昆虫和动物抗冻蛋白相比低很多。不同种植物抗冻蛋白的同源性较低。有些植物的抗冻蛋白不仅具有抗冻活性,还具有其他功能,如樟子松(Scotch pine)的抗冻蛋白,属于PR-10家族,还具有体外抗菌活性[45]。另外,抗冻蛋白在植物细胞内多存在糖基化现象,如沙冬青抗冻蛋白(基因序列号AY590122、AY843521和AY843522)、胡萝卜抗冻蛋白(蛋白序列号A91926.1)和沙棘等的抗冻蛋白,通过糖基化以维持抗冻蛋白的稳定。但是其中沙冬青抗冻蛋白凝集素有一些过敏原,目前转基因不再应用。对不同植物中抗冻蛋白的性质、来源及同源性进行了总结(表 1),抗冻蛋白多定位于细胞的质外体中,多数发现于植物的叶片、根和芽中,只有腊梅[Chimonanthus praecox(linn.)Link.]抗冻蛋白定位于花冠质外体中和桃(Prunus persica)抗冻蛋白定位于树皮细胞质和细胞核中;抗冻蛋白都有一定的热稳定性,热滞活性大多在0.1-1.0,而女贞(Ligustrum lucidum)的抗冻蛋白热滞活性较高,与鱼类相似,可达2℃,云杉的抗冻蛋白热滞活性也达到2.19℃,在植物抗冻蛋白的热滞活性中明显偏高,桃的抗冻蛋白热滞活性较低,为0.06℃;不同来源的抗冻蛋白具有一定的同源性,无芒雀麦(Bromus inermis Leyss)、云杉、腊梅、野生香蕉(Musa rubinea)的抗冻蛋白均与几丁质酶同源,胡萝卜和沙棘的抗冻蛋白与多聚半乳糖醛酸酶抑制剂蛋白同源,连翘(Forsythia suspensa)和桃的抗冻蛋白与脱水蛋白同源,黑麦草和女贞的抗冻蛋白与内切壳多糖酶、内切葡聚糖酶、奇异果甜蛋白和禾本科植物的抗冻蛋白同源,而沙冬青、小麦(Triticum aestivum L.)、茄子(Solanum melongena L.)、冬油菜(Brassica campestris L.)和樟子松的抗冻蛋白的同源性不明显。总之,不同植物抗冻蛋白都有不同抗冻活性,并且抗冻蛋白的性质也各有差异,同源性也有所不同。
为了提高植物的抗寒能力,科学家将抗冻蛋白基因转入植物发现,不仅从植物中提取的抗冻蛋白基因经转化可以提高植物的抗寒能力,鱼类和昆虫的抗冻蛋白基因也能转入植物,提升植物对低温的适应能力。因为植物抗冻蛋白热滞后活性比鱼类低,远小于昆虫,而重结晶抑制活性比鱼类和昆虫高10-100倍[71]。因此,将昆虫和植物抗冻蛋白基因转入植物融合表达,对植物抗寒能力的提高有重要意义。如张振华等[72]将胡萝卜和黄粉虫抗冻蛋白基因融合,转入拟南芥,发现黄粉虫抗冻蛋白的高热滞活性使得转基因拟南芥的冰点降低,而具有高重结晶抑制活性的胡萝卜抗冻蛋白使转基因植株在较长时间的冻害条件下,稳定质外体中的流体,从而使转基因拟南芥在低温下的损伤程度大大降低。陈佳佳[73]将矮沙冬青抗冻蛋白基因导入玉米未成熟幼胚中,将幼苗置于0℃低温胁迫下处理24 h,之后转入室温中解冻,发现对照组玉米的叶片失水萎蔫,而转入抗冻蛋白的阳性植株叶片则表现正常,说明矮沙冬青抗冻蛋白基因在玉米中异源表达,显著的提升了玉米的抗寒能力,为改善玉米作物品质、提高产量提供了新思路。陈亮亮[74]将小胸鳖甲昆虫抗冻蛋白基因Mpafp149转入棉花中发现,转基因棉花的脯氨酸含量转基因植株通过产生脯氨酸来应对低温胁迫,在一定程度上提高了转基因棉花的抗寒性。为了获得抗寒能力高的植株,以提高农作物产量,科学家们分别从昆虫、鱼类和植物中克隆了抗冻蛋白基因,转入植物中,以期提高植物的产量和质量。目前,昆虫抗冻蛋白具有较高抗冻活性,已经成为植物转化研究中选择的抗冻蛋白[75]。由表 2可知,从昆虫、鱼类、植物中得到的抗冻蛋白基因及动植物抗冻蛋白融合基因转入受体植株后,转基因植株都正常生长,并且都表现出一定的对低温的适应能力,表明外源抗冻蛋白基因可以使受体植株抗冻能力得到提升。为了提高农作物抗寒能力以提高产量满足需求,对抗冻蛋白基因转化进行了深入研究(表 2)。由于从沙冬青中获得的抗冻蛋白虽然有效,但有些凝集素存在过敏源,因此目前在转基因中已经不再应用。
近年来,抗冻蛋白在农业、医学、冷食品储藏加工和水产养殖[94]等方面应用越来越广泛。如在农业方面[13],通过种植导入抗冻蛋白基因的农作物,农作物抗寒水平大大增加,从而农作物的种植时间变长,种植地域变广,同时收获之后农作物的储存时间也可以延长。在医学方面[13, 95],抗冻蛋白的发现可以更好地保存血液、器官、胚胎、肝脏及精子和卵子,大大的提高了低温保存中的质量。在冷食品储藏加工方面[13],抗冻蛋白在冷冻面团馒头品质的改善[96-97]、冷鲜肉和冰淇淋等加工和保鲜的过程中起到了很大的作用,在低温条件下会阻止冰渣的产生,增加肉类和冰淇淋的口感,但迄今为止,还没有可用的数据来报告毒性或挑战这些“新型”食品成分的安全性[98]。研究发现,化学阳离子化的抗冻蛋白Ⅲ保留与天然抗冻蛋白Ⅲ类似的重结晶抑制活性,在零度以下的温度对蛋白质结构没有直接的负面影响。因此,化学阳离子化可能为开发更强大的抗冻蛋白提供条件,可以作为补充冷冻保护剂在临床相关细胞的冷冻保存中应用[99]。
5 结语抗冻蛋白的研究正在继续,热滞效应和抑制冰晶重结晶的作用机理都未完全了解,其中抗寒植物受到冷胁迫以后,大量的抗冻蛋白在胞内累积,这些抗冻蛋白是如何受到调控而表达出来的,至今未知[100]。研究表明抗冻蛋白的表达包含钙信号的调控。钙和激素(如乙烯和茉莉酸)可以通过调节植物基因的表达,从而使抗冻蛋白累积[33]。WRKY转录因子可以防止细胞内冰的形成[33]。植物抗冻蛋白可以抑制嗜酸性细菌生长等等[33]。2011年,Walter等[100]在欧白英(Solanum dulcamara Linn.)中确定显示抗冻活性的非蛋白质分子,而是糖脂。该糖脂产生的热滞值和昆虫抗冻蛋白的相近,为(3.1±0.4)℃,这是迄今为止在植物中检测到的最高的热滞活性。另外,抗冻蛋白的表达对于提高植物对低温的适应能力具有重要意义。在抗冻蛋白表达融合中,植物和昆虫或植物和鱼类抗冻蛋白的融合蛋白来提高植株抗冻能力具有更重要的价值,对于动植物抗冻蛋白融合蛋白的研究具有广阔的前景。但是对于植物抗冻机理方面的研究还不够全面,或许还存在着其它未发现的蛋白质分子或非蛋白质分子也具备抗冻活性,需要进一步研究探索。
| [1] |
李瑞梅, 惠杜娟, 刘姣, 等. 植物抗寒转录因子CBF和ICE研究进展[J]. 广东农业科学, 2012, 39(23): 132-135, 138. DOI:10.3969/j.issn.1004-874X.2012.23.043 |
| [2] |
刘丽丽, 朱华, 闫艳春, 等. 鱼类低温耐受机制与功能基因基因研究进展[J]. 生物技术通报, 2018(8): 1-7. |
| [3] |
陈莹, 安虹霏, 张秋爽, 等. 大西洋鲑鱼Ⅳ型抗冻蛋白的表达与纯化[J]. 生物技术, 2017, 27(3): 218-222. |
| [4] |
吕绘倩.太平洋鳕抗冻基因的研究[D].大连: 大连海洋大学, 2017.
|
| [5] |
胡瑞芹.南极鱼(L.Dearborni)抗冻蛋白基因LD的抗寒分子机制研究[A]//中国水产学会.2017年中国水产学会学术年会论文摘要集[C].北京: 中国水产学会, 2017.
|
| [6] |
张凤娟, 孙琳洁, 李素丽, 等. 荒漠昆虫小胸鳖甲抗冻蛋白MpAFP698对酿酒酵母的低温保护作用[J]. 食品与发酵工业, 2017, 43(5): 37-42. |
| [7] |
于淑惠.白蜡虫低温适应分子机制及抗冻蛋白功能研究[D].北京: 中国林业科学研究院, 2016.
|
| [8] |
杜荣俸, 刘忠渊, 毛新芳. 差示扫描量热法分析光滑鳖甲抗冻蛋白ApAFP914 TXT基序对抗冻活性的影响[J]. 生物技术通报, 2016, 32(9): 210-217. |
| [9] |
万军, 朱兴友, 张洋. 昆虫抗冻蛋白研究进展[J]. 北方蚕业, 2012, 33(2): 12-15. DOI:10.3969/j.issn.1673-9922.2012.02.004 |
| [10] |
赵启红.松树PicW同源基因的克隆及抗冻功能分析[D].北京: 北京林业大学, 2016.
|
| [11] |
徐化能, 马淑凤, 张连富. 植物抗冻蛋白分离纯化方法的研究进展[J]. 食品与生物技术学报, 2013, 32(4): 347-352. DOI:10.3969/j.issn.1673-1689.2013.04.002 |
| [12] |
王翠花, 刘沙, 张瑞富, 等. 植物抗寒分子生物学研究概况及展望[J]. 辽宁农业科学, 2014(1): 45-48. |
| [13] |
李树峰, 曹允考, 郝丽, 等. 抗冻蛋白的研究进展及其应用[J]. 东北农业大学学报, 2003(1): 90-94. DOI:10.3969/j.issn.1005-9369.2003.01.020 |
| [14] |
Griffith M, Ala P, Yang DSC, et al. Antifreeze protein produced endogenously in winter rye leaves[J]. Plant Physiology, 1992, 100: 593-596. DOI:10.1104/pp.100.2.593 |
| [15] |
Urrutia ME, Duman JG, Knight CA. Plant Thermal Hysteresis Proteins[J]. Biochimica et Biophysica Acta, 1992, 1121(1): 199-206. |
| [16] |
费云标, 孙龙华, 黄涛, 等. 沙冬青高活性抗冻蛋白的发现[J]. 植物学报, 1994(8): 649-650. |
| [17] |
Sidebottom C, Bukley S, Pudney P, et al. Heat stable antifreeze protein from grass[J]. Nature, 2000, 406: 256-263. DOI:10.1038/35018639 |
| [18] |
汪少芸, 李晓坤, 周焱富, 等. 抗冻蛋白的作用机制及基因工程研究进展[J]. 北京工商大学学报:自然科学版, 2012, 30(2): 58-63. |
| [19] |
李芳, 王博, 艾秀莲. 抗冻蛋白研究进展[J]. 新疆农业科学, 2003, 40(6): 349-352. DOI:10.3969/j.issn.1001-4330.2003.06.009 |
| [20] |
李文轲, 马春森. 抗冻蛋白特征、作用机理与预测新进展[J]. 生命科学, 2012, 24(10): 1089-1097. |
| [21] |
DeVries AL. Glycoproteins as biological antifreeze agents in antarctic fishes[J]. Science, 1971, 172: 1152-1155. DOI:10.1126/science.172.3988.1152 |
| [22] |
Mishra V, Pattnaik P. Anti-freeze proteins:prospects and perspectives in food sector[J]. Food Industry, 1999, 18: 238-244. |
| [23] |
Zachariassen KE, Kristiansen E. Ice nucleation and antinucleation in nature[J]. Cryobiology, 2000, 41: 257-279. DOI:10.1006/cryo.2000.2289 |
| [24] |
Celik Y, Graham LA, Mok YF, et al. Superheating of ice crystals in antifreeze protein solutions[J]. Proc Natl Acad Sci USA, 2010, 107: 5423-5428. DOI:10.1073/pnas.0909456107 |
| [25] |
Venketesh S, Dayananda C. Properties, potentials, and prospects of antifreeze proteins[J]. Critical Reviews in Biotechnology, 2008, 28: 57-82. DOI:10.1080/07388550801891152 |
| [26] |
Yeh Y, Feeney RE. Antifreeze proteins:structures and mechanisms of function[J]. Chemical Reviews, 1996, 96: 601-617. DOI:10.1021/cr950260c |
| [27] |
Zhang DQ, Liu B, Feng DR, et al. Expres-sion, purification, and antifreeze activity of carrot antifreeze protein and its mutants[J]. Protein Expression and Purification, 2004, 35: 257-263. DOI:10.1016/j.pep.2004.01.019 |
| [28] |
Kristiansen E, Ramløv H, Højrup P, et al. Structural characteristics of a novel anti-freeze protein from the longhorn beetle Rhagium inquisitor[J]. Insect Biochemistry and Molecular Biology, 2011, 41: 109-117. DOI:10.1016/j.ibmb.2010.11.002 |
| [29] |
Davies PL, Baardsnes J, Kuiper MJ, et al. Structure and function of antifreeze proteins[J]. Philosophical Transactions of the Royal Society of London Series B-Biological Sciences, 2002, 357: 927-935. DOI:10.1098/rstb.2002.1081 |
| [30] |
Steponkus PL. Role of the plasma membrane in freezing injury and cold acclimation[J]. Annual Review of Plant Physiology, 1984, 35: 543-584. DOI:10.1146/annurev.pp.35.060184.002551 |
| [31] |
Raymond JA, Devries AL. Adsorption inhibition as a mechanism of freezing resistance in polar fishes[J]. Proc Natl Acad Sci USA, 1977, 74(6): 2589-2593. DOI:10.1073/pnas.74.6.2589 |
| [32] |
汪少芸, 赵珺, 吴金鸿, 等. 抗冻蛋白的研究进展及其在食品工业中的应用[J]. 北京工商大学学报:自然科学版, 2011, 29(4): 50-58. |
| [33] |
Gupta R, Deswal R. Antifreeze proteins enable plants to survive in freezing conditions[J]. Journal of Bioscience, 2014, 39: 1-14. DOI:10.1007/s12038-013-9404-x |
| [34] |
刘志东, 马庆保, 陈雪忠. 抗冻蛋白抗冻活性评价方法的研究进展[J]. 天然产物研究与开发, 2017, 29(1): 176-181. |
| [35] |
Yu SO, Brown A, Middleton AJ, et al. Ice restructuring inhibition activities in anti-freeze proteins with distinct differences in thermal hysteresis[J]. Cryobiology, 2010, 61: 327-334. DOI:10.1016/j.cryobiol.2010.10.158 |
| [36] |
Hansen LD, Lewis EA, Eatough DJ, et al. Kinetics of drug decomposition by heat conduction ealorimetry[J]. Pharmaceutical Rresearch, 1989, 6: 20-27. DOI:10.1023/A:1015851100015 |
| [37] |
巩子路.新疆冷水鱼中抗冻蛋白的分离纯化与结构鉴定[D].石河子: 石河子大学, 2015.
|
| [38] |
田童童, 巩子路, 张建. DSC法检测抗冻蛋白的热滞活性的研究[J]. 中国酿造, 2014, 33(1): 127-132. DOI:10.3969/j.issn.0254-5071.2014.01.030 |
| [39] |
Bredow M, Tomalty HE, Walker VK. Identification of plant ice-binding proteins through assessment of ice-recrystallization inhibition and isolation using ice-affinity purification[J]. Journal of Visualized Experiments Jove, 2017(123). |
| [40] |
熊小文, 黄发泉, 黎毛毛, 等. 植物抗冻蛋白研究进展[J]. 江西农业学报, 2009, 21(10): 112-114. |
| [41] |
林善枝, 张志怡, 林元震. 植物抗冻蛋白及抗冻性分子改良[J]. 植物生理与分子生物学报, 2004, 30(3): 251-260. |
| [42] |
Yang DS, Sax M, Chakrabart YA, et al. Crystal structure of an antifreeze poly peptide and its mechanistic im plications[J]. Nature, 1988, 333(6170): 232-237. DOI:10.1038/333232a0 |
| [43] |
陈闯, 姚骏, 王麒琳, 等. 抗冻蛋白的研究现状及其应用[J]. 食品研究与开发, 2016, 37(12): 199-201. DOI:10.3969/j.issn.1005-6521.2016.12.046 |
| [44] |
彭淑红, 姚鹏程, 徐宁迎. 抗冻蛋白的特性和作用机制[J]. 生理科学进展, 2003, 34(3): 238-240. DOI:10.3321/j.issn:0559-7765.2003.03.011 |
| [45] |
李丽丽.樟子松Pin m Ⅲ基因的克隆与功能分析[D].哈尔滨: 东北林业大学, 2012.
|
| [46] |
王维香.沙冬青抗冻蛋白的分离纯化及特性鉴定[D].大连: 大连理工大学, 2004.
|
| [47] |
Fei YB, Sun LH, Huang T, et al. Isolation and identification of antifreeze protein with high activity in Ammopiptanthus mongolicus[J]. Acta Botanica Sinica, 1994, 36: 649-650. |
| [48] |
Yong J, Fei Y, Wei L. Purification and identification of an antifreeze protein from the leaves of Ammopiptanthus mongolicus[J]. Acta Botanica Sinica, 2000, 6: 67-73. |
| [49] |
Fei YB, Cao PX, Gao SQ, et al. Purification and structure analysis of antifreeze proteins from Ammopiptanthus mongolicus[J]. Preparative Biochemistry and Biotechnology, 2008, 38: 179-190. |
| [50] |
Nakamura T, Ishikawa M, Nakatani H, et al. Characterization of cold-responsive extracellular chitinase in bromegrass cell cultures and its relationship to antifreeze activity[J]. Plant Physiology, 2008, 147: 391-401. DOI:10.1104/pp.106.081497 |
| [51] |
Worrall D, Elias E, Ashford D, et al. A carrot leucine-richrepeat protein that inhibits ice recrystallization[J]. Science, 1998, 282: 115-117. DOI:10.1126/science.282.5386.115 |
| [52] |
Smallwood M, Warrall D, Byass L, et al. Isolation and characterization of a novel antifreeze protein from carrot(Daucus carota)[J]. Biochemical Engineering Journal, 1999, 340: 385-391. DOI:10.1042/bj3400385 |
| [53] |
Gupta R, Deswal R. Low temperature stress modulated secretome analysis and purification of antifreeze protein from Hippophae rhamnoides, a Himalayan wonder plant[J]. Journal of Proteome Rresearch, 2012, 11: 2684-2696. DOI:10.1021/pr200944z |
| [54] |
Simpson D, Smallwood M, Twigg S, et al. Purification and characterization of an antifreeze protein from Forsythia suspensa(L.)[J]. Cryobiology, 2005, 51: 230-234. DOI:10.1016/j.cryobiol.2005.06.005 |
| [55] |
Sabala I, Egertsdotter U, Fircks HV, et al. Abscisic acid-induced secretion of an antifreeze-like protein in embryogenic cell lines of Picea abies[J]. Journal of Plant Physiology, 1996, 149: 163-170. DOI:10.1016/S0176-1617(96)80190-8 |
| [56] |
Jarzabek M, Pukacki PM, Nuc K. Cold-regulated proteins with potent antifreeze and cryoprotective activities in spruces(Picea spp.)[J]. Cryobiology, 2009, 58: 268-274. DOI:10.1016/j.cryobiol.2009.01.007 |
| [57] |
Middleton AJ, Marshall CB, Faucher FB, et al. Antifreeze protein from freeze-tolerant grass has a beta-roll fold with an irregularly structured ice-binding site[J]. JMB Online, 2012(5): 416. |
| [58] |
Hon WC, Griffith M, Mlynarz A, et al. Antifreeze proteins in winter rye are similar to pathogenesisrelated proteins[J]. Plant Physiology, 1995, 109: 879-889. DOI:10.1104/pp.109.3.879 |
| [59] |
邓顺阳.黑麦草抗冻蛋白基因的克隆、原核表达及植物转基因研究[D].株洲: 中南林业科技大学, 2010.
|
| [60] |
Lauersen KJ, Brown A, Middleton A, et al. Expression and characterization of an antifreeze protein from the perennial rye grass, Lolium perenne[J]. Cryobiology, 2011(3): 62. |
| [61] |
Chun JU, Yu XM, Griffith M. Genetic studies of antifreeze proteins and their correlation with winter survival in wheat[J]. Euphytica, 1998, 102: 219-226. DOI:10.1023/A:1018333730936 |
| [62] |
Kontogiorgos V, Regand A, Yada RY, et al. Isolation and characterization of ice structuring proteins from cold acclimated winter wheat grass extract for recrystallization inhibition in frozen foods[J]. Journal of Food Biochemistry, 2007, 31: 139-160. DOI:10.1111/jfbc.2007.31.issue-2 |
| [63] |
高轩.小麦抗冻蛋白基因的分离与遗传转化研究[D].武汉: 华中科技大学, 2010.
|
| [64] |
Zhang SH, Wei YL, Liu J, et al. An apoplastic chitinase CpCHT1 isolated from the corolla of wintersweet exhibits both antifreeze and antifungal activities[J]. Plant Biology, 2011, 55: 141-148. DOI:10.1007/s10535-011-0019-5 |
| [65] |
Wisniewski M, Webb R, Balsamo R, et al. Purification, immunolocalization, cryoprotective, and antifreeze activity of PCA60:a dehydrin from peach(Prunus persica)[J]. Plant Physiology, 1999, 105: 600-608. DOI:10.1034/j.1399-3054.1999.105402.x |
| [66] |
Duman JG. Purification and characterization of a thermal hysteresis protein from a plant, the bittersweet nightshade Solanum dulcamara[J]. Biochimica et Biophysica Acta-biomembranes, 1994, 1206: 129-135. DOI:10.1016/0167-4838(94)90081-7 |
| [67] |
杨刚, 史鹏辉, 孙万仓, 等. 白菜型冬油菜质外体抗冻蛋白研究[J]. 中国生态农业学报, 2016, 24(2): 210-217. |
| [68] |
邵强, 李海峰, 刘国生, 等. 抗冻蛋白的抗冻活性及其测定方法[J]. 中原大学学报, 2005(4): 111-113. |
| [69] |
刘尚, 廖祥儒, 张建国, 等. 一种女贞叶抗冻蛋白的分离纯化[J]. 植物学通报, 2007(4): 505-510. DOI:10.3969/j.issn.1674-3466.2007.04.011 |
| [70] |
张妙霞, 赖钟雄, 蔡英卿. 野生香蕉几丁质酶抗冻蛋白基因(Chi I2)的克隆及分析[J]. 龙岩学院学报, 2016, 34(5): 120-124. |
| [71] |
樊绍刚, 张党权, 邓顺阳, 等. 抗冻蛋白和冰核蛋白对植物抗冻性能的作用机制[J]. 经济林研究, 2009, 27(2): 125-130. DOI:10.3969/j.issn.1003-8981.2009.02.028 |
| [72] |
张振华, 陈介南, 卢孟柱, 等. 胡萝卜与黄粉虫抗冻融合基因在拟南芥中的表达与抗冻性分析[J]. 中国农学通报, 2012, 28(31): 146-152. DOI:10.3969/j.issn.1000-6850.2012.31.027 |
| [73] |
陈佳佳.矮沙冬青抗冻蛋白基因(AnAFP)转化玉米[D].雅安: 四川农业大学, 2015.
|
| [74] |
陈亮亮.转昆虫抗冻蛋白基因棉花的分子检测及其耐寒性研究[D].乌鲁木齐: 新疆大学, 2013.
|
| [75] |
Duman JG, Wisniewski MJ. The use of antifreeze proteins for frost protection in sensitive crop plants[J]. Environmental and Experimental Botany, 2014, 106: 60-69. DOI:10.1016/j.envexpbot.2014.01.001 |
| [76] |
马纪, 李春平, 邱立明, 等. 花粉管介导的准噶尔小胸鳖甲抗冻蛋白转基因棉花的筛选[J]. 新疆农业科学, 2008(3): 381-385. |
| [77] |
崔宁宁.昆虫抗冻蛋白的检测、功能鉴定及转基因应用[D].泰安: 山东农业大学, 2013.
|
| [78] |
Huang T, Nicodemus J, Zarka D G, et al. Expression of an insect antifreeze protein in Arabidopsis thaliana results in a decrease in plant freezing temperature[J]. Plant Molecular Biology, 2002, 50: 333-344. DOI:10.1023/A:1019875922535 |
| [79] |
邓龙群.矮沙冬青抗冻蛋白基因(AnAFP)功能验证[D].雅安: 四川农业大学, 2014.
|
| [80] |
郭丽琼, 林俊芳, 熊盛, 等. 抗冷冻蛋白基因遗传转化草菇的研究[J]. 微生物学报, 2005, 45(1): 39-43. DOI:10.3321/j.issn:0001-6209.2005.01.010 |
| [81] |
Kumar SR, Kiruba R, Balamurugan S, et al. Carrot antifreeze protein enhances chilling tolerance in transgenic tomato[J]. Acta Physiologiae Plantarum, 2014, 36(1): 21-27. DOI:10.1007/s11738-013-1383-x |
| [82] |
刘洁.青杄云杉抗冻基因PicW的克隆及功能分析[D].北京: 北京林业大学, 2014.
|
| [83] |
Hightower R, Baden C, Penzes E, et al. Expression of antifreeze proteins in transgenic plants[J]. Plant Molecular Biology, 1991, 17: 1013-1021. DOI:10.1007/BF00037141 |
| [84] |
赵凌, 王才林, 张亚东, 等. 花粉管介导的转抗冻蛋白基因(AFP)水稻[J]. 江苏农业学报, 2006, 22(4): 315-317. DOI:10.3969/j.issn.1000-4440.2006.04.001 |
| [85] |
褚明宇.胡萝卜抗冻蛋白AFP基因的克隆及对葡萄的遗传转化[D].兰州: 甘肃农业大学, 2012.
|
| [86] |
Worrall D, Elias L, Ashford D, et al. A carrot leucine-rich-repeat protein that inhibits ice recrystallization[J]. Science, 1998, 282: 115-117. DOI:10.1126/science.282.5386.115 |
| [87] |
Meyer K, Keil M, Naldrett MJ. A leucine-rich repeat protein of carrot that exhibits antifreeze activity[J]. FEBS Letter, 1999, 447: 171-178. DOI:10.1016/S0014-5793(99)00280-X |
| [88] |
Fan Y, Liu B, Wang H, et al. Cloning of antifreeze protein gene from carrot and its influence on cold tolerance in transgenic tobacco plants[J]. Plant Cell Report, 2002, 21: 296-301. DOI:10.1007/s00299-002-0495-3 |
| [89] |
Zhang CZ, Fei SZ, Arora R, et al. Ice recrystallization inhibition proteins of perennial ryegrass enhance freezing tolerance[J]. Planta, 2010, 232: 155-164. DOI:10.1007/s00425-010-1163-4 |
| [90] |
Yeh S, Moffatt BA, Griffith M, et al. Chitinase genes responsive to cold encode antifreeze proteins in winter cereals[J]. Plant Physiology, 2000, 124: 1251-1263. DOI:10.1104/pp.124.3.1251 |
| [91] |
孙仲序, 冯殿齐, 刘静, 等. afp基因导入花粉管对杏果实发育影响的研究[J]. 山东农业大学学报:自然科学版, 2005, 36(1): 1-6. |
| [92] |
王艳, 邱立明, 谢文娟, 等. 昆虫抗冻蛋白基因转化烟草的抗寒性[J]. 作物学报, 2008, 34(3): 397-402. DOI:10.3321/j.issn:0496-3490.2008.03.008 |
| [93] |
Deller RC, Carter BM, Zampetakis I, et al. The effect of surface charge on the thermal stability and ice recrystallization inhibition activity of antifreeze protein Ⅲ(AFP Ⅲ)[J]. Biochemical and Biophysical Research Communications, 2017, 495(1): 1055-1060. |
| [94] |
徐睿航, 张敬燕, 张国庚, 等. 水产动物抗冻蛋白及其应用前景的研究[J]. 农技服务, 2018(7): 1-2. DOI:10.3969/j.issn.1004-8421.2018.07.002 |
| [95] |
金周筠, 刘宝林. 抗冻蛋白及其应用前景[J]. 食品研究与开发, 2014, 35(20): 142-146. DOI:10.3969/j.issn.1005-6521.2014.20.036 |
| [96] |
姬成宇, 石媛媛, 李梦琴, 等. 抗冻蛋白对预发酵冷冻面团发酵流变特性和馒头品质的影响[J]. 食品工业科技, 2018, 39(4): 68-72, 93. |
| [97] |
张艳杰.燕麦抗冻蛋白的分离纯化及对冻藏面团品质的影响[D].无锡: 江南大学, 2017.
|
| [98] |
Hassas-Roudsari M, Goff HD. Ice structuring proteins from plants:Mechanism of action and food application[J]. Food Research International, 2012, 46(1): 425-436. DOI:10.1016/j.foodres.2011.12.018 |
| [99] |
张振华, 卢孟柱, 王义强, 等. 抗冻蛋白提高植物抗寒性研究进展[J]. 中国农学通报, 2011, 27(9): 342-346. |
| [100] |
Walters KR, Serianni AS, Voituron Y, et al. A thermal hysteresis-producing xylomannan glycolipid antifreeze associated with cold tolerance is found in diverse taxa[J]. Journal of Comparative Physiology, 2011, 181: 631-640. DOI:10.1007/s00360-011-0552-8 |






