在植物中, 多酚氧化酶(Polyphenol oxidase, PPO)能将酚类物质催化反应出能直接杀灭病原菌的醌类物质, 被认为对植物抗虫、病菌等生物因素性胁迫是有益的。然而, 因为PPO催化产生深褐色的醌类物质又直接危害果蔬、水稻及小麦等农产品的外观品质, 因此, 过强的PPO酶活性对作物的品质有害。植物中的PPO的功能具有多样性, 在豆类[1]、番茄[2-3]、马铃薯[4]、红三叶草[5-6]、苹果[7]、水稻[8]和小麦[9-10]等植物中已有大量的报道。育种学家在研究PPO基因功能的基础上, 根据需求选育出PPO酶活性强或者弱的品种, 创制出抗病虫害或者不易褐化的产品。烟草也存在抗病虫害与低褐变烟叶品种的需求, 利用现代分子标记手段揭示烟草品种耐烤性的分子基础, 提出决定烟草品种耐烤性的候选基因[11-12]。但烟草PPO基因的功能研究主要集中在烟草调制过程中褐变与PPO酶活力相关性的研究[13-16]。针对烟草PPO基因功能的研究相对较少[17-23]。研究烟草PPO基因功能, 需要创制突变体材料。CRISPR/Cas9技术于2015年成功应用于烟草[24]基因功能研究, 目前, 国内关于烟草中CRISPR/Cas9技术的应用正在普及。为了获得NtPPO1的定点突变体, 本研究利用CRISPR/Cas9技术构建烟草多酚氧化酶NtPPO1的编辑载体, 筛选NtPPO1被定点编辑敲除的纯合突变体。通过实时定量PCR技术检测到突变体中NtPPO1的相对表达量, 突变体的创制为研究其基因功能奠定了材料基础。
1 材料与方法 1.1 材料栽培烟草品种(Nicotiana tabacum)K326、DH5α大肠杆菌与LBA4404农杆菌感受态为云南省烟草农业科学研究院实验室保存。pORE-CRISPR/Cas9植物表达载体由西南大学惠赠。引物合成和测序均由上海英潍捷基贸易有限公司(Invitrogen)完成。
1.2 方法 1.2.1 引物设计和基因克隆以烟草叶片cDNA为模板, 根据NtPPO1序列设计引物(F:5'-ATGGCTTCTTCATTTGTTCTTCAAGC-3';R:5'-TTAACAAGGGACCAACTGGATCTCAAC-3'), 利用Q5超保真DNA聚合酶进行扩增, 扩增产物经过琼脂糖凝胶电泳进行检测。回收、纯化、连接和转化, 经抗性筛选, PCR鉴定后挑选阳性单克隆菌落测序验证。
1.2.2 sgRNA表达载体的构建根据测序正确的NtPPO1序列, 设计靶位点sgRNA序列:5'-CATTT-GTTCTTCAAGCTCCA-TGG-3'作为CRISPR/Cas9敲除NtPPO1的靶位点序列。
根据pORE-CRISPR/Cas9植物表达载体构建方法, 需要在sgRNA靶序列添加核苷酸G与BsaⅠ的酶切接头(F:5'-GATTGCATTTGTTCTTCAAGCTC-CA-3';R:5'-AAACTGGAGCTTGAAGAACAAATGC-3')。sgRNA退火反应:在PCR仪器中设定程序每8 s降低0.1℃, 将混合单链引物从95℃降至4℃以形成引物DNA双链。
利用BsaⅠ酶切pORE-CRISPR/Cas9植物表达载体, 将其与已退火好的靶位点DNA引物进行连接, 构建成NtPPO1的CRISPR/Cas9载体。将目的载体直接转化大肠杆菌DH5α感受态细胞, 利用含卡那霉素的抗性培养基筛选阳性克隆。利用上游引物:5'-TTAGGTTTACCCGCCAATA-3', 与sgRNA反向引物配合PCR筛选阳性菌落。
1.2.3 农杆菌转化载体构建与烟草遗传转化提取克隆载体中的质粒转化农杆菌LBA4404。利用含载体农杆菌浸染烟草叶盘8-10 min。然后经过2 d共培养, 转移至含有NAA、6-BA和卡那霉素(50 mg/L)以及头孢噻肟钠(500 mg/L)的MS固体培养基中进行组培再生, 获得转基因烟草植株。
1.2.4 烟草NtPPO1突变体的筛选提取转基因烟草植株DNA。利用Kana引物(F:5'-CAGGTTCTC-CGGCCGCTTGG-3', R:5'-GGAGATCCTGCCCCGG-CACT-3')进行PCR, 检测阳性植株。利用Cas9引物(F:5'-TGTCGGGACAGGGCGACAGT-3', R:5'-CGCCGCGTTCAGCCTTTGTG-3')进行PCR, 检测阳性植株。
挑取经PCR检测阳性的烟草小苗, 设计包含靶位点区域的长度为770 bp的片段引物(F:5'-TTCACGCACTAATTCGTCTCATTGGA-3', R:5'-TCTGTCGGCAACGCCTTCA-3')进行检测。
PCR扩增NtPPO1片段, 扩增产物经测序、比对后, 分析转基因后代植株中NtPPO1在靶位点处核苷酸序列变化。
基因编辑成功的转基因阳性T1植株, 分单株套袋自交收获T2种子。播种萌发T2种子获得T2小苗100株, 提取T2植株DNA, 利用上述方法检测NtPPO1突变情况, 并分析T2纯合突变烟草中NtPPO1序列在靶位点处突变类型。
1.2.5 烟草NtPPO1的Realtime-PCR检测按照Quant qRT-PCR kit(SYBR Green)(TIANGEN公司)使用说明在QuantStudioTM 6 Flex荧光定量PCR仪器(ABI公司)上进行qRT-PCR检测。3个生物学重复, 3个技术重复, 利用Excel进行统计分析, 以sigmplot软件绘制qRT-PCR分析图。分析NtPPO1的相对表达量, 内参基因为26S。所需引物为NtPPO1_qRT_F:5'-AGCACTGCCTTTATTGATG-ATGG-3', NtPPO1_qRT_R:5'-ACTTAGCTATGTAT-TCGTCATCTACAGTT-3'。26S_F:5'-GAAGAAGGT-CCCAAGGGTTC-3', 26S_R:5'-TCTCCCTTTAACAC-CAACGG-3'。
2 结果 2.1 NtPPO1全长cDNA序列验证如图 1所示, 利用设计的克隆引物以烟草cDNA为模板, 特异性扩增出一条约1.8 kb的片段, 经测序比对分析NtPPO1的基因座(图 2-A), NtPPO1编码序列为1 746 bp, 其外显子有3个, 其中第2外显子可以选择性拼接。测序发现5个克隆中有4个克隆的NtPPO1编码序列为1、2、3外显子拼接而成(图 2-B), 另外1个克隆的NtPPO1编码序列为1、3外显子拼接而成(图 2-C)。NtPPO1可变剪切形式为外显子跳过, 在不改变起始位点的情况下, NtPPO1转录后的mRNA会提前出现终止密码子。跳过的第2外显子序列为5'-GTACTTATACTTCCATGAGAGAATCTTGGCTTCCCTAATTGGTGACCCTACATTTGCTTTGCCATATTGGAATTGGGACCATCCTAAAGGCATGCATTTGCCTGACATGTTTGATGTCGAAG-3'。
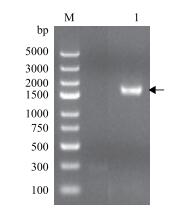
|
| 图 1 NtPPO1的cDNA扩增产物 M:Trans2K DNA Marker; 1:NtPPO1的cDNA扩增产物 |
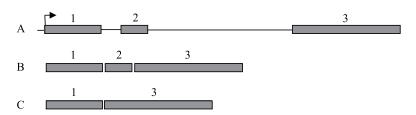
|
| 图 2 NtPPO1基因座图 A:NtPPO1基因座位示意图。灰色方框表示外显子, 黑色线条是内含子, 黑色箭头指示转录起始位点。B:表示1、2、3个外显子剪切的转录形式。C:表示1、3外显子剪切的形式 |
在野生型的烟草植株中, NtPPO1就存在2种不同的转录形式, 虽然转录本会提前出现终止子(图 2-C), 但是烟草中保存这种转录剪切方式应该有其重要的生理功能, 推测这种无义介导的mRNA降解(Nonsense-mediated mRNAdecay, NMD)可以监控细胞中的mRNA水平以便烟草能够快速的响应外界刺激。
2.2 NtPPO1突变靶位点的选择与载体构建NtPPO1的CDS序列经过测序验证后, 选取翻译起始密码子ATG后第11-30的20 bp核苷酸序列作为敲除基因的靶位点序列, 构建CRISPR/Cas9植物表达载体, 目标载体转入农杆菌后, 图 3显示, 通过测序验证筛选出含sgRNA序列正确插入到CRISPR/Cas9表达载体的农杆菌菌株。
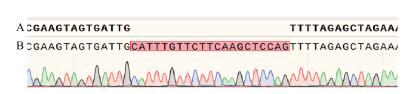
|
| 图 3 pORE-CRISPR/Cas9∷sgRNA基因编辑载体 A:空载体; B:插入sgRNA靶序列的基因编辑载体, 红色高亮的标记sgRNA靶序列 |
含正确插入sgRNA的基因编辑载体, 利用农杆菌叶盘法转化烟草, 经过组培再生成转基因T1代植株。
2.3 NtPPO1敲除阳性T1植株筛选通过测序方法筛选NtPPO1被编辑的转基因植株T1(图 4), 编辑成功的T1植株在sgRNA-PAM位点后序列经测序出现双峰, 并且测序峰图紊乱的情况明显不一致, 说明Cas9蛋白在切断目标序列后, DNA修复的情况有差异。将此三类转基因T1杂合突变植株盆栽后自交收种。经过自交分离后产生的T2代植株中, 会得到三类NtPPO1纯合突变的T2植株。

|
| 图 4 NtPPO1定点敲除转基因T1植株筛选 黑色箭头指示突变起始位置; A:NtPPO1编码参考序列, 蓝色部分为PAM靶位点序列; B、C和D:NtPPO1敲除成功的3株T1转基因植株 |
经测序分析T2植株NtPPO1在目标敲除序列后(图 5), 突变体M1植株的NtPPO1缺失了1个G碱基, M2植株的NtPPO1缺失了2个G碱基, M3植株的NtPPO1突变是插入了1个A碱基, 此3类突变都会造成NtPPO1编码序列的移码突变, 如果转录出mRNA, 在起始阅读框不变的情况下会提前出现终止密码子。
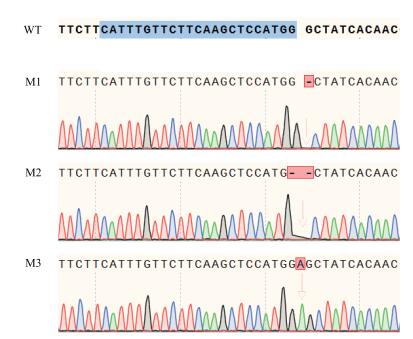
|
| 图 5 T2代转基因植株NtPPO1的突变类型 红色箭头显示T2植株NtPPO1突变区域; WT:野生型; M1、M2和M3:突变体 |
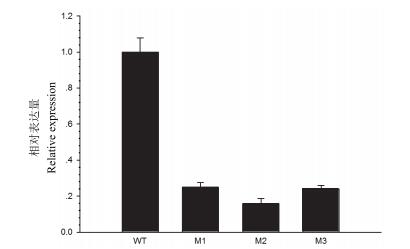
测定NtPPO1纯合突变植株M1、M2、M3的基因表达量如图 6所示, 相对于野生型对照, M1、M2、M3突变体NtPPO1的表达量分别下降了75%、84%和76%。结果表明, 利用CRISPR/Cas9技术创制的NtPPO1的突变体也影响了此基因的转录。在DNA水平上的点突变, 造成了基因转录水平的改变。NtPPO1的突变是位于第1外显子区域, 而不是位于启动子区域。理论上, 造成NtPPO1表达量降低就应该发生在转录后的水平调控, 具体是发生在转录后的哪个时期还有待进一步的研究。
|
| 图 6 T2转基因植株中NtPPO1的相对表达量分析 |
如图 7所示, 利用CRISPR/Cas9技术创制的NtPPO1突变体与对照野生型烟草之间的田间外观表型无明显差异。

|
| 图 7 NtPPO1纯合突变体植株表 WT:野生型; M1、M2和M3:纯合突变体 |
本研究选取了一个烟草多酚氧化酶NtPPO1进行基因序列克隆验证, 结果表明, NtPPO1存在一种可变剪切形式。在验证了NtPPO1序列的基础上, 采用CRISPR/Cas9技术, 创制1、2 bp碱基缺失和1 bp碱基插入的NtPPO1定点纯合突变体M1、M2和M3。通过基因表达发现, 突变体中NtPPO1表达水平有显著的下降。
植物中的PPO功能具有多样性。根据前人的研究结果, PPO与植物抗虫、抗细菌性病害的能力相关。但是, 在一些作物中通过降低作物中的PPO酶活, 会减轻农作物发生褐变的程度, 如在葡萄[25]、小麦[26]、水稻[27]等作物中的结果显示, 低的PPO活力能不同程度的显示出不易褐变、耐贮藏的特性。根据本实验基因测序的结果显示, NtPPO1已经被成功敲除, 并且基因的表达量也发生了显著的下降。王曼玲等[28]报道植物的PPO一般存在多个基因编码, 而本研究普通栽培烟草中的PPO基因至少有15个(研究未发表), 单独敲除某一个PPO基因, 可能会由于另外一个PPO基因在功能上互补, 造成植株整体上的PPO活力下降并不显著。所以需要研究烟草中的PPO基因的功能, 还需要进一步的创制出各PPO基因的突变体, 甚至是烟草PPO双、三基因突变体, 才能更全面的研究PPO基因功能。
根据qPCR测定结果显示CRISPR/Cas9创制的NtPPO1的纯合突变体其NtPPO1的表达水平显著降低。说明利用CRISPR/Cas9在烟草中创制某个基因的定点突变时, 也可能会影响此基因转录。这个结果和Cai等[29]在大豆中的研究结果类似, Cai等在大豆中靶向敲除控制开花的基因GmFT2a, 在长日照和短日照的条件下, GmFT2a的相对表达量下降。根据Wu等[30]的研究表明, 真核生物中, 如果基因序列存在早期终止子(Premature termination codons, PTCs), 相对于没有PTCs的mRNA, 携带PTCs的mRNA会通过无义mRNA降解途径(Nonsense-mediated mRNA decay pathway)快速降解, 防止因翻译出无意蛋白的积累才启动降解蛋白调控。本研究利用CRISPR/Cas9在NtPPO1靠近起始密码子的核苷酸序列上引入了移码突变, 结果提前出现了终止密码子, 可能启动了烟草本身的NMD调控途径, 进而造成了NtPPO1的转录下降。当然, 这只是一个推论。本研究利用CRISPR/Cas9基因编辑技术创制NtPPO1突变体, 其NtPPO1表达水平发生下降的机理还有待于进一步的研究。
本研究利用CRISPR/Cas9基因组编辑技术获得了烟草PPO基因NtPPO1的编辑敲除突变体, 对NtPPO1的功能进行了初步研究, 为烟草PPO基因功能研究和烟草育种奠定了材料基础。
4 结论本研究克隆验证了烟草多酚氧化酶NtPPO1编码序列, 并利用CRISPR/Cas9技术成功创制了3个NtPPO1定点突变体材料, NtPPO1在突变体中的表达量显著降低, 而突变材料与对照烟草表型上无显著差异。
| [1] |
Cary JW, Lax AR, Flurkey WH, et al. Cloning and characterization of cDNAs coding for Vicia faba polyphenol oxidase[J]. Plant Mol Biol, 1992, 20(2): 245-253. DOI:10.1007/BF00014492 |
| [2] |
Newman SM, Eannetta Nt, Yu H, et al. Organisation of the tomato polyphenol oxidase gene family[J]. Plant Mol Biol, 1993, 21(6): 1035-1051. DOI:10.1007/BF00023601 |
| [3] |
Thipyapong P, Joel DM, Steffens JC. Differential expression and turnover of the tomato polyphenol oxidase gene family during vegetative and reproductive development[J]. Plant Physiol, 1997, 113(3): 707-718. DOI:10.1104/pp.113.3.707 |
| [4] |
Thygesen PW, Dry IB, Robinson SP.Polyphenol oxidase in potato.A multigene family that exhibits differential expression patterns[J].Plant Physiol, 1995, 109(2): 525-531.
|
| [5] |
Sullivan ML, Hatfield RD, Thoma SL, et al. Cloning and characterization of red clover polyphenol oxidase cDNAs and expression of active protein in Escherichia coli and transgenic alfalfa[J]. Plant Physiol, 2004, 136(2): 3234-3244. DOI:10.1104/pp.104.047449 |
| [6] |
Winters A, Heywood S, Farrar K, et al. Identification of an extensive gene cluster among a family of PPOs in Trifolium pratense L.(red clover)using a large insert BAC library[J]. BMC Plant Biology, 2009, 9(1): 94. DOI:10.1186/1471-2229-9-94 |
| [7] |
Boss PK, Gardner RC, Janssen BJ, et al. An apple polyphenol oxidase cDNA is up-regulated in wounded tissues[J]. Plant Mol Biol, 1995, 27(2): 429. DOI:10.1007/BF00020197 |
| [8] |
Yu Y, Tang T, Qian Q, et al. Independent losses of function in a polyphenol oxidase in rice:differentiation in grain discoloration between subspecies and the role of positive selection under domestication[J]. Plant Cell, 2008, 20(11): 2946-2959. DOI:10.1105/tpc.108.060426 |
| [9] |
Wang XB, Ma CX, Si HQ, et al. Gene markers for grain polyphenol oxidase activity in common wheat[J]. Molecular Breeding, 2008, 23(1): 163-170. |
| [10] |
Zhai S, He Z, Wen W, et al. Genome-wide linkage mapping of flour color-related traits and polyphenol oxidase activity in common wheat[J]. Theor Appl Genet, 2016, 129(2): 377-394. DOI:10.1007/s00122-015-2634-6 |
| [11] |
郝贤伟.烤烟耐烤性遗传分析及QTL定位研究[D].北京: 中国农业科学院, 2013.
|
| [12] |
王春凯.烤烟烘烤特性QTL位点发掘研究[D].北京: 中国农业科学院, 2016.
|
| [13] |
王传义, 吕国新, 朱启法, 等. 烤烟烘烤特性与烟草多酚氧化酶活性相关性研究[J]. 湖北农业科学, 2016, 55(6): 1495-1499, 1503. |
| [14] |
王传义.不同烤烟品种烘烤特性研究[D].北京: 中国农业科学院, 2008.
|
| [15] |
戴亚, 唐宏, 施春华, 等. 烟草多酚氧化酶的分离提纯及性质研究[J]. 中国烟草学报, 2001, 7(4): 7-12. DOI:10.3321/j.issn:1004-5708.2001.04.002 |
| [16] |
韩富根, 赵铭钦, 朱耀东, 等. 烟草中多酚氧化酶的酶学特性研究[J]. 烟草科技, 1993(6): 33-36. |
| [17] |
Jiang H, Shi C, Xie Y, et al. Activation of tobacco leaf polyphenol oxidase by sodium dodecyl sulfate[J]. Indian J Biochem Biophys, 2003, 40(5): 350-353. |
| [18] |
Shi C, Liu Q, Dai Y, et al. The mechanism of azide activation of polyphenol oxidase Ⅱ from tobacco[J]. Acta Biochim Pol, 2002, 49(4): 1029-1035. |
| [19] |
Shi C, Dai Y, Xu X, et al. The purification of polyphenol oxidase from tobacco[J]. Protein Expr Purif, 2002, 24(1): 51-55. DOI:10.1006/prep.2001.1543 |
| [20] |
Shi C, Dai Y, Xu X, et al. The interaction of azide with polyphenol oxidase Ⅱ from tobacco[J]. J Protein Chem, 2001, 20(6): 463-468. DOI:10.1023/A:1012550328542 |
| [21] |
Broothaerts W, Mcpherson J, Li B, et al. Fast apple(Malus x domestica)and tobacco(Nicotiana tobacum)leaf polyphenol oxidase activity assay for screening transgenic plants[J]. J Agric Food Chem, 2000, 48(12): 5924-5928. DOI:10.1021/jf000599m |
| [22] |
Goldman MH, Seurinck J, Marins M, et al. A tobacco flower-specific gene encodes a polyphenol oxidase[J]. Plant Mol Biol, 1998, 36(3): 479-485. DOI:10.1023/A:1005914918284 |
| [23] |
蔡传斌, 吴玉俊, 曹宁, 等. 烟草多酚氧化酶基因的克隆与序列分析[J]. 山地农业生物学报, 2016, 35(1): 57-61. |
| [24] |
Gao J, Wang G, Ma S, et al. CRISPR/Cas9-mediated targeted mutagenesis in Nicotiana tabacum[J]. Plant Mol Biol, 2015, 87(1/2): 99-110. |
| [25] |
Rathjen AH, Robinson SP. Aberrant processing of polyphenol oxidase in a variegated grapevine mutant[J]. Plant Physiol, 1992, 99(4): 1619-1625. DOI:10.1104/pp.99.4.1619 |
| [26] |
Hystad SM, Martin JM, Graybosch RA, et al. Genetic characteriza-tion and expression analysis of wheat(Triticum aestivum)line 07OR1074 exhibiting very low polyphenol oxidase(PPO)activity[J]. Theoretical and Applied Genetics, 2015, 128(8): 1605-1615. DOI:10.1007/s00122-015-2535-8 |
| [27] |
Yu YC, Tang T, Qian Q, et al. Independent Losses of function in a polyphenol oxidase in rice:differentiation in grain discoloration between subspecies and the role of positive selection under domestication[J]. Plant Cell, 2008, 20(11): 2946-2959. DOI:10.1105/tpc.108.060426 |
| [28] |
王曼玲, 胡中立, 周明全, 等. 植物多酚氧化酶的研究进展[J]. 植物学通报, 2005, 22(2): 215-222. DOI:10.3969/j.issn.1674-3466.2005.02.013 |
| [29] |
Cai Y, Chen L, Liu X, et al. CRISPR/Cas9-mediated targeted mutagenesis of GmFT2a delays flowering time in soya bean[J]. Plant Biotechnol J, 2018, 16(1): 176-185. DOI:10.1111/pbi.2018.16.issue-1 |
| [30] |
Wu J, Kang JH, Hettenhausen C, et al. Nonsense-mediated mRNA decay(NMD)silences the accumulation of aberrant trypsin proteinase inhibitor mRNA in Nicotiana attenuata[J]. Plant J, 2007, 51(4): 693-706. DOI:10.1111/j.1365-313X.2007.03173.x |



