2. 农业部农业转基因生物安全评价(食用)重点实验室,北京 100083;
3. 中国农业科学院北京畜牧兽医研究所国家畜禽改良研究中心,北京 100193
2. Key Laboratory of Safety Assessment of Genetically Modified Organism(Food Safety), Ministry of Agriculture, Beijing 100083;
3. Beijing Institute of Animal Science, Chinese Academy of Agricultural Sciences, Beijing 100193
锌指蛋白6 (ZBED6)作为一个新发现的转录调控因子,序列高度保守,可抑制IGF2基因的表达,促进肌肉的生长发育,降低脂肪沉积。ZBED6具有广泛的组织特异性分布,可调控细胞的生长发育和生物大分子的合成代谢,具有多种生物学功能,本文总结了ZBED6基因的生物学特性及其生理功能的研究进展。
1 ZBED6的生物学特性1999年,Jeon等[1]建立了欧洲野猪和大白猪的杂交系,利用该杂交系建立了瘦肉型家猪的数量性状位点(Quatitative trait locus,QTL),研究发现,猪2号染色体和人11号染色体上的QTL位于胰岛素样生长因子2 (Insulin-like growth factor,IGF2)调控区,IGF2内含子3区域发生单碱基突变(G→A)后可破坏某转录因子与该调控区的结合,导致IGF2表达水平上调3倍,进而促进骨骼肌生长,降低皮下脂肪沉积[2]。2009年,Markljung等[3]将这一未知的转录因子命名为ZBED6,并验证得到该转录因子是哺乳动物中与肌肉生长发育密切相关的基因,成果发表于PLoS Biology,引起了人们广泛的关注。
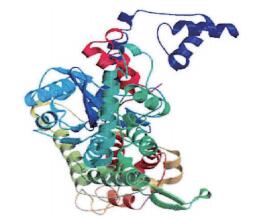
ZBED6位于ZC3H11A (Zinc finger CCCH type containing 11A)基因的第一个内含子中[3],起源于DNA转座子[4-5],ZC3H11A外显子1上游RNA聚合酶Ⅱ的结合位点构成两者共同的启动子,但ZBED6编码一个与ZC3H11A完全不同的蛋白。ZBED6由2个BED结构(即DNA结合区域)和1个hATC二聚体结构组成,通过利用分子生物学技术对ZBED6基因进行序列测定,并推测编码蛋白质的二级、三级结构以及理化性质,结果发现ZBED6基因编码区序列长度为2 943 bp,共编码980个氨基酸,相对分子质量为109 518.38,并预测得到ZBED6基因编码蛋白的三维空间结构(图 1) [6]。ZBED6基因为胎盘哺乳类动物特有,序列高度保守,该序列富含赖氨酸和精氨酸,属于核定位基因[4],经研究发现该基因在26个物种之间具有100%相似性[7]。ZBED6具有广泛的组织特异性分布,可调控IGF2在内的多种基因的表达,影响基因的转录以及细胞的增殖分化,ZBED6敲低后家猪的肌肉生长速度加快、心脏增大,皮下脂肪沉积减少。
2 ZBED6生理功能研究 2.1 调控肌肉相关基因的表达小鼠成肌细胞来源于C2C12细胞,对C2C12细胞进行染色质免疫共沉淀(Chromatin immunoprecip-itation sequence,ChIp-seq)测序后发现有2 500个ZBED6结合位点[3],为研究ZBED6调控靶基因表达的作用机制,Jiang等[7]利用小干扰RNA (Small interfering RNA,si-RNA)技术沉默小鼠肌原细胞中ZBED6的表达,结果发现IGF2表达水平上调,利用组学分析ZBED6下游靶基因,发现差异表达基因可分为3类:与肌肉蛋白、收缩纤维、心脏发育以及细胞骨架结合蛋白相关的基因;ZBED6可抑制细胞分化过程中肌管的形成,其机制是通过抑制IGF2的表达,抑制myod1和Mef2c的基因活性,myod1为成肌细胞决定基因,Mef2c可影响肌内脂肪含量以及肌纤维的类型,Mef2c还能促进肌肉相关基因的表达,因此ZBED6可抑制细胞分化过程中肌管的形成。
IGF2是重要的生长调节因子,可调控机体的生长发育,ZBED6可与IGF2内含子3区域结合,结合后可抑制IGF2的表达,为研究ZBED6-IGF2对机体生长发育的调控机制,Younis等[2]构建了ZBED6-/-小鼠模型,相对于野生型小鼠,ZBED6-/-小鼠体重增加15%,血清中IGF2浓度增加10倍左右,肌肉中IGF2表达水平上调,即ZBED6通过与IGF2结合,抑制IGF2的表达,进而导致肌肉生长速度和小鼠体重发生明显变化。
牛的生长性状由环境和数量性状决定位点(Quantitative trait loci,QTLs)共同决定,IGF2可影响肌肉的生长发育,ZBED6可抑制IGF2表达,为研究ZBED6在牛肌原细胞中的作用机制,Huang等研究了4种不同品系的9种组织器官中ZBED6和IGF2的表达情况,结果发现,ZBED6抑制IGF2活性,可促进肌原细胞的分化[8],牛中ZBED6序列发生3个自然突变后,突变型与野生型相比体重相差10%左右[9],也就是说ZBED6可影响机体中肌肉细胞的生长,进而导致体重发生明显变化。
王丹丹等[10]利用RNA Sequencing (RNA-seq)技术比较了ZBED6基因敲除巴马小型猪和同日龄正常巴马小型猪的心脏组织的转录组,发现ZBED6敲除猪的心脏重以及IGF2表达量均显著高于对照组;RNA-seq测序结合GO和IPA分析的结果表明差异基因主要富集在免疫反应、肌肉发育、肌动蛋白细胞骨架和RhoA通路等与肌肉发育密切相关的生物学通路,也就是说,ZBED6可调控心肌的生长发育。
2.2 调控胰岛细胞的增殖分化已有研究发现,在自发性糖尿病大鼠Goto-Kakizaki模型中,胰腺内缺乏IGF2/IGF1R蛋白,进而导致β细胞功能异常[12],ZBED6作为IGF2抑制因子,可能与胰岛细胞的增殖相关,为研究ZBED6对胰岛细胞发育及其功能的影响,Wang等[4]利用siRNA技术沉默β细胞中ZBED6的表达,ZBED6表达水平下调后,IGF2表达水平上调,细胞增殖率下降,胰岛素释放量增加,进而影响脂肪和蛋白质等生物大分子的合成/分解代谢;同时,ZBED6敲除后,与胰岛细胞分化相关的转录因子MafA的表达水平上调,因此,ZBED6通过与IGF2、MafA发生相互作用以调控基因的转录翻译以及大分子的生物合成,进而调控胰岛细胞的增殖、分化与凋亡。
2.3 调控结肠癌细胞的增殖分化结肠癌发展过程中,PI3K途径的成员PIK3CA/PTEN发生体细胞突变后可促进肿瘤的生长和侵袭[8-9, 11],IGF2过表达可抑制该突变[12],而ZBED6作为IGF2的抑制因子,可抑制IGF2过表达,Akhtar等[13]为研究ZBED6在人类结肠癌发展过程中的作用,敲除了人类结肠癌细胞系RKO和HCT116细胞中ZBED6基因,结果发现细胞中IGF2表达量上调,RKO细胞生长速度加快,而HCT116细胞生长速度下降,转录组学的结果表明差异表达基因主要与细胞增殖相关,但两种细胞系的变化方向不同,可能是由于ZBED6在两种细胞系中作用的靶位点不同而导致,通过实验验证得到10种基因为ZBED6直接靶基因,其中8个基因与Wnt、Hippo、TGF-β等通路相关,而Wnt、Hippo、TGF-β三种通路均可调控细胞的增殖分化,与结肠癌的发展密切相关,即ZBED6直接参与结肠癌的发展,但ZBED6在人类结肠癌发展过程中的调控作用机制有待进一步研究。
2.4 对脂肪细胞增殖分化的影响IGF2表达水平上调3倍左右,肌肉量增加3%-4%,背部脂肪沉积降低[2],因此ZBED6作为转录调节因子,可以调控家猪体内的肌肉含量与脂肪沉积。为研究ZBED6对脂肪细胞增殖分化的影响,Zhang等[14]敲低了小鼠3T3-L1前体脂肪细胞中ZBED6基因,结果发现敲低ZBED6组与对照组相比,脂滴大小、脂肪细胞大小以及细胞数目没有明显变化,与脂肪细胞分化相关基因的表达水平(CEBP/α、CEBP/β、CEBP/δ、FASN、PPARγ、SREBP-1)也没有显著性差异,以上研究结果均不能表明ZBED6/IGF2在脂肪细胞增殖分化过程中发挥作用。
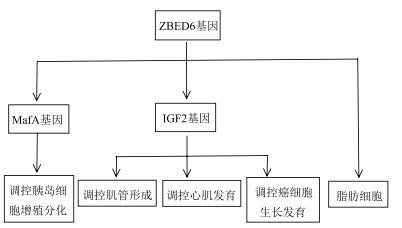
对ZBED6基因的生理功能研究表明ZBED6可抑制IGF2的表达,ZBED6与靶位点结合后调控相关基因的转录与表达,进而调节脂质、蛋白质等生物大分子的合成/分解代谢,最终影响成肌细胞、胰岛细胞、结肠癌细胞等细胞的增殖分化(图 2)。
|
| 图 2 ZBED6参与调控不同生命活动的机制 |
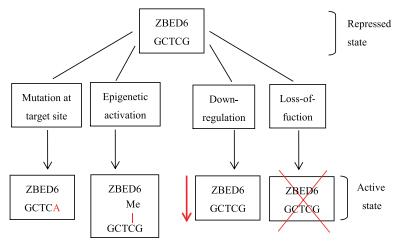
ZBED6的结合序列为5'-GCTCG-3',结合位点位于转录起始位点TSS附近5 kb以内,结合序列发生碱基突变或基因启动子区域的CPG岛发生甲基化修饰都可以影响ZBED6与靶基因的结合(图 3)。
3.1 碱基突变小鼠体内实验表明,小鼠成肌细胞中IGF2内含子3区域以及Twist2上游区域发生单碱基突变(3-G3072A)后,ZBED6的结合序列被破坏,ZBED6作为IGF2抑制因子以及Twist2激活因子,结合序列破坏后ZBED6不能与靶基因结合,导致IGF2表达量上调,Twist2基因表达量下调,电泳迁移率分析(EMSA)结果表明,ZBED6不能与突变基因结合[7]。在牛体内,ZBED6基因位于牛的16号染色体上,仅含有1个外显子,共编码980个氨基酸,Huang等[15]研究了牛的8种不同组织中ZBED6的表达水平,并鉴定了ZBED6基因的单核苷酸多态性(SNP)与基因表达和生长性状之间的关系,结果发现肌肉、心脏中ZBED6的表达水平较高;肌肉、脂肪组织中ZBED6的表达水平随年龄的增长而降低;不同组织中ZBED6发生3种不同的单碱基突变(启动子区突变-826G > A以及编码区的错义突变680C > G、1043A > G)后,ZBED6表达水平下降,而ZBED6作为IGF2抑制因子,因此IGF2表达水平升高,牛的生长速度加快。
3.2 DNA甲基化DNA甲基化是一种表观遗传学修饰,对细胞生长发育起着重要的作用,位于基因启动子区域的CPG岛发生甲基化后可影响基因的表达,一般情况下与基因沉默相关[16]。Huang等[17]研究了牛在不同发育阶段,不同组织中DNA甲基化水平与ZBED6 mRNA表达水平之间的关系,结果发现,肝、肺、脾组织中DNA甲基化水平具有明显差异,而且在DNA甲基化水平高的组织中,ZBED6 mRNA表达水平较低;同时随着年龄的增长DNA甲基化水平降低,ZBED6表达水平随之升高,DNA甲基化可调控ZBED6基因的转录和表达,肉牛中IGF2表达水平与DNA甲基化呈负相关(P < 0.05) [4]。
3.3 组蛋白修饰组蛋白修饰也是一种重要的表观遗传学修饰,可调控细胞内染色质活性及基因的转录活性,进而影响细胞的生长发育。Jiang等[7]通过ChIp-seq、RNA-seq以及GO Analysis等方法分析了小鼠肌原细胞中组蛋白修饰情况与基因表达水平之间的关系,结果发现敲低ZBED6基因的细胞与对照组细胞相比,组蛋白修饰发生了明显变化,ChIp-seq结果表明H3K4me3/H3K4me2/H3K27ac (H-组蛋白,K-赖氨酸,me-甲基化,ac-乙酰化)等组蛋白修饰在ZBED6结合位点处有显著性富集,影响ZBED6与靶基因的结合,即高水平H3K4me3/H3K4me2/H3k27ac等修饰有助于ZBED6的结合。
3.4 回文序列回文结构是指双链DNA中含有一段结构相同、方向相反的序列,当双链解开时可形成发夹结构,该结构有利于DNA与特异性结合蛋白结合,Jiang等[7]研究了ZBED6结合序列中的回文结构对ZBED6与靶基因结合的影响,在ZBED6与Twist2的结合序列中构建一段回文序列,结果发现Twist2基因表达水平下调,而小鼠成肌细胞中ZBED6作为Twist2激活因子,当结合序列中含有回文结构时可抑制靶基因的表达,因此结合序列中是否具有回文结构可决定ZBED6作为抑制因子或激活因子。
4 ZBED6基因在动物育种中的应用猪肉是膳食中蛋白质的主要来源,在我国国民经济中占有重要地位,现今利用转基因技术制备瘦肉型猪是遗传育种领域的研究热点。1999年,Pursel等[18]建立了在骨骼肌中过表达IGF-1的转基因猪模型,相对于野生型猪,转基因猪的瘦肉率升高,体脂率下降。2014年,中国农业大学利用基因同源重组技术结合转基因技术制备了肌肉抑素(Myostatin,MSTN)敲除猪以及卵泡抑素(Follistatin,FST)肌肉特异性表达的转基因猪,与野生型相比,MSTN+/-转基因猪的瘦肉率显著增加1.04%,体脂率降低4.46%;FST过表达转基因猪的瘦肉率增加3.77%,两种转基因猪都促进了骨骼肌的发育、降低了脂肪沉积,为通过基因修饰的方法培育优良的畜禽品种提供了参考和借鉴[19]。ZBED6作为一个新发现的与肌肉生长发育密切相关的转录因子,北京畜牧兽医研究所利用CRISPR/Cas9基因打靶技术构建了敲除ZBED6瘦肉型猪的动物模型,与对照组相比瘦肉率显著提高,机体各部位的脂肪含量显著降低,为我国培育优良瘦肉型猪的品种作出了贡献[20]。
2017年,党云龙[6]以辽宁绒山羊为研究对象,发现ZBED6基因可调控肌肉的生长发育,并且在不同组织中存在差异性表达和DNA甲基化修饰,而这些差异表达基因与肌肉细胞的生长分化以及代谢有着重要的关系,这也为辽宁绒山羊的育种工作提供了理论依据。
利用基因编辑技术构建ZBED6敲除/过表达的动物模型,通过组学研究得到ZBED6下游靶基因以及下游调控通路,进而明确ZBED6在机体内发挥调控作用的作用机制,为瘦肉型动物培育作出贡献。
5 总结与展望ZBED6作为一个崭新的转录调节因子,仅存在于哺乳动物体内,对机体的生长发育起着重要的调控作用。ZBED6通过与IGF2结合影响IGF2的表达水平,进而调控脂肪、蛋白质等大分子的合成/分解代谢以及肌肉的生长发育。已有研究发现ZBED6可通过抑制myod1和Mef2c等基因的表达,进而抑制细胞分化过程中肌管的形成,进而导致肌肉的生长速度和机体体重发生明显变化[2-3];王丹丹等[10]利用RNA-seq技术结合GO和IPA分析发现ZBED6的下游靶基因主要富集在与肌肉发育、肌动蛋白细胞骨架和RhoA通路等与肌肉发育密切相关的生物学通路,即ZBED6可调控心肌的生长发育;Wang等[4]发现ZBED6可通过与IGF2、MafA发生相互作用以调控基因的转录翻译以及大分子的生物合成,进而改变胰岛细胞的增殖、分化与凋亡。本文总结了ZBED6基因的生物学特性及其生理功能,以及在动物遗传育种方面的应用,为ZBED6的进一步研究提供了参考。同时,发现ZBED6与糖尿病和癌症的发展过程有着密切的联系,但是其具体的作用机制有待进一步研究。现今随着世界肥胖人口的不断增加,糖尿病的发病率不断升高,成为威胁人类健康的重要因素。而治疗糖尿病的药物也不断研究,噻唑烷二酮类药物(TZDs)如罗格列酮、吡格列酮等,属于有胰岛素敏化剂,用于治疗二型糖尿病[21],该类药物的作用机制是通过激活过氧化物酶体增殖剂激活受体(PPARγ)发挥药效[22],但其具有一定的副作用如促进脂质累积[23-24],因此新型药物的研发迫在眉睫,而ZBED6基因与糖尿病之间存在一定的联系,可通过研究ZBED6基因在糖尿病发病过程中发挥作用的机制,进而利用药物或生物学手段靶向ZBED6基因,进而达到治疗糖尿病的目的,从而改善人类健康。
| [1] |
Jeon JT, Carlborg Ö, Törnsten A, et al. A paternally expressed QTL affecting skeletal and cardiac muscle mass, in pigs maps to the IGF2 locus[J]. Nature Genetics, 1999, 21(2): 157-158. DOI:10.1038/5938 |
| [2] |
Younis S, Schönke M, Massart J, et al. The ZBED6-IGF2 axis has a major effect on growth of skeletal muscle and internal organs in placental mammals[J]. Proc Natl Acad Sci USA, 2018, 115(9): E2048. DOI:10.1073/pnas.1719278115 |
| [3] |
Markljung E, Jiang L, Jaffe JD, et al. ZBED6, a novel transcription factor derived from a domesticated DNA transposon regulates IGF2 expression and muscle growth[J]. Plos Biology, 2009, 7(12): e1000256. DOI:10.1371/journal.pbio.1000256 |
| [4] |
Wang X, Jiang L, Wallerman O, et al. Transcription factor ZBED6 affects gene expression, proliferation, and cell death in pancreatic beta cells[J]. Proc Natl Acad Sci USA, 2013, 110(40): 15997-16002. DOI:10.1073/pnas.1303625110 |
| [5] |
Huang Y, Sun Y, Li M, et al. Evaluation of the causality of the zinc finger BED-type containing 6 gene (ZBED6) for six important growth traits in Nanyang beef cattle[J]. Animal Genetics, 2015, 46(2): 225-226. DOI:10.1111/age.2015.46.issue-2 |
| [6] |
党云龙.辽宁绒山羊IGF2和ZBED6基因分子特征、表达及甲基化研究[D].沈阳: 沈阳农业大学, 2017. http://cdmd.cnki.com.cn/Article/CDMD-10157-1017123303.htm
|
| [7] |
Jiang L, Wallerman O, Younis S, et al. ZBED6 modulates the transcription of myogenic genes in mouse myoblast cells[J]. PLoS One, 2014, 9(4): e94187. DOI:10.1371/journal.pone.0094187 |
| [8] |
Samuels Y, Wang Z, Bardelli A, et al. High frequency of mutations of the PIK3CA gene in human cancers[J]. Science, 2004, 304(5670): 554. DOI:10.1126/science.1096502 |
| [9] |
Ericson K, Gan C, Cheong I, et al. Genetic inactivation of AKT1, AKT2, and PDPK1 in human colorectal cancer cells clarifies their roles in tumor growth regulation[J]. Proc Natl Acad Sci USA, 2010, 107(6): 2598-2603. DOI:10.1073/pnas.0914018107 |
| [10] |
王丹丹.利用ZBED6基因敲除猪研究瘦肉性状的分子机制[C].中国畜牧基因组产业转化高峰论坛, 2017. http://cpfd.cnki.com.cn/Article/CPFDTOTAL-PSKJ201708001009.htm
|
| [11] |
Yoshie S, Suzuki Y, Wada K, et al. Estimation of mutagenic effects of intermediate frequency magnetic field using mammalian cells[C]// General Assembly and Scientific Symposium, IEEE, 2011: 1-4. https://www.researchgate.net/publication/224263790_Estimation_of_mutagenic_effects_of_intermediate_frequency_magnetic_field_using_mammalian_cells
|
| [12] |
Calderari S, Gangnerau MN, Thibault M, et al. Defective IGF2 and IGF1R protein production in embryonic pancreas precedes beta cell mass anomaly in the Goto-Kakizaki rat model of type 2 diabetes[J]. Diabetologia, 2007, 50(7): 1463-1471. DOI:10.1007/s00125-007-0676-2 |
| [13] |
Akhtar AM, Younis S, Wallerman O, et al. Transcriptional modulator ZBED6 affects cell cycle and growth of human colorectal cancer cells[J]. Proc Natl Acad Sci USA, 2015, 112(25): 7743-7748. DOI:10.1073/pnas.1509193112 |
| [14] |
Zhang W, Cline MA, Liu D, et al. Knockdown of ZBED6 is not associated with changes in murine preadipocyte proliferation or differentiation[J]. Adipocyte, 2013, 2(4): 251-255. DOI:10.4161/adip.26028 |
| [15] |
Huang YZ, Sun YJ, Zhan ZY, et al. Expression, SNP identification, linkage disequilibrium, and haplotype association analysis of the growth suppressor gene ZBED6 in Qinchuan beef cattle[J]. Animal Biotechnology, 2014, 25(1): 35-54. DOI:10.1080/10495398.2013.814572 |
| [16] |
Chuang JC, Jones PA. Epigenetics and microRNAs[J]. Pediatric Research, 2007, 61(5 Pt 2): 17R. |
| [17] |
Huang YZ, Zhang ZJ, He H, et al. Correlation between ZBED6 Gene Upstream CpG Island methylation and mRNA expression in cattle[J]. Animal Biotechnology, 2017, 28(2): 104-111. DOI:10.1080/10495398.2016.1212060 |
| [18] |
Pursel VG, Wall RJ, Mitchell AD, et al. Expression of insulin-like growth factor-I in skeletal muscle of transgenic swine[J]. Transgenic Animals in Agriculture, 1999, 131-144. |
| [19] |
畅飞. Myostatin基因敲除猪与Follistatin转基因猪骨骼肌发育的相关研究[D].北京: 中国农业大学, 2014. http://cdmd.cnki.com.cn/Article/CDMD-10019-1016045481.htm
|
| [20] |
Butter F, Kappei D, Buchholz F, et al. A domesticated transposon mediates the effects of a single-nucleotide polymorphism responsible for enhanced muscle growth[J]. Embo Reports, 2010, 11(4): 305-311. DOI:10.1038/embor.2010.6 |
| [21] |
Colca JR, Kletzien RF. What has prevented the expansion of insulin sensitisers?[J]. Expert Opinion on Investigational Drugs, 2006, 15(3): 205. DOI:10.1517/13543784.15.3.205 |
| [22] |
Soccio RE, Chen ER, Lazar MA. Thiazolidinediones and the promise of insulin sensitization in Type 2 diabetes[J]. Cell Metabolism, 2014, 20(4): 573-591. DOI:10.1016/j.cmet.2014.08.005 |
| [23] |
Halberg N, Wernstedt I, Scherer PE. The adipocyte as an endocrine cell[J]. Endocrinology & Metabolism Clinics of North America, 2008, 37(3): 753-768. |
| [24] |
Rieraguardia N, Rothenbacher D. The effect of thiazolidinediones on adiponectin serum level: a meta-analysis[J]. Diabetes Obesity & Metabolism, 2008, 10(5): 367-375. |