2. 中国科学院近代物理研究所,兰州 730030
2. Institute of Modern Physics, Chinese Academy of Sciences, Lanzhou 730030
随着全球工业化的发展,能源、信息和材料在技术和产业结构上已经达到了巅峰,伴随而来的是能源匮乏和环境恶化[1]。研究显示,预计2020年全球70%的能源来自石油,其余的30%为天然气和新能源。如何降低石油在能源中的比例,以及增加新能源的产出备受关注[2]。冶金、采矿、化肥和农药的使用都会带来环境污染,在环境污染中尤其以重金属污染最为严重[3]。重金属污染是指密度由5或5以上的金属及金属化合物引起的污染,常见的引起环境污染的重金属有镉、铅、铬、汞、镍、铜、锌和锰等[4]。
重金属污染不仅会降低土壤的生长性能,也可通过食物链进入动物体中,降低动物的生产性能。因此,修复重金属污染的土壤极其关键。常规的土壤污染修复因其对土壤破坏力大,价格昂贵等逐渐退出了人们的视线。
生物修复是一种新型的土壤污染修复技术,因其成本低廉,对土壤破坏力小,安全性高、可进行原位实施等在最近几年受到了越来越多的关注[5]。通常用于生物修复的植物有印度芥菜(Brassica juncea L.)、天蓝遏蓝菜(Thlaspi caerulescens)、向日葵(Helianthus annuus)、柳树(Salix babylonica)和杨树(Populus)等[6]。研究表明,用于重金属污染修复的超富集植物往往具有植株矮小、生长速度慢及生物量小等缺点[7-8]。近年来,高生物量植物尤其是绿色能源植物,越来越多的用于重金属污染土壤的修复。
甜高粱是国际公认的能源植物,与其他能源植物相比,甜高粱除了具有抗逆、抗旱、耐涝、耐贫瘠、耐盐碱等特性外,还具有生长快、生物产量高、易收割及机械化操作简单等优势[9]。
甜高粱庞大的根系对土壤中重金属有很强的吸收作用,是重金属吸收和储存的主要器官,Pb和Cd等重金属主要储存在根中。因此,利用高粱对重金属富集能力和转移能力,可以吸收土壤中的重金属,达到修复土壤的目的[10]。植物对重金属抗性的获得有避性与耐性两种途径,耐性又具有两条基本途径:排斥与富集,排斥机制中,植物通过减少根系吸收和向地上部运输来降低重金属含量;富集机制则是重金属在植物体内以不具生物活性的大分子形式存在[11-12]。
甜高粱对不同重金属吸收能力存在较大差异。研究表明,甜高粱对汞(Hydrargyrum,Hg)、镉(Cadmium,Cd)、锰(Manganese,Mn)、锌(Zinc,Zn)和镍(Nickel,Ni)的吸收作用显著,但对钴(Cobalt,Co)、铬(Chromium,Cr)、铅(Lead,Pb)和铜(Copper,Cu)的吸收作用相比其他作物不是特别显著[13]。甜高粱对Hg、Cd、Zn、Mn和Ni的吸收随着土壤中重金属的含量高低而变化,土壤中较高的含量有利于甜高粱的吸收和在植株中的积累,可能是这几种重金属在甜高粱根内较易向地上部分转移,将其富集在叶片和茎秆中;甜高粱对土壤中Co、Cr、Pb和Cu的吸收与土壤中的重金属含量关系较小,大部分被集中在植物的根部,甜高粱对这几种重金属的吸收和积累达到一定量后就不再增加,向地上部分的转移受到限制。可见,对重金属的耐性机理主要是排斥机制,对这几种重金属没有吸收和积累作用,而是靠根的渗透压及维管束的输送功能进入植株内[14-15]。
目前国内综述大多阐述甜高粱对镉的吸收、积累和转运或镉胁迫下甜高粱的生理生化机理,而对于整个过程的报道相对较少。
本文综述甜高粱在重金属镉胁迫下的生理生化机制,其中生理生化机制主要是萌发率、抗氧化酶活性、光合速率、叶片超微结构、微量元素吸收的变化。而甜高粱对重金属镉的耐受性及分子机理。耐受性主要是的外排、螯和及液泡区室化。分子机理主要依赖谷胱甘肽途径的调节,晚期胚胎丰富蛋白和自然抗性相关巨噬蛋白的表达。此外,甜高粱对重金属镉的吸收积累和转运相关的蛋白,将甜高粱用于重金属污染土壤的生物修复和生物质产能结合起来。
1 甜高粱甜高粱[Sorghum bicolor (L.) Moench]起源于干旱、炎热、土壤贫瘠的非洲大陆,是全世界广泛栽培的作物品种,抗旱、耐捞、耐盐碱、生物质资源丰富,并且是太阳能转换效率最高的作物之一,水分利用效率最高的作物之一,是一种理想的生物能源作物[16]。甜高粱生物量大,株高可达2-5 m,每公顷可收获3-6 t的种子,45-75 t的秸秆,茎秆糖锤度一般为16%-22%,可产糖约6-9 t,秸秆用于发酵生产生物乙醇,既可以解决能源危机,也可以将土壤中的重金属转移到植物中,避免了植物中的重金属难以处理而造成的二次污染[17]。此外,甜高粱还具有生育周期短,可在一年内收获2季,甚至3季。适合边际性土壤的种植,机械化操作简单等优势。
2 甜高粱在镉胁迫下的生理生化机制 2.1 重金属镉对种子萌发和幼苗的影响种子萌发是种子经过吸胀作用吸水,贮藏物水解并运输到生长部位的过程。镉胁迫下甜高粱种子的萌发率降低可能是由于植物细胞中的核酸合成的减少[18]。An等[19]的研究表明种子的萌发率对镉的毒性不敏感。更进一步的研究表明高粱可以耐受0.5 mmol/L的镉,当镉浓度大于3 mmol/L时种子萌发会受到不可逆的影响,而幼苗则会出现生长停滞的现象[20]。刘大林等[21]的研究结果与Kuriakose等[20]类似,低浓度的镉促进高粱的生长,高浓度的镉明显抑制生长。丁氏清茶比较了两个甜高粱品系,低浓度镉可以促进幼苗的生长,当镉浓度大于25 mg/kg抑制幼苗的生长,主要表现为株高明显降低[22]。总结以上研究结果,低浓度镉不但刺激种子的萌发而且促进幼苗的生长,高浓度抑制种子的萌发和幼苗的生长。
2.2 重金属镉对抗氧化酶活的影响植物在遭受重金属镉胁迫时会产生活性氧,如O2-、H2O2和OH-等,抗氧化酶主要负责清除植物体内过多的自由基,发挥清道夫的功能[23]。刘大林的研究表明,轻度镉胁迫主要是超氧化物歧化酶(Superoxide dismutase,SOD)和过氧化物酶(Peroxidase,POD)发挥抗氧化功能,中度镉胁迫主要依靠过氧化氢酶(Catalase,CAT)进行抗氧化应答,然而高浓度镉胁迫由谷胱甘肽(Glutathione,GSH)来进行抗氧化应答。外源施加谷胱甘肽可以降低镉对植物的毒效应,施加硫可以降低镉对甜高粱根系的毒效应,提高POD的活性[24-26]。
2.3 重金属对光合参数的影响在重金属镉胁迫下,植物的光合速率显著降低。刘大林研究显示镉浓度与叶绿素合成呈正相关,Soudek等[27]证明茎中的重金属镉导致叶绿素a/叶绿素b (Chl a / b,Chlorophyll a/Chlorophyll b)比例增加,丁氏清茶的研究结果与上述类似[22-24]。丁氏清茶发现低浓度镉对净光合速率(Net photosynthesis rate,Pn)没有影响,高浓度镉可明显降低其值。高浓度镉导致叶绿素含量损失,并最终导致叶片的萎黄。镉胁迫降低叶绿素含量,损伤光合系统,减少二氧化碳(Carbondioxide,CO2)的吸收,干扰气孔的开放。因此降低了植物的光合速率[27],增加了胞间CO2浓度。这可能是由于重金属与呼吸作用相关的酶结合,导致呼吸作用降低,积累了更多的CO2,最终导致胞间CO2浓度的升高,蒸腾速率对不同浓度的镉不敏感。
2.4 重金属镉对超微结构的影响在植物毒性症状表现出来之前,亚细胞水平已经有明显的变化。叶绿体双层膜结构消失,内囊体散乱,随着受害程度的加剧,核糖体消失,核仁核膜解体。在电镜下发现,镉浓度在一定范围内,刺激根毛的生长,超出临界值根毛密度降低[20]。镉可以使叶肉细胞内的淀粉粒变大,叶绿体变得狭长,叶绿体内的基粒片层膜排列紊乱,最终导致细胞壁增厚[28]。引起基粒片层膜上的酶的数量减少,这也是引起光合速率下降的一个原因。根尖内皮层细胞变成了镰刀状,后生木质部数量明显下降[29]。这是因为根的发育方式是内始式,最先成熟的是原生木质部;其次是后生木质部。这些结果表明镉可以延迟根的发育。
2.5 镉对微量元素吸收的的影响微量元素是植物需要量极少,但对于植物的生长发育必不可少一类元素。重金属镉胁迫影响甜高粱对于微量元素的吸收。0.5 mmol/L处理可以显著增加甜高粱根对铁和铜的吸收,根对锌和锰的吸收没有显著变化,茎中的锌和锰含量降低。在茎和根中钙的含量均增加,然而镁吸收会降低[24]。
3 甜高粱对重金属镉的耐受性及分子机理通常植物对重金属镉的耐受分为细胞内部耐受和外排机理,植物通过外排机理排出镉,避免了镉在细胞内的积累。而内部耐受机制主要是镉离子与有机配体的结合,形成镉-植物螯合素大分子,缓解了镉对植物的毒效应。
3.1 外排机理(转运:从胞内到胞外的转运)通过根际进入植物细胞的重金属经细胞膜转运蛋白排出细胞,降低了重金属对植物细胞的毒性。常见的重金属外排蛋白有黄色条状蛋白(Yellow stripe 1-like,YSL)、重金属ATP酶4 (Heavy metal atpase 4,HMA4)、植物镉抗性蛋白1 (Plant Cadmium Resistance 1,PCR1)、植物镉抗性蛋白2 (Plant Cadmium Resistance 2,PCR2)和多效性耐药性蛋白8 (Pleiotropic drug resistance 8,PDR8) [30-31]。
3.2 重金属的螯合进入细胞膜的重金属首先与高亲和力的配体螯合胞质中的金属如氨基酸、有机酸、植物螯合素和金属硫蛋白。螯合金属离子的氨基酸和有机酸包括组氨酸、半胱氨酸、烟草胺(Nicotinamide,NA)、柠檬酸和苹果酸,所有这些在金属耐受性中发挥重要作用[32]。
目前,最常见的植物螯合素是一种生物小分子,谷胱甘肽和植物螯合剂,谷胱甘肽不仅是一种植物螯合剂,而且具有抗氧化、抗还原和促进植物生长发育的功能。还原性的谷胱甘肽是植物螯合剂的合成前体,在镉和其他重金属的胁迫下,与植物鳌合剂结合形成复合体,然后运输进入液泡,积累在液泡中,降低了重金属的毒性,增加了植物的耐受性[33]。
3.3 液泡区室化重金属液泡区室化是指进入细胞质的重金属,经过液泡膜转运蛋白进入液泡中,在液泡中完成重金属的解毒。或者进入细胞质的重金属与植物螯合剂结合形成复合物,经液泡膜特定的转运蛋白进入植物液泡,区室化隔离,液泡区室化是植物体内重金属稳态的关键[34]。复合物的转运它依赖于液泡膜转运蛋白,重金属进入液泡依赖两种转运蛋白液泡氢离子ATP转运体(Vacuolar H+ transporting ATPase,V-AT-Pase)和液泡H+无机焦磷酸酶转运体(Vacuolar H+ transporting inorganic pyrophosphatase,V-PPase),非重金属富集植物液泡区室化主要在根细胞,然而重金属超积累植物液泡区室化在叶片细胞中完成[35-36]。
3.4 耐受性分子机理目前为止,植物对镉耐受性的分子机理研究主要集中在模式植物拟南芥、小麦和水稻中,对甜高粱的研究较少。陈建等[37]构建了拟南芥β-甘露聚糖酶(XVE system-induced cadmium-tolerance 1,xcd1-D)突变体,超表达可以增加拟南芥对镉的耐受性,进一步的研究表明镉的耐受性增加依赖于谷胱甘肽途径的调节,这一结论与在甜高粱和杨树中外源施加谷胱甘肽可增加镉的耐受性结论类似[37-38]。晚期胚胎丰富蛋白(Late embryogenesis abundant,LEA)参与植物生长发育的不同阶段,可以增加植物对不良环境的适应能力[39],在水稻中超表达该基因可以增加水稻对重金属的耐受性[40]。
近年来,随着分子生物学技术的迅速发展,尤其是转录组学、功能基因组学和蛋白组学的兴起,为揭示甜高粱耐镉的分子机理提供了可能。李银心比较了96个甜高粱品系对镉的吸收积累转运能力,并选择了高抗镉品系(H18)和低抗镉品系(L69)进行转录组学比较,甜高粱自然抗性相关的巨噬蛋白5 (Sorghum bicolor natural resistance associated macrophage protein5,SbNramp5)基因的表达分别上调4倍和1.5倍。这一结果与之前大麦中自然抗性相关的巨噬蛋白5 (Hordeum vulgare natural resistance associated macrophage protein5,HvNramp5)基因的功能类似,尽管它表现出对镉、锰的转运能力,但其表达不受镉的影响[41-42]。最近对Nramp5基因的研究是在籼稻中,利用CRISPR/Cas9敲除籼稻自然抗性相关的巨噬蛋白5 (Oryza sativa natural resistance associated macrophage protein5,OsNramp5)基因,显著降低了籼稻根和茎中的镉含量,而不影响籼稻产量。更进一步验证了Nramp5是籼稻镉转运的特异性基因[43]。韩国忠北大学的研究人员分别用100 µmol/L和150 µmol/L处理10 d大小的甜高粱幼苗,利用二维凝胶电泳技术,出现了33个差异表达的蛋白,它们参与了碳固定,ATP合成、蛋白质的合成过程,但是关于甜高粱耐受镉的分子机理还需要进一步的探索[44]。
虽然,一些植物已经用进化多种途径来吸收Cd的策略,但调控Cd耐受的机制还不完全清楚[45]。
4 甜高粱对镉的吸收、积累和转运机理 4.1 甜高粱对重金属镉的吸收和积累植物对重金属镉的吸收主要分为以下几步:重金属富集在根际周围,从而吸附到根际表面;重金属通过细胞膜进入到根细胞;进入根细胞的重金属被固定在液泡中;胞间移动的重金属通过细胞膜进入到木质部;重金属从木质部转运进入地上部分[46]。
通过根际进入植物的重金属主要积累在植物的根中,但是会有一部分镉通过木质部装载进入韧皮部,运输进入茎和叶。Soudek等[27]研究表明:镉和锌的积累主要是在甜高粱植物的根中。外源施加谷胱甘肽可以增加镉在根中的积累同时也可以提高茎中的镉浓度。丁氏清茶比较了两个品系对镉的积累顺序为:根部 > 茎部 > 老叶片 > 新叶片 > 种子,镉优先积累在低节间,越往上镉积累量越少[22]。植物对不同重金属的积累能力大小存在差异。能源草对不同重金属在茎中的积累顺序:Zn > Cd~Cu > Ni > Pb[47]。外源施加乙二胺四乙酸(Ethylene diamine tetraacetic acid,EDTA)可以增加植物的生长参数和铜的转运效率,但是并不能够增加铜在植物体内的积累[48]。
4.2 重金属镉的转运重金属从根到茎的转运,或者从木质部到韧皮部的转运主要有两种途径,质外体途径和共质体途径,镉积累的代谢阻遏物处理或低温条件下只有质外体途径转运,常温下既可以进行质外体转运,也可以进行共质体转运。共质体转运需要借助细胞膜上的转运蛋白,常见的胞膜重金属转运蛋白分为两类(图 1)。
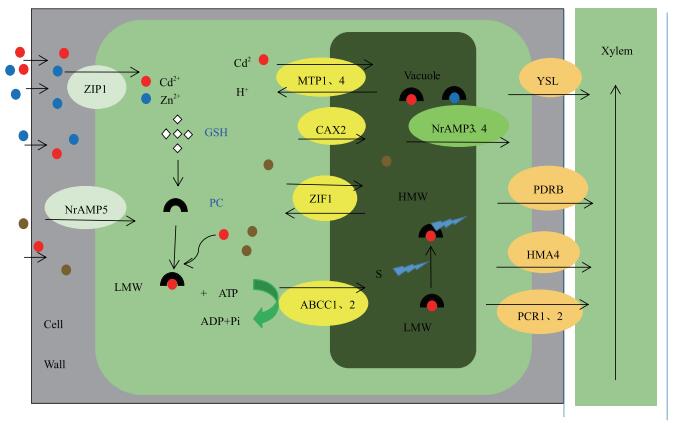
|
| 图 1 植物对重金属的转运 |
第一类为锌铁离子转运蛋白(Zinc-regulated transporter and iron-regulated transporter protein,ZIP),可以转运Zn2+、Cd2+、Fe2+和Mn2+二价阳离子[49]。
第二类细胞膜转运蛋白为Nramp转运家族,可以转运Zn2+、Cd2+、Fe2+、Mn2+、Cu2+、Ni2+和Co2+[43, 50]。
进入植物根际细胞的重金属,一部分进入液泡,液泡区室化完成重金属的解毒。另外的一部分重金属装载进入木质部,完成从地下部分(根)到地上部分的转运。参与木质部装载的蛋白主要分为以下几类:
第一类YSL蛋白转运家族,主要转运在细胞质中与尼克酰胺结合的金属阳离子,包括Ni2+、Fe2+、Fe3+。最近在水稻中的研究:OsYSL9可以转运NA-Fe2+和Fe3+脱氧麦根酸进入维管组织[31, 51]。
第二类HMA4,属于P型三磷酸腺苷酶(P1B-ATPase)家族成员,在拟南芥中该家族有8个成员AtHMA1-AtHMA8,它们的结构、功能各不相同,但都与重金属的转运和稳态相关。HMA4主要功能是转运镉和锌进入木质部[52]。
第三类PCR1/2,在拟南芥中的研究表明PCR2参与锌的再分配和解毒,在pcr2突变体的根中可以积累更多的锌,超表达则会降低锌在根中的积累。PCR2主要定位于表皮细胞和幼根的木质部,而在高度分化的表皮细胞的根部表达。然而,拟南芥中的研究结果显示AtPCR1参与钙的转运[53-54]。
5 甜高粱用于重金属污染土壤的修复土壤重金属污染越来越严重,随着科学技术的的发展和时代的进步,常规的土壤污染修复技术因其成本高昂、对土壤破坏力大等逐渐退出了人们的视线。生物修复是利用植或作物对环境中的重金属进行吸附的一种新型的土壤污染修复技术。其优点对土壤破坏力小,原位实施,可以大规模进行修复。将甜高粱用于生物修复,汁液发酵生产生物乙醇,废弃的秸秆可以燃烧发电,从灰分中收集重金属镉,不仅能解决能源危机,而且能修复环境(图 2)。本文综述了近年来重金属胁迫对甜高粱的生理生化、甜高粱对重金属的耐受性分子机理、以及甜高粱重金属的吸收积累转运能力。为后期甜高粱在重金属污染地区的修复奠定基础,引领环境修复行业向绿色可持续发展的方向迈进。
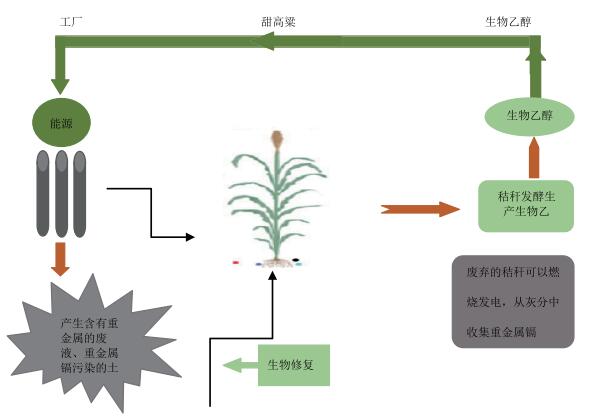
|
| 图 2 甜高粱用于重金属镉污染土壤的修复 |
随着重金属镉污染土地面积的日益扩大和镉中毒事件的频繁发生,修复镉污染的土壤势在必行。深入研究甜高粱对镉的吸收积累转运机理显得极其重要;另一方面,阐明镉超积累植物的耐性与解毒机制,可以分离并克隆镉超积累的功能基因,培育高效的修复植物,为镉污染土壤的修复提供理想材料。为实现以上目标,还需从以下几个方面进行深入探讨。
6.1 甜高粱对镉的转运能力的研究目前来说甜高粱对镉的吸收能力因品种的不同而存在较大的差异,虽然已经筛选出了吸镉能力较强的甜高粱品种,但甜高粱对镉的转运能力相对较差。因此,培育高效转运镉的甜高粱,仍然需要我们共同的努力。
6.2 甜高粱遗传转化体系的建立小麦、水稻已经建立了一套完整的遗传转化体系,甜高粱遗传转化体系并未完全建立,即使利用土壤农杆菌可以进行遗传转化,但遗传转化率很低。因此,完善高粱的遗传转化体系,为培育高效修复镉污土壤的甜高粱具有现实意义。
6.3 废弃秸秆的处理含有重金属镉的甜高粱,汁液可以用来发酵生产生物乙醇,废弃的秸秆可以燃烧发电,从灰分中收集重金属镉,防止秸秆中镉对环境的二次污染。
6.4 发酵车间的利用效率甜高粱汁液用来发酵生产生物乙醇,但由于北方甜高粱的成熟期集中在9-10月,其他月份车间处于停滞状态,因此,发酵车间利用效率很低。
6.5 结合其它修复技术生物修复虽有成本低廉,可进行原位修复等优点。但通常只适用于中低浓度重金属污染的土壤修复,因此可以结合其他修复技术综合修复。这样,不仅可以降低对土壤的破坏力,而且可以改良土壤的生长性能。
| [1] |
段光正.能源革命: 本质探究及中国的选择方向[D].郑州: 河南大学, 2016. http://cdmd.cnki.com.cn/Article/CDMD-10475-1016202814.htm
|
| [2] |
徐枫, 唐镭. 节能减排背景下广东能源结构优化及对策研究[J]. 科技管理研究, 2015, 35(15): 233-239. DOI:10.3969/j.issn.1000-7695.2015.15.044 |
| [3] |
宋伟, 陈百明, 刘琳. 中国耕地土壤重金属污染概况[J]. 水土保持研究, 2013, 20(2): 93-298. |
| [4] |
Krämer U. Metal hyperaccumulation in plants[J]. Annual Review of Plant Biology, 2010, 61: 517-534. DOI:10.1146/annurev-arplant-042809-112156 |
| [5] |
Shukla S, Felderhoff TJ, Saballos A, et al. The relationship between plant height and sugar accumulation in the stems of sweet sorghum (Sorghum bicolor (L.) Moench)[J]. Field Crops Research, 2017, 203: 181-191. DOI:10.1016/j.fcr.2016.12.004 |
| [6] |
王海慧, 恒福, 罗瑛, 等. 土壤重金属污染及植物修复技术[J]. 中国农学通报, 2009, 25(11): 210-214. |
| [7] |
Bauddh K, Singh K, Singh B, et al. Ricinus communis: a robust plant for bio-energy and phytoremediation of toxic metals from contaminated soil[J]. Ecological Engineering, 2015, 84: 640-652. DOI:10.1016/j.ecoleng.2015.09.038 |
| [8] |
Nwaichi EO, Colin SE. Sequestration of PAHs in a phytoremediation using indian mustard and ambara plants[J]. Journal of Biotechnology Research, 2017, 3(5): 31-41. |
| [9] |
高华晨, 钱雪冬, 白露, 等. 国内五个甜高粱主栽品种生理生化指标的比较研究[J]. 湖北农业科学, 2017, 56(19): 3621-3623. |
| [10] |
Díaz-Nava LE, Montes-Garcia N, Domínguez JM, et al. Effect of carbon sources on the growth and ethanol production of native yeast Pichia kudriavzevii ITV-S42 isolated from sweet sorghum juice[J]. Bioprocess and Biosystems Engineering, 2017, 40(7): 1069-1077. DOI:10.1007/s00449-017-1769-z |
| [11] |
Zhuang P, Wensheng SHU, Zhian LI, et al. Removal of metals by sorghum plants from contaminated land[J]. Journal of Environmental Sciences, 2009, 21(10): 1432-1437. DOI:10.1016/S1001-0742(08)62436-5 |
| [12] |
Cobbett CS. Phytochelatins and their roles in heavy metal detoxification[J]. Plant Physiol, 2000, 123(3): 825-832. DOI:10.1104/pp.123.3.825 |
| [13] |
籍贵苏, 永路, 吕芃, 等. 不同高粱种质对污染土壤中重金属吸收的研究[J]. 中国生态农业学报, 2014, 22(2): 185-192. |
| [14] |
张玉秀, 于飞, 张媛雅, 等. 植物对重金属镉的吸收转运和累积机制[J]. 中国生态农业学报, 2008(5): 1317-1321. |
| [15] |
Pan F, Luo S, Shen J, et al. The effects of endophytic bacterium SaMR12 on Sedum alfredii Hance metal ion uptake and the expression of three transporter family genes after cadmium exposure[J]. Environmental Science and Pollution Research, 2017, 24(10): 9350-9360. DOI:10.1007/s11356-017-8565-9 |
| [16] |
董喜存. 碳离子束辐照诱导的甜高粱早熟突变体KTJT-1的田间评价[J]. IMP & amp; HIRFL Annual Report, 2009(0): 127-128. |
| [17] |
马淑敏, 孙振钧, 王冲. 蚯蚓-甜高粱复合系统对土壤镉污染的修复作用及机理初探[J]. 农业环境科学学报, 2008(1): 133-138. DOI:10.3321/j.issn:1672-2043.2008.01.023 |
| [18] |
崔永行, 范仲学, 杜瑞雪, 等. 镉胁迫对甜高粱种子萌发的影响[J]. 华北农学报, 2008(S1): 140-143. DOI:10.7668/hbnxb.2008.S1.035 |
| [19] |
An YJ. Soil ecotoxicity assessment using cadmium sensitive plants[J]. Environmental Pollution, 2004, 127(1): 21-26. DOI:10.1016/S0269-7491(03)00263-X |
| [20] |
Kuriakose SV, Prasad MNV. Cadmium stress affects seed germination and seedling growth in Sorghum bicolor (L.) Moench by changing the activities of hydrolyzing enzymes[J]. Plant Growth Regulation, 2008, 54(2): 143-156. DOI:10.1007/s10725-007-9237-4 |
| [21] |
Liu DL, Hu KQ, Ma JJ, et al. Effects of cadmium on the growth and physiological characteristics of sorghum plants[J]. African Journal of Biotechnology, 2011, 10(70): 15770-15776. |
| [22] |
丁氏清茶.甜高粱在重金属镉胁迫下的生理反应和基因鉴定[D].重庆: 西南大学, 2016. http://cdmd.cnki.com.cn/Article/CDMD-10635-1016908998.htm
|
| [23] |
林宇丰, 李魏, 戴良英. 抗氧化酶在植物抗旱过程中的功能研究进展[J]. 作物研究, 2015, 29(3): 326-330. DOI:10.3969/j.issn.1001-5280.2015.03.26 |
| [24] |
Liu DL, Zhang SP, Zheng C, et al. Soil cadmium regulates antioxidases in sorghum[J]. Agricultural Sciences in China, 2010, 9(10): 1475-1480. DOI:10.1016/S1671-2927(09)60240-6 |
| [25] |
Suzuki N, Koizumi N, Sano H. Screening of cadmium-responsive genes in Arabidopsis thaliana[J]. Plant, Cell & Environment, 2001, 24(11): 1177-1188. |
| [26] |
马伊馨, 徐宗国, 陈春, 等. 镉胁迫下硫对甜高粱幼苗根系形态和生理特性的影响[J]. 延安大学学报:自然科学版, 2016, 35(4): 84-88. |
| [27] |
Soudek P, Petrová Š, Vaňková R, et al. Accumulation of heavy metals using Sorghum sp[J]. Chemosphere, 2014, 104: 15-24. DOI:10.1016/j.chemosphere.2013.09.079 |
| [28] |
Jia W, Lv S, Feng J, et al. Morphophysiological characteristic analysis demonstrated the potential of sweet sorghum (Sorghum bicolor (L.) Moench) in the phytoremediation of cadmium-contaminated soils[J]. Environmental Science and Pollution Research, 2016, 23(18): 18823-18831. DOI:10.1007/s11356-016-7083-5 |
| [29] |
Feng J, Jia W, Lv S, et al. Comparative transcriptome combined with morpho-physiological analyses revealed key factors for differential cadmium accumulation in two contrasting sweet sorghum genotypes[J]. Plant Biotechnology Journal, 2017, 16: 558-571. |
| [30] |
Song WY, Choi KS, Geisler M, et al. Arabidopsis PCR2 is a zinc exporter involved in both zinc extrusion and long-distance zinc transport[J]. Plant Cell, 2010, 22(7): 2237-2252. DOI:10.1105/tpc.109.070185 |
| [31] |
Gendre D, Czernic P, Conéjéro G, et al. TcYSL3, a member of the YSL gene family from the hyper-accumulator Thlaspi caerulescens, encodes a nicotianamine-Ni/Fe transporter[J]. Plant J, 2007, 49(1): 1-15. |
| [32] |
Wycisk K, Kim EJ, Schroeder JI, et al. Enhancing the first enzymatic step in the histidine biosynthesis pathway increases the free histidine pool and nickel tolerance in Arabidopsis thaliana[J]. FEBS Letters, 2004, 578(1-2): 128-134. DOI:10.1016/j.febslet.2004.10.086 |
| [33] |
Gallego SM, Pena LB, Barcia RA, et al. Unravelling cadmium toxicity and tolerance in plants: Insight into regulatory mechanisms[J]. Environmental & Experimental Botany, 2012, 83(5): 33-46. |
| [34] |
Tong YP, Kneer R, Zhu YG. Vacuolar compartmentalization: a second-generation approach to engineering plants for phytoremediation[J]. Trends in Plant Science, 2004, 9(1): 7-9. DOI:10.1016/j.tplants.2003.11.009 |
| [35] |
Kabała K, Janicka-Russak M, Reda M, et al. Transcriptional regulation of the V-ATPase subunit c and V-PPase isoforms in Cucumis sativus under heavy metal stress[J]. Physiologia Plantarum, 2014, 150(1): 32-45. DOI:10.1111/ppl.2014.150.issue-1 |
| [36] |
Emamverdian A, Ding Y, Mokhberdoran F, et al. Heavy metal stress and some mechanisms of plant defense response[J]. The Scientific World Journal, 2015, 2015: 1-18. |
| [37] |
Chen J, Yang L, Gu J, et al. MAN3 gene regulates cadmium tolerance through the glutathione-dependent pathway in Arabidopsis thaliana[J]. New Phytol, 2015, 205(2): 570-582. DOI:10.1111/nph.13101 |
| [38] |
He J, Li H, Ma C, et al. Overexpression of bacterial γ-glutamylcysteine synthetase mediates changes in cadmium influx, allocation and detoxification in poplar[J]. New Phytol, 2015, 205(1): 240-254. DOI:10.1111/nph.13013 |
| [39] |
Hundertmark M, Hincha DK. LEA (late embryogenesis abundant) proteins and their encoding genes in Arabidopsis thaliana[J]. BMC Genomics, 2008, 9(1): 118. DOI:10.1186/1471-2164-9-118 |
| [40] |
Hu T, Zhu S, Tan L, et al. Overexpression of OsLEA4 enhances drought, high salt and heavy metal stress tolerance in transgenic rice (Oryza sativa L.)[J]. Environmental and Experimental Botany, 2016, 123: 68-77. DOI:10.1016/j.envexpbot.2015.10.002 |
| [41] |
Jia W, Miao F, Lv S, et al. Identification for the capability of Cd-tolerance, accumulation and translocation of 96 sorghum genotypes[J]. Ecotoxicology and Environmental Safety, 2017, 145: 391-397. DOI:10.1016/j.ecoenv.2017.07.002 |
| [42] |
Wu D, Yamaji N, Yamane M, et al. The HvNramp5 transporter mediates uptake of cadmium and manganese, but not iron[J]. Plant physiology, 2016, 172(3): 1899-1910. DOI:10.1104/pp.16.01189 |
| [43] |
Tang L, Mao B, Li Y, et al. Knockout of OsNramp5 using the CRISPR/Cas9 system produces low Cd-accumulating indica rice without compromising yield[J]. Scientific Reports, 2017, 7(1): 14438. DOI:10.1038/s41598-017-14832-9 |
| [44] |
Roy SK, Cho SW, Kwon SJ, et al. Morpho-physiological and proteome level responses to cadmium stress in sorghum[J]. PLoS One, 2016, 11(2): 1-27. |
| [45] |
DalCorso G, Farinati S, Furini A. Regulatory networks of cadmium stress in plants[J]. Plant Signaling & Behavior, 2010, 5(6): 663-667. |
| [46] |
Manara A. Plant responses to heavy metal toxicity[M]// Plants and heavy metals. Italy: Dordrecht, 2012: 27-53.
|
| [47] |
Sipos G, Solti Á, Czech V, et al. Heavy metal accumulation and tolerance of energy grass (Elymus elongatus subsp. ponticus cv. Szarvasi-1) grown in hydroponic culture[J]. Plant Physiol Biochem, 2013, 68: 96-103. DOI:10.1016/j.plaphy.2013.04.006 |
| [48] |
Székely Á, Poór P, Bagi I, et al. Effect of EDTA on the growth and copper accumulation of sweet sorghum and sudangrass seedlings[J]. Acta Biologica Szeged, 2011, 55: 159-164. |
| [49] |
Plaza S, Tearall KL, Zhao FJ, et al. Expression and functional analysis of metal transporter genes in two contrasting ecotypes of the hyperaccumulator Thlaspi caerulescens[J]. J Exp Bot, 2007, 58(7): 1717-1728. DOI:10.1093/jxb/erm025 |
| [50] |
Nevo Y, Nelson N. The NRAMP family of metal-ion transporters[J]. Biochimica et Biophysica Acta (BBA) -Molecular Cell Research, 2006, 1763(7): 609-620. DOI:10.1016/j.bbamcr.2006.05.007 |
| [51] |
Senoura T, Sakashita E, Kobayashi T, et al. The iron-chelate transporter OsYSL9 plays a role in iron distribution in developing rice grains[J]. Plant Mol Biol, 2017, 95(4-5): 375-387. DOI:10.1007/s11103-017-0656-y |
| [52] |
Williams LE, Mills RF. P1B-ATPases-an ancient family of transition metal pumps with diverse functions in plants[J]. Trends in Plant Science, 2005, 10(10): 491-502. DOI:10.1016/j.tplants.2005.08.008 |
| [53] |
Zeng L, Zhu T, Gao Y, et al. Effects of Ca addition on the uptake, translocation, and distribution of Cd in Arabidopsis thaliana[J]. Ecotoxicology and Environmental Safety, 2017, 139: 228-237. DOI:10.1016/j.ecoenv.2017.01.023 |
| [54] |
Lin YF, Aarts MGM. The molecular mechanism of zinc and cadmium stress response in plants[J]. Cellular and Molecular Life Sciences, 2012, 69(19): 3187-3206. DOI:10.1007/s00018-012-1089-z |




