曲霉(Aspergillus spergillus)是最常见且具有重要应用价值的丝状真菌, 在自然界的空气、土壤、水以及作物上都可以发现其存在, 目前已广泛地应用在传统酿造业、生物工程研究和现代发酵等。杂色曲霉(A.versicolor)是世界性广泛分布种, 也是我国最常见的曲霉之一。杂色曲霉(A.versicolor)作为曲霉属的一种, 能产生多种有用的活性代谢产物, 分别具有抗病[1]、抗虫[1]、抗病毒[2]、抗肿瘤[3]、抗氧化[4]、细胞免疫[5]和抗炎症[6]等多种生物活性。罗寒等[1]从分离自红树林植物内生真菌的杂色曲霉MA-229的发酵产物中得到9个化合物, 分别对小麦全蚀病菌和小麦赤霉病菌有较好的抑制活性, 并且还有抗虫活性; Yan等[4]从深海中分离到1株杂色曲霉, 可产生具有抗氧化活性的胞外多糖体; 巩婷等[6]从海洋真菌杂色曲霉F62中分离得到6个丁内酯类活性化合物, 均表现出较强的抗炎活性。众多文献表明杂色曲霉(A.versicolor)生物活性物质非常丰富。
1980年, Alberts等[7]从土曲霉(A.terreus)中提取到称为洛伐他汀(Lovastatin)的化合物。Lovastatin是降血脂的他汀类药物, 主要作用机理是该分子酸式结构与羟甲基戊二酸辅酶A(HMG-CoA)相似, 而HMG-CoA还原酶是合成胆固醇的限速酶, Lovastatin能选择性的与该限速酶结合, 起到竞争性抑制作用, 从而阻断胆固醇的合成来降低心血管疾病的病发[8-9]。目前, Lovastatin在食品和药品工业中已被广泛应用。微生物发酵工业中, 影响产量的两个关键因素是生产菌种和发酵条件。因此, 选育稳定高产Lovastatin的曲霉新菌种对并其发酵工艺进行优化, 可为Lovastatin工业化生产提供理论依据。
1 材料与方法 1.1 材料 1.1.1 曲霉属菌株从不同生境(食品、土壤、有机质等)收集的自然发酵样品, 经分离筛选得到曲霉属纯菌株。
1.1.2 培养基(1) PDA培养基(g/L):马铃薯200、葡萄糖20、琼脂15、水、pH 5.5;用于曲霉菌株的分离纯化和鉴定。(2)PD培养液(g/L):马铃薯200、葡萄糖20、水、pH 5.5;用于高产Lovastatin曲霉菌株的筛选和种子培养。(3)发酵培养液(g/L):马铃薯200、葡萄糖20、牛肉膏5、水、pH 5.5;用于高产Lovastatin菌株的发酵培养。(4)碳源筛选基础培养基(g/L):牛肉膏5、NaCl 2、KH2PO4 1、MgSO4·7 H2O 1、水、pH 5.5;用于碳源筛选。(5)氮源筛选基础培养基(g/L):乳糖20、NaCl 2、KH2PO4 1、MgSO4·7 H2O 1、水、pH 5.5;用于氮源筛选。
1.2 方法 1.2.1 曲霉菌株的分离纯化从不同生境收集的样品表面挑取少量菌丝接入PDA平板, 28℃培养24 h, 白色绒毛状菌丝长出后, 取少许顶端菌丝转接于另一PDA平板上培养3 d, 显微镜观察, 挑取具有曲霉的典型特征少许顶端菌丝纯化3次, 得性状均一的曲霉纯菌株。编号保存于25%甘油中, 4℃备用。
1.2.2 产生洛伐他汀曲霉菌株的筛选 1.2.2.1 曲霉属各菌株的培养保存的菌株在PDA平板上28℃活化培养3 d后, 取1菌饼(直径8 mm)接种于PD培养液中, 28℃、180 r/min摇床培养2 d, 制得种子液; 按8%转接到发酵培养液中, 28℃、180 r/min培养7 d, 发酵液用于检测Lovastatin的产量, 筛选高产曲霉菌株。
1.2.2.2 薄层层析法(Thin-layer chromatography, TL-C)初筛发酵液超声破壁30 min, 取1.5 mL于离心管中, 8 000 r/min离心10 min, 取上清液500 μL加100 μL乙酸乙酯振荡萃取取上层液为待测样品, 毛细吸管吸取1/4管样品点5次于硅胶板上; Lovastatin标准品为对照, 乙酸乙酯作展开剂, 展开至15 cm, 晾干, 紫外灯(波长254 nm)观察斑点并拍照。
1.2.2.3 高效液相法(High performance liquid chro-matography, HPLC)复筛取发酵液0.4 mL于2 mL离心管中, 加入1.6 mL的甲醇, 25 Hz超声波30 min, 50℃水浴2 h, 间歇振荡3-4次, 8 000 r/min离心10 min, 取上清液用0.45 µm有机膜过滤到另一2 mL离心管中, HPLC法测定滤液中的Lovastatin含量。HPLC检测的色谱条件:Agilent 5 TC-C18(250×4.6 mm)液相色谱柱; 乙腈为色谱纯, 磷酸为优级纯, 水为超纯水, 检测波长λ = 237 nm, 柱温28℃, 流速1 mL/min, 进样量20 μL。Lovastatin标准曲线的绘制参照文献[10]。
1.2.3 目标菌株的鉴定目标菌株在PDA平板上28℃培养7 d, 显微镜观察其菌丝、分生孢子头、分生孢子梗、顶囊、分生孢子等的形态特征。提取目标菌株的基因组DNA, 扩增rDNA ITS基因序列, 送上海生物工程公司测序。根据形态特征和rDNA ITS基因序列, 参考曲霉属《The Genus Aspergillus》分种检索表确定所目标菌株属种。
1.2.4 培养基配方及摇瓶发酵条件优化用单因素实验优化培养基配方(碳源种类、氮源种类、碳源含量、氮源含量、碳氮比C/N)和发酵条件(温度、初始pH、摇床转速、接种量), 实验设3次平行重复。数据用SPSS软件数据统计, Dunan’s多重检验进行均值比较, 显著性水平设为P≤0.05。
2 结果 2.1 不同生境分离纯化曲霉菌株的形态特征经分离纯化获得86株曲霉纯菌株。不同曲霉菌株的菌落形态有较大差异(图 1); 分生孢子头、分生孢子梗、顶囊、分生孢子等显微形态特征也各不相同(图 2), 表明来源于不同生境的曲霉菌株具有丰富的多样性。
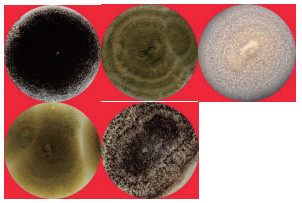
|
| 图 1 5株代表性曲霉菌株的菌落形态 |
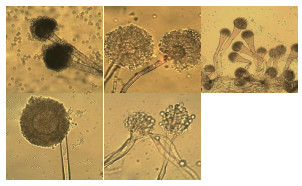
|
| 图 2 5株代表性曲霉菌株的分生孢子头显微形态 |
通过TLC法初步筛选得到36株产Lovastatin的曲霉菌株。如图 3所示, 不同曲霉菌株产生Lovast-atin产量不同, 有些菌株发酵液与标准品相同位置条带明显, 表明该菌株产生Lovastatin含量较高; 有些菌株在该位置条带不明显或没有, 表明该菌株产生Lovastatin能力较弱或不产生。选取Lovastatin条带较明显的菌株进行HPLC法定量检测复筛。
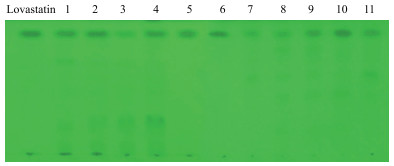
|
| 图 3 Lovastatin标准品和曲霉菌株发酵液TLC法初筛结果 |
用HPLC法复筛结果(图 4)表明不同曲霉菌株Lovastatin产量存在显著差异。Lovastatin产量大部分分布在10-25 μg/mL之间(34株), 25-58 μg/mL范围内有2株曲霉菌株。经进一步筛选确证8号曲霉菌株Lovastatin产量最高, 为58 μg/mL, 并将其编号为A-8。
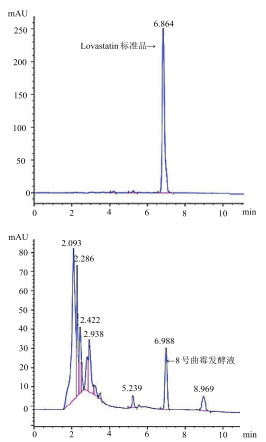
|
| 图 4 Lovastatin标准品和8号曲霉发酵液HPLC检测结果 横坐标为出峰时间; 纵坐标为峰面积(mAU); 峰顶数字为出峰时间 |
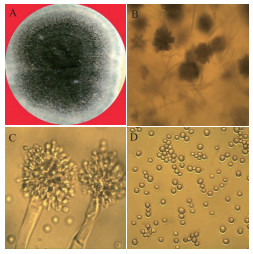
PDA培养基上的菌落初期为白色绒毛状或絮状, 后变成灰绿色, 边缘白色, 7 d菌落直径可达50 mm; 显微镜观察菌丝光滑, 有隔膜, 分支状; 分生孢子头初为球形, 后呈放射形, 顶囊呈半椭圆形至半球形; 上半部或3/4部位着生小梗, 小梗双层, 分生孢子呈淡绿色, 球形或近球形, 粗糙, 直径(4-5)μm×(4-4.5)μm(图 5)。
|
| 图 5 Av-8曲霉菌株PDA上培养7 d菌落(A)、分生孢子头(B、C)和分生孢子(D) |
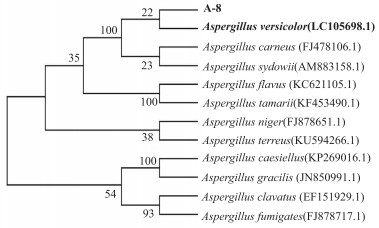
A-8曲霉菌株ITS基因序列如图 6, 长度为545 bp; 系统发育树(图 7)分析表明:与杂色曲霉亲缘关系最近, 达99%。根据A-8曲霉菌株的菌落和显微形态特征和rDNA ITS基因序列, 结合曲霉属分种检索表, 鉴定8号菌株为杂色曲霉。

|
| 图 6 A-8曲霉菌株ITS rDNA基因序列(545 bp) |
|
| 图 7 基于12株曲霉属ITS rDNA基因序列建立的A-8菌株系统发育树 |
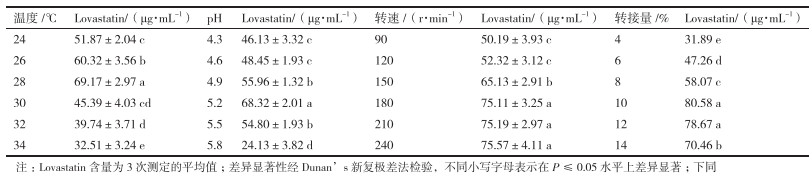
发酵条件的优化结果见表 1。在24-34℃温度范围内, 最适发酵温度为28℃; 在最适温度的基础上, 初始pH以5.2最为适宜; 在适宜温度和初始pH的基础上, 摇床转速以180 r/min为宜; 在适宜的培养温度、pH和摇床转速的基础上, 接种量以10%为宜。
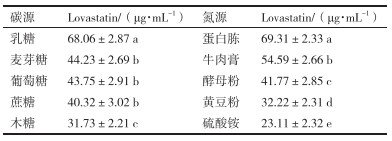
碳源和氮源种类的筛选结果见表 2, 乳糖为较适宜的碳源, 蛋白胨为较适宜的氮源。
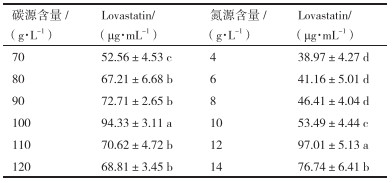
乳糖和蛋白胨含量对Lovastatin产量的影响结果见表 3。以乳糖为适宜碳源, 在70-120 g/L乳糖含量范围内设置6个梯度; 当乳糖含量为100 g/L时, Lovastatin达到最大值为84.33 μg/mL。以蛋白胨为适宜氮源, 在4-14 g/L蛋白胨含量范围内设置6个梯度; 当蛋白胨为12 g/L时, Lovastatin达到最大值为87.01 μg/mL。
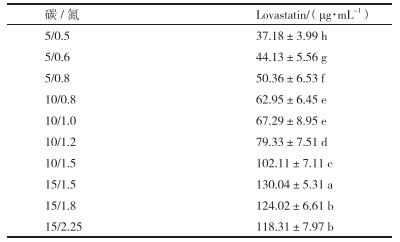
碳氮比对Lovastatin产量的影响结果见表 4。以乳糖为碳源, 蛋白胨为氮源, 在碳氮比5/0.5-15/2.25范围内设置10个梯度; 当碳氮比为15/1.5时, Lovastatin达到最大值为130.04 μg/mL。
Alberts等[7, 11]报道, 红曲霉及其它一些丝状真菌如木霉属(Trichoderma)、青霉属(Penicillium)、曲霉属(Aspergillus)等都会产Lovastatin。其中曲霉属真菌报道最多, 主要种类有费舍尔曲霉(A.fischeri)[12]、黄曲霉(A.flavus)[13]、黄柄曲霉(A.flavipes)[13]、黑曲霉(A.niger)[13]、寄生曲霉(A.parasiticus)[13], 土曲霉(A.terreus)[14]等。目前Lovastatin的主要工业生产菌种国外为土曲霉(A.terreus)、国内为红曲霉(Monascus)。
已报道的部分曲霉菌株Lovastatin的产量比较见表 5。Javed等报道[13], 用黄曲霉(A.flavus GCBL-60)发酵菌种, 米糠为主要原料, 在35℃、pH 5.5等条件下, 液体发酵96 h, Lovastatin产量约为28.36 ± 0.76 mg/100 mL。刘爱英等[15]用紫外诱变处理1株紫色红曲霉(M.purpureus ZZ), 诱变后摇瓶发酵该菌株Lovastatin产量为219.9 μg/mL。童振宇等[16]对1株紫色红曲霉(M.purpureusWX)液态发酵培养基进行了优化, Lovastatin产量达到了297.4 μg/mL。游玟娟等[17]采用Box-Behnken设计对1株红曲霉高产突变株(Monascus sp.UV-D-9)发酵生产Lovastatin条件进行了响应面优化, 得到适宜发酵条件为:发酵温度30.4℃, 装液量为134 mL, 转速187 r/min, 发酵时间10 d, 接种量8%;Lovastatin产量约为320 mg/L; 章婷等[18]筛选到1株产生洛伐他汀棒曲霉(A.clavatus), 经响应面优化Lovastatin产量约为236 μg/mL; Hasan等[19]通过基因工程手段过表达乙酰辅酶A羧化酶(acetyl-CoA carboxylase), 使土曲霉(A.terreus)Lovastatin产量提高了40%;Fu等[20]筛选到1株产生洛伐他汀类似物的杂色曲霉(A.versicolor SC0156)。而利用杂色曲霉发酵产生Lovastatin国内外尚未见有报道, 本实验室筛选的曲霉菌株A-8, 经培养基配方和培养条件初步优化, Lovastatin产量达130 μg/mL左右; 通过理化诱变或基因工程改良, Lovastatin产量可进一步提高, 本实验丰富了生产Lovastatin的菌种资源, 所选的杂色曲霉菌株具有良好的应用前景。
本实验结果表明, 来源于不同生境(食品、土壤、空气和有机质等)的曲霉菌株在菌落形态、显微形态和代谢产物产生上具有丰富的多样性。经筛选获得1株高产Lovastatin曲霉A-8菌株; 经鉴定A-8菌株为杂色曲霉(A.versicolor)。经单因素实验初步优化发酵条件和培养基配方, A-8曲霉菌株发酵产生Lovastatin的水平可达130.04 μg/mL, A-8曲霉菌株是较有潜力的工业菌株。
| [1] |
罗寒, 李晓栋, 李晓明, 等. 红树林来源内生真菌杂色曲霉Aspergillus versicolor MA-229次级代谢产物研究[J]. 中国抗生素杂志, 2017, 42(4): S14-S20. |
| [2] |
Hu QF, Xing HH, Wang YD, et al. Prenylated isocoumarins from the fermentation products of the endophytic fungus Aspergillus versicolor and their anti-tobacco mosaic virus activities[J]. Chemistry of Natural Compounds, 2017, 53(3): 436-439. DOI:10.1007/s10600-017-2017-0 |
| [3] |
Li PH, Fan YQ, Chen H, et al. Phenylquinolinones with antitumor activity from the indian ocean-derived fungus Aspergillus versicolor Y31-2[J]. Chinese Journal of Oceanology and Limnology, 2016, 34(5): 1072-1075. DOI:10.1007/s00343-016-5097-y |
| [4] |
Yan MX, Mao WJ, Liu X, et al. Extracellular polysaccharide with novel structure and antioxidant property produced by the deep-sea fungus Aspergillus versicolor N(2)bC[J]. Carbohydrate Polymers, 2016, 147: 272-281. DOI:10.1016/j.carbpol.2016.03.090 |
| [5] |
Hou XM, Zhang YH, Zheng HY, et al. Aspersymmetide A, a new centrosymmetric cyclohexapeptide from the marine-derived fungus Aspergillus versicolor[J]. Marine Drugs, 2017, 15: 363. DOI:10.3390/md15110363 |
| [6] |
巩婷, 董世豪, 朱平, 等. 海洋真菌杂色曲霉F62丁内酯类化合物研究[J]. 菌物学报, 2014, 33(3): 706-712. |
| [7] |
Alberts AW. Discovery, biochemistry and biology of Lovastatin[J]. The American Journal of Cardiology, 1988, 62(15): 10-15. DOI:10.1016/0002-9149(88)90002-1 |
| [8] |
Guo CJ, Sun WW, Bruno KS, et al. Molecular genetic characterization of terreic acid pathway in Aspergillus terreus[J]. Organic Letters, 2014, 16: 5250-5253. DOI:10.1021/ol502242a |
| [9] |
Boruta T, Bizukojc M. Culture-based and sequence-based insights into biosynthesis of secondary metabolites by Aspergillus terreus ATCC 20542[J]. Journal of Biotechnology, 2014, 175: 53-62. DOI:10.1016/j.jbiotec.2014.01.038 |
| [10] |
许楚旋, 吕梦霞, 王嘉琦, 等. 5种高产洛伐他汀曲霉的筛选和鉴定[J]. 湖南农业科学, 2018(3): 1-6. |
| [11] |
Akira Endo. The discovery and development of HMG-CoA reduct-ase inhibitors[J]. J Lipid Res, 1992, 33(11): 1569-1582. |
| [12] |
Latha PM, Chanakya P, Manipati S. Lovastatin production by Aspergillus fischeri under solid state fermentation from coconut oil cake[J]. Nepal Journal of Biotechnology, 2012, 2(1): 26-36. |
| [13] |
Javed S, Meraj M, et al. Biosynthesis of Lovastatin using agro-industrial wastes as carrier substrates[J]. Tropical Journal of Pharmaceutical Research February, 2017, 16(2): 263-269. DOI:10.4314/tjpr.v16i2.1 |
| [14] |
Robles JE, Suarez IR, Diaz J E, et al. Secondary metabolites isolated from the strain Aspergillus terreus[J]. Chemistry of Natural Compounds, 2014, 50(6): 1101-1102. DOI:10.1007/s10600-014-1170-y |
| [15] |
刘爱英, 孙嘉龙, 邹晓, 等. 提高红曲霉发酵产品Monacolin K含量的研究[J]. 贵州农业科学, 2007, 35(6): 5-7. DOI:10.3969/j.issn.1001-3601.2007.06.001 |
| [16] |
童振宇, 周立平, 陈旭峰. 响应面法优化红曲霉菌株Monascus purpureusWX液态发酵产Monacolin K工艺条件[J]. 浙江工业大学学报, 2007, 35(1): 35-40. DOI:10.3969/j.issn.1006-4303.2007.01.009 |
| [17] |
游玟娟, 温拥军. 高产洛伐他汀红曲霉(Monascus sp.UV-D-9)的发酵条件优化[J]. 食品工业科技, 2017, 38(7): 141-144. |
| [18] |
章婷, 等. 高产洛伐他汀棒曲霉菌株的筛选、鉴定及发酵条件优化[J]. 工业微生物, 2016, 46(6): 20-29. DOI:10.3969/j.issn.1001-6678.2016.06.004 |
| [19] |
Hasan H, Muhammad HAR, Leona C. Overexpression of acetyl-CoA carboxylase in Aspergillus terreus to increase lovastatin production[J]. New Biotechnology, 2018, 44: 64-71. DOI:10.1016/j.nbt.2018.04.008 |
| [20] |
Fu Y, Wu P, Xue JH, et al. Versicorin, a new Lovastatin analogue from the fungus Aspergillus versicolor SC0156[J]. Natural Product Research, 2018, 29(14): 1363-1368. |