2. 山东大学 微生物技术国家重点实验室, 济南 250100
2. State Key Laboratory of Microbial Technology, Shandong University, Ji'nan 250100
结核分枝杆菌(Mycobacterium tuberculosis)是肺结核病的病原菌, 携带人口数约占全世界总人口的1/4, 结核分枝杆菌多重耐药性菌株的发病率已经接近10%[1], 因此结核病的预防和治疗面临严峻挑战。研究表明, 结核分枝杆菌的致病性与其分泌蛋白有关, 分泌蛋白参与了病原菌与宿主之间的相互作用, 在结核分枝杆菌侵入、潜伏和致病等方面扮演着重要的角色。Type Ⅶ分泌系统是在结核分枝杆菌中发现的分泌系统, 包括ESX-1、ESX-2、ESX-3、ESX-4和ESX-5等, 负责一些与致病性有关的蛋白质分泌[2]。例如, ESX-1系统负责分泌ESAT-6和CFP-10蛋白, ESAT-6是在感染早期分泌的主要抗原蛋白, 能够抑制巨噬细胞的自噬功能, 帮助结核分枝杆菌从溶酶体逃逸到细胞质, 诱导巨噬细胞的凋亡[3-6]; 而ESX-5系统负责分泌PE和PPE大分子蛋白, PE和PPE与细菌免疫原性有关, 参与了修饰巨噬细胞成熟化、诱导促炎症因子IL-1β表达和诱导巨噬细胞死亡等过程[7-8]。
结核分枝杆菌有一层由分枝菌酸组成的外膜, 在细菌表面形成通透性屏障阻碍蛋白质的分泌, 现在还不清楚其外膜运输机制, 例如ESX-1的外膜运输通道[9]。Rv1057是结核分枝杆菌中唯一的7-折叠片β-螺旋蛋白, β-螺旋蛋白具有典型的筒状蛋白质结构特征, 生物功能包括转运蛋白、结构蛋白、信号蛋白和细胞膜蛋白等[10]。结核分枝杆菌在巨噬细胞内的生长早期大量合成Rv1057, 而生长后期几乎检测不到Rv1057[11]。此外, 敲除rv1057基因会显著降低ESAT-6的分泌[12], 说明Rv1057可能参与了结核分枝杆菌的早期感染过程。
rv1057基因存在复杂的转录调控, 其上游基因间隔区域具有1 003个碱基。前期研究显示rv1057基因受到双组份信号转导系统(Two-component regulatory system, TCS)MprAB和TrcRS的调控, 应答调控蛋白TrcR可以结合rv1057启动子区域中富含AT碱基的序列[11], MprA在rv1057启动子区域有多个结合位点[13]。MprA是激活rv1057转录的调控因子, TrcR则是阻遏rv1057转录的调控因子[14]。
原核生物染色体形成直径仅数微米的拟核结构, 由一系列拟核结合蛋白(Nucleoid-associated proteins, NAPs)维持, Lsr2是革兰氏阳性菌中第一个被发现的拟核结合蛋白[15], 在低氧、营养缺乏等压力条件下, lsr2基因表达明显上调, 并通过与DNA结合形成物理屏障, 协助细菌对抗损伤[16]。研究发现Lsr2在结核分枝杆菌基因组上有数百个结合位点, 说明Lsr2能发挥全局性调控作用[17]。我们预测Lsr2可能是rv1057基因转录的一个阻遏蛋白, 本研究通过凝胶阻滞迁移试验(Electrophoretic mobility shift assay, EMSA)分析和转录水平分析解析了Lsr2对rv1057基因的调控方式, 研究结果可为阐明Rv1057的生物学功能提供试验依据。
1 材料与方法 1.1 材料 1.1.1 菌株和质粒结核分枝杆菌野生型菌株H37Rv为本实验室保存, △lsr2突变菌株为Voskuil MI馈赠[16]。大肠杆菌DH5α和BL21(DE3)购自碧云天生物技术公司。pEASY-Blunt载体购自全式金生物技术公司。携带无启动子lacZ报告基因的pSM128载体和表达载体pET15b为本实验室保存。
1.1.2 实验试剂7H9、7H10、OADC、胰蛋白胨、酵母提取物购自美国Difco公司, [γ-32P]ATP购自美国PerkinElmer公司, T4 Polynucleotide Kinase购自美国Promega公司, Silica/Ceramic Beads购自美国MP公司, M-MLV购自Thermo公司, SYBR Premix EX Taq购自大连宝生物。
1.2 方法 1.2.1 重组Lsr2蛋白和TrcR蛋白的表达与纯化以结核分枝杆菌H37Rv基因组DNA为模板, 用PCR扩增Lsr2蛋白的编码基因, 连接到pEASY-Blunt组成pBlunt-Lsr2, 并进行DNA测序验证。测序正确后用Nde I和Xho I进行酶切, 切下的片段连接到pET15b质粒构建重组表达载体pET15b-Lsr2。然后将pET15b-Lsr2转入大肠杆菌BL21(DE3), 经IPTG诱导和Ni-NTA柱(Sangon)纯化获得重组Lsr2蛋白, 纯化的重组Lsr2蛋白经SDS-PAGE分析和浓度检测后备用。TrcR蛋白用已报道的方法进行制备[14]。Lsr2编码基因的PCR扩增引物为:Lsr2-15b-F:CATATGGCGAAGAAAGTAACCGTCACCT和Lsr2-15b-R:CTCAGATCAGGTCGCCGCGTGGTATGCGTC。
1.2.2 EMSA分析Lsr2蛋白与rv1057启动子片段的结合情况EMSA试验按照已报道的方法进行[14]。首先采用Rv1057-ForN/Rv1057-RevN引物PCR扩增含Lsr2结合位点的rv1057基因的255 bp(-503 - -249)启动子片段, 并用[γ-32P]ATP和T4 Polynucleotide Kinase进行末端标记, 然后与适量Lsr2蛋白溶液温育, 8 %非变性聚丙烯酰胺凝胶电泳分离, 最后用X-胶片曝光。
采用同样的方法分析Lsr2蛋白、TrcR蛋白与带突变位点启动子序列的结合情况, 带突变位点的81 bp启动子序列采用化学合成获得。rv1057基因启动子片段的PCR扩增引物为Rv1057-ForN:TGACCACTAACCAGTCTCATCG, Rv1057-RevN:GGTATGTGGCAAACCAGTGCTA。
1.2.3 启动子-lacZ报告基因菌株构建和lacZ基因转录水平分析报告基因菌株构建按照已报道的方法进行[12]。采用重叠PCR扩增不同区域和带突变位点的rv1057启动子片段, 连接到中间载体并测序验证, 然后连接到pSM128载体上, 构建启动子-lacZ融合载体。重组质粒和pSM128空质粒通过Gene PulserXcell(BioRad)电击转化分别转入H37Rv菌株, 用50 μg/mL链霉素筛选转化子并用PCR进行验证。
将导入不同重组pSM128质粒的H37Rv菌株培养至对数生长期, 然后接入新鲜7H9/OADC培养基中并加入0.05%十二烷基硫酸钠(Sodium dodecyl sulfate, SDS), 分别在第24 h, 48 h和120 h收集菌体, 提取总RNA, 反转录成cDNA, 并用荧光实时定量PCR(qRT-PCR)分析基因转录水平, 试验重复3次。用不加模板的样品作为阴性对照, 并用看家基因16S rRNA作为内标校正因样品初始浓度不同而造成的差异。
lacZ融合载体构建的PCR扩增引物:Rv1057-fusFor1:TGATCACTAGTGCTTGGTTTGTTCGCCG, Rv1057-fusRev1:TGATCAGCGCCGCTCCTCCTCAT-CA。lacZ基因上游:CCTGAGGCCGATACTGTCGT, 下游:TTGGTGTAGATGGGCGCAT; 16S rRNA基因上游:TCCCGG GCCTTGTACACA, 下游:CCACT-GGCTTCGGGTGTTA。
1.2.4 △lsr2突变菌株中Rv1057蛋白表达分析将H37Rv和△lsr2突变菌株培养到对数生长期, 转接到新鲜7H9/OADC培养基中并加入0.05% SDS, 并在37℃水平摇床上晃动培养, 分别在第24 h, 第48 h和120 h离心收集菌体。提取总RNA, 反转录成cDNA, 并用qRT-PCR分析lsr2基因转录水平。用不加模板的样品作为阴性对照, 并用看家基因16S rRNA作为内标校正因样品初始浓度不同而造成的差异。同时用FastPrep(MP)振荡破碎菌体, 离心收集上清, 制备菌体蛋白。菌体蛋白按照以前的方法进行Western blot检测[14], 检测Rv1057蛋白表达量。
2 结果 2.1 Lsr2对rv1057启动子的结合分析Lsr2是一个拟核结合蛋白, 生物信息学分析发现rv1057启动子中有一个可能的Lsr2结合区域。
EMSA实验结果(图 1-A)显示, 重组Lsr2蛋白在体外条件下可以特异性地结合rv1057启动子片段, 提高Lsr2蛋白用量时阻滞效应更加明显, 而过量的非标记rv1057启动子片段能够将标记的rv1057启动子片段从Lsr2蛋白上竞争性解离下来, 表明Lsr2可以结合rv1057的启动子。与此同时, TrcR也结合该启动子片段, 而且同时加入Lsr2和TrcR蛋白产生2条阻滞条带(图 1-B), 说明Lsr2和TrcR都能够结合rv1057启动子。
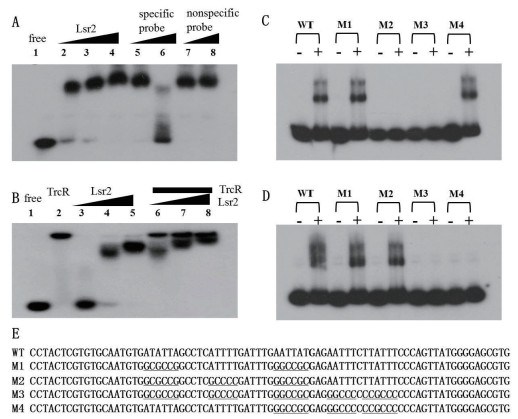
|
| 图 1 Lsr2和TrcR结合rv1057启动子的EMSA分析 A:Lsr2与rv1057启动子的EMSA结果(泳道1-8加入等量的标记的rv1057启动子, 1为无Lsr2对照, 2-4为0.5-1.5 μg Lsr2, 5-6分别加入60倍、120倍未标记rv1057启动子和1.5μg Lsr2;7-8分别加入60倍、120倍未标记随机DNA和1.5 μg Lsr2)。B:Lsr2和TrcR结合rv1057启动子的EMSA结果(泳道1-8加入等量的标记的rv1057启动子, 1为无蛋白对照, 2为1.0 μg TrcR, 3-5为分别加入0.25-1.0 μg Lsr2, 6-8为分别加入0.25-1.0 μg Lsr2和1.0 μg TrcR)。C-D:C中“+”为加1.0 μg TrcR, D中“+”为加1.0 μg Lsr2, “-”为无蛋白对照。E:rv1057启动子片段及其突变形式。WT:不含突变位点的rv1057启动子片段(-396 ~-316, 81 bp), M1-M4:含不同突变位点的rv1057启动子片段, 下划线为突变的位点 |
我们进一步设计了可能含突变TrcR或Lsr2结合位点的启动子序列M1-M4(图 1-E), 结果(图 1-C和1-D)显示Lsr2和TrcR结合野生型rv1057启动子片段和M1片段, 仅Lsr2能结合而TrcR不结合M2片段, 仅TrcR能结合而Lsr2不结合M4片段, Lsr2和TrcR都不能结合M3片段。
2.2 Lsr2和TrcR对rv1057启动子的调控分析本研究构建了含有野生型和突变型rv1057启动子的pSM128重组载体, 分析rv1057启动子上Lsr2结合位点对报告基因lacZ转录的影响。
qRT-PCR结果(图 2)显示, 包含完整rv1057启动子的P1可以正常转录报告基因lacZ, 但第120小时lacZ转录水受明显受到抑制, 第24小时lacZ表达量为第120小时lacZ表达量的6.25倍, 差异有统计学意义(t=27.84, P < 0.05);缺失Lsr2结合位点的P1-M4启动子也能正常激活lacZ的转录, 但第120小时lacZ转录水平显著高于野生型rv1057启动子, 是野生型启动子的8.94倍, 差异有统计学意义(t=13.54, P < 0.05);缺失TrcR结合位点(P1-M2)时lacZ转录水平在第24小时明显升高, 第120小时与野生型rv1057启动子无明显差异; 而同时缺失Lsr2和TrcR结合位点(P1-M3)时, lacZ转录水在第24小时和第120小时都显著高于野生型rv1057启动子, 差异有统计学意义(t值分别为8.61和20.23, P < 0.05)。
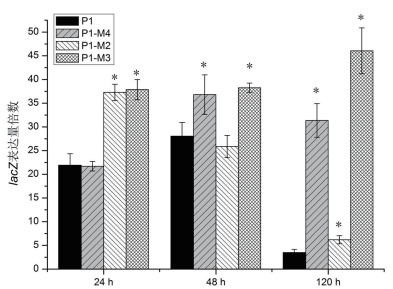
|
| 图 2 突变Lsr2位点对rv1057启动子的调控作用 P1为野生型rv1057启动子, P1-M4为突变Lsr2结合位点的rv1057启动子, P1-M2为突变TrcR结合位点的rv1057启动子, P1-M3为突变Lsr2和TrcR结合位点的rv1057启动子。*:与P1相比较, 显著性分析P < 0.05 |
报告基因转录分析结果说明TrcR可能在感染早期发挥阻遏作用, 而Lsr2可能在感染的中后期发挥阻遏作用。
2.3 Lsr2对rv1057表达的影响分析为进一步研究在结核分枝杆菌内Lsr2对rv1057表达的影响, 本研究采用qRT-PCR分析H37Rv和△lsr2突变菌株中trcR和lsr2转录水平的变化情况, 并用Western blot分析Rv1057蛋白的表达情况。
qRT-PCR分析结果(图 3-A)显示, 培养24 h H37Rv菌株中lsr2转录水平较低, 而第48小时和120 h的lsr2转录水平基本一致, 分别是24 h的5.03倍和4.53倍, 差异有统计学意义(t值分别为24.44、16.86, P < 0.05);但是在H37Rv菌株中trcR转录水平的变化趋势与lsr2转录水平相反, 第24小时的trcR转录水平是第48小时的4.86倍, 是第120小时的10.03倍(图 3-B), 差异具有统计学意义(t值分别为6.79、10.16, P < 0.05)。△lsr2突变菌株中trcR转录变化趋势与H37Rv菌株基本一致(图 3-B)。以上实验结果说明TrcR主要在结核分枝杆菌生长早期表达, 而Lsr2在结核分枝杆菌生长中后期表达。
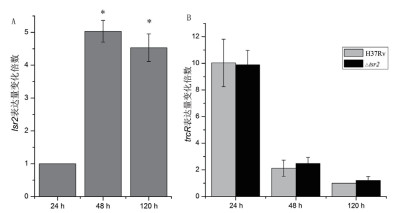
|
| 图 3 lsr2和trcR转录水平的qRT-PCR分析 A:lsr2转录水平, 24 h的值设定为1个单位; *:与24 h相比较, 显著性分析P < 0.05。B:trcR转录水平, 120 h H37Rv菌株的值设定为1个单位 |
Western blot分析结果(图 4), 显示, H37Rv菌株中Rv1057在培养24 h和48 h的表达量较高, 培养120 h Rv1057表达量非常少, 而△lsr2突变菌株在培养120 h的Rv1057表达量较高, 说明Lsr2在结核分枝杆菌生长中后期抑制Rv1057的表达, 与qRT-PCR试验的分析结果一致。上述结果表明Lsr2是rv1057基因的负调控因子, 在结核分枝杆菌生长的中后期阻遏rv1057基因的表达。
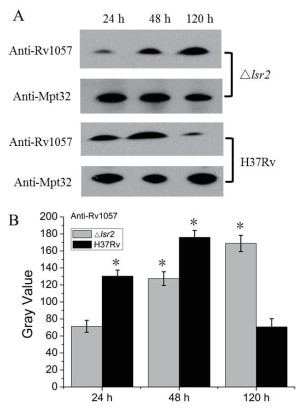
|
| 图 4 H37Rv和△lsr2突变菌株中Rv1057蛋白的表达分析 A:Western Blot检测24 h, 48 h和120 h的Rv1057表达水平。Mpt32蛋白作为内参。B:通过Image J软件对A图中Anti-Rv1057的条带进行定量分析。*:与△lsr2突变菌株中24 h表达的Rv1057蛋白量相比较, 显著性分析P < 0.05 |
综合上述试验结果, 本研究进一步完善了rvl057转录调控的模型:Lsr2和TrcR都是阻遏调控蛋白, MprA是激活调控蛋白; 在结核分枝杆菌生长早期, TrcR结合rvl057启动子并阻碍rvl057的转录, 当受到环境条件压力后MprA激活rvl057的转录并阻遏trcR表达, 而随着时间的延长结核分枝杆菌开始表达Lsr2并阻碍rvl057的表达。
3 讨论Rv1057是一个7-折叠片β-螺旋蛋白, 这类β-螺旋蛋白在细菌中具有功能多样性[10]。我们前期发现敲除rv1057基因影响结核分枝杆菌在巨噬细胞内的存活率[18], 以及ESAT-6和CFP-10的分泌[12], 说明rv1057可能影响结核分枝杆菌感染早期与巨噬细胞之间的应答, 参与结核分枝杆菌与宿主之间的相互作用。转录组测序分析显示在抑制细胞合成药物万古霉素的压力下rv1057转录水平上升[19]; Western blot检测显示在感染巨噬细胞的早期大量表达Rv1057, 但感染后期检测不到Rv1057[11]; 我们课题组前期研究则表明Rv1057在结核分枝杆菌受到细胞膜压力诱导(例如SDS或Triton X-100)的情况下被大量表达[13], 而且MprAB和TrcRS双组份信号转导系统同时参与rv1057的转录调控[13, 18], 这些研究结果提示rv1057受到了非常精细和复杂的调控作用。
Lsr2是一个拟核结合蛋白, 在革兰氏阳性菌中广泛存在[15]。染色质免疫共沉淀和基因表达芯片实验表明, Lsr2能够结合基因组的高AT含量区域并调控基因转录[17]。研究显示, TrcR和Lsr2都结合富含AT碱基的DNA序列, 但是TrcR和Lsr2的结合位点不同, Lsr2的DNA结合结构域能够特异性结合在高AT含量区域的DNA双螺旋结构小沟, 沿DNA小沟方向伸展并覆盖约5个AT碱基序列[20]。rv1057启动子存在高AT含量区域, 研究显示TrcR结合rv1057启动子的高AT区域, 并且阻遏rv1057的转录[11]。本研究证实Lsr2也结合rv1057启动子的高AT区域, 与TrcR均可阻遏rv1057的转录, 但两者在不同的生长时期发挥阻遏作用。本研究发现H37Rv菌株中Rv1057在培养48 h的表达量较24 h的表达量有所升高(图 4), 暗示rv1057除了受到Lsr2和TrcR的调控, 还受到其它调控因子(比如MprAB双组份信号转导系统)的调控, 说明rv1057的表达受到非常精细和复杂的调控作用。
综上所述, 本研究发现Lsr2结合rv1057启动子的高AT含量区域, 和TrcR均可阻遏rv1057基因的表达。但TrcR在诱导条件下可以完全阻遏rv1057基因的表达, 而Lsr2可能起到基础阻遏作用, 不能完全封闭rv1057基因的表达。
4 结论本研究通过凝胶阻滞迁移实验、荧光定量PCR实验和Western blot实验发现结核分枝杆菌拟核结合蛋白Lsr2是rv1057基因转录的阻遏蛋白, 并且与已知的阻遏蛋白TrcR均可调控rv1057基因的表达; Lsr2在结核分枝杆菌生长周期的中后期大量表达并阻遏rv1057的转录, TrcR则在结核分枝杆菌生长周期的早期阻遏rv1057的转录。
| [1] |
Houben RM, Dodd PJ. The global burden of latent tuberculosis infection:A re-estimation using mathematical modelling[J]. PLoS Medicine, 2016, 13(10): e1002152. DOI:10.1371/journal.pmed.1002152 |
| [2] |
Abdallah AM, Gey van Pittius NC, Champion PA, et al. Type Ⅶ secretion-mycobacteria show the way[J]. Nature Reviews Microbiology, 2007, 5(11): 883-891. DOI:10.1038/nrmicro1773 |
| [3] |
Liu J, Tran V, Leung AS, et al. BCG vaccines:their mechanisms of attenuation and impact on safety and protective efficacy[J]. Human Vaccines, 2009, 5(2): 70-78. DOI:10.4161/hv.5.2.7210 |
| [4] |
Zhang L, Zhang H, Zhao Y, et al. Effects of Mycobacterium tuberculosis ESAT-6/CFP-10 fusion protein on the autophagy function of mouse macrophages[J]. DNA Cell Biology, 2012, 31(2): 171-179. DOI:10.1089/dna.2011.1290 |
| [5] |
Champion PA, Stanley SA, Champion MM, et al. C-terminal signal sequence promotes virulence factor secretion in Mycobacterium tuberculosis[J]. Science, 2006, 313(5793): 1632-1636. DOI:10.1126/science.1131167 |
| [6] |
Ernst JD, Trevejo-Nunez G, Banaiee N. Genomics and the evolution, pathogenesis, and diagnosis of tuberculosis[J]. The Journal of Clinical Investigation, 2007, 117(7): 1738-1745. DOI:10.1172/JCI31810 |
| [7] |
Bottai D, Di-Luca M, Majlessi L, et al. Disruption of the ESX-5 system of Mycobacterium tuberculosis causes loss of PPE protein secretion, reduction of cell wall integrity and strong attenuation[J]. Molecular Microbiology, 2012, 83(6): 1195-1209. DOI:10.1111/j.1365-2958.2012.08001.x |
| [8] |
Sayes F, Sun L, Di Luca M, et al. Strong immunogenicity and cross-reactivity of Mycobacterium tuberculosis ESX-5 type Ⅶ secretion-encoded PE-PPE proteins predicts vaccine potential[J]. Cell Host Microbe, 2012, 11: 352-363. DOI:10.1016/j.chom.2012.03.003 |
| [9] |
Marrakchi H, Laneelle MA, Daffe M. Mycolic acids:structures, biosynthesis, and beyond[J]. Chemistry & Biology, 2014, 21(1): 67-85. |
| [10] |
Chen CK, Chan NL, Wang AH. The many blades of the beta-propeller proteins:conserved but versatile[J]. Trends in Biochemical Sciences, 2011, 36(10): 553-561. DOI:10.1016/j.tibs.2011.07.004 |
| [11] |
Haydel SE, Clark-Curtiss JE. The Mycobacterium tuberculosis TrcR response regulator represses transcription of the intracellularly expressed Rv1057 gene, encoding a seven-bladed beta-propeller[J]. Journal of Bacteriology, 2006, 188(1): 150-159. DOI:10.1128/JB.188.1.150-159.2006 |
| [12] |
Fu J, Zong G, Zhang P, et al. Deletion of the β-propeller protein gene Rv1057 reduces ESAT-6 secretion and intracellular growth of Mycobacterium tuberculosis[J]. Curr Microbiol, 2017. DOI:10.1007/s00284-017-1394-8 |
| [13] |
Pang X, Cao G, Neuenschwander PF, et al. The beta-propeller gene Rv1057 of Mycobacterium tuberculosis has a complex promoter directly regulated by both the MprAB and TrcRS two-component systems[J]. Tuberculosis, 2011, 91(S1): S142-149. |
| [14] |
宗工理, 张佩佩, 付加芳, 等. 双组份信号转导系统MprAB和TrcRS协同调控结核分枝杆菌Rv1057基因表达的分子机制研究[J]. 中华传染病杂志, 2017, 35(8): 486-491. DOI:10.3760/cma.j.issn.1000-6680.2017.08.008 |
| [15] |
彭如超, 徐文玺, 王洪海, 等. 分枝杆菌LSR2蛋白的研究进展[J]. 中华结核和呼吸杂志, 2012, 35(8): 610-611. DOI:10.3760/cma.j.issn.1001-0939.2012.08.013 |
| [16] |
Bartek IL, Woolhiser LK, Baughn AD, et al. Mycobacterium tuberculosis Lsr2 is a global transcriptional regulator required for adaptation to changing oxygen levels and virulence[J]. Mbio, 2014, 5(3): e01106-e01114. |
| [17] |
Gordon BRG, Li YF, Wang LR, et al. Lsr2 is a nucleoid associated protein that targets AT-rich sequences and virulence genes in Mycobacterium tuberculosis[J]. PNAS, 2010, 107(11): 5154-5159. DOI:10.1073/pnas.0913551107 |
| [18] |
付加芳, 张佩佩, 古苑欣, 等. 结核分枝杆菌Rv1057基因对巨噬细胞感染早期细胞因子表达的影响分析[J]. 生命科学研究, 2017, 21(6): 494-500. |
| [19] |
Provvedi R, Boldrin F, Falciani F, et al. Global transcriptional response to vancomycin in Mycobacterium tuberculosis[J]. Microbiology, 2009, 155: 1093-1102. DOI:10.1099/mic.0.024802-0 |
| [20] |
Qu Y, Lim CJ, Whang YR, et al. Mechanism of DNA organization by Mycobacterium tuberculosis protein Lsr2[J]. Nucleic Acids Res, 2013, 41(10): 5263-5272. DOI:10.1093/nar/gkt249 |




