瑞典科学家Boman在研究巨型蚕蛾Hyalophora cecropia滞育蛹的诱导型防御系统时, 发现了具有抗菌活性的多肽即抗菌肽(Antimicrobial peptides, AMPs)[1], 随后科学家相继在微生物、昆虫、植物和人体中发现了抗菌肽[2]。目前已发现2 600多种抗菌肽[3], 广泛分布于病毒、细菌、真菌及各类动物体内。抗菌肽属于抗生素的一个新的家族, 可作为常规抗生素治疗药物, 也可与抗生素协调发挥作用。研究表明, 两种或几种抗菌肽、抑或抗菌肽与传统抗生素联用, 可以拓宽抗生素的抗菌谱乃至增强治疗效果[4]。它不仅可以作用于细菌、真菌, 对病毒和癌细胞也有抑制作用, 具有广谱的抗菌活性[5]。此外, 抗菌肽还可以有效地杀灭引起人类及动物寄生虫病(如疟疾、氏病、菜什曼病等)的寄生虫, 并且具有抗精子作用、神经毒性、调节细菌以及在LDS或LPS协同作用下, 增强人和鼠巨噬细胞产生呼吸爆发等生物学功能。
与传统抗生素相比, 抗菌肽的抗菌作用主要有以下几个特点:(1)抗菌谱广:对革兰氏阴性菌[6-7]、革兰氏阳性菌、革兰氏兼性菌和真菌[7-9]都有高效的杀菌作用; (2)作用专一:原核细胞, 肿瘤细胞与正常细胞的细胞膜结构不同, 可以选择性地作用于原核细胞和癌细胞, 而对正常细胞几乎无作用; (3)杀菌快速:大多数抗菌肽都可在5 min内引起菌类细胞的死亡; (4)不易产生抗药性:对抗菌肽的抗药性起决定性作用的因素系其疏水性和两亲性, 而非肽链长度和所携电荷数, 这种特殊的作用机制使得致病菌很难产生抗药性或交叉抗性[10]; (5)不易蓄积中毒; (6)无致畸作用。
目前, 公认的抗菌肽的作用机制有两种:膜作用机制, 即破坏细胞膜, 造成膜穿孔; 非膜作用机制, 又可分为细胞外机制和细胞内机制, 细胞外机制主要指抗菌肽抑制细胞壁合成、激活自溶素或磷脂酶而发生溶菌作用[11], 细胞内机制则与干扰真核生物线粒体功能的发挥, 影响核糖体合成蛋白质, 影响基因的转录、表达和调控有关。陈旋等[12]研究了抗菌肽P7对大肠杆菌的非膜作用机制发现, 抗菌肽P7可造成DNA的损伤, 使DNA复制相关基因下调、DNA损伤修复基因上调, 抑制DNA的复制和RNA的合成。
人类许多疾病的治疗得益于抗生素的发现和临床使用, 但近40年以来, 新型抗生素仅发现了3种[13], 而随着抗生素的滥用, 耐药细菌感染已成威胁人类健康的一大隐患。抗菌肽抗菌活性高、抗菌谱广[14]、种类多、不易引发细菌的耐药性及对宿主无毒性或毒性小等特征, 使其有望开发为新型的抗菌药物。天然抗菌肽经过人工改造可降低细胞毒性、增强抗菌性和稳定性, 对实现大规模生产进而造福人类具有重要意义[15]。以肠道菌群和抗菌肽间的相互作用为基础, 通过监测抗菌肽表达水平的方式建立起的一种疾病预防和诊断治疗的辅助手段, 可用来预估机体肠道的健康状态[16]。此外, 抗菌肽在防控动物疫病、增强动物机体免疫水平和抗氧化能力、提高动物生产性能等方面也具有广阔的开发利用前景[17]。
蜈蚣(Centipede)是地球上最古老的捕食动物之一, 属于节肢动物门唇足纲整形目蜈蚣科虫体。据《神农本草经》所载, 蜈蚣具有熄风止痉, 通络止痛和攻毒散结的作用, 而且在治疗癌症、肝炎、脑血管病及多种皮肤病等均有明显的疗效。研究发现, 少棘蜈蚣(Scolopendra subspinipes mutilans)的毒液具有多种生化和生理作用[18-19]。Peng等[20]从少棘蜈蚣毒液中分离得到两种抗菌肽, 命名为Scolopin 1和Scolopin 2。其中, Scolopin 2经酰胺化修饰获得的Scolopin-2-NH2(S-2-N), 具有比其母体肽Scolopin-2(S-2)更强的抗菌活性, 但对抗菌肽S-2-N和S-2的抗菌机理尚未知晓。因此, 本论文对抗菌肽S-2-N和S-2的抗菌活性、理化性质进行了研究, 并从细胞水平和分子水平对其抗菌机制进行了探讨。
1 材料与方法 1.1 材料 1.1.1 抗菌肽及菌种抗菌肽:Scolopin-2(S-2):GILKKFMLHRGTKVYKMRTLSKRSH; Scolopin-2-NH2(S-2-N):GILKKFMLHRGTKVYKMRTLSKRSH-NH2; 均由吉尔生化(上海)有限公司合成, 自动多肽合成仪APEX396, 通过HPLC液相色谱进行脱盐、纯化, 分子量测定采用快原子轰击质谱法, 纯度≥95%。菌种:大肠杆菌(E.coli K12D31)、金黄色葡萄球菌(Staphylococcus aureus)、沙门氏菌(salmonella)和枯草杆菌(Bacillus subtilis)均由本实验室保存。
1.1.2 试剂抗生素Kan+、Amp+购自Amresco公司; AnnexinV-FITC/PI双染凋亡检测试剂盒购于南京Vazyme公司; DAPI染色液购于美国Sigma公司; DNA Marker、蛋白质Marker、通用型基因组DNA提取试剂盒(MiniBESTUniversal Genomic DNA Extraction Kit Ver.5.0)和逆转录试剂盒(PrimeScriptTM RT reagent Kit)购于TaKaRa生物公司; SYBR® Premix Ex TaqTMⅡ染料购于南京罗氏生物公司; RNA提取试剂盒(TranZolTM Up Plus RNA Kit, ER501)购于南京TransGen Biotech公司; 细胞周期试剂盒(KGA512)购于凯基生物公司。
1.1.3 仪器ELx800型酶联免疫检测仪(美国BLO-TEK公司)、320-SpH计(Mettler Toledo公司)、圆二色谱仪(英国Chirascan, Applied Photophysics)、流式细胞仪(美国BD公司)、PTC-200 PCR仪(美国MJ Research公司)、核酸与蛋白分析仪(美国NanoDropND-1000), StepOnePlusTMReal-Time PCR System(美国AB生物系统公司)。
1.2 方法 1.2.1 抗菌肽Scolopin-2-NH2的抗菌活性及理化性质 1.2.1.1 抗菌肽的抗菌活性及最小抑菌浓度配置LB培养基, pH调至7.0。分别将冻存的4种菌(大肠杆菌K12D31、金黄色葡萄球菌、沙门氏菌和枯草杆菌)按1:100接种到液体LB培养基中, 摇床培养过夜。
将固体LB培养基融化并冷却至55℃左右, 按1:100加入菌液并摇匀, 倒入灭菌平板培养皿, 9 mL/皿, 置于超净工作台内冷却至凝固。用灭菌的打孔器在带菌的固体LB平板上打孔, 孔径为8 mm, 分别加入20 μmol/L抗菌肽S-2/S-2-N于琼脂孔内, 置于37℃培养10 h, 拍照。
按最小抑菌浓度(Minimum inhibitory concentra-tion, MIC)测定法检测抗菌肽S-2/S-2-N对4种菌株(大肠杆菌K12D31、金黄色葡萄球菌、沙门氏菌和枯草杆菌)的抗菌活性, 酶标仪测定OD值, 与初始OD值相比, OD值尚未显著变化的最小浓度定义为此抗菌肽对该菌的最小抑菌浓度。
1.2.1.2 抗菌肽的理化性质以圆二色谱仪检测抗菌肽的二级结构, 数据用Orign 8软件处理作图。
检测抗菌肽的热稳定性、酸碱稳定性、离子强度稳定性及对消化酶的不敏感性。将抗菌肽样品分别经下述条件处理:温度(100℃水浴0 min、5 min、10 min、20 min、30 min)、pH磷酸盐缓冲液(PBS)(pH梯度为1.0、3.0、5.0、7.0、10.0和12.0)、NaCl、KCl、CaCl2(离子浓度分别为0 mmol/L、50 mmol/L、100 mmol/L和200 mmol/L)、胰蛋白酶和胃蛋白酶(37℃处理0 min、30 min和60 min), 加入带菌(E.coli K12D31)的LB平板琼脂孔里, 37℃培养10 h, 量取抑菌圈直径。
1.2.2 抗菌肽Scolopin-2-NH2对细菌细胞膜的影响 1.2.2.1 抗菌肽在细菌细胞内的定位荧光标记S-2/S-2-N。将活化的E.coli K12D31培养至对数生长期(105), 5 000 r/min离心5 min收集菌液; PBS洗3次后加入FITC-S-2/S-2-N(10 μmol/L)37℃避光培养30 min和1 h; PBS洗3次, 5 000 r/min, 离心5 min, 激光共聚焦显微镜下观察拍照。
1.2.2.2 观察细菌超微结构、分析细胞膜完整性及抗菌肽的穿膜效率将活化的E.coliK12D31培养至对数生长期(OD=0.5), 离心收集菌液, 加入抗菌肽S-2/S-2-N(20 μmol/L)37℃培养30 min和2 h, 阴性对照为PBS; 以此为材料制备超薄切片, 透射电镜下观察细菌超微结构。
在带有抗菌肽的E.coli K12D31中加入PI溶液, 用流式细胞仪检测PI着染阳性细菌数。用流式细胞仪检测FITC-S-2/S-2-N处理后的E.coli K12D31着染的阳性细菌数。
1.2.3 抗菌肽Scolopin-2-NH2对细菌DNA和RNA的作用研究 1.2.3.1 细菌基因组DNA、总RNA含量的检测酶标仪测定经S-2/S-2-N处理的E.coli K12D31的基因组DNA和RNA的荧光强度。重复3次, 取平均值。
1.2.3.2 抗菌肽与细菌DNA/RNA的凝胶阻滞分析参照试剂盒提取法提取E.coli K12D31基因组DNA。分别用S-2/S-2-N溶于DNA binding buffer并作梯度稀释, 加入到细菌DNA溶液中, 1%的琼脂糖凝胶电泳检测, 紫外凝胶成像观察拍照。同上法进行抗菌肽与细菌RNA的凝胶阻滞分析。
1.2.3.3 抗菌肽结合DNA后的结构变化在E.coli K12D31基因组DNA中加入S-2/S-2-N, 制成样品。圆二色谱仪扫描, 每个样品连续扫描3次, 取平均值; 数据用Orign 8软件处理。
1.2.3.4 抗菌肽对细菌细胞周期及细菌DNA复制与修复相关基因表达的影响将活化的E.coli K12D31培养至对数生长期, 加入S-2/S-2-N, 37℃分别培养0.5 h后, 加入PI染色液, 流式细胞仪检测。
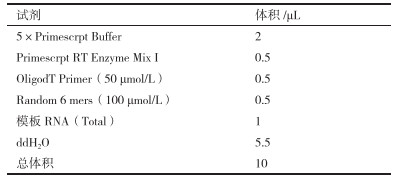
取上述培养菌体进行总RNA提取, 逆转录反应体系合成cDNA(表 1)。
用罗氏Green qPCR Master Mix试剂盒对dnaA、dnaB、dnaG、SSB、RecA和RecN基因进行RT-PCR分析。按表 3加入20 μL RT-PCR反应体系所需的各种试剂于八联管中。引物序列如表 2所示, 进行RT-PCR。
所有的实验至少重复3次。采用SPSS18.0统计软件分析处理, 采用t检验, 数据以平均值±标准差(x±s)表示, (*)P < 0.05为具有显著差异。
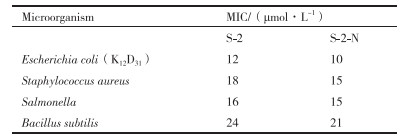
2 结果 2.1 抗菌肽Scolopin-2-NH2的抗菌活性及理化性质 2.1.1抗菌活性检测及最小抑菌浓度(MIC)两种抗菌肽的最小抑菌浓度(MIC)见表 4。可以看出酰胺化修饰的AMP-S-2-N的抑菌活性明显强于其母肽AMP-S-2, 且二者对E.coli K12D31的抑菌效果最佳, 故可选择大肠杆菌作为抗菌敏感菌株。
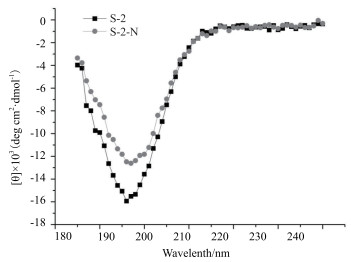
圆二色谱技术探究抗菌肽S-2/S-2-N的二级结构, 如图 1显示的, 二者均在197 nm处有一个负峰, 说明具有一个无规则卷曲结构。AMP-S-2的峰值为-15.52, 而AMP-S-2-N的峰值为-12.60, 负峰值降低, 即峰有所上移, 这可能与S-2-N比S-2具有更强的抗菌活性有关。
|
| 图 1 抗菌肽二级结构预测 |
如图 2-A所示, 沸水浴5、10、20 min后, S-2/S-2-N仍具有较好的抗菌活性, 30 min后抑菌圈直径有所减小。说明抗菌肽对高温具有较强的耐受性, 仅在温度超过30 min时, 抑菌能力才有所下降。

|
| 图 2 抗菌肽的稳定性 A:热稳定性; B:不同pH缓冲液对抗菌肽抑菌活性的影响; C-D:不同离子强度对抗菌肽的影响; E-F:胰蛋白酶和胃蛋白酶对抗菌肽抗菌活性的影响 |
如图 2-B, pH为1、3、5、10、12时与pH为7时的抑菌圈大小无明显差别。这暗示了AMP-S-2/S-2-N具有酸碱耐受性。
如图 2-C(S-2)和2-D(S-2-N)显示, 除了Ca2+对AMP-S-2-N有轻微的抑制作用外, 不同浓度的NaCl、KCl、CaCl2离子对抗菌肽的抑制作用不明显。说明抗菌肽对Na+和K+离子的耐受力较强, 而Ca2+可能对其抗菌活性有一定的影响。
抗菌肽经胰蛋白酶和胃蛋白酶37℃酶切处理后, 由图 2-E(胰蛋白酶处理)与图 2-F(胃蛋白酶)发现, 处理60 min的实验组抑菌圈直径大小与阴性对照组没有明显变化, 表明AMP-S-2/S-2-N对这两种消化酶具有一定的耐受力。
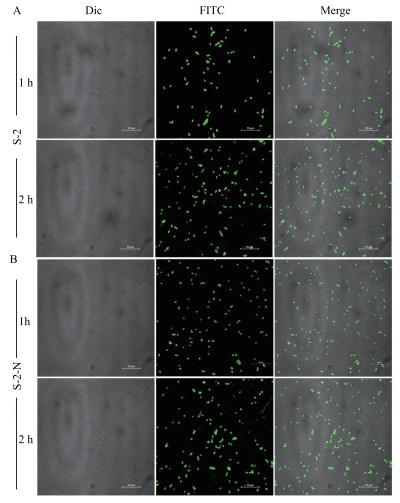
2.2 抗菌肽Scolopin-2-NH2对细菌细胞膜的影响 2.2.1 抗菌肽在细菌细胞内的定位如图 3所示, 经FITC-S-2/S-2-N处理后的细胞均带有荧光, 说明S-2/S-2-N已完全进入细胞质内; 细胞形态没有发生变化, 说明S-2/S-2-N的作用靶点应位于细胞质内。处理2 h后, 观察到抗菌肽进入的细胞数增多, 且经S-2-N处理后的细胞有少量细胞碎片。
|
| 图 3 激光共聚焦观察FITC-S-2/S-2-N处理过的大肠杆菌细胞 A:S-2;B:S-2-N |
如图 4, AMP-S-2/S-2-N处理20 min后, E.coli K12D31细胞膜边缘出现轻微的模糊, 细菌的形态还比较完整; 2 h后, S-2处理的细胞的细胞膜开始破裂, 内容物开始释放出来, 但形态还可以看清; 而经S-2-N处理的细胞内容物泄露呈弥散状, 整个细胞已基本瓦解破裂。因此推断, AMP-S-2-/S-2-N作用细菌2 h后导致细胞质膜的破裂。
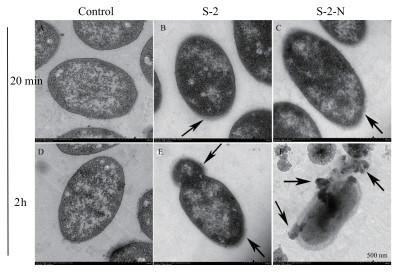
|
| 图 4 大肠杆菌经S-2/S-2-N处理后的电镜图 PBS:20min(A)和2h(D); S-2:20 min(B)和2 h(E), S-2-N:20 min(C)和2 h(F)。箭头所指为从细胞中泄露的内容物 |
如图 5所示, 处理20 min后, 10 μmol/L S-2使PI着染阳性细胞比例为4.10%, 而经10 μmol/L S-2-N处理后染阳性细胞比例为4.96%。当处理浓度增大到20 μmol/L时, 阳性细胞数分别为7.48%和8.82%。考虑到背景干扰, 这样的结果暗示了S-2/S-2-N对细菌胞膜有轻微的破坏作用, 虽然在MIC时, S-2/S-2-N并没有破坏细胞膜, 影响质膜的完整性, 但浓度增大破坏性增强, 且S-2-N对细胞膜的扰动总比S-2强一些。
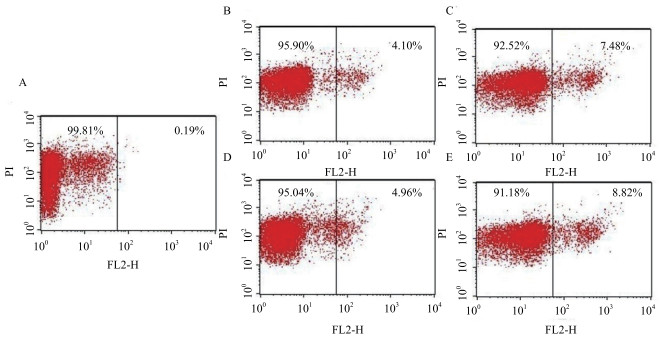
|
| 图 5 流式细胞仪分析PI流入抗菌肽处理的大肠杆菌细胞的结果 A:PBS; B:10 μmol/L S-2;C:10 μmol/L S-2-N; D:20 μmol/L S-2;E:20 μmol/L S-2-N |
如图 6所示, 经10 μmol/L的S-2/S-2-N处理20 min后, 有41.28%的大肠杆菌细胞被S-2侵入, 而S-2-N则为43.05%, 均高于PBS阴性对照组(0.08%); 当S-2-N浓度为20 μmol/L时, 同样处理20 min, 阳性细胞比例为54.97%高于S-2(44.83%)。以上结果暗示了S-2-N穿透E.coli K12D31细胞膜的效率比亲本(S-2)高, 这可能也是酰胺化的S-2-N比其亲本抗菌活性强的原因之一。
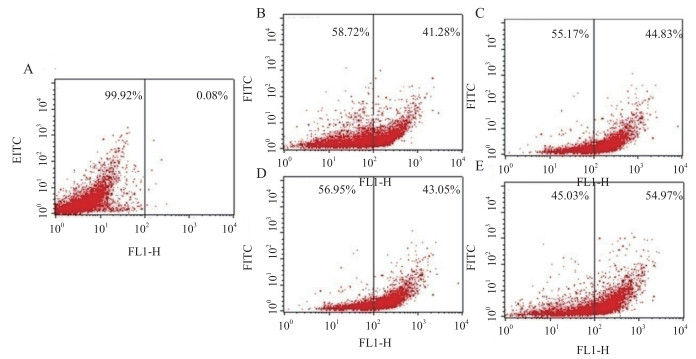
|
| 图 6 流式细胞仪分析FITC-抗菌肽流入大肠杆菌细胞的结果 A:PBS; B:10 μmol/L S-2;C:10 μmol/L S-2-N; D:20 μmol/L S-2;E:20 μmol/L S-2-N |
如图 7显示, S-2/S-2-N分别作用5 h后, 与对照组相比, S-2-N组DNA合成量减少了36%(P < 0.05), 而S-2组为22%;RNA合成量也减少了33%, 而S-2组为20%。结果表明S-2/S-2-N均可抑制大肠杆菌核酸的合成, 且S-2-N抑菌能力强于母体肽S-2。
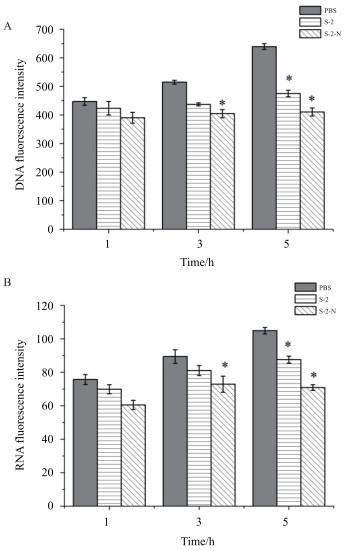
|
| 图 7 S-2/S-2-N对大肠杆菌核酸合成的影响 A:DNA; B:RNA.*P < 0.05 |
通过凝胶阻滞实验发现, AMP-S-2/S-2-N与基因组DNA具有很强的结合力。如图 8所示, 当S-2浓度为10.4 µmol/L时, 即开始出现阻滞现象, 当浓度达到13.0 µmol/L时, S-2与NDA已经强烈结合, 使DNA无法跑出点样孔, 即已被完全阻滞。而当S-2-N为10.4 µmol/L时, 已经将DNA阻滞在点样孔里, 随着浓度的增大, S-2-N与DNA结合的程度使得gold view已经无法插入到DNA的碱基对中, 使得点样孔中的DNA没有发出荧光。以上现象暗示了这两个抗菌肽中, 至少S-2-N, 与DNA结合的方式可能与gold view插入DNA的方式类似。实验结果不仅说明了AMP-S-2/S-2-N能与DNA强烈结合, 而且S-2-N结合DNA的能力比S-2强。
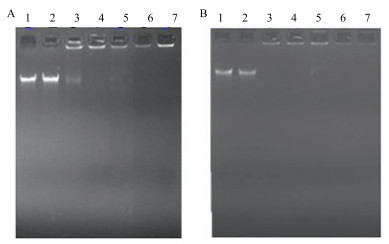
|
| 图 8 抗菌肽S-2(A)和S-2-N(B)分别与大肠杆菌DNA作用的凝胶阻滞分析 A:1-7泳道:0、7.8、10.4、13.0、15.6、31.2、62.5 µmol/L。B:1-7泳道:0、7.8、10.4、13.0、15.6、31.2、62.5 µmol/L |
在抗菌肽与RNA的凝胶阻滞实验中, 如图 9所示(图中拖尾现象可能是在提取过程中RNA部分降解, 但主条带仍保持完好), S-2/S-2-N可与RNA强烈结合, 当S-2为15.6 µmol/L时, RNA就出现了阻滞现象, 当浓度达到62.5 µmol/L时已基本被阻滞在点样孔里; 对S-2-N来说, 浓度为7.8 µmol/L时, 就开始有明显的阻滞现象, 当浓度大于15.6 µmol/L时, RNA已经完全跑不出点样孔。实验结果说明S-2-N结合RNA的能力比S-2强。
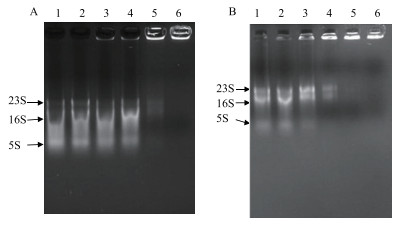
|
| 图 9 抗菌肽S-2(A)和S-2-N(B)分别与大肠杆菌RNA作用的凝胶阻滞分析 A:1-6:0、7.8、15.6、31.2、62.5、125 µmol/L; B:1-6:0、1.8、3.9、7.8、15.6、31.2 µmol/L |
如图 10所示, 在DNA的CD谱中, 270 nm的正峰是由于碱基堆积作用产生的, 240 nm的负峰则对应DNA的双螺旋结构的B型构象。AMP-S-2-N/S-2的加入都使DNA的正峰和负峰强度都降低了, 且S-2-N使负峰降低强度更大, 说明二者都使DNA的双螺旋结构变得松散, 也消弱了DNA碱基对之间的π-π堆积作用; 图中DNA的CD谱峰位未发生红移(即左右平移), 说明二者只影响了DNA的二级结构, 没有引起双螺旋的解旋。该结果暗示了AMP-S-2-N与DNA发生了碱基嵌插或沟槽作用。

|
| 图 10 抗菌肽S-2和S-2-N分别对大肠杆菌DNA二级结构的影响 |
凝胶阻滞试验和圆二色谱法分析可知, AMP-S-2/S-2-N可以引起DNA结构的变化。DNA是信息传递的载体, 故DNA的基本功能必定受到影响, 因此利用流式细胞术分析了抗菌肽对大肠杆菌细胞周期的影响。
图 11-A为正常大肠杆菌的细胞周期图, 处于S期的细胞数为18.14%, 阳性对照组(Buforin Ⅱ)进入S期的细胞数为33.10%。经S-2/S-2-N处理后, 如图 11-B-C所示, 处于S期的细胞数为23.86%和26.32%, 虽然比阳性对照组(Buforin Ⅱ)稍低, 但与对照组相比有明显差别(P < 0.05), 说明S-2和S-2-N可以使细胞停留于S期, 进而抑制细胞的增殖。

|
| 图 11 抗菌肽对大肠杆菌细胞周期的影响 A:PBS; B:S-2;C:S-2-N; D:Buforin Ⅱ |
如图 12显示, 阳性对照组为Buforin Ⅱ(5-21)处理, 阴性对照组为PBS处理。基因dnaA、dnaB、dnaG和SSB与DNA复制相关。在S-2和S-2-N的作用下, 基因dnaA在经S-2-N处理后表达水平明显降低为56.68%(P < 0.05), 比阳性对照组62.03%还低; dnaG在实验组(S-2-N)中, 表达量为66.00%, 与阳性对照组64.78%结果类似; 其他基因dnaB和SSB的表达量也均有一定程度的降低。RecA和RecN是与DNA修复相关的基因, 与阴性对照组相比, S-2组为1.17倍和1.08倍, 而S-2-N组是1.24倍和1.3倍(P < 0.05), 二者的表达量均有增加, 与阳性对照组类似, 说明S-2/S-2-N都可以损伤DNA, 且暗示了S-2-N引起的DNA损伤高于其亲本。表明S-2/S-2-N可以影响DNA复制与修复相关基因的表达。
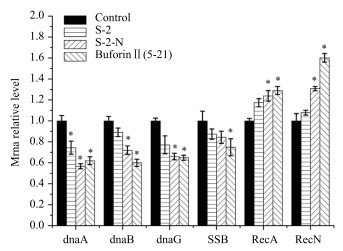
|
| 图 12 抗菌肽对大肠杆菌复制与修复相关基因表达的影响 |
AMP-S-2是一种分离自少棘蜈蚣毒液的阳离子肽, 具有广谱的抗菌活性, 但并不够理想。本实验室通过前期对AMP-S-2进行酰胺化改造, 获得了AMP-S-2-N。在此基础上, 本研究首先采用琼脂糖孔穴法, 通过筛选不同菌种, 发现AMP-S-2和S-2-N对E.coli K12D31具有较强的抑制作用, 且AMP-S-2-N比亲本具有更强的抑菌活性, 最小抑菌浓度(MIC)实验也印证了这一点。
据报道, 分别来自猪和牛的抗菌肽PR-39和Indolicidin都具有无规则卷曲的松散结构, 其作用机制是通过抑制大分子合成来发挥抗菌作用[21]。本实验通过圆二色谱仪预测AMP-S-2和S-2-N的二级结构, 发现二者具有无规则卷曲的松散结构; 且AMP-S-2-N的负峰峰值降低, 峰位上移, 这可能与其抗菌活性更强的原因之一。
另外, 抗菌肽本身也存在着许多亟待解决的问题, 如抗菌肽进入人体后易被蛋白酶水解, 稳定性低等在新药开发研制中普遍存在。于是, 在本文中AMP-S-2和S-2-N在经热、不同pH缓冲液、不同离子强度和不同蛋白酶处理后的, 二者均100℃热的耐受性较强, 仅在作用半小时后抗菌能力才有所下降; 对强酸和强碱的环境具有不敏感性; 对不同离子强度也具有一定的耐受力; 可抵抗消化酶的消化作用。AMP-S-2和S-2-N的这种对消化酶的不敏感性, 有利于开发为口服药, 此研究解除了对抗菌肽易被体内蛋白酶水解及稳定性低方面的担忧。
有研究认为, 抗菌肽在发挥抑菌作用时, 首先攻击的位点是细胞膜, 通过促使细胞膜破裂等起到杀死细菌的作用, 例如, 抗菌肽Alamethicin主要通过由3-11个螺旋杆排列形成跨膜螺旋束或形成桶-板模式使细胞膜上形成许多孔洞, 从而增强细胞膜的通透性而杀死细菌[22]。本实验通过激光共聚焦显微镜观察得知, FITC绿色荧光可以充满整个细菌细胞, 表明S-2/S-2-N能够完全进入细胞质内, 且暗示了S-2/S-2-N的作用靶点应位于细胞质内。
据报道, 环形肽可以扰乱磷脂双分子层形成1-2 nm的环形孔, 导致细胞内容物大量外漏发挥杀伤作用[23]。通过电子透射显微镜观察超微结构发现, S-2/S-2-N处理细胞2 h后, 大肠杆菌细胞均有内容物流出, 且S-2-N可使细胞达到基本破裂, 甚至瓦解, 最后导致细菌死亡。
有研究发现, 抗菌肽protegrin-1(PG-1)以一种依靠脂质成分的膜相互作用方式来穿透细胞膜发挥杀菌作用[24]。于是, 我们利用流式细胞仪检测了S-2/S-2-N对大肠杆菌细胞完整性和穿透效率的影响, 结果发现对大肠杆菌菌膜的破坏作用不太强, 但二者穿透细胞膜的效率比较高(即阳性细胞的比例), 且S-2-N的穿透效率达到了54.97%。此结果正好与透射电镜所观察到的结果一致, 均说明了AMP-S-2-N具有更强的杀菌能力。
大多数抗菌肽的作用靶点为细胞膜, 通过破坏或溶解细胞膜来达到杀伤细菌的效果。而研究发现有些抗菌肽的作用靶点则位于细胞内, 例如, 抗菌肽Indolicidin可以诱导大肠杆菌丝化并抑制大肠杆菌DNA的合成[25]。在本实验中, AMP-S-2-N和AMP-S-2的主要作用部位就是胞内的核酸-DNA。从图 7可以看出AMP-S-2-N/S-2都减少了大肠杆菌(K12D31)细胞中DNA/RNA的含量, 即影响了核酸的合成。已报道, 抗菌肽Butorin Ⅱ穿透大肠杆菌细胞膜后与DNA和RNA结合, 抑制细胞功能从而导致细菌快速死亡; 而magainin 2也可以进入细胞内与DNA和RNA结合, 从起到抑菌作用[26-27]。本文通过凝胶阻滞实验证明了AMP-S-2-N和AMP-S-2可以不同程度地结合DNA和RNA, 呈浓度梯度依赖性, 且AMP-S-2-N结合DNA的能力强于母体肽。另外, 图 9结果与凝胶阻滞实验结果相一致, 再次证明了AMP-S-2-N和AMP-S-2与DNA具有亲和力, 但具体抗菌肽通过哪种作用力与DNA什么部位结合需要进一步探究。
此外, 有些抗菌肽可以抑制DNA复制相关的酶, 如PR-39[28]。本实验发现, AMP-S-2-N和AMP-S-2不仅能够影响大肠杆菌的细胞周期而且对DNA相关基因的表达也有影响。从图 11可以看出, 在正常大肠杆菌的细胞周期图中, 处于S期的细胞数为18.14%, S-2/S-2-N处理后, 处于S期的细胞数为23.86%和26.32%, 与阴性对照组有明显差异, 且与阳性对照组(Buforin Ⅱ)33.10%结果类似, 说明AMP-S-2-N和AMP-S-2抑制了大肠杆菌细胞周期的进行; 另外, 通过RT-PCR技术分析与大肠杆菌DNA复制和修复相关的基因表达情况发现, AMP-S-2-N和AMP-S-2下调了基因dnaA、dnaB、dnaG和SSB的表达, 同时促进了RecA和RecN的表达。
综上所述, AMP-S-2-N和AMP-S-2通过抑制大肠杆菌DNA和RNA合成, 能够结合DNA和RNA, 影响DNA二级结构以及细胞周期和DNA相关基因的表达, 从而达到抑菌的效果。
4 总结本研究主要以少棘蜈蚣抗菌肽Scolopin-2-NH2为研究对象, 对其抗菌活性、理化性质以及在细胞和分子水平上抗菌机制的进行了探究。得出了以下结论:(1)抗菌肽Scolopin-2-NH2及其母体肽对E.coli K12D31具有较强的抗菌活性, 且Scolopin-2-NH2强于母体肽; 研究发现抗菌肽Scolopin-2-NH2和Scolopin-2具有无规则卷曲的松散二级结构, 这可能与其抗菌活性有关; 另外, 二者对外界环境(热、酸碱、离子、消化酶)具有一定的稳定性。(2)从细胞水平对抗菌机制研究表明, 抗菌肽Scolopin-2-NH2及其母体肽不仅可以破坏大肠杆菌胞膜、快速地进入细胞质内使细菌内容物泄露, 还通过结合DNA/RNA及影响DNA二级结构来达到抑菌效果。(3)从分子水平对抗菌机制研究显示, 抗菌肽Scolopin-2-NH2及其母体肽还可以阻滞大肠杆菌的细胞周期, 抑制DNA复制相关基因(dnaA、dnaB、dnaG和SSB)表达和促进DNA修复相关基因(RecA和RecN)的表达来抑制大肠杆菌的细胞增殖, 从而发挥抗菌作用。
| [1] |
Boman HG, Nilsson I, Rasmuson B. Inducible antibacterial defence system in drosophila[J]. Nature, 1972, 237: 232-235. DOI:10.1038/237232a0 |
| [2] |
Jenssen H, Hamill P, Hancock REW. Peptide antimicrobial agents[J]. Clinical Microbiology Reviews, 2008, 19(3): 491-511. |
| [3] |
刘明辉, 张尚志, 马艳, 等. 抗菌肽及其分子改造研究进展[J]. 安徽农业科学, 2016, 44(16): 147-150. DOI:10.3969/j.issn.0517-6611.2016.16.049 |
| [4] |
李冠楠, 夏雪娟, 隆耀航, 等. 抗菌肽的研究进展及其应用[J]. 动物营养学报, 2014, 26(1): 17-25. DOI:10.3969/j.issn.1006-267x.2014.01.003 |
| [5] |
Michael Z. Antimicrobial peptides of multicellular organisms[J]. Nature, 2002, 415(6870): 389-395. DOI:10.1038/415389a |
| [6] |
Gudmundsson GH, Magnusson KP, Chowdhary BP, et al. Structure of the gene for porcine peptide antibiotic PR-39, a cathelin gene family member:comparative mapping of the locus for the human peptide antibiotic FALL-39[J]. Proc Natl Acad Sci USA, 1995, 92(15): 7085-7089. DOI:10.1073/pnas.92.15.7085 |
| [7] |
Lee H, Hwang JS, Lee J, et al. Scolopendin 2, a cationic antimicrobial peptide from centipede, and its membrane-active mechanism[J]. Biochimica et Biophysica Acta(BBA)- Biomembranes, 2015, 1848(2): 634-642. DOI:10.1016/j.bbamem.2014.11.016 |
| [8] |
Gupta R, Srivastava S. Antifungal effect of antimicrobial peptides(AMPs LR14)derived from Lactobacillus plantarum strain LR/14 and their applications in prevention of grain spoilage[J]. Food Microbiology, 2014, 42(12): 1-7. |
| [9] |
燕晓翠, 杨春蕾, 姚大为, 等. 抗菌肽的国内外研究进展[J]. 天津农业科学, 2017, 23(5): 35-41. DOI:10.3969/j.issn.1006-6500.2017.05.008 |
| [10] |
薛林贵, 马萍, 尚海, 等. 鱼类及两栖动物的抗菌肽研究进展[J]. 生物技术通报, 2017, 33(12): 61-66. |
| [11] |
Bierbaum G, Sahl HG, Bierbaum G, et al. Autolytic system of Staphylococcus simulans 22:influence of cationic peptides on activity of N-acetylmuramoyl-L-alanine amidase[J]. Journal of Bacteriology, 1988, 169(12): 5452-5458. |
| [12] |
陈旋, 李莉蓉. 抗菌肽P7抑制大肠杆菌的非膜作用机制[J]. 微生物学报, 2016, 56(11): 1737-1745. |
| [13] |
王建忠, 徐汉江, 陈晶, 等. 抗菌肽研究进展[J]. 世界最新医学信息文摘, 2016, 16(72): 77-89. DOI:10.3969/j.issn.1671-3141.2016.72.037 |
| [14] |
Tysoe SA, Morgan RJ, Baker AD, et al. Spectroscopic investigation of differential binding modes of.DELTA.-and.LAMBDA.Ru(bpy)2(ppz)2+ with calf thymus DNA[J]. Journal of Physical Chemistry, 1993, 97(8): 1707-1711. DOI:10.1021/j100110a038 |
| [15] |
杨平, 袁奕豪, 杨晓莉, 等. 抗菌肽高效表达及生产优化研究进展[J]. 生物技术通报, 2016, 32(3): 24-30. |
| [16] |
刘伟, 皮雄娥, 王欣. 抗菌肽与肠道健康研究新进展[J]. 微生物学报, 2016, 56(10): 1537-1543. |
| [17] |
陈亮, 李瑞静, 黄亮, 等. 微生物抗菌肽及其在动物生产中的应用[J]. 中国畜牧杂志, 2017, 53(2): 15-18. |
| [18] |
Pemberton RW. Insects and other arthropods used as drugs in Korean traditional medicine[J]. J Ethnopharmacol, 1999, 65(3): 207-216. DOI:10.1016/S0378-8741(98)00209-8 |
| [19] |
You WK, et al. Purification and molecular cloning of a novel serine protease from the centipede, Scolopendra subspinipes mutilans[J]. Insect Biochemistry and Molecular Biology, 2004, 34(3): 239-250. DOI:10.1016/j.ibmb.2003.10.003 |
| [20] |
Peng K, Kong Y, et al. Two novel antimicrobial peptides from centipede venoms[J]. Toxicon, 2010, 55(2-3): 274-279. DOI:10.1016/j.toxicon.2009.07.040 |
| [21] |
Boman HG, Agerberth B, Boman A. Mechanisms of action on Escherichia coli of cecropin P1 and PR-39, two antibacterial peptides from pig intestine[J]. Infecti Immun, 1993, 61(7): 2978-2984. |
| [22] |
Yanmei L, Qi X, Qihao Z, et al. Overview on the recent study of antimicrobial peptides:origins, functions, relative mechanisms and application[J]. Peptides, 2012, 37(2): 207-215. DOI:10.1016/j.peptides.2012.07.001 |
| [23] |
Junkes C, Harvey RD, Bruce KD, et al. Cyclic antimicrobial R-, W-rich peptides:the role of peptide structure and E.coli outer and inner membranes in activity and the mode of action[J]. Biophysics of Structure & Mechanism, 2011, 40(4): 515-528. |
| [24] |
Gidalevitz D, Ishitsuka Y, Muresan AS, et al. Interaction of antimicrobial peptide protegrin with biomembranes[J]. Proc Natl Acad Sci USA, 2003, 100(11): 6302-6307. DOI:10.1073/pnas.0934731100 |
| [25] |
Subbalakshmi C, Sitaram N. Mechanism of antimicrobial action of Indolicidin[J]. Fems Microbiology Letters, 1998, 160(1): 91-96. DOI:10.1111/fml.1998.160.issue-1 |
| [26] |
Park CB, Kim HS, Kim SC. Mechanism of action of the antimicrobial peptide buforin Ⅱ:buforin Ⅱ kills microorganisms by penetrating the cell membrane and inhibiting cellular functions[J]. Biochem Biophys Res Commun, 1998, 244(1): 253-257. DOI:10.1006/bbrc.1998.8159 |
| [27] |
Imura Y, Nishida M, Matsuzaki K. Action mechanism of PEGylated magainin 2 analogue peptide[J]. Biochimica Et Biophysica Acta, 2007, 1768(10): 2578-2585. DOI:10.1016/j.bbamem.2007.06.013 |
| [28] |
Anbanandam A, Albarado DD, Simons M, et al. Molecular basis for proline- and arginine-rich peptide inhibition of proteasome[J]. Journal of Molecular Biology, 2008, 384(384): 219-227. |