真菌毒素是真菌的次级代谢产物, 在食品中复合污染现象极为普遍, 在东南亚、南欧和北美粮油产品中AFB1和ZEN两种毒素检出率分别高达65%、41%、49%和8%、87%和52%[1]。此外, 肝癌(Hepatocellular carcinoma, HCC)是威胁全球公众健康最严重的恶性肿瘤之一, 每年大约有60万人死于HCC[2-4]。在我国, HCC仅次于肺癌, 死亡率高达14.56%, 并呈上升趋势, 导致HCC的因素非常复杂, 其中通过膳食摄入真菌毒素是关键暴露途径, 尤其是多种毒素的联合暴露, 但该因素常常被忽略[4]。
AFB1已被明确为Ⅰ类致癌物, 全球大约4.6%-28.2%的HCC由AFB1摄入引起[5]。同时, 其他多项研究表明与AFB1产生联合毒性效应的ZEN也可诱导随后肝病变和HCC的发生[3, 7-8]。当前主要认同联合肝毒性分子机制大体可描述为:抑制线粒体功能, 细胞内钙稳态紊乱, 凋亡通路被激活, 产生氧化应激反应, 抑制或激活特异性酶功能(如P450)导致免疫功能障碍和代谢失调, 发生肝损伤及后期癌变等[9]。其中凋亡路径是影响肝毒性联合效应主要通路之一, 凋亡基因Bax与caspases-3等, 以及代谢活性表达基因P450等起到至关重要的作用[10]。Xu等[11]利用人源原代肝细胞针对四环素等300余种具有肝毒性药物进行体外高内涵(HCS)高通量测试, 并与临床结果进行比对, 发现线粒体损伤(Mito)、氧化应激(ROS)、胞内还原型谷胱甘肽(GSH)含量是表针肝毒性3个最重要的特征指标, 假阳性率低至0-5%。Li等[12]采用组合荧光探针标记的HTS结合模型预测实现了多种生物毒素联合肝毒性效应的合理估计及预测。但基于HepG2肝癌细胞, 从凋亡通路基因表达、亚细胞早期损伤及细胞凋亡结局等层面来探讨联合肝毒性还较少。基于此, 本研究拟采用高内涵筛选、RT-PCR手段并结合CI指数模型及Tukey HSD多重分析比较等, 研究“AFB1+ZEN”单一及复合作用于HepG2细胞诱导的联合肝毒性效应及可能的机制, 结果为多种真菌毒素联合毒性的识别及风险管控措施的制定提供借鉴与参考。
1 材料与方法 1.1 材料HepG2人肝癌细胞购自中国科学院上海生命科学研究院细胞资源中心; DMEM培养基、胎牛血清(FBS)、青霉素-链霉素溶液(PS)、磷酸盐缓冲溶液(PBS)购自Gibco公司; AFB1标准品(纯度≥99%)、ZEN标准品(纯度≥99%)、二甲基亚砜(DMSO)购自Sigma公司; 荧光探针:HCS NuclearMaskTM Deep Red Stain(NDR)、CellROX Green Reagent(CellROX)、monochlorobimane(mBCL)、Mitotracker red(Mito)以及高纯总RNA快速提取试剂TRIzol Reagent购自Invitrogen公司; 反转录试剂盒Transcriptor First Strand cDNA synthesis Kit、qPCR试剂FastStart Universal SYBR GreenMaster(ROX)购自Roche公司。
OperettaTM高内涵筛选系统(High Content Screening), 美国Perkin Elmer公司; 7500 Fast Real-Time PCR仪, 美国Applied Biosystems公司; NanoDrop 2000C超微量分光光度计和CO2恒温培养箱, 美国Thermo Scientific公司; Countstar全自动细胞计数仪, 上海睿钰生物科技有限公司。
1.2 方法 1.2.1 细胞复苏与培养液氮中取出冻存的HepG2细胞, 悬浮放置37℃水浴锅内, 并于1 min内快融, 1 000 r/min离心3 min, 无菌操作条件下, 弃上清液, 加入1 mL新鲜培养基重悬吹打均匀。将HepG2细胞利用含有10%胎牛血清和1%青霉素-链霉素的DMEM培养液, 于饱和湿度5%CO2、37℃培养箱中培养。HepG2细胞为贴壁生长, 每隔2 d可传代培养。传代时1 mL胰蛋白酶液消化2 min, 待细胞变圆同时出现间隙, 立刻加入2 mL完全培养液终止消化, 轻轻吹打成细胞悬液, 1 000 r/min离心3 min, 弃上清, 2 mL完全培养液重悬细胞, 吹打均匀后将其分装至2瓶。
1.2.2 细胞活性试验取对数生长期的HepG2细胞消化、收集制成单细胞悬液, 计数并调整细胞浓度并以1×104个/孔接种于96孔板中进行培养, 待其贴壁更换含有不同浓度AFB1、ZEN及其联合组的培养液, 其中单一染毒条件是AFB1和ZEN的终浓度均分别为:1、2、4、5、8、10 μg/mL, 以确定IC50; 联合染毒以单一真菌毒素的IC50为基准, 做等毒1:1混合, 并以2倍梯度稀释, 共设5个梯度; 单一及联合染毒每孔均加入药液100 μL, 所需浓度梯度以含有0.1%DMSO培养基稀释。对照组每孔加入等体积含有0.1%DMSO的培养基, 空白组只加入等体积培养液, 实验组与对照组均设6个平行。高内涵筛选系统选择DPC明场通道、20×物镜下进行细胞计数, 每孔选取23个视野观察并计算, AFB1、ZEN的IC50通过GraphPad Prism 7.04软件计算获取。进行3次独立重复试验验证试验结果。
1.2.3 CI模型评估联合肝毒性组合指数(combination index, CI)是在半数效应基础上发展起来的不依赖于作用模式, 用于估计混合物联合毒性指数的模型, 可定性评估联合毒性相互作用模式(协同、增毒或拮抗)和定量评估相互联合作用的大小, 已广泛用于多种药物联合用药的安全性评价及研究。对于n种药物组合, 分析模型有:

其中, n(CI)x表示n种真菌毒素的混合物产生x%细胞抑制率下的组合指数; (Dx)1-n是x%细胞损失率下n种真菌毒素混合物浓度之和; {([D]j)∑1n[D]}是x%细胞损失率下每种真菌毒素的比例; Dm是中值效应剂量; (Dm)j{(fax)j/[1-(fax)j]}1/mj表示单一真菌毒素产生x%细胞损失率下的浓度水平。AFB1、ZEN的联合作用模式可由CompuSyn软件2.0计算[13]。
1.2.4 高内涵筛选分析组合筛选荧光探针NDR(Ex/Em 638/686 nm), CellROX(Ex/Em 504/529 nm), mBCL(Ex/Em 380/461 nm)和Mito(Ex/Em 579/599 nm), 分别标记细胞核、活性氧(ROS)、谷胱甘肽(GSH)和线粒体膜电位(MMP)等肝毒性敏感指针。将稀释的探针逐次加入37℃预热的培养基中制备荧光探针混合物。然后按照1.2.2方法, 将AFB1、ZEN单独及联合染毒HepG2细胞, 分别处理3 h、6 h和24 h后更换荧光探针混合物, 共孵育30 min, 弃液, 用PBS清洗2-3次。上述过程均在避光条件下操作。选择适当荧光通道, 20×物镜下, 每孔选取7个视野观察和计算。ROS、GSH和MMP荧光强度用HCS中Harmony软件进行分析, 进行3次独立重复试验验证试验结果。
1.2.5 总RNA提取及RT-PCR按照1.2.4的方法, 以AFB1、ZEN的IC50单独剂量和1:1等毒联合组处理HepG2细胞, 分别作用3 h、6 h和24 h后吸除培养基。用Trizol法抽提细胞中总RNA, 取少量用NanoDrop测定其OD值, 确定DNA浓度水平, 其余于-80℃冰箱内保存。采用Transcriptor First Strand cDNA synthesis Kit进行RNA反转录, 并于-20℃下保存。按SYBR® Premix Ex TaqTMⅡ试剂盒进行荧光定量PCR反应, 用荧光定量PCR仪检测基因表达强度Ct值, 按2-ΔΔCt方法计算[14], 进行3次独立重复试验取平均值。设计上下游引物和内参引物序列如表 1所示。
不同浓度AFB1、ZEN单独处理HepG2细胞24 h, 基于HCS计算得出AFB1和ZEN的IC50分别为6.29 μg/mL、7.44 μg/mL。由图 1-A可见, 随着AFB1、ZEN浓度升高, 在较低浓度范围内, 细胞损失率变化趋势更为显著。根据CI模型评估联合组浓度、fa(效应水平)和CI指数之间的关系(图 1-B), 总体趋势随着混合物浓度的升高, fa不断增强, 当fa=0.05时, 呈现轻微拮抗作用; 而当fa>0.05时, 在实验浓度范围内, 呈现增毒及协同效应, 且随fa增强, 由轻微增毒逐步过渡至协同效应且逐步增强。
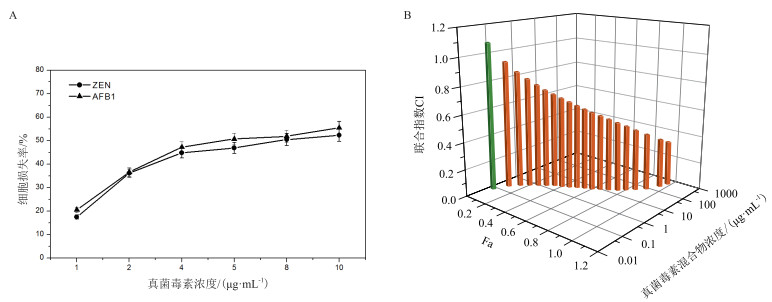
|
| 图 1 AFB1、ZEN单一及联合肝毒性效应 A:单一作用于HepG2细胞的损失率; B:基于CI指数模型分析得出联合毒性强度及性质 |
早期毒性损伤指标ROS、GSH和MMP以每个细胞荧光强度均值相对于空白荧光强度来表征。图 3所示, AFB1和ZEN单一及联合处理细胞, ROS水平均随毒素处理时间的延长而上升, 而GSH和MMP水平呈现逐步下降趋势。不同处理时间的差异基于Tukey HSD多重分析比较进行评价, 单一及联合处理条件下, 3 h时, ROS均很快上升至较高水平, 而后随处理时间延长, 其上升趋势逐步缓慢; 处理3-6 h, ZEN与ZEN+AFB1联合组差异不显著, 而与AFB1相比呈现显著差异; 6-24 h, 3组均具有显著差异。对于GSH而言, ZEN及AFB1+ZEN组随处理时间延长GSH变化差异显著, 而AFB1单独处理细胞, 染毒0-3 h内下降趋势较为显著, 3-6 h趋势减缓, 继续延长染毒时间下降趋势又显著增强; MMP变化趋势与GSH类似。
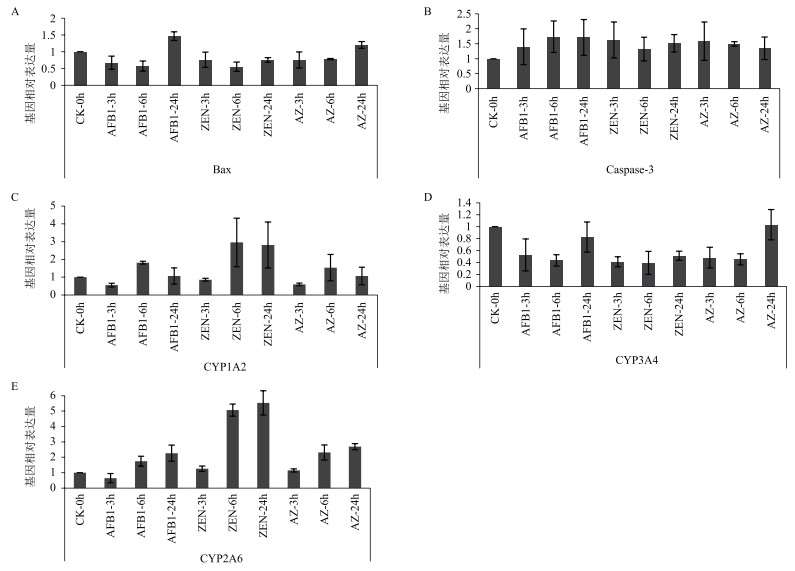
|
| 图 3 AFB1和ZEN单独及联合组作用于HepG2细胞相关基因表达影响 h为对照组; 3 h不同毒素处理样本AFB1-3h、ZEN-3h、AZ(AFB1+ZEN)-3h;6 h不同毒素处理样本AFB1-6h、ZEN-6h、AZ-6h;24 h不同毒素处理样本AFB1-24h、ZEN-24h、AZ-24h。A:Bax基因相对表达量; B:Caspase-3基因相对表达量; C:CYP1A2基因相对表达量; D:CYP2A6基因相对表达量; D:CYP3A4基因相对表达量 |
由图 4-A可见, 相比对照组, ZEN、AFB1与AFB1+ZEN作用3-6 h后, Bax相对表达量均下调, 而作用6-24 h, 表达量上调; 同时, Bax相对表达量变化总体趋势与GSH、MMP的变化趋势同步。由图 4-B AFB1、ZEN单独及其联合均上调Caspase-3基因相对表达量, 但不同时间组, 该差异不显著。
CYP1A2、CYP2A6和CYP3A4同为p450基因家族中的一员, 结合图 4-C、D、E可见, AFB1处理3 h时, 3种基因表达均呈下调; 随后3种基因表达变化趋势出现差异, 其中CYP1A2和CYP2A6表达量快速上升, 24 h又恢复至接近3h表达水平, 而CYP3A4基因表达量在6-24 h一直维持上调。
3 讨论目前联合毒性研究主要基于体外敏感细胞系, 并采用MTT法、中性红法和CCK-8法等活力测定来实现评价, 但已有研究表明上述方法在精准度上依然存在不足[15]。此外, 传统体外细胞毒性评价表征晚期毒性, 对亚细胞及早期损伤信号的捕获及过程呈现上严重不足, 机制阐述具有严重局限性。本研究利用HCS手段结合RT-PCR, 通过对关键凋亡基因、亚细胞早期损伤指针及细胞损失率等, 分析AFB1、ZEN单一及联合作用于HepG2细胞的联合肝毒性效应及可能的机制。
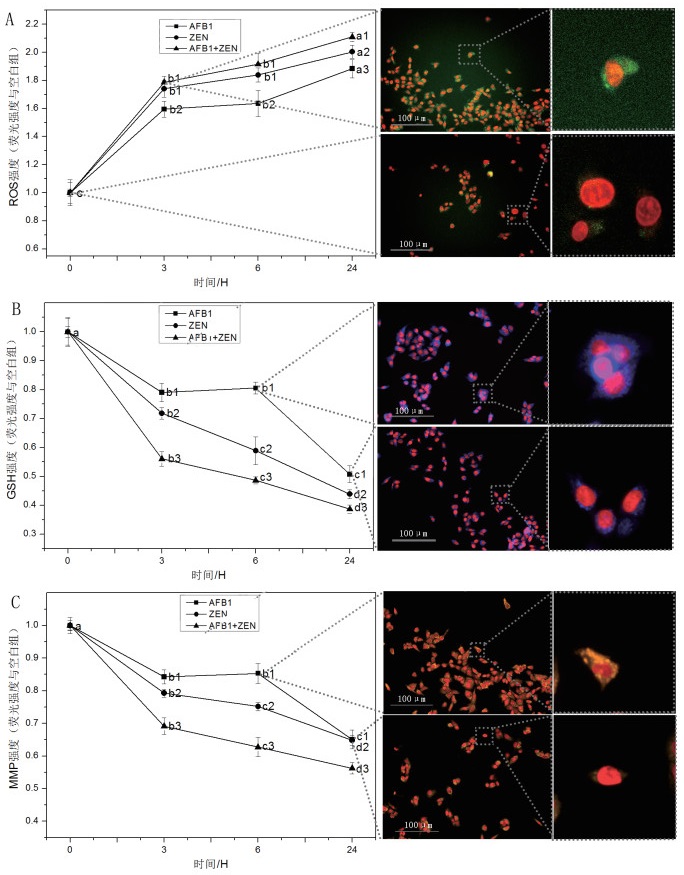
|
| 图 2 单一及联合处理HepG2细胞, ROS、GSH、MMP强度随时间变化影响及HCA图像 红色代表细胞核; A:绿色代表ROS强度; B:蓝色代表GSH强度; C:橙色代表MMP强度。基于单因素方差分析分析和Tukey HSD多重分析比较不同处理组之间的差异, 其中相同字母(数字)表示没有差异, 不同的字母(数字)表示显著差异(P < 0.05) |
CI模型评估结果显示, 试验浓度范围内, 随浓度水平的升高, AFB1+ZEN联合毒性由弱拮抗效应转变为增毒直至协同效应。有研究表明[16], 猪肾脏细胞系(PK-15)联合暴露于AFB1+ZEN, 低浓度水平下产生拮抗作用, 但剂量提高至5 μmol/L和10 μmol/L则产生协同效应。AFB1+ZEN+DON三元组合作用于BRL 3A细胞系, 低剂量水平下也表达为拮抗效应而高浓度下呈现协同效应[17]。因此, 总体表明, 随浓度的升高, 真菌毒素联合暴露组作用细胞的联合毒性呈现拮抗效应向协同效应转变的趋势, 但具体发生的拐点根据具体暴露组合、剂量水平、作用时间、作用方式下以及细胞系酶代谢活性及能力不同而不同, 联合毒性的强度也会呈现差异, 甚至差异性较大。
AFB1和ZEN作用于HepG2细胞, 呼吸链Complex Ⅰ和Complex Ⅲ反应产生ROS以应对外源刺激, 胞内GSH可不断清除代谢过程中产生的ROS, 使细胞内氧化还原系统处于相对动态、平衡和稳定的水平。由于线粒体缺乏谷胱甘肽合成酶, 因此mGSH和GSH在细胞质中合成, 但AFB1、ZEN作用细胞会导致该功能运输系统破坏, mGSH合成减少, 进而导致ROS积聚, 活性氧产生并触发抗氧化防御能力失衡从而降低MMP, Hassen等[18]的研究也证实该结论。另外相关研究[19-21]表明, 无论单一还是联合组, 通过p53线粒体信号通路, 会增加促凋亡因子/抗凋亡因子比来诱导GSH和MMP水平下降。因此, CI模型预测AFB1+ZEN联合作用细胞, 肝毒性呈现协同联合效应可能与线粒体损伤和GSH与MMP下降有关。
基因表达层面, 细胞P450主要参与体内药物代谢, 许多内源性、外源性化合物在体内Ⅰ相生物转化上具有重要作用, 真菌毒素通过P450基因家族的调控来影响其毒性表达。细胞暴露于AFB1 3h, CYP1A2、CYP2A6和CYP3A4基因表达均受到抑制, 这可能由于细胞关闭了p450代谢途径中相关重要基因表达通道, 但细胞生存应激, 又开启其他补偿途径, 使CYP1A2和CYP2A6基因表达量快速上升, 以促进细胞对AFB1的代谢。ZEN处理细胞, CYP1A2、CYP2A6和CYP3A4基因表达量先下调后上调, 直至24 h, 这表明细胞对ZEN的代谢持续时间较长, 24 h可能依然未完成。有研究[22]发现, P450降低与线粒体氧化损伤有关, 本研究得出CYP1A2等p450基因家族表达量的变化也与ROS、MMP等亚细胞早期凋亡指标表达趋势呈现上述相关性。
Bax、Caspase-3等是诱导细胞凋亡的关键基因[23-24]。其中, Bax基因主要存在于线粒体膜上, 为促凋亡因子, 主要调控细胞凋亡途径中外源通路的线粒体通路[25]。外源性通路主要由Caspase家族中的启动因子来调控, 以线粒体为核心来激活细胞凋亡, 大量的胞内信号包括各种应激、DNA损失、异常的细胞信号均可引起促凋亡蛋白Bax的活化, 该蛋白诱导线粒体释放细胞色素C, 形成凋亡小体或活化启动子。内源性和外源性通路最终会激活Caspase家族中的效应因子如Caspase-3, 从而启动细胞凋亡进程[26]。结合Bax表达结果分析, AFB1和ZEN造成细胞凋亡的途径交叉存在, Bax基因主要参与毒素作用后期。细胞凋亡途径十分复杂且交互作用。线粒体中心磷脂氧化、通透性转换孔开放等是较MMP改变的线粒体损伤更早期指标[21]; 另外, 真菌毒素除引起线粒体损伤外, 还可通过其它方式, 如脂肪变性、胆汁淤积等诱导肝毒性[27], 因此利用HCA同步监测更多毒性早期损伤指标具有在联合毒性的作用机制解析上具有重要意义。
4 结论本研究利用HCS手段, 从基因、亚细胞二级信使以及细胞活性等层面对“AFB1+ZEN”单一及联合作用于HepG2肝癌细胞的毒性效应和机制进行探究。实验结果表明, 真菌毒素AFB1和ZEN肝毒性机制可能有:一方面利用死亡受体激活凋亡执行子caspases-3进入凋亡程序; 另一方面, 毒素刺激诱导HepG-2细胞内促凋亡因子Bax表达增加, 线粒体膜电位下降, 释放细胞色素C并激活caspase-3, 诱导细胞产生氧化应激损伤, 最终通过蛋白酶水解而诱导细胞产生早期损伤直至凋亡。多种毒性指标及CI模型评估验证了此两种毒素对细胞的联合毒性作用在高剂量水平下多表现为协同效应, 由于该效应对风险具有放大作用, 同时考虑实际毒素大多会以慢性/亚慢性膳食消费模式经口暴露, 因此为更科学合理保护消费者健康安全, 在实际农产品和食品限量制定和防控监管过程中, 适当考虑该风险具有一定意义。
| [1] |
Rodrigues I, Naehrer K. Biomin Survey 2010:Mycotoxins inseparable fromanimal commodities and feed[J]. Raw Materials, 2011, 2: 17-20. |
| [2] |
Gomaa AI, Khan SA, Toledano MB, et al. Hepatocellular carcinoma:Epidemiology, risk factors and pathogenesis[J]. World Journal of Gastroenterology, 2008, 14(27): 4300-4308. DOI:10.3748/wjg.14.4300 |
| [3] |
Kucukcakan B, Hayrulaimusliu Z. Challenging role of dietary aflatoxin B1 exposure and hepatitis B infection on risk of hepatocellular carcinoma[J]. Open Access Macedonian Journal of Medical Sciences, 2015, 3(2): 363-369. DOI:10.3889/oamjms.2015.032 |
| [4] |
Palencia ER, Hinton DM, Bacon CW. The black Aspergillus species of maize and peanuts and their potential for mycotoxin Production[J]. Toxins, 2010, 2(4): 399-416. DOI:10.3390/toxins2040399 |
| [5] |
Rocha MEBD, Maia FEF, Guedes MIF, et al. Mycotoxins and their effects on human and animal health[J]. Food Control, 2014, 36(1): 159-165. DOI:10.1016/j.foodcont.2013.08.021 |
| [6] |
Zhou H, George S, Hay C, et al. Individual and combined effects of Aflatoxin B 1, deoxynivalenol and zearalenone on HepG2 and RAW 264.7 cell lines[J]. Food & Chemical Toxicology, 2017, 103: 18-27. |
| [7] |
Wan LY, Turner PC, Elnezami H. Individual and combined cytotoxic effects of Fusarium toxins(deoxynivalenol, nivalenol, zearalenone and fumonisins B1)on swine jejunal epithelial cells[J]. Food & Chemical Toxicology, 2013, 57(7): 276-283. |
| [8] |
Wang HW, Wang JQ, Zheng BQ, et al. Cytotoxicity induced by ochratoxin A, zearalenone, and α-zearaleno:Effects of individual and combined treatment[J]. Food & Chemical Toxicology, 2014, 71: 217-224. |
| [9] |
Schoonen WG, de Roos JA, Westerink WM, et al. Cytotoxic effects of 110 reference compounds on HepG2 cells and for 60 compounds on HeLa, ECC-1 and CHO cells.Ⅱ mechanistic assays on NAD(P)H, ATP and DNA contents[J]. Toxicology in Vitro, 2005, 19(4): 491-503. DOI:10.1016/j.tiv.2005.01.002 |
| [10] |
李文竹, 张根义, 桑亚秋. 真菌毒素(DON、AFB_1)对HepG2/C3A细胞联合毒性及机理研究[J]. 食品与生物技术学报, 2017, 36(11): 1171-1179. DOI:10.3969/j.issn.1673-1689.2017.11.008 |
| [11] |
Xu JJ, Henstock PV, Dunn MC, et al. Cellular imaging predictions of clinical drug-induced liver injury[J]. Toxicological Sciences, 2008, 105(1): 97-105. DOI:10.1093/toxsci/kfn109 |
| [12] |
Li Y, Wang TQ, Wu J, et al. Multi-parameter analysis of combined hepatotoxicity induced by mycotoxin mixtures in HepG2 cells[J]. World Mycotoxin J, 2018, 11(2): 225-235. DOI:10.3920/WMJ2017.2201 |
| [13] |
Chou TC, Martin N. CompuSyn software for drug combinations and for general dose-effect analysis, and user's guide[M]. Paramus(NJ), USA: ComboSyn Inc, 2005.
|
| [14] |
Vanguilder HD, Vrana KE, Freeman WM. Twenty-five years of quantitative PCR for gene expression analysis[J]. Biotechniques, 2008, 44(5): 619-626. DOI:10.2144/000112776 |
| [15] |
Ramirez CN, Antczak C, Djaballah H. Cell viability assessment:toward content-rich platforms[J]. Expert Opinion on Drug Discovery, 2010, 5(3): 223-233. DOI:10.1517/17460441003596685 |
| [16] |
Lei M, Zhang N, Qi D. In vitro investigation of individual and combined cytotoxic effects of aflatoxin B1 and other selected mycotoxins on the cell line porcine kidney 15[J]. Experimental & Toxicologic Pathology, 2013, 65(7-8): 1149-1157. |
| [17] |
Sun LH, Lei MY, Zhang NY, et al. Individual and combined cytoto-xic effects of aflatoxin B1, zearalenone, deoxynivalenol and fumoni-sin B1 on BRL 3A rat liver cells[J]. Toxicon J, 2015, 95: 6-12. DOI:10.1016/j.toxicon.2014.12.010 |
| [18] |
Hassen W, Ayed-Boussema I, Oscoz AA, et al. The role of oxidative stress in zearalenone-mediated toxicity in HepG2 cells:Oxidative DNA damage, gluthatione depletion and stress proteins induction[J]. Toxicology, 2007, 232(3): 294-302. DOI:10.1016/j.tox.2007.01.015 |
| [19] |
Liu Y, Du M, Zhang G. Proapoptotic activity of aflatoxin B 1, and sterigmatocystin in HepG2 cells[J]. Toxicology Reports, 2014, 1(C): 1076-1086. |
| [20] |
Ren Z, Deng H, Deng Y, et al. Combined effects of deoxynivalenol and zearalenone on oxidative injury and apoptosis in porcine splenic lymphocytes in vitro[J]. Experimental & Toxicologic Pathology, 2017, 69(8): 612-617. |
| [21] |
张跃.P53介导的ROS及线粒体通路在Azurin及其联合化疗药物诱导骨肉瘤细胞凋亡的机制探讨[D].杭州: 浙江大学, 2013. http://cdmd.cnki.com.cn/Article/CDMD-10335-1013314518.htm
|
| [22] |
Guerre P, Pineau T, Costet P, et al. Effects of AFB1 on CYP 1A1, 1A2 and 3A6 mRNA, and P450 expression in primary culture of rabbit hepatocytes[J]. Toxicology Letters, 2000, 111(3): 243-251. DOI:10.1016/S0378-4274(99)00181-2 |
| [23] |
Gollibennour EE, Kouidhi B, Bouslimi A, et al. Cytotoxicity and genotoxicity induced by aflatoxin B1, ochratoxin A, and their combination in cultured Vero cells[J]. Journal of Biochemical & Molecular Toxicology, 2010, 24(1): 42-50. |
| [24] |
Satoh D, Iwado S, Abe S, et al. Establishment of a novel hepatocyte model that expresses four cytochrome P450 genes stably via mammalian-derived artificial chromosome for pharmacokinetics and toxicity studies[J]. PLoS One, 2017, 12(10): e0187072. DOI:10.1371/journal.pone.0187072 |
| [25] |
Li D, Ma H, Ye Y, et al. Deoxynivalenol induces apoptosis in mouse thymic epithelial cells through mitochondria-mediated pathway[J]. Environ Toxicol Pharmacol, 2014, 38(1): 163-171. DOI:10.1016/j.etap.2014.05.015 |
| [26] |
徐慧, 石慧, 张银志, 等. 真菌毒素DON和ZEN的体外联合毒性评价[J]. 食品工业科技, 2017(23): 268-274. |
| [27] |
O'Brien PJ. High-content analysis in toxicology:screening substances for human toxicity potential, elucidating subcellular me-chanisms and in vivo use as translational safety biomarkers[J]. Basic & Clinical Pharmacology & Toxicology, 2014, 115(1): 4-17. |





