2. 中国热带农业科学院橡胶研究所/农业部橡胶树生物学与遗传资源利用重点实验室/省部共建国家重点实验室培育基地-海南省热带作物栽培生理学重点实验室/海南省热带作物栽培生理学重点实验室, 儋州 571737
2. Rubber Research Institute, Chinese Academy of Tropical Agricultural Sciences/Key Laboratory of Biology and Genetic Resources of Rubber Tree for Ministry of Agriculture/State Key Laboratory Incubation Base for Cultivation & Physiology of Tropical Crops/Hainan Provincial Key Laboratory of Tropical Crops Cultivation and Physiology, Danzhou 571737
橡胶树(Hevea brasiliensis)原产于亚马逊河流域, 是2 000多种产胶植物中唯一商业化种植收获胶乳(天然橡胶原料)的植物。天然橡胶作为四大工业原料之一, 是关系国计民生的基础产业和重要战略物资。我国天然橡胶供需矛盾日益凸显, 自2009年以来自给率已不足20%。我国属非传统植胶区, 橡胶树在生长周期内不可避免会受低温、台风、季节性干旱、病虫害等逆境条件影响。作为橡胶树生长环境中的重要影响因子, 逆境胁迫必然对橡胶树的生长、发育和胶乳代谢等造成影响[1-4]。因此, 如何有效提高橡胶树对逆境胁迫的耐受性, 是橡胶树研究领域中重要且有潜在应用前景的课题。
多胺(Polyamines, PAs)是一类具有强生物活性的低分子脂肪族含氮碱, 它可调节植物胚胎发生、根茎生长和衰老、花发育和果实成熟等生理过程[5-8]。PAs生物合成起始于腐胺(Putrescine, Put), 在由精氨酸脱羧酶(Arginine decarboxylase, ADC)和鸟氨酸脱羧酶(Ornithine decarboxylase, ODC)催化的2条Put合成途径中[9], 已报道的多数植物中以ADC合成途径为主。ADC是一种依赖于吡哆醛-5'-磷酸(Pyridoxal 5'-phosphate, PLP)的酶[10], 作为PAs合成的重要酶, ADC在调控PAs动态平衡中发挥重要作用, 同时ADC还与植物的抗逆相关。继燕麦中克隆ADC基因后[11], 又相继从苹果、水稻、桃、棉花、颠茄等物种中克隆和鉴定出[12-16]。ADC基因表达一般无组织特异性, 它通过调节PAs代谢参与植物抗逆反应。酸胁迫下大豆ADC活性增加, 并与ADC mRNA水平呈正相关[17]。在水稻中过表达曼陀罗ADC基因可提高Spd和Spm水平, 进而增强水稻抗旱性[18]。在金柑中, 转录因子FcWRKY70通过调控ADC基因表达水平来调节Put合成, 以此增强植株抗旱性[19], ADC基因的表达调控PAs的水平, 增强杜梨抗旱性[20]。胁迫诱导的AtADC2调节植株体内Put积累, 从而增强转基因拟南芥的抗旱和耐盐性, AtADC2突变体对盐敏感需外施Put缓解[21-22]。ADC与枳ICE1相互作用调节PAs水平增强抗寒能力[23]。提高小麦中依赖ADC的Put含量从而降低根细胞壁的铝残留率, 增强小麦植株的耐铝性[24]。除与非生物逆境反应相关外, ADC基因还参与细胞凋亡、抗病和防御反应。胡椒ADC1通过调节PAs和γ-氨基丁酸代谢调控细胞凋亡和防御反应[25]。拟南芥ADC基因参与植株对抗黄绿假单胞菌的反应[26]。柑橘中过表达枳PtADC导致转基因植株矮化, 气孔密度降低, 并极显著地提高了植株对溃疡病的抗性[27]。
鉴于PAs代谢重要基因—ADC在进化和功能上的保守性, 推测其可能在橡胶树逆境胁迫耐受性中发挥重要作用。本实验克隆了一个橡胶树ADC基因、研究了其表达模式, 为深入解析该基因在橡胶树中的功能奠定基础。
1 材料与方法 1.1 材料所用橡胶树的组织样品(雄花、雌花、茎尖、树皮、胶乳和叶片)、不同发育时期叶片、过氧化氢(H2O2)、伤害及乙烯利(Ethephon, ET)处理的胶乳样品, 均采自中国热带农业科学院试验农场定植的橡胶树品系热研7-33-97。低温、干旱、高盐胁迫处理取材为移栽6个月且长势基本一致的热研7-33-97组培苗叶片。
1.2 方法 1.2.1 材料处理选取长势基本一致的未开割热研7-33-97进行创伤、H2O2、ET处理, 以不作任何处理的未开割树为对照。每个处理时间点取3次重复, 每次重复取样5棵树, 采集的胶乳在液氮中速冻并保存, 用于后续RNA提取。参考Hao等[28]方法, 用1%的ET涂于割线及其上方约2 cm割面处, 并采集处理0、4、8、24、48及72 h后的胶乳。伤害和H2O2处理参考Zhu等[29]和Tang等[30]的方法, 将2% H2O2浸泡的棉花包在割线及其上方约2 cm割面处, 采集处理0、6、24及48 h后的胶乳, 用于提取RNA。对橡胶树品系热研7-33-97组培苗进行低温、干旱、高盐胁迫处理, 洗净组培苗根部泥土并放入清水中, 在温度为30℃、湿度为80%、光照12 h(光照强度480 μmol·m-2·s-2)及黑暗12 h环境中静置培养2-3 d, 随后进行胁迫处理。参考安泽伟等[31]方法进行低温(4℃)处理, 参考刘辉等[32]方法进行干旱及高盐胁迫处理, 干旱和高盐胁迫条件分别用30% PEG 6000及1 mol/L NaCl, 采集处理0、3、24及48 h后的叶片并立刻用液氮冻存提取RNA。
1.2.2 总RNA提取、cDNA合成和基因克隆样品总RNA提取用北京百泰克生物技术有限公司的通用植物总RNA提取试剂盒, 提取方法参照说明书。用分光光度法进行定量检测, 用琼脂糖凝胶电泳进行完整性检测。样品cDNA合成操作参照PrimeScriptTM RT reagent Kit with gDNA Eraser试剂盒说明。
根据橡胶树割面干涸机制实验室获得的部分橡胶树ADC基因序列设计特异性引物(F:5'-GCAT-AGAACAAAGGCACCAATTG-3'和R:5'-GCATAGA-ACAAAGGCACCAATTG-3')扩增橡胶树ADC基因, 并通过测序获得基因序列。
1.2.3 生物信息学分析开放阅读框预测用NCBI的ORF finder; 蛋白保守结构域预测用NCBI保守结构域数据库网站(https://www.ncbi.nlm.nih.gov/Structure/cdd/wrpsb.cgi); 用Smart分析蛋白保守结构域(http://smart.emblheidelberg.de/); 用Expasy网站的Prot-Param程序分析蛋白质理化性质(http://web.expasy.org/protparam/); 同源性分析用NCBI中的BLAST和DNASTAR软件; 信号肽预测用SignalP 4.1 Server软件(http://www.cbs.dtu.dk/services/SignalP/); 用TMHMM 2.0程序预测跨膜结构域(http://www.cbs.dtu.dk/services/TMHMM/); 通过在线工具Psort分析目的序列的亚细胞定位(https://www.genscript.com/psort.html)。用ClustalX 1.8及MEGA 5.1做多序列比对并构建进化树[33]。
1.2.4 实时荧光定量PCR根据HbADC1序列设计特异性荧光定量引物(F:5'-GGTTTATACTATGGC-AACGAG-3'和R:5'-GCACAAAACCAACCATACAC-G-3'), 以不同样品反转录cDNA稀释5倍后作为模板, 反应体系为模板2 μL、正反向引物各1 μL、SYBR Premix Ex Taq Ⅱ(2×)10 μL及ddH2O 6 μL。内参为橡胶树18S rRNA(F:5'-GCTCGAAGA-CGATCAGATACC-3'和R:5'-TTCAGCCTTGCGACC-ATAC-3')。每个样品设置3个生物学重复, 基因相对表达量用2-ΔΔCt法计算。用Origin 9.0软件进行数据处理并作图, 相对表达量结果为3次重复的x±s。
2 结果 2.1 HbADC1的克隆及序列分析在分析橡胶树转录组测序数据时发现一条与植物ADC基因高度一致的序列(TSA接受号:GDFU01108758)。根据该序列设计特异性引物, 以橡胶树cDNA为模板进行PCR。扩增产物切胶回收并连接到pMD18-T载体, 挑选阳性克隆PCR扩增验证后进行测序。测序结果(图 1)表明, 该序列长2 594 bp且包含完整ORF, 经Blastx比对, 确定该基因为植物ADC家族成员, 并命名为HbADC1。HbA-DC1最长开放阅读框2 175 bp, 编码724个氨基酸。

|
| 图 1 HbADC1核苷酸序列及推导的氨基酸序列 加粗部分为起始密码子和终止密码子 |
HbADC1预测理论分子量约为77.7 kD, 理论等电点为5.14。HbADC1第119-687位为ADC保守结构域, 第130-404位和第436-604位残基分别为鸟氨酸/赖氨酸/精氨酸和相关底物的结合位点, 属于2-磷酸吡哆醛依赖性的Ⅳ型(鸟氨酸/二氨基庚二酸/精氨酸)ADC家族[37]。信号肽预测结果(图 2)显示, HbADC1无信号肽。亚细胞定位预测结果表明该蛋白属叶绿体运输肽、线粒体靶肽和分泌途径信号肽外的其他类蛋白。

|
| 图 2 HbADC1同源蛋白序列比对 单下划线为预测的信号肽序列; 双下划线为鸟氨酸/二氨基庚二酸/精氨酸脱羧酶家族2-磷酸吡哆醛结合位点; 参与磷酸吡哆醛结合的赖氨酸残基上方用▽标出; 阴影为高度保守序列 |
为分析HbADC1与其他植物ADC蛋白的进化关系, 通过ClustalX 1.8和MEGA 5.1软件, 用N-J(neighbor-joining)法进行1 000次Bootstrap构建橡胶树(Hevea brasiliensis)、木薯(Manihot esculenta)、麻风树(Jatropha curcas)、蓖麻(Ricinus communis)、毛白杨(Populus trichocarpa)、苹果(Malus domes-tica)、枣树(Zizyphus jujuba)、烟草(Nicotiana tab-acum)、拟南芥(Arabidopsis thaliana)、可可(Ery-throxylum coca)、水稻(Oryza sativa)、玉米(Zea mays)、高粱(Sorghum bicolor)、乌拉尔图小麦(Triticum urartu)ADC蛋白系统进化树。结果(图 3)表明, HbADC1与木薯ADC(XP_021610770.1)、麻风树ADC(XP_012084432.1)蛋白为一个分支, 与玉米、水稻和小麦等ADC蛋白属不同分支, 暗示HbADC1与木薯和麻风树ADC蛋白亲缘关系较近, 而与玉米、水稻和小麦等ADC蛋白亲缘关系较远。

|
| 图 3 HbADC1与其他植物ADC蛋白的系统进化分析 Hb:Hevea brasiliensis; Me:Manihot esculenta; Jc:Jatropha curcas; Rc:Ricinus communis; Pt:Populus trichocarpa; Md:Malus domestica; Zj:Zizyphus jujuba; Md:Malus domestica; Nt:Nicotiana tabacum; At:Arabidopsis thaliana; Ec:Erythroxylum coca; Os:Oryza sativa; Zm:Zea mays; Sb:Sorghum bicolor; Tu:Triticum urartu |
以橡胶树18S rRNA作为内参, 对不同组织、不同发育时期叶片、逆境胁迫和乙烯处理条件下的HbADC1表达模式进行实时荧光定量PCR分析。
2.3.1 HbADC1在不同组织及叶片不同发育时期的表达分析实时荧光定量PCR结果(图 4)表明, HbADC1在橡胶树不同组织(叶片、雌花、雄花、树皮、胶乳、茎尖)中均有表达, 雌花中表达最高, 接下来是茎尖、雌花、叶片、树皮和胶乳。
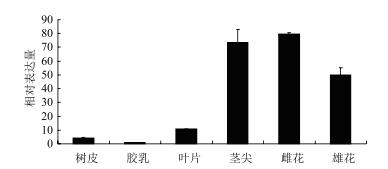
|
| 图 4 不同组织中HbADC1的表达 |
HbADC1在叶片不同发育时期表达存在差异, 淡绿期表达量远高于其他4个时期, 古铜期、变色期和衰老期表达量相当, 稳定期表达量最低(图 5)。
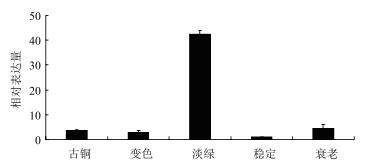
|
| 图 5 叶片不同发育时期HbADC1的表达 |
与其他植物ADC基因在逆境条件下表达模式一致, 低温、干旱、伤害、高盐及H2O2处理均能调控HbADC1表达, 各处理HbADC1表达模式各异。
低温胁迫下, HbADC1表达呈现先微降后显著上升模式(图 6-A)。干旱处理后, HbADC1表达水整体呈升高趋势, 24 h持续上调并在48 h保持平稳(图 6-B)。伤害处理, HbADC1表达先上升, 后下降再上升, 处理后24 h和48 h表达水平均低于处理前水平(图 6-C)。HbADC1的表达受高盐胁迫调控, HbADC1表达在高盐胁迫后先下降, 随后上升并在24 h达到最高后又下降(图 6-D)。HbADC1的表达还受H2O2诱导, 处理后的表达水平先升后降, 表达最高和最低点分别出现在6和48 h(图 6-E)。综合HbADC1在逆境条件下表达模式, 推测HbADC1参与橡胶树多种逆境胁迫反应, 并在其中发挥重要作用。
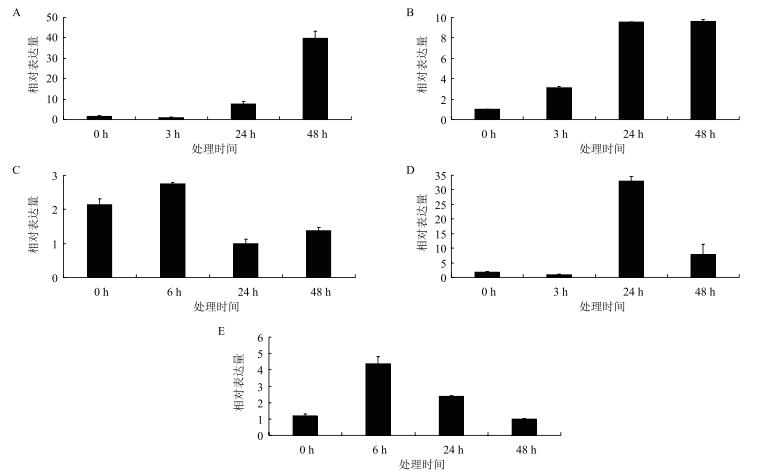
|
| 图 6 不同胁迫下HbADC1的表达 A:低温(4℃); B:干旱(30% PEG 6000);C:伤害; D:高盐(1 mol/L NaCl); E:2% H2O2 |
ET是橡胶树中研究最深入且应用最广的植物激素, 作为橡胶树增产刺激剂, ET通过延长排胶时间提高橡胶树胶乳产量。实时荧光定量PCR结果(图 7)显示HbADC1表达受ET调控。ET处理后HbADC1表达存在波动, 呈先升后降再升模式, 但整体呈上升趋势, 处理后各时间点表达量均高于处理前, 8 h达到表达高峰, 上述结果暗示HbADC1参与橡胶树ET反应。

|
| 图 7 ET处理下HbADC1的表达 |
ADC是PAs合成途径中一种依赖于PLP的重要酶。本研究克隆了一个橡胶树的ADC基因, HbADC1序列长2 594 bp, 最长ORF序列长2 175 bp, 编码724个氨基酸。与其他植物ADC蛋白一致, HbADC1包含ADC保守结构域, 具有鸟氨酸/赖氨酸/精氨酸和相关底物的结合位点, 属于2-磷酸吡哆醛依赖性的Ⅳ型ADC家族[34], 与已鉴定的植物ADC蛋白相同[12, 22]。以上结构域和特征对ADC蛋白行使功能至关重要, 推测HbADC1具有ADC蛋白活性, 可行使ADC蛋白功能。拟南芥AtADC1和AtADC2在细胞质和叶绿体中均表现出双重亚细胞定位[35], 与此不同, 亚细胞定位预测HbADC1不定位于叶绿体, 属其他类蛋白。当然, HbADC1亚细胞定位预测结果还有待于进一步实验确认。橡胶树属大戟科, 进化分析显示HbADC1与大戟科植物木薯、麻风树等ADC蛋白为同一分支, 与玉米、小麦和水稻等ADC蛋白属不同分支, 表明其与大戟科植物木薯、麻风树等ADC蛋白亲缘关系较近。上述结果与传统分类一致, 暗示HbADC1与上述植物ADC蛋白功能相似。
本研究发现HbADC1表达无组织特异性, 该结果与其他植物ADC基因组织表达模式相似, 如桃树ADC基因在根和老叶中表达量最低, 在嫩枝和幼叶中的表达高于花和茎[14]; 棉花ADC基因在叶片的表达量远高于根和茎, 在根中表达量最低[16]; 芥菜ADC基因主要在根和茎中表达, 在叶片中几乎不表达[36]; AtADC1为组成型表达, 而AtADC2仅在莲座叶和角果中表达[37]。此外, HbADC1在橡胶树叶片淡绿期表达远高于其他4个时期, 暗示HbADC1与橡胶树叶片发育密切相关。
植物ADC活性调节依赖于生理条件, 且与多种非生物胁迫有关[18-21, 23-25, 27]。拟南芥中ADC活性低会减少PAs合成, 从而降低植株耐盐性[38]。PbrMYB21在烟草中过表达使ADC表达上升, PAs积累增强了烟草对脱水和干旱胁迫的耐受性[20]; 拟南芥和芥菜中ADC活性分别受渗透胁迫和盐胁迫调控[36, 39]; AtADC2在细菌侵染后表达上升, 蛋白活性增加[26]。与上述结果相似, 本研究中HbADC1表达受干旱、低温、伤害、高盐和H2O2等逆境胁迫调控, 表明HbADC1可能参与巴西橡胶树逆境胁迫反应。ET通过延长排胶时间提高胶乳产量[40]。本研究发现, ET处理后HbADC1表达存在波动, 但整体呈上升趋势, 暗示其可能参与橡胶树ET反应和产排胶过程。
4 结论克隆获得橡胶树HbADC1。其蛋白属于2-磷酸吡哆醛依赖性的Ⅳ型ADC家族, 与大戟科植物木薯、麻风树ADC聚为一支。HbADC1无组织特异性表达。HbADC1可能参与橡胶树的叶片发育过程及橡胶树逆境胁迫和乙烯应答过程。
| [1] |
Comish K, Deborah JS. Immunoinhibition of rubber particle-bound cis-prenyl transferases in ficus elastica and parthenium argentatum[J]. Phytochemistry, 1994, 35(6): 1425-1428. DOI:10.1016/S0031-9422(00)86868-5 |
| [2] |
何康, 黄宗道. 热带北缘巴西橡胶树栽培[M]. 广州: 广东科技出版社, 1987: 398-402, 407-416.
|
| [3] |
黄雪梅, 杨少琼, 黎瑜, 等. 多胺在RRIM 600橡胶树割面上的分布及与割胶的关系[J]. 热带作物学报, 2000, 21(4): 15-19. DOI:10.3969/j.issn.1000-2561.2000.04.003 |
| [4] |
安锋, 林位夫, 王纪坤. 我国巴西橡胶树种植业前景展望[J]. 中国热带农业, 2017, 6: 6-9. |
| [5] |
Li Z, Zhang Y, Peng D, et al. The inhibition of polyamine biosyn-thesis weakens the drought tolerance in white clover(Trifolium repens)associated with the alteration of extensive proteins[J]. Protoplasma, 2017, 255(3): 803-817. |
| [6] |
Cui X, Ge C, Wang R, et al. The BUD2 mutation affects plant architecture through altering cytokinin and auxin responses in Arabidopsis[J]. Cell Research, 2010, 20(5): 576-586. DOI:10.1038/cr.2010.51 |
| [7] |
Milhinhos A, Prestele J, Bollhöner B, et al. Thermospermine levels are controlled by an auxin-dependent feedback-loop mechanism in Populus xylem[J]. Plant J, 2013, 75(4): 685-698. DOI:10.1111/tpj.2013.75.issue-4 |
| [8] |
Vuosku J, Suorsa M, Ruottinen M, et al. Polyamine metabolism during exponential growth transition in Scots pine embryogenic cell culture[J]. Tree Physiology, 2012, 32(10): 1274-1287. DOI:10.1093/treephys/tps088 |
| [9] |
Walters DR. Inhibition of polyamine biosynthesis in fungi[J]. Mycological Research, 1995, 99(2): 129-139. DOI:10.1016/S0953-7562(09)80876-9 |
| [10] |
Coleman CS, Hu G, Pegg AE. Putrescine biosynthesis in mammalian tissues[J]. Biochemical Journal, 2004, 379(3): 849-855. DOI:10.1042/bj20040035 |
| [11] |
Bell E, Malmberg RL. Analysis of a cDNA encoding arginine decarboxylase from oat reveals similarity to Escherichia coli arginine decarboxylase and evidence of protein processing[J]. Molecular and General Genetics, 1990, 224(3): 431-436. |
| [12] |
Hao YJ, Kitashiba H, Honda C, et al. Expression of arginine decarboxylase and ornithine decarboxylase genes in apple cells and stressed shoots[J]. J Exp Bot, 2005, 56(414): 1105-1115. DOI:10.1093/jxb/eri102 |
| [13] |
Akiyama T, Jin S. Molecular cloning and characterization of an arginine decarboxylase gene up-regulated by chilling stress in rice seedlings[J]. J Plant Physiol, 2007, 164(5): 645-654. DOI:10.1016/j.jplph.2006.04.006 |
| [14] |
Liu JH, Ban Y, Wen XP, et al. Molecular cloning and expression analysis of an arginine decarboxylase gene from peach(Prunus persica)[J]. Gene, 2009, 429(1/2): 10-17. |
| [15] |
王中平, 秦白富, 强玮, 等. 颠茄精氨酸脱羧酶基因的克隆与表达分析[J]. 中草药, 2016, 47(15): 2734-2740. |
| [16] |
Ya DL, Hui JM, Wang XF, et al. Cloning and expression analysis of an arginine decarboxylase gene from Gossypium hirsutum[J]. Cotton Science, 2013, 25(4): 291-299. |
| [17] |
Nam KH, Lee SH, Lee J. Differential expression of ADC mRNA during development and upon acid stress in soybean(Glycine max)hypocotyls[J]. Plant & Cell Physiology, 1997, 38(10): 1156-1166. |
| [18] |
Capell T, Bassie L, Christou P. Modulation of the polyamine biosynthetic pathway in transgenic rice confers tolerance to drought stress[J]. Proc Natl Acad Sci USA, 2004, 101(26): 9909-9914. DOI:10.1073/pnas.0306974101 |
| [19] |
Gong X, Zhang J, Hu J, et al. FcWRKY70, a WRKY protein of Fortunella crassifolia, functions in drought tolerance and modulates putrescine synthesis by regulating arginine decarboxylase gene[J]. Plant Cell Environ, 2015, 38(11): 2248-2262. DOI:10.1111/pce.12539 |
| [20] |
Li K, Xing C, Yao Z, et al. PbrMYB21, a novel MYB protein of Pyrus betulaefolia, functions in drought tolerance and modulates polyamine levels by regulating arginine decarboxylase gene[J]. Plant Biotechnology Journal, 2017, 15(9): 1186-1203. DOI:10.1111/pbi.2017.15.issue-9 |
| [21] |
Alcázar R, Planas J, Saxena T, et al. Putrescine accumulation confers drought tolerance in transgenic Arabidopsis plants over-expressing the homologous Arginine decarboxylase 2 gene[J]. Plant Physiol Biochem, 2010, 48(7): 547-552. DOI:10.1016/j.plaphy.2010.02.002 |
| [22] |
Urano K, Yoshiba Y, Nanjo T, et al. Characterization of Arabidopsis genes involved in biosynthesis of polyamines in abiotic stress responses and developmental stages[J]. Plant Cell Environ, 2003, 26(11): 1917-1926. DOI:10.1046/j.1365-3040.2003.01108.x |
| [23] |
Huang XS, Zhang Q, Zhu D, et al. ICE1 of Poncirus trifoliata functions in cold tolerance by modulating polyamine levels through interacting with arginine decarboxylase[J]. J Exp Bot, 2015, 66(11): 3259-3274. DOI:10.1093/jxb/erv138 |
| [24] |
Yu Y, Jin C, Sun C, et al. Elevation of arginine decarboxylase-dependent putrescine production enhances aluminum tolerance by decreasing aluminum retention in root cell walls of wheat[J]. Journal of Hazardous Materials, 2015, 299: 280-288. DOI:10.1016/j.jhazmat.2015.06.038 |
| [25] |
Kim NH, Kim BS, Hwang BK. Pepper arginine decarboxylase is required for polyamine and γ-aminobutyric acid signaling in cell death and defense response[J]. Plant Physiol, 2013, 162(4): 2067-2083. DOI:10.1104/pp.113.217372 |
| [26] |
Rossi FR, Marina M, Pieckenstain FL. Role of Arginine decarboxylase(ADC)in Arabidopsis thaliana defence against the pathogenic bacterium Pseudomonas viridiflava[J]. Plant Biology, 2015, 17(4): 831-839. DOI:10.1111/plb.12289 |
| [27] |
Wang J, Sun PP, Chen CL, et al. An arginine decarboxylase gene PtADC from Poncirus trifoliata confers abiotic stress tolerance and promotes primary root growth in Arabidopsis[J]. J Exp Bot, 2011, 62(8): 2899-2914. DOI:10.1093/jxb/erq463 |
| [28] |
Hao BZ, Wu JL. Laticifer differentiation in Hevea brasiliensis:induction by exogenous jasmonic acid and linolenic acid[J]. Annals of Botany, 2000, 85(1): 37-43. DOI:10.1006/anbo.1999.0995 |
| [29] |
Zhu JH, Zhang QQ, Wu R, et al. HbMT2, an ethephon-induced metallothionein gene from Hevea brasiliensis responds to H2O2 stress[J]. Plant Physiol Biochem, 2010, 48(8): 710-715. DOI:10.1016/j.plaphy.2010.04.004 |
| [30] |
Tang CR, Huang DB, et al. The sucrose transporter HbSUT3 plays an active role in sucrose loading to laticifer and rubber productivity in exploited trees of Hevea brasiliensis(para rubber tree)[J]. Plant Cell Environ, 2010, 33(10): 1708-1720. DOI:10.1111/pce.2010.33.issue-10 |
| [31] |
安泽伟, 陈根辉, 程汉, 等. 橡胶树冷应答转录组cDNA-AFLP分析[J]. 林业科学, 2010, 46(3): 62-67. |
| [32] |
刘辉, 邓治, 陈江淑, 等. 巴西橡胶树类钙调素蛋白基因HbCML27克隆与表达分析[J]. 分子植物育种, 2015, 13(12): 2721-2727. |
| [33] |
Kumar S, Nei M, Dudley J, et al. MEGA:a biologist-centric softw-are for evolutionary analysis of DNA and protein sequences[J]. Brief Bioinform, 2008, 9(4): 299-306. DOI:10.1093/bib/bbn017 |
| [34] |
Sandmeier E, Hale TI, Christen P. Multiple evolutionary origin of pyridoxal-5'-phosphate-dependent amino acid decarboxylases[J]. Febs Journal, 1994, 221(3): 997-1002. |
| [35] |
Maruri-López I, Jiménez-Bremont JF. Hetero- and homodimeriza-tion of Arabidopsis thaliana arginine decarboxylase AtADC1 and AtADC2[J]. Biochem Biophys Res Commun, 2017, 484(3): 508-513. DOI:10.1016/j.bbrc.2017.01.083 |
| [36] |
Mo H, Pua EC. Up-regulation of arginine decarboxylase gene expression and accumulation of polyamines in mustard(Brassica juncea)in response to stress[J]. Physiologia Plantarum, 2002, 114(3): 439-449. DOI:10.1034/j.1399-3054.2002.1140314.x |
| [37] |
Urano K, Yoshiba Y, Nanjo T, et al. Arabidopsis stress-inducible gene for arginine decarboxylase AtADC2 is required for accumulation of putrescine in salt tolerance[J]. Biochem Biophys Res Commun, 2004, 313(2): 369-375. DOI:10.1016/j.bbrc.2003.11.119 |
| [38] |
Kasinathan V, Wingler A. Effect of reduced arginine decarboxylase activity on salt tolerance and on polyamine formation during salt stress in Arabidopsis thaliana[J]. Physiologia Plantarum, 2004, 121(1): 101-107. |
| [39] |
Feirer RP, Hocking KL, Woods PJ. Involvement of arginine decarboxylase in the response of Arabidopsis thaliana to osmotic stress[J]. J Plant Physiol, 1998, 153(5/6): 733-738. |
| [40] |
王聪, 校现周, 等. 橡胶树铜转运蛋白HbCOPT基因克隆与表达分析[J]. 植物生理学报, 2016, 52(9): 1389-1396. |




