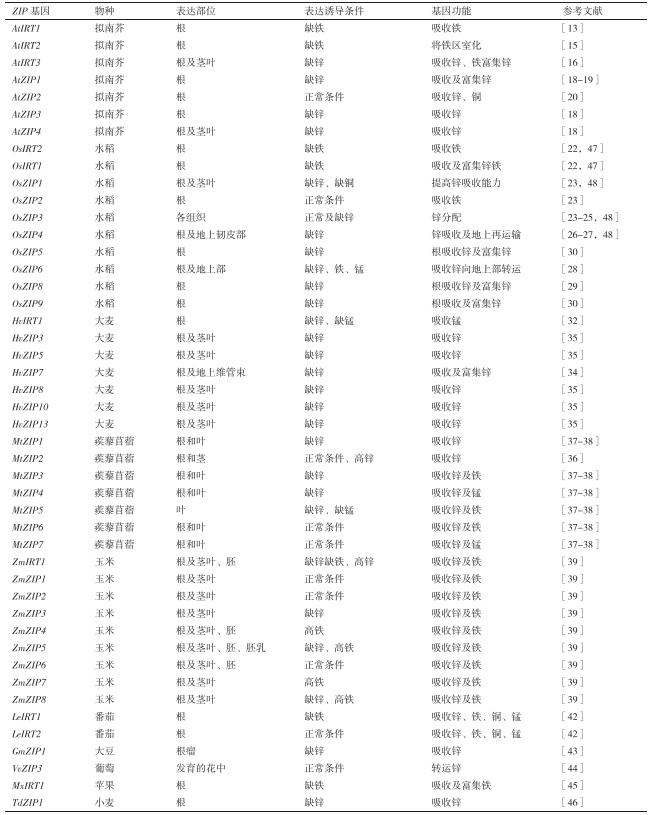
锌铁作为植物营养所必需的微量元素,虽然用量很少,但对于植物的生长和发育是必不可少的。铁元素在光合作用、呼吸作用和叶绿素生物合成等反应中起着重要的作用[1]。我国华北平原、黄河故道和西北黄土高原等地,其土壤pH值高达7.5-8.5,并富含游离碳酸钙,因而缺铁现象较为严重[2]。植物缺铁表现出叶片变黄,严重时会导致其产量和品质的降低。人类缺铁会出现贫血,严重危害孕妇及儿童的健康[3-4]。世界上约三分之一的人群面临着不同程度的缺铁所造成的健康问题。锌是生物体内多种酶的辅助因子[5],参与机体的各种代谢[6]。石灰性土壤、盐碱土和砂性土壤有机质含量低、保肥蓄水能力差,所以这几类土壤严重缺锌[7]。植物缺锌会导致节间缩短、叶子向内卷曲及叶片变小等[7],严重缺锌会导致植物生长受阻进而影响植物的产量和品质。人类缺锌会导致生长发育缓慢、智力发育低下、营养不良等[8]。世界约17.3%的人口面临着锌吸收不足的威胁[9]。锌铁对于植物的生长及提高谷物的产量是至关重要的,人们依赖从植物中获得日常膳食所需的锌铁。所以,增加植物获得锌铁的能力,对植物的生长发育和人类的健康具有重要的意义。为实现这一目的,揭示植物应答及获得锌铁的机制是至关重要的。锌铁转运蛋白(Zinc-regulated transporters,Iron-regulated transporter-like protein,ZIP)家族蛋白在锌铁吸收和转运中有重要作用。ZIP家族蛋白一般由309-476个氨基酸组成,绝大部分成员具有8个跨膜结构域及相似的拓扑结构。第Ⅲ、Ⅳ跨膜区之间有一长的可变区,可变区位于胞内,其C、N末端位于胞外,该区富含组氨酸残基,可能与二价金属离子的结合、转运有关[10]。ZIP通过将二价金属离子吸收转运至细胞质保持体内离子的平衡。表 1为近年来已经在拟南芥、水稻及其它植物中开展的一些相关基因功能的研究工作。
拟南芥(Arabidopsis thaliana)中有16个ZIP基因,AtIRT1是首先被鉴定的基因,主要在拟南芥的根中表达,AtIRT1能够互补酵母铁突变体的功能。AtIRT1是铁转运体,irt1突变体导致叶片黄化致死表型,并且表现出明显的发育缺陷,包括减少了叶绿体类囊体在基粒中的叠加,影响叶片栅栏薄壁细胞的分化,茎中维管束数目的减少以及根的皮层及内皮层细胞排列不规则等。并且irt1突变体导致铁在茎叶的积累减少。irt1突变体应答缺锌及缺铁是通过激活ZIP1在茎叶的表达,降低ZIP2及增强IRT2在根部的表达来保持体内锌铁平衡的[11]。以上结果说明AtIRT1对于植物的正常发育以及体内锌铁平衡的调节是必需的。35S (The cauliflower mosaic virus 35S promoter)启动AtIRT1的过表达植株中,mRNA在整个植物体内均有表达,而其蛋白只在缺铁的根中检测到,说明AtIRT1是受转录后调节的[12]。高镍诱导AtIRT1的表达,缺铁条件下,AtIRT1能够导致镍的含量在拟南芥中积累,说明镍的积累是由于AtIRT1在铁的吸收过程中导致的结果[13]。AtIRT2是与AtIRT1高度相似的铁转运体,能够恢复铁缺陷突变体的转运活性。其主要在根中表达,受缺铁诱导,并且IRT2启动子与报告基因的融合实验证明AtIRT2主要在根顶端的外层细胞表达,说明AtIRT2在缺铁条件下能够从土壤中吸收锌与铁[14]。之后的研究证明AtIRT2定位于囊泡,其可能通过对铁的区室化起到解毒的作用[15]。AtIRT3能够互补锌缺陷突变体的转运活性,其蛋白定位于质膜。过表达AtIRT3能够使茎叶锌的含量增加,根中铁的含量增加。证明AtIRT3具有锌铁转运功能[16]。
AtZIP1-AtZIP5、AtZIP9-AtZIP12及AtIRT3受缺锌诱导,所以这些基因可能对于锌的吸收有作用[17]。有研究证明AtZIP1-AtZIP3在酵母中具有锌的吸收活性,AtZIP1与AtZIP3在缺锌的根中表达,推测其可能具有从土壤中吸收锌的功能。AtZIP2的表达在根中未检测到,而AtZIP4在缺锌的根及茎叶均有表达,所以AtZIP4可能在细胞内或者植物组织间转运锌[18]。利用Ubiquitin启动子驱动AtZIP1在大麦中过表达,在短期缺锌条件下过表达植株种子中锌含量是增加的,如果在正常条件及长时间缺锌条件下,转基因植株叶片及茎中锌的含量及生物量与野生型相比无明显变化。但在缺锌条件下,AtZIP1转基因植株从根向茎叶的转运效率比野生型升高,所以土壤条件会影响转基因植物对锌的获得[19]。AtZIP1及AtZIP2能互补锌与铜的酵母突变体活性,推测其吸收锌及铜。AtZIP1及AtAIP2均在根的中柱表达,AtZIP1也在叶的维管束表达,且其蛋白定位至液泡膜,而AtZIP2定位于质膜。T-DNA插入突变体进行功能研究,说明AtZIP1及AtZIP2从根向茎叶转运铜(可能转运锌)。AtZIP1可能具有将铜从液泡转运至中柱细胞,进而运至木质部薄壁细胞的功能;AtZIP2可能具有将铜(或锌)吸收至根的中柱细胞,进而转运至木质部薄壁细胞的功能[20]。
1.2 水稻中ZIPs家族基因的研究ZIP家族基因在水稻(Oryza sativa L.)中也有研究,目前已知水稻ZIP基因家族包含16个成员。OsIRT1与OsIRT2是水稻中的两个铁转运体,其主要在根中受缺铁诱导表达。在酵母中其能互补铁突变体的转运活性[21]。在水稻中过表达OsIRT1可增强植物对缺铁的耐受力,并且植物的株型发生变化,在生殖生长阶段转基因植株与野生型相比株高降低、分蘖数减少。此外,转基因植物对高锌与高镉比较敏感,说明OsIRT1也转运锌和镉。过表达OsIRT1可使水稻的根、茎、叶和成熟种子中锌铁的含量提高,说明OsIRT1可用于强化谷物中的锌铁含量[22]。在缺锌条件下,OsZIP1与OsZIP3在根和茎叶中的表达量均升高,而OsZIP2的表达量主要在根中升高;原位杂交实验证明,OsZIP1和OsZIP3主要在茎叶的维管束、根的维管束和韧皮部细胞表达[23]。后续研究表明oszip3突变体与野生型之间锌的含量有显著差异,突变体地上部(不包括基部)锌的含量升高,地上基部区域锌的含量下降。通过同位素标记67Zn示踪,发现突变体中锌的含量在下部叶片中较高,在地上部伸长区和节点处含量较少,表明OsZIP3负责将锌从木质部卸载并优先分配到正在生长发育的组织中[24-25]。OsZIP4主要在缺锌的根与茎叶中表达,在缺锌条件下,OsZIP4的转录水平在根和茎叶中均比OsZIP1和OsZIP3高。此外,OsZIP4能够互补锌突变的转运活性,说明OsZIP4是锌转运体。OsZIP4-GFP定位于洋葱表皮的质膜,原位杂交实验证明,其在缺锌条件下的根与茎叶的韧皮部和分生组织中表达,推测OsZIP4可能负责锌在水稻中的转运[26]。利用35S启动子启动OsZIP4在水稻中过表达,结果发现转基因水稻根中锌的含量比野生型升高约100倍,而茎叶及种子中锌的含量分别降低了5倍和4倍。Northern及实时定量PCR证明35S启动的OsZIP4在根及茎叶中均有表达,而内源的OsZIP4在根中的表达量降低,在茎叶中的表达量升高。这些结果表明过表达OsZIP4改变了锌在水稻中的分布,并且需要严格调节OsZIP4的表达来保持体内锌的平衡[27]。在缺锌、缺铁和缺锰诱导时,OsZIP6在地上部表达水平升高3倍,但只有缺铁条件下根中OsZIP6表达量才能够升高3倍[28]。OsZIP7a在缺铁的根中表达,而OsZIP8在缺锌的根及茎叶均有表达;OsZIP7a与OsZIP8分别互补酵母缺铁及缺锌突变体活性。说明OsZIP7a与OsZIP8分别是铁与锌的转运体[29]。OsZIP5与OsZIP8是缺锌诱导的基因,能够互补酵母锌突变体的转运活性,其蛋白均定位于质膜。过表达OsZIP5及OsZIP8使水稻根中的锌含量增加,而茎叶中锌的含量减少。结果说明OsZIP5与OsZIP8是锌转运体,并且对锌在水稻中的分布有重要作用[30-31]。OsZIP9与OsZIP5是高度相似的蛋白,OsZIP9也受缺锌诱导,并且能互补OsZIP5的功能[30]。说明OsZIP9与OsZIP5是水稻中具有相似的功能锌转运体。
1.3 大麦中ZIPs家族基因的研究大麦(Hordeum vulgare)中共鉴定了13个ZIP基因,HvIRT1与水稻OsIRT1同源,其在酵母中转运锌、铁、锰及镉。HvIRT1受缺铁、缺锰诱导,其蛋白定位于质膜。HvIRT1的表达与锰的吸收效率是一致的,说明HvIRT1对于锰在大麦根中的吸收有重要作用[32]。随后通过酵母互补实验证明了大麦中的3个锌转运体HvZIP3、HvZIP5和HvZIP8。HvZIP8在大麦的根中表达,而HvZIP3与HvZIP5在缺锌的根中表达。这些结果说明HvZIP3、HvZIP5和HvZIP8是在大麦根中参与锌平衡的转运体[33]。HvZIP7在根及茎叶中均受缺锌诱导,其蛋白定位于质膜。过表达HvZIP7在高锌条件下茎叶锌的积累升高,其它离子铁、锰、铜、镉均无明显变化。说明HvZIP7是有功能的锌转运体[34]。后续研究对大麦中的13个ZIPs基因进行表达分析,发现HvZIP3、HvZIP7、HvZIP8、HvZIP10、HvZIP13与HvZIP5在根中表达,在缺锌条件下基因表达量是有锌条件下的3倍,并且在茎叶中升高14倍。而HvZIP2的表达在缺锌的根中升高1.5倍,在茎叶中升高5倍。再重新提供有锌的条件,以上7个基因在茎叶中的表达量与缺锌条件下无明显差异,比在最初有锌的条件下表达量略有降低。重新提供锌,HvZIP2与HvZIP10在根中的表达量比缺锌条件有所降低,而其它5个基因在根中的表达量升高。HvIRT1、HvZIP1、HvZIP11、HvZIP14、HvZIP16与HvZIP6不受缺锌诱导,再重新提供锌时基因表达也无明显变化。HvZIP3、HvZIP5、HvZIP7、HvZIP8、HvZIP10和HvZIP13蛋白均定位于质膜。以上结果说明HvZIP3、HvZIP5、HvZIP7、HvZIP8和HvZIP-13这5个HvZIPs基因对于将锌吸收至根并转运至茎叶中有重要作用(重新提供锌的条件下) [35]。
1.4 蒺藜苜蓿中ZIPs家族基因的研究在苜蓿(Medicago truncatula)中共鉴定了7个ZIP基因,首先报道的ZIP基因是MtZIP2,其在酵母中能转运锌,MtZIP2蛋白定位于质膜,在苜蓿的根与茎中表达。不像其它ZIP一样,MtZIP2是高锌诱导的转运体。说明MtZIP2可能对于锌的解毒有作用[36]。后来鉴定了MtZIP1、MtZIP3、MtZIP4、MtZIP5、MtZIP6和MtZIP7共6个MtZIPs蛋白,MtZIP1、MtZIP5和MtZIP6能恢复酵母锌缺陷突变体的转运活性,MtZIP4和MtZIP7能恢复酵母锰缺陷突变体的转运活性,MtZIP3、MtZIP5和MtZIP6能恢复酵母铁缺陷突变体的转运活性。表达分析发现,MtZIP1在缺锌苜蓿的根及叶中均有表达;MtZIP3与MtZIP4在缺铁的叶片中表达量下降,而在缺锌的根及叶中表达上调;MtZIP5在缺锌及缺锰的叶片中表达量升高;MtZIP6与MtZIP7的表达不受金属离子浓度的影响。以上结果说明MtZIPs具有不同的离子选择性,并且对植物体内金属离子的调节及保持金属离子的平衡具有不同的作用[37]。进一步研究表明MtZIP1对锌的亲和力比MtZIP5与MtZIP6低[38]。
1.5 玉米中ZIPs家族基因的研究本实验室在玉米(Zea mays L.)中共鉴定了9个ZmZIPs基因,分别将玉米中的9个ZIP基因命名为ZmZIP1-8及ZmIRT1。前期的工作对玉米幼苗、授粉后不同天数的胚和胚乳进行了Real-time RT-PCR表达分析。结果显示,ZmIRT1在缺铁玉米的根和茎叶中表达均上调,ZmZIP4、ZmZIP5、ZmZIP7、ZmZIP8在高铁处理条件下表达上调。这些结果说明ZmIRT1可能对锌和铁的吸收起着一定的作用,ZmZIP4、ZmZIP5、ZmZIP7及ZmZIP8可能与铁的储存和解毒有关。ZmZIP4主要在胚中表达,ZmZIP5在胚和胚乳中均有表达,推测ZmZIP4和ZmZIP5可能对胚根和胚芽的生长有重要作用。然而,ZmIRT1和ZmZIP6在胚发育的后期表达量上调,推测ZmIRT1和ZmZIP6可能与胚的成熟有关。这些结果说明ZmIRT1、ZmZIP4、ZmZIP5和ZmZIP6可能在胚和胚乳的发育过程中具有非常重要的作用,推测它们与籽粒中锌或铁的积累有关。ZmZIPs-GFP融合蛋白定位于质膜与内质网,推测ZmZIPs可能在植物细胞中起吸收、转运和储存锌铁的作用,也可能参与锌铁离子的解毒。酵母互补实验显示ZmIRT1在低锌和低铁条件下分别能显著地互补fet3fet4DEY1453和zrt1zrt2ZHY3突变体的功能,其它基因表现出不同程度的互补功能。证实了ZmZIPs可能在锌铁吸收及转运过程中起主要作用[39]。后续研究中,将ZmIRT1、ZmZIP3及ZmZIP7在拟南芥中过表达。ZmIRT1能够增加拟南芥根及种子中的锌铁含量,ZmZIP3将较多的锌聚集于根中,ZmZIP7使锌铁在根中积累及铁在种子中积累。ZmIRT1及ZmZIP7的过表达激活了拟南芥中铁吸收及转运相关基因的表达,而ZmZIP3过表达抑制了铁吸收及转运相关基因的表达。以上结果说明,ZmZIPs在保持体内锌铁平衡中具有不同的作用[40-41]。
1.6 其它植物中ZIPs基因的研究番茄(Lycopersicon esculentum)中鉴定了LeIRT1与LeIRT2两个基因,其主要在番茄的根中表达,LeIRT2的表达水平不受铁离子水平的影响,而LeIRT1受缺铁诱导。酵母互补实验证明LeIRT1与LeIRT2均能互补铁缺陷突变体的转运活性,并且也能互补锌、铜与锰缺陷突变体的转运活性,说明LeIRT1与LeIRT2能够转运多种金属离子[42]。在大豆中分离了一个ZIP基因GmZIP1,Nothern分析发现GmZIP1在缺锌23 d的大豆根、茎及叶片中没有表达,但是在根瘤中有表达,并且随着缺锌天数的增加其在根瘤中的表达量逐渐升高。推测大豆GmZIP1可能在大豆与根瘤菌的共生关系中发挥作用[43]。葡萄(Vitis vinifera L.)中的VvZIP3主要在生殖器官尤其在发育的花中表达,能恢复缺锌酵母突变体的转运活性,其蛋白定位于质膜。并且锌在葡萄各个组织中的积累与其表达量呈正相关,说明VvZIP3是有功能的锌转运体[44]。苹果(Malus xiaojinensis)中的MxIRT1是铁转运体,在水稻中过表达MxIRT1能够增加水稻对缺锌、缺铁的耐受性,并且能够增加水稻种子中的锌铁含量,但是镉的含量降低。说明MxIRT1是生物强化籽粒中锌铁含量比较好的基因[45]。野生二粒小麦(Triticum turgidum)中克隆的TdZIP1为缺锌诱导的锌转运体,其定位在内质网,过表达TdZIP1导致锌在细胞内的积累对细胞产生毒性[46]。说明锌铁的平衡必须严格的调节才能保证植物的正常生长发育。
2 结语通过对多种植物中ZIP的研究表明,不同ZIP基因在植物中的表达部位、蛋白的亚细胞定位、对于二价金属离子的选择性以及各基因在植物吸收、转运及储存锌铁中的功能是有区别的。因此,对ZIP在植物中不同功能的了解,有助于根据不同需求选择基因进行有效利用。例如,利用ZIP和其它有利于锌铁在种子中富集的基因,增加籽粒中的锌铁含量,直接或间接缓解人类摄入锌铁不足的状况;利用将锌铁聚集于茎秆及叶片中的基因在植物中过表达增加地上部组织中的锌铁含量,饲喂牲畜满足其对微量元素的需求;对该家族中吸收储存重金属镉的基因加以改造,使其特异地将镉聚集于植物中,从而减轻土壤中重金属的污染,是通过生物对土壤进行修复和改良的重要发展方向。
| [1] |
Kobayashi T, Nishizawa NK. Iron uptake, translocation, and regulation in higher plants[J]. Annual Review of Plant Biology, 2012, 63: 131-152. DOI:10.1146/annurev-arplant-042811-105522 |
| [2] |
张凌云, 张先发, 翟衡. 土壤因子对植物缺铁失绿的影响[J]. 土壤通报, 2002, 33(1): 74-77. DOI:10.3321/j.issn:0564-3945.2002.01.020 |
| [3] |
王华梅. 儿童缺铁性贫血的临床分析[J]. 中国城乡企业卫生, 2016(6): 65-66. |
| [4] |
邱建萍. 妊娠期妇女缺铁性贫血分析[J]. 世界最新医学信息文摘, 2016, 16(42): 61. DOI:10.3969/j.issn.1671-3141.2016.42.039 |
| [5] |
Haydon MJ, Cobbett CS. A novel major facilitator superfamily protein at the tonoplast influences zinc tolerance and accumulation in Arabidopsis[J]. Plant Physiol, 2007, 143(4): 1705-1719. DOI:10.1104/pp.106.092015 |
| [6] |
Mathews WR, Wang F, Eide DJ, et al. Drosophila fear of intimacy encodes a Zrt/IRT-like protein (ZIP) family zinc transporter functionally related to mammalian ZIP proteins[J]. The Journal of Biological Chemistry, 2005, 280(1): 787-795. DOI:10.1074/jbc.M411308200 |
| [7] |
倪卫东, 成少华, 迟金和, 等. 玉米种植过程中缺锌症状及其防治措施[J]. 现代农业科技, 2014(1): 93-94. DOI:10.3969/j.issn.1007-5739.2014.01.058 |
| [8] |
刘陵霞. 缺锌对儿童发育身高影响分析[J]. 微量元素与健康研究, 2000, 17(1): 29-30. |
| [9] |
Wessells KR, Brown KH. Estimating the global prevalence of zinc deficiency: results based on zinc availability in national food supp-lies and the prevalence of stunting[J]. PLoS One, 2012, 7(11): e50568. DOI:10.1371/journal.pone.0050568 |
| [10] |
Guerinot ML. The ZIP family of metal transporters[J]. Biochimica et Biophysica Acta, 2000, 1465(1-2): 190-198. |
| [11] |
Henriques R, et al. Knock-out of Arabidopsis metal transporter gene IRT1 results in iron deficiency accompanied by cell differentiation defects[J]. Plant Mol Biol, 2002, 50(4-5): 587-597. |
| [12] |
Connolly EL, Fett JP, Guerinot ML. Expression of the IRT1 metal transporter is controlled by metals at the levels of transcript and protein accumulation[J]. Plant Cell, 2002(6): 1347-1357. |
| [13] |
Nishida S, Tsuzuki C, et al. AtIRT1, the primary iron uptake trans-porter in the root, mediates excess nickel accumulation in Arabido-psis thaliana[J]. Plant Cell Physiol, 2011(8): 1433-1442. |
| [14] |
Vert G, Briat JF, Curie C. Arabidopsis IRT2 gene encodes a root-periphery iron transporter[J]. Plant J, 2001, 26(2): 181-189. DOI:10.1046/j.1365-313x.2001.01018.x |
| [15] |
Vert G, Barberon M, et al. Arabidopsis IRT2 cooperates with the high-affinity iron uptake system to maintain iron homeostasis in root epidermal cells[J]. Planta, 2009(6): 1171-1179. |
| [16] |
Lin YF, Liang HM, Yang SY, et al. Arabidopsis IRT3 is a zinc-regulated and plasma membrane localized zinc/iron transporter[J]. New Phytol, 2009, 182(2): 392-404. DOI:10.1111/j.1469-8137.2009.02766.x |
| [17] |
Krämer U, Talke IN, Hanikenne M. Transition metal transport[J]. Febs Letters, 2007, 581(12): 2263-2272. DOI:10.1016/j.febslet.2007.04.010 |
| [18] |
Grotz N, Fox T, Connolly E, et al. Identification of a family of zinc transporter genes from Arabidopsis that respond to zinc deficiency[J]. Proc Natl Acad Sci USA, 1998(12): 7220-7224. |
| [19] |
Ramesh SA, Choimes S, Schachtman DP. Over-expression of an Arabidopsis zinc transporter in hordeum vulgare increases short-term zinc uptake after zinc deprivation and seed zinc content[J]. Plant Mol Biol, 2004, 54(3): 373-385. DOI:10.1023/B:PLAN.0000036370.70912.34 |
| [20] |
Milner MJ, Seamon J, Craft E, Kochian LV. Transport properties of members of the ZIP family in plants and their role in Zn and Mn homeostasis[J]. J Exp Bot, 2013, 64(1): 369-381. DOI:10.1093/jxb/ers315 |
| [21] |
Ishimaru Y, Kim S, et al. Mutational reconstructed ferric chelate reductase confers enhanced tolerance in rice to iron deficiency in calcareous soil[J]. Proc Natl Acad Sci USA, 2007(18): 7373-7378. |
| [22] |
Lee S, An G. Over-expression of OsIRT1 leads to increased iron and zinc accumulations in rice[J]. Plant Cell and Environment, 2009, 32(4): 408-416. DOI:10.1111/pce.2009.32.issue-4 |
| [23] |
Ramesh SA, Shin R, Eide DJ, et al. Differential metal selectivity and gene expression of two zinc transporters from rice[J]. Plant Physiol, 2003, 133(1): 126-134. DOI:10.1104/pp.103.026815 |
| [24] |
Sasaki A, Yamaji N, et al. A node-localized transporter OsZIP3 is responsible for the preferential distribution of Zn to developing tissues in rice[J]. Plant J, 2015(2): 374-384. |
| [25] |
孟璐, 孙亮, 谭龙涛. 水稻锌铁转运蛋白ZIP基因家族研究进展[J]. 遗传, 2018, 40(1): 33-43. |
| [26] |
Ishimaru Y, et al. OsZIP4, a novel zinc-regulated zinc transporter in rice[J]. J Exp Bot, 2005, 422: 3207-3214. |
| [27] |
Ishimaru Y, Masuda H, Suzuki M, et al. Overexpression of the OsZIP4 zinc transporter confers disarrangement of zinc distribution in rice plants[J]. J Exp Bot, 2007, 58(11): 2909-2915. DOI:10.1093/jxb/erm147 |
| [28] |
PGK, Kuruvilla S, Mathew MK. Functional characterization of a transition metal ion transporter, OsZIP6 from rice (Oryza sativa L.)[J]. Plant Physiol Biochem, 2015, 97: 165-174. DOI:10.1016/j.plaphy.2015.10.005 |
| [29] |
Yang X, Huang J, Jiang Y, et al. Cloning and functional identification of two members of the ZIP (Zrt, Irt-like protein) gene family in rice (Oryza sativa L.)[J]. Molecular Biology Reports, 2009, 36(2): 281-287. DOI:10.1007/s11033-007-9177-0 |
| [30] |
Lee S, Jeong HJ, et al. OsZIP5 is a plasma membrane zinc transpo-rter in rice[J]. Plant Mol Biol, 2010, 73(4-5): 507-517. DOI:10.1007/s11103-010-9637-0 |
| [31] |
Lee S, Kim SA, Lee J, et al. Zinc deficiency-inducible OsZIP8 encodes a plasma membrane-localized zinc transporter in rice[J]. Molecules and Cells, 2010, 29(6): 551-558. DOI:10.1007/s10059-010-0069-0 |
| [32] |
Pedas P, Ytting CK, Fuglsang AT, et al. Manganese efficiency in barley: identification and characterization of the metal ion transporter HvIRT1[J]. Plant Physiol, 2008(1): 455-466. |
| [33] |
Pedas P, Schjoerring JK, Husted S. Identification and characterization of zinc-starvation-induced ZIP transporters from barley roots[J]. Plant Physiol Biochem, 2009(5): 377-383. |
| [34] |
Tiong J, McDonald GK, Genc Y, et al. HvZIP7 mediates zinc accumulation in barley (Hordeum vulgare) at moderately high zinc supply[J]. New Phytol, 2014, 201(1): 131-143. DOI:10.1111/nph.12468 |
| [35] |
Tiong J, McDonald G, Genc Y, et al. Increased expression of six ZIP family genes by zinc (Zn) deficiency is associated with enhanced uptake and root-to-shoot translocation of Zn in barley (Hordeum vulgare)[J]. New Phytol, 2015(4): 1097-1109. |
| [36] |
Burleigh SH, Kristensen BK, Bechmann IE. A plasma membrane zinc transporter from Medicago truncatula is up-regulated in roots by Zn fertilization, yet down-regulated by arbuscular mycorrhizal colonization[J]. Plant Mol Biol, 2003, 52(5): 1077-1088. DOI:10.1023/A:1025479701246 |
| [37] |
Lopez-Millan AF, Ellis DR, Grusak MA. Identification and characterization of several new members of the ZIP family of metal ion transporters in Medicago truncatula[J]. Plant Mol Biol Reporter, 2004, 54(4): 583-596. DOI:10.1023/B:PLAN.0000038271.96019.aa |
| [38] |
Stephens BW, et al. Characterization of zinc transport by divalent metal transporters of the ZIP family from the model legume Medicago truncatula[J]. Biometals, 2011, 24(1): 51-58. DOI:10.1007/s10534-010-9373-6 |
| [39] |
Li S, Zhou X, et al. Identification and characterization of the zinc-regulated transporters, iron-regulated transporter-like protein (ZIP) gene family in maize[J]. BMC Plant Biol, 2013, 13: 114. DOI:10.1186/1471-2229-13-114 |
| [40] |
Li S, Zhou X, Zhao Y, et al. Constitutive expression of the ZmZIP7 in Arabidopsis alters metal homeostasis and increases Fe and Zn content[J]. Plant Physiol Biochem, 2016, 106: 1-10. DOI:10.1016/j.plaphy.2016.04.044 |
| [41] |
Li S, Zhou X, Li H, et al. Overexpression of ZmIRT1 and ZmZIP3 enhances iron and zinc accumulation in transgenic Arabidopsis[J]. PLoS One, 2015, 10(8): e0136647. DOI:10.1371/journal.pone.0136647 |
| [42] |
Eckhardt U, Mas Marques A, Buckhout TJ. Two iron-regulated cation transporters from tomato complement metal uptake-deficient yeast mutants[J]. Plant Mol Biol, 2001, 45(4): 437-448. DOI:10.1023/A:1010620012803 |
| [43] |
Moreau S, Thomson RM, Kaiser BN, et al. GmZIP1 encodes a symbiosis-specific zinc transporter in soybean[J]. The Journal of Biological Chemistry, 2002, 277(7): 4738-4746. DOI:10.1074/jbc.M106754200 |
| [44] |
Gainza-Cortes F, Perez-Diaz R, Perez-Castro R, et al. Characterization of a putative grapevine Zn transporter, VvZIP3, suggests its involvement in early reproductive development in Vitis vinifera L.[J]. BMC Plant Biology, 2012, 12: 111. DOI:10.1186/1471-2229-12-111 |
| [45] |
Tan S, Han R, Li P, et al. Over-expression of the MxIRT1 gene increases iron and zinc content in rice seeds[J]. Transgenic Research, 2014, 24(1): 109-122. |
| [46] |
Durmaz E, Coruh C, Dinler G, et al. Expression and cellular localization of ZIP1 transporter under zinc deficiency in wild emmer wheat[J]. Plant Mol Biol Reporter, 2011, 3: 582-596. |
| [47] |
Ishimaru Y, Suzuki M, Tsukamoto T, et al. Rice plants take up iron as an Fe3+-phytosiderophore and as Fe2+[J]. Plant J, 2006, 45(3): 335-346. DOI:10.1111/tpj.2006.45.issue-3 |
| [48] |
Chen WR, Feng Y, Chao YE. Genomic analysis and expression pattern of OsZIP1, OsZIP3, and OsZIP4 in two rice (Oryza sativa L.) genotypes with different zinc efficiency[J]. Russian Journal of Plant Physiology, 2008, 55(3): 400-409. DOI:10.1134/S1021443708030175 |