艰难梭菌(Clostridium difficile)为革兰氏阳性厌氧芽孢杆菌,是抗生素药物相关性腹泻的主要致病菌[1-2];由于近年来抗生素的广泛使用,特别是强毒菌株(027/NAPI/BI)的出现,使得艰难梭菌感染(Clostridium difficile infection,CDI)在国内外呈上升趋势[3];CDI常见病症为假膜性结肠炎,外周白细胞明显增多,腹泻,发热等,严重的会出现急性肾衰竭和低血压甚至死亡,复发率高达40%[4]。
目前用万古霉素、非达霉素作为感染的一线治疗方案,然而抗生素药物易进一步破坏肠道微生态,加重菌群失衡,从而引起反复感染[5]。1989年在骆驼的血清中发现一种天然缺失轻链只含有重链的抗体[9]。具有相对分子质量小(分子量只有15 kD左右)、稳定性强、抗原结合性能好、易表达及免疫原性低等特点。这种只由重链可变区构成的单域抗体被称为VHH抗体(Variable domain of heavy chain of heavy-chain antibody,VHH)[6],亦被称为纳米抗体(Nanobody,Nb)。纳米抗体具有多种优势[12-13],在食品及药物开发等领域拥有广阔的前景。
本实验室已获得了从驼羊血清中分离的抗艰难梭菌毒素的基因E3和AA6,通过短小的连接序列(Linker)将E3及AA6串联在一起,从而转化成二价双特异的形式,相比单价纳米抗体,二价纳米抗体具有更高的抗原识别能力及抗原亲和力[7]。从而增强其对毒素B的抑制效率,为治疗艰难梭菌感染奠定基础。
乳酸菌是治疗性蛋白载体,自身具有免疫佐剂作用,能够在强胃酸环境下生存,不需要对抗原进行复杂的处理。乳酸菌高效表达系统NICE(The nisin controlled expression,NICE)是在乳链菌肽(Nisin)诱导下由nisA启动子控制目的基因表达的[8]。nisin可以在含有nisRK的菌中高度诱导克隆在nisA启动子之后的基因而自身不会产生内毒素。当在菌的对数生长期时加入微量的nisin,目的基因的浓度依赖诱导将会发生,且诱导作用与nisin的浓度在一定范围内成正比,诱导效率可高1 000倍以上[9]。
本研究应用NICE系统构建质粒pNZ8148-E3-AA6,获得重组乳酸乳球菌NZ9000/ pNZ8148-E3-AA6,诱导表达纳米抗体,通过SDS-PAGE和Western blot鉴定表达产物,亲和层析法纯化目标蛋白,并对所获得重组二价纳米抗体进行初步活性鉴定,可以中和艰难梭菌毒素TcdB的细胞毒性。本研究成功在乳酸乳球菌中表达具有抑制TcdB细胞毒性的纳米抗体,旨在为治疗艰难梭菌感染提供一个潜在方法,具有一定的应用前景。
1 材料与方法 1.1 材料 1.1.1 菌株、质粒和培养基乳酸乳球菌NZ9000,质粒pNZ8148(氯霉素抗性)由江南大学生物工程学院张娟博士惠赠。M17培养基:购自青岛海博生物技术有限公司;GM17液体培养基(M17培养基中含0.5%葡萄糖);G-SGM17液体培养基:M17干粉培养基37.25 g/L,蔗糖0.5 mol/L,甘氨酸2.5%,115℃高压灭菌20 min,待冷却至50℃以下时加入0.22 μm滤膜过滤的葡萄糖溶液,其终浓度为0.5%。细胞培养相关试剂:DMEM(Dulbecco’s Modified Eagle Medium)细胞培养基(Gibco),胰蛋白酶(0.25% Trypsin,Gibco),PBS缓冲液(双螺旋生物科技,上海),胎牛血清(FBS,Gibco),青霉素和链霉素双抗(Gibco),二甲基亚砜(DMSO,Sigma)
1.1.2 主要试剂及仪器PrimerSTAR Max聚合酶、DNA Marker购自宝生物工程(大连)有限公司。限制性内切酶NcoⅠ和SacⅠ、T4DNA连接酶购自Thermo公司。CCK8检测液购自背景索宝来生物科技有限公司,质粒小提试剂盒以及胶回收试剂盒购自TIANGEN公司。革兰阳性菌质粒小提试剂盒购自北京索莱宝科技有限公司,BCA Protein Assay Kit购自Thermo公司,nisin购自Sigma公司。非洲绿猴肾细胞株(Vero细胞,实验室保存)。其他试剂均为分析纯。PCR仪Bio-Rad公司,凝胶成像仪Bio-Rad,荧光倒置显微镜(Olypus IX71,日本)。Spectramax M5酶标仪购自美谷分子仪器(上海)有限公司。
1.2 方法 1.2.1 引物的设计与合成根据E3和AA6的基因序列,在E3基因序列的3'端添加Linker(G4S)密码子,在AA6的3'端添加6个His标签,利用Primer 5.0设计扩增基因的引物:E3-F1:5'- CATGCCATGGCTATGGCGGCCGCTTCCCAG-3'(下划线处为NcoⅠ酶切位点),E3-R1:5'-ATCGAGCTCTTAGTGGTGGTGGTGGTGGTGTGATCCGCCTCCGCCTTGTGGTTTTGGTGTCTTGGGTTCC-3'(下划线处为SacⅠ酶切位点)。AA6-F2:5'-ATCGAGCTCATGGCGGCCGCTCAGTTGCA -3'(下划线处为SacⅠ酶切位点),AA6-R2:5'-CCCAAGCTTTTAGTGGTGGTGGTGGTGGTGTTGTGGTTTTGGTGTCTTGGGTTCTGA-3'(下划线处HindIII酶切位点),引物由生工生物工程(上海)服务有限公司合成。
1.2.2 重组表达载体的构建及蛋白小量表达PCR分别扩增E3、AA6纳米抗体编码基因,酶切依次将AA6、E3连接至载体pNZ8148上,双酶切及测序鉴定获得质粒pNZ8148-E3-AA6。按Holo等[10]方法制备乳酸乳球菌NZ9000感受态细胞。将连接产物通过电穿孔转化法转化到NZ9000感受态细胞中,设置电压2 000 V,电脉冲时间为1.5-5.0 ms。电转细胞在GM17恢复培养基(含20 mmol/LMgCl2,2 mmol/L CaCl2)30℃培养2 h后,取100 μL涂布到GM17氯霉素抗性平板上,30℃厌氧培养24-48 h。双酶切进行鉴定,重组菌株为NZ9000/ pNZ8148-E3-AA6。
30℃静置培养过夜的重组菌按照1:100的比例转接至5 mL GM17培养基中(氯霉素终浓度为10 ug/mL),测定不同时间点重组乳酸乳球菌NZ9000/ pNZ8148-E3-AA6的OD600值,在培养至菌液OD600值为0.4-0.5时加入终浓度为1 ng/mL的诱导剂nisin进行诱导表达,12 h时收集菌体。收集的菌体经超声破碎后,SDS-PAGE和Western-blot鉴定。
1.2.3 重组乳酸乳球菌的大量表达将诱导后的菌液500 mL离心,每克湿菌体用3 mL 5 mmol/L咪唑缓冲液重悬,菌体用高压破碎仪进行破碎,4℃ 12 000 r/min离心30 min收集上清液。将上清液加入预先用5 mmol/L咪唑缓冲液平衡的Ni-NTA层析柱内,分别用100(20% buffer B)mmol/L、150(30% buffer B)mmol/L咪唑缓冲液洗脱,并收集洗脱液,SDS-PAGE电泳检测目的蛋白分离纯化效果,透析至1×PBS溶液,使用BCA蛋白浓度测定试剂盒测定蛋白浓度。
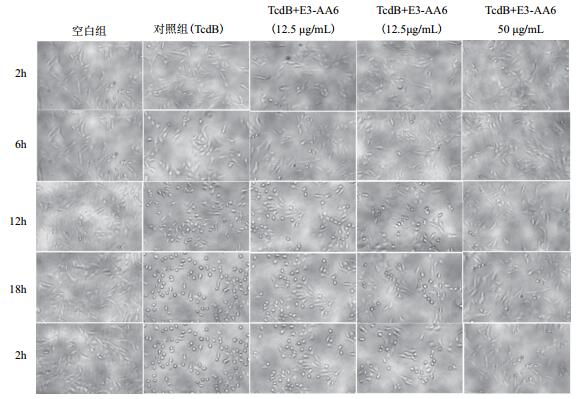
1.2.4 CCK8法检测二价纳米抗体E3-AA6蛋白对毒素TcdB的抑制实验在细胞变圆实验中,用不同浓度梯度TcdB处理Vero细胞,并且在显微镜下观察细胞的形态变化。分别统计细胞变圆率,通过观察统计得出,当毒素TcdB浓度为0.0125 ng/mL时,24 h变圆率约为70%左右,选定此浓度为对照实验施加毒素浓度。将对数生长期Vero细胞,用含10%胎牛血清的DMEM培养基配制1×105/mL细胞悬液,按每孔个细胞约1×104个(100 μL)加入到96孔细胞培养板中,过夜培养后,进行毒素中和实验。分别设置3个实验组:空白组、对照组、实验组。空白组施加完全培养基,对照组施加完全培养基和0.0125 ng/mL TcdB,实验组为Vero细胞同时施加加0.0125 ng/mL TcdB和12.5、25、50 μg/mL的重组纳米抗体蛋白,每个浓度设置3次平行实验。培养2 h,6 h,12 h,18 h和24 h后每孔加入10 μL CCK8检测液,37℃孵育2 h后,酶标仪在450 nm检测其吸光度值。
1.2.5 统计学处理采用Origin 9.1.软件及SPSS 22.0软件进行数据分析,数据以x±s表示。
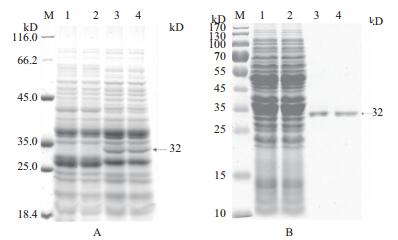
2 结果 2.1 重组乳酸乳球菌蛋白表达与鉴定根据重组乳酸乳球菌的生长曲线确定菌液OD600为0.4-0.5时,加入nisin,终浓度为1 ng/ mL。将12h诱导培养的重组乳酸乳球菌,超声破碎处理后进行SDS-PAGE(图 1-A)可见经诱导的重组菌在32 kD处有与预期大小一致的条带,未诱导的重组乳酸乳球菌未见相应条带,说明经诱导的目的蛋白在重组乳酸乳球菌中获得表达。
|
| 图 1 表达产物的SDS-PAGE分析 M:蛋白质分子质量标准;(A)小量表达1:未诱导的NZ3900/pNZ8148-E3-AA6全液;2:未诱导的NZ3900/pNZ8148-E3-AA6上清;3:nisin(1 ng/mL)诱导的NZ3900/pNZ8148-E3-AA6全液;4:nisin(1 ng/mL)诱导的NZ9000/pNZ8148-E3-AA6上清。(B)大量表达1:上样液2:穿过液;3:20% buffer B洗脱;4:30% buffer B洗脱 |
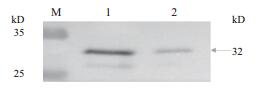
Western-blot、Anti-His-tag抗体检测结果(图 2)显示,诱导的重组乳酸乳球菌在32 kD处有特异性条带,表明目的蛋白在重组乳酸乳球菌中获得表达,通过镍柱亲和层析纯化目的蛋白,SDS-PAGE检测(图 1-B),BCAProtein Quantification Kit测定其蛋白浓度为720 μg /mL。
|
| 图 2 表达产物的Western-blotting分析 M:蛋白质分子质量标准;1:nisin(1 ng/mL)诱导的NZ3900/pNZ8148-E3-AA6全液;2:nisin(1 ng/mL)诱导的NZ9000/pNZ8148-E3-AA6上清 |
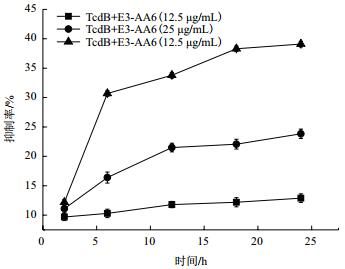
CCK8法实验结果(图 3)表明二价纳米抗体E3-AA6对TcdB有抑制作用,并且TcdB的抑制作用与纳米抗体的浓度呈现一定的正相关,根据公式:抑制率(%)={1-[OD(实验组)-OD(空白)]/[OD(对照组)-OD(空白)]}×100,计算得出当二价纳米抗体E3-AA6浓度为50 μg /mL时,对TcdB的抑制率在24 h时为39%。
|
| 图 3 纳米抗体E3-AA6对毒素TcdB的抑制效应 |
|
| 图 4 不同浓度E3-AA6对毒素TcdB的抑制作用 |
艰难梭菌广泛存在于自然环境及动物粪便中,是人体肠道中的正常菌群。由于广泛应用广谱抗生素、免疫抑制剂或化疗药物等药物,人体肠道微生物菌群平衡被扰乱,艰难梭菌大量繁殖,引发艰难梭菌感染,导致严重腹泻和肠道炎症甚至死亡。
目前针对艰难梭菌感染,常见的CDI治疗是抗生素治疗[11],甲硝唑用于CDI轻中度患者,万古霉素用于CDI重度患者,菲达霉素是一种大环内酯类抗菌药物,对艰难梭菌有杀菌活性,但是对其他革兰氏阳性菌作用有限,一般用于治疗复发患者[12]。但近年高毒素菌株出现,药物的敏感性降低,甲硝唑和万古霉素可进一步破坏肠道微生态平衡,艰难梭菌感染复发率很高,且治愈后复发率高达25%-60%[13]。因此抗生素药物需要向窄谱,不可吸收,可重复给药,安全性高等方向发展[14]。另一种新型CDI治疗方式是粪菌移植法,其原理是将健康供体的粪便经过过滤后注入到患者的结肠中,达到重新恢复正常结肠菌群的目的[15-16]。
纳米抗体因其分子量小、高特异性等特性,在治疗艰难梭菌感染方面有着天然优势[17]。本实验室获得了从驼羊血清中分离的抗艰难梭菌毒素的基因E3和AA6,蛋白分子量分别为15 kD左右,通过Linker连接,设计成双特异性纳米抗体,通过乳酸乳球菌表达系统,获得了32 kD的纯化蛋白。在细胞毒素实验中,施加0.0125 ng/mL TcdB,Vero细胞24 h的变圆率为70%,施加50 μg/mL二价纳米抗体E3-AA6,细胞变圆率明显降低,通过CCK8试剂盒测定细胞活性,抑制率达到39%。证明二价纳米抗体E3-AA6对艰难梭菌TcdB有一定的中和作用。结合乳酸乳球菌可通过胃进入到肠道,直接作用于艰难梭菌,为今后的体内实验提供实验依据。
4 结论本研究成功构建了抗艰难梭菌毒素的重组表达载体pNZ8148-E3-AA6,通过NICE系统实现了二价纳米抗体E3-AA6稳定表达;在对Vero细胞变圆实验及CCK8实验中,E3-AA6能够有效的中和艰难梭菌毒素TcdB。
| [1] |
Kelly CP, Lamont JT. Clostridium difficile -more difficult than ever[J]. N Engl J Med, 2008, 359(18): 1932-1940. DOI:10.1056/NEJMra0707500 |
| [2] |
Magill SS, Edwards JR, Bamberg W, et al. Multistatle point-prevalence survey of health care-associated infections[J]. N Engl J Med, 2014, 370(13): 1198-1208. DOI:10.1056/NEJMoa1306801 |
| [3] |
Leffler DA, Lamont JT. Clostridium difficile infection[J]. Annual Review of Medicin, 2015, 372(16): 1539-1548. |
| [4] |
Vedantam G, Clark A, Chu M, et al. Clostridium difficile infection[J]. Gut Microbes, 2012, 3(2): 121-134. DOI:10.4161/gmic.19399 |
| [5] |
Pepin J. Fidaxomicin versus Vancomycin for Clostridium difficile Infection — NEJM[J]. N Engl J Med, 2011, 364(5): 422-431. DOI:10.1056/NEJMoa0910812 |
| [6] |
Tillib SV, Ivanova TI, Vasilev LA, et al. Formatted single-domain antibodies can protect mice against infection with influenza virus(H5N2)[J]. Antiviral Research, 2013, 97(3): 245-254. DOI:10.1016/j.antiviral.2012.12.014 |
| [7] |
Tillib SV, Ivanova TI, et al. Nanoantibodies for detection and blocking of bioactivity of human vascular endothelial growth factor A(165)[J]. Biochemistry(Mosc), 2012, 77(6): 659-665. |
| [8] |
Kuipers OP, Beerthuyzen MM, de Ruyter PG, et al. Autoregulation of nisin biosynthesis in Lactococcus lactis by signal transduction[J]. J Biol Chem, 1995, 270(45): 27299-27304. DOI:10.1074/jbc.270.45.27299 |
| [9] |
Mierau I, Leij P, Swam IV, et al. Industrial-scale production and purification of a heterologous protein in Lactococcus lactis using the nisin-controlled gene expression system NICE:The case of lysostaphin[J]. Microbial Cell Factories, 2005, 4(1): 15-21. DOI:10.1186/1475-2859-4-15 |
| [10] |
Holo H, Nes IF. High-frequency transformation, by electroporation, of Lactococcus lactis subsp. cremoris grown with glycine in osmotically stabilized media[J]. Appl Environ Microbiol, 1989, 55(12): 3119-3123. |
| [11] |
Mcfarland LV, Mulligan ME, Kwok RY, et al. Nosocomial acquisition of Clostridium difficile infection[J]. N Engl J Med, 1989, 18(1): 204-210. |
| [12] |
Kelly CP, Lamont JT. Clostridium difficile Infection[J]. New England Journal of Medicine, 2012, 1(1): 375-390. |
| [13] |
谢玲林. 艰难梭菌感染的机制与防治进展[J]. 基层医学论坛, 2017, 21(1): 110-111. |
| [14] |
王佳, 万献尧. 艰难梭菌感染的代谢机制及防治策略[J]. 中华医学杂志, 2018(2): 58-60. |
| [15] |
Johnson S, Gerding DN. Fecal fixation:fecal microbiota transplantation for clostridium difficile infection[J]. Clinical Infectious Diseases,, 64(3): 272-274. DOI:10.1093/cid/ciw735 |
| [16] |
Dutta SK, Girotra M, et al. Efficacy of combined jejunal and colonic fecal microbiota transplantation for recurrent Clostridium difficile Infection[J]. Clin Gastroenterol Hepatol, 2014, 12(9): 1572-1576. DOI:10.1016/j.cgh.2013.12.032 |
| [17] |
Yang Y, Kang Z, Zhou J, et al. High-level expression and characterization of recombinant acid urease for enzymatic degradation of urea in rice wine[J]. Applied Microbiology & Biotechnology, 2015, 99(1): 301-308. |




