2. 北京生泰云科技有限公司研发中心,北京 100081;
3. 农业农村部饲料生物技术重点开放实验室,北京 100081;
4. 中国农业科学院饲料研究所基因工程研究室,北京 100081
2. D & R Center, Beijing Shengtai Clouds Bio-Technology Inc., Beijing 100081;
3. Key Laboratory of Feed Biotechnology, Ministry of Agriculture, Beijing 100081;
4. Gene Engineering Laboratory, Feed Research Institute, Chinese Academy of Agricultural Sciences, Beijing 100081
洗发、护发类化妆品是人们日常生活中的必备用品。随着人们对不同功能产品的需求,氨基酸、蛋白质、植物提取物等多种营养成分被添加到洗/护发产品中,同时也为微生物的生长提供了有利条件[1]。《化妆品安全技术规范》(2015年版)规定,每克或每毫升化妆品中不得检出粪大肠杆菌、金黄色葡萄球菌和铜绿假单胞菌[2]。因此防腐剂在防止化妆品污染,尤其在二次污染中起到了举足轻重的作用。然而研究表明,在防腐剂使用中居于首位的对羟基苯甲酸酯(尼泊金酯类),会由于接触性过敏而引起皮肤损伤和皮炎症状发生,同时它还能够促进脂肪形成,可能是造成肥胖流行的因素之一[3-5]。此外,许多微生物对现在广泛使用的防腐剂,包括尼泊金甲酯、卡松、布罗波尔等都具有抗药性[6-7]。2014年,欧盟已禁止将尼泊金酯类防腐剂添加到化妆品中。因此,研究和开发防腐效果、无毒副作用的化妆品防腐剂特别是洗发类产品的防腐剂已成为化妆品行业研发热点。
抗菌肽是一类小分子多肽,是生物免疫防御系统的重要组成部分,具有抗菌谱广、热稳定性好、分子量小、结构简单及两亲性和强阳离子性等优点。抗菌肽抑菌机理独特,常以多靶位点共同作用的方式进行杀菌,因而病原菌很难通过改变细胞膜的结构而产生抗性[8]。另外,抗菌肽作为天然多肽类抗菌物质,对人体更加安全,如乳酸菌素(Nisin)已被作为天然防腐剂而广泛应用于食品领域[9]。因此,本研究主要通过体外抗菌实验检测抗菌肽对洗发液中主要污染细菌及皮肤常驻菌群金黄色葡萄球菌、大肠杆菌群和铜绿假单胞菌的抑制作用,研究抗菌肽在洗发液中的防腐效力,并且对抗菌肽的安全性能进行评估,为替代洗发液及关联产品中尼泊金甲酯等常规防腐剂进行前期探索。
1 材料与方法 1.1 材料 1.1.1 实验菌株大肠杆菌(Escherichia coli,E. coli)CVCC195和金黄色葡萄球菌(Staphylococcus aureus,S. aureus)ATCC25923购自中国兽医药品监察所,铜绿假单胞菌(Pseudomonas aeruginosa,P. aeruginosa)CICC10419购自中国工业微生物菌种保藏管理中心。
1.1.2 细胞及小鼠Hacat人永生化表皮细胞(北京协和医院);6周龄SPF级SD雌鼠(180 g/只)(北京维通利华实验动物技术有限公司)。
1.1.3 主要实验试剂抗菌肽:N2和N6强耀生物有限公司合成,NZ2114和DLP4来自中国农业科学院饲料研究所基因工程室;椰油酸单乙醇酰胺(CMEA)、椰油基二乙酸酰胺(65011: 1)、珠光浆、柠檬酸、阳离子瓜尔胶(C-14S)、(广州市雨露化工有限公司)、对羟基苯甲酸甲酯(尼泊金甲酯)(浙江圣效化学品有限公司);MH琼脂培养基;DMEM培养基(JIBCO),2',7'-二氯荧光黄双乙酸盐(DCFH-DA(Sigma)。
1.1.4 主要实验仪器高速冷冻台式离心机,全温振荡培养箱,自电热压力蒸汽灭菌锅,pH计,流式细胞仪,二氧化碳培养箱。
1.2 方法 1.2.1 抗菌肽最小抑菌浓度(MIC)测定参照临床和实验室标准协会(Clinical and laboratory standards institute,CLSI)制定的操作方法[10],即将受试菌株的单菌落挑至MH液体培养基中过夜培养活化后,转接至MH液体培养基中培养至对数生长期(OD600 nm = 0.4-0.6),然后制备成105 CFU/mL的菌液,加入96孔无菌细胞培养板内,每孔90 µL。抗菌肽用PBS通过2倍倍比法进行稀释,每孔10 µL抗菌肽,使其终浓度分别为0.0625、0.125、0.25、0.5、1、2、4、8、16、32、64、128和256 µg/mL,阴性对照组为PBS代替抗菌肽的受试菌液,空白对照组为无菌MH培养基。每个处理3个平行样。将培养板置于37℃恒温培养箱孵育16-18 h,直至阴性对照孔出现肉眼可见的明显浑浊菌液,能够完全抑制细菌生长的最低浓度即为抗菌肽对受试菌株的MIC值。
1.2.2 抗菌肽杀菌曲线的测定受试菌过夜活化后转接至MH液体培养基中培养至对数生长期,然后制备成105 CFU/mL的菌液。加入抗菌肽溶液,使其终浓度分别为1倍、2倍和4倍MIC,37℃,250 r/min培养。同时,加入相同体积的生理盐水和1×倍MIC浓度的尼泊金甲酯分别作为对照组。在0、0.5、1、2、3、4、6、8、10和24 h时间点分别取100 µL菌液样品后进行10倍梯度稀释,涂板计数,绘制时间-杀菌曲线。
1.2.3 洗发液基础配方的配制将阳离子瓜尔胶(0.3%)加入无菌烧杯中,用100倍去离子水溶解备用;椰油酸单乙醇酰胺(CMEA)(6%)和椰油基二乙酸酰胺(65011: 1)(6%)加入烧杯加热到70-80℃熔化备用;去离子水(84%)加入烧杯加热到50℃,加入椰油酸单乙醇酰胺(CMEA)、椰油基二乙酸酰胺(65011: 1)、珠光浆(3.5%)、阳离子瓜尔胶搅拌2 h;加入柠檬酸(0.2%)搅拌1 h;冷却至30-40℃后分装[11]。本实验受试配方pH为6.5。
1.2.4 抗菌肽在洗发液中杀菌效果的测定将培养至对数生长期的受试菌,用新鲜的MH培养基稀释,控制菌量在5×107-5×108 CFU/mL,作为测试菌液。取若干份制备好的洗发水9 g于无菌锥形瓶中,加入1 mL细菌悬液并充分搅拌均匀,分别加入不同浓度的NZ2114、N2和尼泊金甲酯混匀后封口膜封好,加入1 mL生理盐水组作为空白对照,然后将样品静置在30℃条件下,于接种后第1、2、5、7和14天分别测样品中活细菌含量[12]。
1.2.5 细胞毒性实验细胞毒性实验采用MTT比色法,参照实验手册[13],步骤略有改动。HaCaT以2.5×l05 cell/mL密度接种于96孔板中,每孔100 μL,设置3个重复。24 h后移除培养基,每孔按浓度梯度加入100 μL浓度为0.5、1、2、4、8、16、32、64、128 μg/mL样品肽,对照孔加等量的PBS溶液。继续孵育24 h后,移除培养基,PBS洗两次,每孔中加入100 μL浓度为5 mg/mL的MTT(避光操作)。将96孔板移至培养箱继续培养4 h,而后吸弃MTT液,加入150 µL DMSO,微量振荡器振荡10 min待孔底结晶完全溶解后,使用酶标仪570 nm波长处测各孔吸光度即OD值。根据以下公式计算细胞存活率:存活率(%)=处理组OD值/对照组OD值×100%。
1.2.6 流式细胞术测定细胞活性氧利用荧光探针DCFH-DA检测细胞内ROS的形成。HaCaT细胞分别用80 µg/mL的N2和NZ2114,2 mg/mL的尼泊金甲酯作用4 h后,用PBS洗两次,每组细胞加入20 μM的DCFH-DA,在37 oC下孵育30 min,吸弃上清,然后用胰酶消化,PBS洗两次后立即用流式细胞仪进行检测,激发波长488 nm,发射波长525 nm,每次记数1×104个细胞。
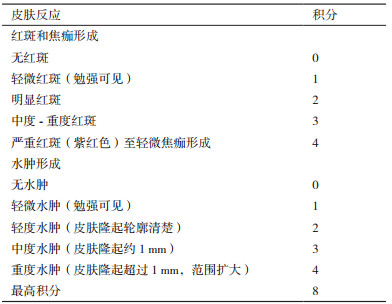
1.2.7 小鼠皮肤刺激性实验取6周龄SPF级SD雌鼠一只,将其背部毛剪短后使用8%的硫化钠将老鼠背部的毛脱尽,分区域滴100 µL浓度为80 µg/mL的N2和NZ2114,2 mg/mL的尼泊金甲酯,以无菌水和30% SDS作为对照组。敷用4 h后用温水清洗残留的药物,于清洗后的1、24、48 h观察涂抹部位皮肤反应,按表 1进行皮肤刺激反应评分判断皮肤刺激强度,48 h观察后,取小鼠皮肤组织,制备切片并在显微镜下观察病理学变化。
本实验所用4种抗菌肽分别来自不同生物体,均由本小组前期工作创制制备[14-16]。NZ2114是由真菌防御素Plectasin突变而来的抗菌肽,DLP4是从黑水虻中分离出来的昆虫防御素,N2和N6是海蚯蚓抗菌肽NZ17074的突变体,它们的序列及理化性质如表 2所示。
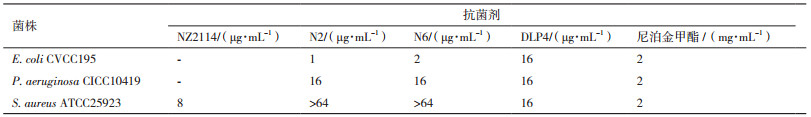
测定抗菌肽和尼泊金甲酯对洗发水主要污染细菌的MIC值,结果如表 3所示,尼泊金甲酯对E. coli CVCC195、P. aeruginosa CICC10419和S. aureus ATCC25923的MIC值均为2 mg/mL,N2,N6对E. coli CVCC195和P. aeruginosa CICC10419的抗菌活性是尼泊金甲酯的1 000-2 000和125倍(MIC值分别为1 µg/mL和16 µg/mL),NZ2114和DLP4对S. aureus ATCC25923的抗菌活性是尼泊金甲酯的250和125倍(MIC值分别为8和16 µg/mL),抗菌肽的抗菌活性显著优于尼泊金甲酯,根据抗菌活性高低,选用N2和NZ2114分别进行后续实验。
通过体外杀菌-时间曲线来检测不同浓度抗菌肽的杀菌能力。如图 1所示,N2对E. coli CVCC195和P. aeruginosa CICC10419抗菌效果随浓度增加而增强,N2对E. coli CVCC195呈现出快速杀菌作用,1 µg/mL(1×MIC)N2在2 h内杀菌率高达99.9%;N2对P. aeruginosa CICC10419的杀菌作用相对缓慢,64 µg/mL(4×MIC)在3 h内可高效杀菌,16 µg/mL(1×MIC)处理组的活菌数持续减少至8 h,杀菌率达到99.9%;32 µg/mL(4×MIC)浓度的NZ2114对S. aureus ATCC25923在1 h内快速杀菌,8 µg/mL(1×MIC)在2 h的杀菌率达到99.9%,且抗菌肽组24 h内菌落数均未出现反弹;而2 mg/mL(1×MIC)的尼泊金甲酯只能抑制E. coli,P. aeruginosa和S. aureus的生长,无法达到彻底杀菌的效果。
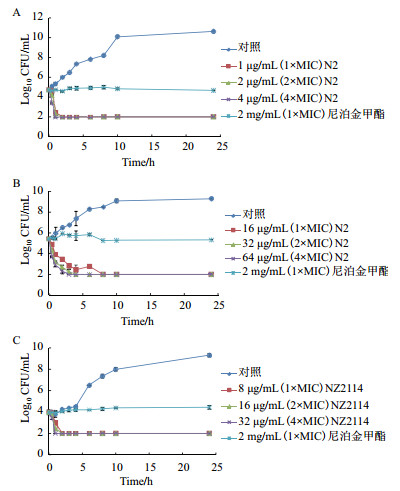
|
| 图 1 抗菌肽杀菌动力学曲线 N2对(A)E. coli CVC C195和(B)P. aeruginosa CICC10419以及NZ2114对(C)S. aureus ATCC25923的杀菌动力学曲线 |
通过测定抗菌肽在洗发液中的杀菌效果与常用防腐剂进行比较。在接种5×108 CFU/mL E. coli CVCC195的洗发水中分别添加5 µg/mL N2和1 mg/mL尼泊金甲酯(图 2-A),细菌生长状态与空白样品组相似,没有受到抑制,并有繁殖生长趋势。10 µg/mL N2组细菌数大约降低1.5个数量,20、40和80 µg/mL N2组1d内杀菌率高达100%,且14 d检测无反弹现象。当添加2 mg/mL尼泊金甲酯时,洗发液中的细菌在7 d内逐渐减少直至全部死亡。N2对接种5×107 CFU/mL P. aeruginosa CICC10419的洗发水也具有快速杀菌作用(图 2-B),添加浓度为40 µg/mL以上时,铜绿假单胞菌在1 d内全部失活,10 µg/mL时5 d内也可全部失活,当添加2 mg/mL尼泊金甲酯时,5 d内洗发液中的细菌全部死亡。N2在洗发液中杀灭大肠杆菌和绿脓杆菌效力分别比尼泊金甲酯高7倍和5倍,并且所需浓度远低于尼泊金甲酯。
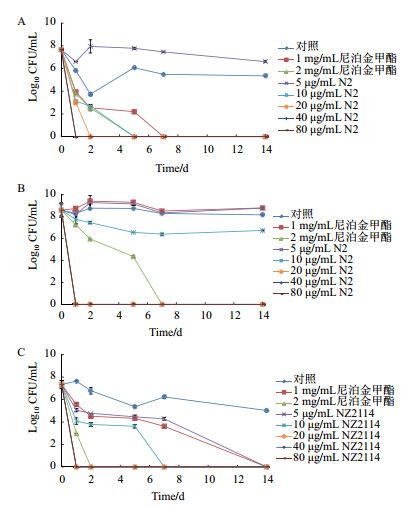
|
| 图 2 抗菌肽在洗发液中菌效果测定 N2在洗发液中对(A)E. coli CVCC195和(B)P. aeruginosa CICC10419的=杀菌效果;NZ2114在洗发液中对(C)S. aureus ATCC25923杀菌效果 |
接种S. aureus ATCC25923的洗发水空白样品组细菌的生长受到一定抑制,14 d后菌落数由2.5×107 CFU/mL减少到2.5×105 CFU/mL,添加5 µg/mL NZ2114和1 mg/mL尼泊金甲酯时,细菌14 d内完全失活,添加NZ2114浓度增加至10 µg/mL时,7 d内洗发液中的细菌全部死亡;添加浓度大于20 µg/mL时,1 d内杀菌效率即可达到100%;当添加高浓度的尼泊金甲酯(2 mg/mL)时,1 d菌落数从2.5×107 CFU/mL降到1×103 CFU/mL,2 d细菌全部失活。这说明抗菌肽N2和NZ2114对洗发水中主要污染细菌具有快速高效的杀菌作用,而且其有效抑菌(金黄色葡萄球菌)效力比传统防腐剂至少高200倍以上。
2.4 细胞毒性实验如图 3所示,N2和NZ2114在0.5-64 µg/mL浓度下细胞的存活率均在90%以上,在高浓度128 µg/mL时,细胞的存活率也在85%以上,对细胞影响不明显;而尼泊金甲酯在正常应用浓度1-2 mg/mL时,细胞存活率仅为30%-50%,对细胞具有一定的细胞毒性。
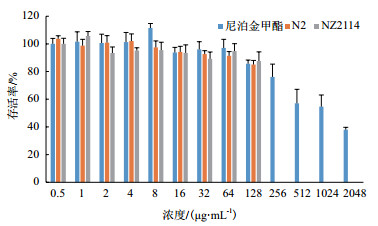
|
| 图 3 HaCaT细胞毒性的测定 |
通过流式细胞仪检测法,分析高浓度抗菌肽作用下HaCaT内的活性氧水平。结果如图 4所示,空白对照组活性氧含量为11.9%,H2O2阳性对照组活性氧含量为98.10%,尼泊金甲酯组活性氧含量为41.4%,是NZ2114和N2活性氧水平的11.5和5.5倍(3.6%和7.5%),抗菌肽组不仅不会提高细胞内活性氧水平,与对照组相比还具有轻微的抗氧化作用。
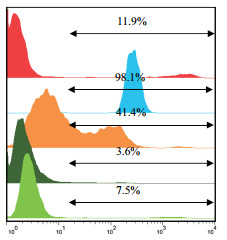
|
| 图 4 HaCaT细胞活性氧测定 |
如图 5-A所示,小鼠皮肤对照区和处理区观察2 d后,仅30%SDS组有明显红斑刺激症状,根据表 1皮肤刺激反应总积分为值为2分,N2、NZ2114和尼泊金甲酯区未见明显异常,皮肤刺激反应总积分值小于0.5。
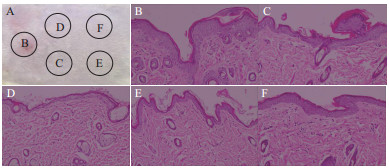
|
| 图 5 小鼠皮肤刺激性实验 A:小鼠皮肤刺激;B:30% SDS;C:ddH2O;D:2 mg/mL尼泊金甲酯;E:80 μg/mL N2 F:80 μg/mLNZ2114 |
小鼠皮肤组织病理学观察结果如图 5。空白对照组小鼠皮肤组织(角质层、表皮和真皮)结构清晰,未见异常;30% SDS阳性对照组的局部表皮可见浓肿,角质层明显角化过度,表皮棘层增厚,真皮炎症细胞浸润,病变部位纤维组织增生,乳头内毛细血管扩张;尼泊金甲酯组,可见表皮基底层胞浆空泡样变,细胞核固缩,呈现凋亡样改变,病变细胞分布于表皮,真皮结构未见异常;N2处理组的皮肤组织结构清晰,未见异常;NZ2114处理组有轻微表皮棘层增厚现象,其余未见异常。
3 讨论抗菌肽作为天然多肽,通过破坏细菌的细胞壁,与细胞内大分子物质结合等多种途径抑制细菌的生长,且不易产生耐药性。已有研究表明抗菌肽可以作为防腐剂应用在化妆品,食品等领域[17-18]。防腐剂的主要作用是防治微生物污染,大肠埃希菌、铜绿假单胞菌和金黄色葡萄球菌是化妆品防腐效果评价用菌株,并且化妆品中禁止检出[2]。本研究发现所选取的4种抗菌肽对大肠埃希菌、铜绿假单胞菌和金黄色葡萄球菌有不同程度的抑制效果。其中,NZ2114和DLP4是由6个半胱氨酸组成的CSαβ模体(Cysteine-stabilized alpha beta),主要针对革兰氏阳性菌具有较好的抗菌活性[15],而N2和N6则是由两个反向平行的折叠片层组成的β-折叠构象,对革兰氏阴性菌具有强抗菌活性,且N2的疏水活性比N6强(分别为0.521和0.375)(表 2),具有更强的抗菌活性[16]。根据MIC结果可以更精确反应4种抗菌肽之间杀菌效果的差异(表 3)。N2对E. coli CVCC195的抗菌活性分别是N6和DLP4的2倍和16倍,而对P. aeruginosa CICC10419三种抗菌肽活性相同,NZ2114对革兰氏阴性菌几乎无杀菌效果,针对革兰氏阳性菌,尤其是S. aureus具有高效杀菌活性性(MIC在0.11-0.9 µmol/L之间)[14],且效果优于DLP4,而Nisin同样作为针对革兰氏阳性菌广泛应用的抗菌肽类食品防腐剂,其对金黄色葡萄球菌的MIC为0.5-4.1 mg/L,抗菌活性远低于NZ2114[19]。此外,Nisin的溶解度和热稳定性与pH相关。Nisin在酸性环境下具有较高的溶解度和热稳定性,随着pH升高,溶解度降低,热稳定性降低,当pH > 7时,溶解度几乎为0,而洗发水一般呈弱酸性,pH6左右,这对Nisin的溶解度和热稳定性影响较大[20-21]。所以选择N2和NZ2114分别作为预防洗发水中大肠埃希菌、铜绿假单胞菌和金黄色葡萄球菌的抗菌肽。
细菌在生长代谢过程中会产生色素、释放刺激性气味、分解洗发水中的营养物质,造成产品变质,另外金黄色葡萄球菌在生长过程中释放的外毒素会诱导皮肤细胞中IL-22大量表达,从而引起人过敏性皮炎症状发生,因此防腐剂的杀菌效率是影响产品质量及人体健康的重要因素[22-23]。体外杀菌动力学是衡量抗菌肽杀菌效率的主要指标。N2和NZ2114在浓度为1倍MIC就可彻底杀菌,4倍MIC可以在1-3 h之内快速杀灭99.9%的细菌,抑菌效率呈现浓度依赖性,且24 h未出现反弹现象(图 1)。尼泊金甲酯作为对照组,当浓度为2 mg/mL(即0.2%添加)时对大肠杆菌、铜绿假单胞菌和金黄色葡萄球菌只能起到抑制作用但无法彻底杀灭菌株。《化妆品安全技术规范》(2015年)规定尼泊金甲酯允许使用的最大浓度为0.4%,一般洗发水中的添加量约为0.2%,由此可知,在体外杀菌效率上,抗菌肽相较于常用的防腐剂具有明显优势。在制备好的洗发水中进行抗菌肽的防腐评估,杀菌效率与体外杀菌动力学结果相似,均呈现浓度依赖性(图 3),且80 µg/mL的N2和NZ2114在1 d内就可彻底杀死洗发水中的细菌,杀菌效率明显优于高浓度的尼泊金甲酯(N2对E. coli CVCC195和P. aeruginosa CICC10419的杀菌效率分别是尼泊金甲酯的7倍和5倍,NZ2114对S. aureus ATCC25923的杀菌效率是尼泊金甲酯的2倍)。但是2 mg/mL的尼泊金甲酯在杀菌动力学和洗发水杀菌实验中的杀菌效率有很大的差异,可能是由于本实验中配制的洗发水仅为基础配方,不含有其他营养物质,不利于细菌的生长,在添加尼泊金甲酯后比较容易造成细菌死亡[24]。
革兰氏阴性菌在死亡过程中会释放内毒素,它可以造成多种组织器官损伤,严重时可引起内毒素血症,对健康造成严重影响,然而统计表明由于皮肤软组织感染引起的内毒素血症高达70%-81.1%,所以在杀灭洗发水中革兰氏阴性菌的同时清除内毒素也是至关重要的[25]。研究表明N2不仅能够快速杀死大肠杆菌,还可以在体内体外中和内毒素,降低内毒素感染对小鼠体内TNF-α,IL-1,IL-6的影响,提高小鼠存活率[16]。而尼泊金甲酯仅能通过改变细菌渗透性,使细菌体内的酶类和代谢物逸出导致其失活,无法清除释放出来的内毒素[26]。因此,以40 µg/mL N2和20 µg/mL NZ2114进行复配并添加到洗发水中,可达到快速高效杀菌作用。此外,还能中和内毒素防止皮肤感染引起其他并发症。
洗发水防腐剂不仅要达到防腐要求,还要对人体安全无害,才能发挥其使用价值。通过对HaCaT细胞毒性测定可知(图 3),N2和NZ2114在使用浓度时(40和20 µg/mL)几乎无细胞毒性,而尼泊金甲酯在洗发水中添加浓度为2 mg/mL时,具有较强毒性(细胞存活率约为40%)。化学试剂对细胞的损伤主要是引起细胞内ROS的升高,从而导致细胞凋亡。流式细胞术检测HaCaT细胞ROS水平(图 4),尼泊金甲酯的浓度为2 mg/mL时,细胞内ROS水平是正常细胞的3.5倍,远远超过正常细胞ROS的代谢水平,对细胞造成不可逆的损伤。高浓度的N2和NZ2114(80 µg/mL)没有引起ROS水平的提高,反而略微低于正常细胞ROS水平,可能具有轻微的抗氧化作用。进一步通过小鼠皮肤刺激性实验,更加直观地分析评价防腐剂的安全性能,肉眼观察抗菌肽与尼泊金甲酯作用后的小鼠皮肤(图 5-A),并无明显变化,然而病理学观察发现尼泊金甲酯对小鼠细胞损伤分布于表皮,呈现凋亡样改变,抗菌肽N2和NZ2114对皮肤无明显影响(图 5)。其他学者研究发现,尼泊金甲酯不仅对人体正常皮肤角质细胞存在伤害,还可能有引发乳腺癌的风险[4, 27]。在体内外研究表明,尼泊金甲酯对精子形成和激素分泌均会产生不利影响[28]。而抗菌肽作为外用防腐制剂对皮肤损伤的研究鲜有报道,因此,抗菌肽作为防腐剂添加到化妆品中更加安全。
4 结论抗菌肽不仅具有高效的抗菌作用,而且够中和细菌死亡过程中释放的内毒素,还具有一定程度的抗氧化作用,与化妆品中主要的防腐剂尼泊金甲酯相比抗菌肽在安全性能方面更具优势,是一种极具开发价值的体表洗浴润肤等日化产品专用天然防腐剂,作为当下高质量发展、供给侧改革、美好生活建设的题中应有之义,值得重视和期待[29-30]。
| [1] |
Smart R, Spooner DF. Microbiological spoilage in pharmaceuticals and cosmetics[J]. Fresenius Zeitschrift Für Analytische Chemie, 1972, 23: 600-620. |
| [2] |
化妆品安全技术规范.食品药品监管总局公告2015年第268号[EB/OL].
|
| [3] |
Nagel JE, Fuscaldo JT, Fireman P. Paraben allergy[J]. Jama, 1977, 237(15): 1594. DOI:10.1001/jama.1977.03270420062018 |
| [4] |
Handa O, Kokura S, Adachi S, et al. Methylparaben potentiates UV-induced damage of skin keratinocytes[J]. Toxicology, 2006, 227(1-2): 62-72. DOI:10.1016/j.tox.2006.07.018 |
| [5] |
Hu P, Chen X, Whitener RJ, et al. Effects of parabens on adipocyte differentiation[J]. Toxicological Sciences an Official Journal of the Society of Toxicology, 2013, 131(1): 56. DOI:10.1093/toxsci/kfs262 |
| [6] |
黄小茉, 王春华, 谢小保, 等. 微生物对化妆品杀菌防腐剂的耐受性和抗药性及其治理措施[J]. 日用化学品科学, 2006, 29(7): 19-21. DOI:10.3969/j.issn.1006-7264.2006.07.005 |
| [7] |
文霞, 杨秀茳, 谢小保, 等. 化妆品中腐败微生物的抗药性研究[J]. 工业微生物, 2015, 45(5): 37-41. DOI:10.3969/j.issn.1001-6678.2015.05.008 |
| [8] |
Wang X, Teng D, Mao R, et al. Combined systems approaches reveal a multistage mode of action of a marine antimicrobial peptide against pathogenic Escherichia coli and its protective effect against bacterial peritonitis and endotoxemia[J]. Antimicrob Agents Chemother, 2017, 61(1): 1-20. |
| [9] |
Adams M, Smid E. 2-Nisin in multifactorial food preservation[M]. Natural Antimicrobials for the Minimal Processing of Foods, 2003: 11-33.
|
| [10] |
Wiegand I, Hilpert K, Hancock REW. Agar and broth dilution methods to determine the minimal inhibitory concentration(MIC)of antimicrobial substances[J]. Nature Protocols, 2008, 3(2): 163-175. DOI:10.1038/nprot.2007.521 |
| [11] |
朱卫, 蔺国敬, 张贵民. 个人洗护用品配方原理及应用技术(Ⅰ)-洗发香波的配方原理及其性能评价[J]. 日用化学工业, 2004, 34(5): 323-326. DOI:10.3969/j.issn.1001-1803.2004.05.015 |
| [12] |
范新雨, 张太军, 程双印, 等. 一种新的化妆品微生物挑战实验方法[J]. 香料香精化妆品, 2007, 2007(1): 13-16. DOI:10.3969/j.issn.1000-4475.2007.01.005 |
| [13] |
Van MJ, Kaspers GJ, Cloos J. Cell sensitivity assays:the MTT assay[J]. Methods in Molecular Biology, 2011, 731(88): 237. |
| [14] |
Zhang Y, Teng D, Mao R, et al. High expression of a plectasin-derived peptide NZ2114 in Pichia pastoris and its pharmacodynamics, postantibiotic and synergy against Staphylococcus aureus[J]. Applied Microbiology & Biotechnology, 2014, 98(2): 681-694. |
| [15] |
Li Z, Mao R, Teng D, et al. Antibacterial and immunomodulatory activities of insect defensins-DLP2 and DLP4 against multidrug-resistant Staphylococcus aureus[J]. Scientific Report, 2017, 7(1): 1-16. DOI:10.1038/s41598-016-0028-x |
| [16] |
Yang N, Liu X, Teng D, et al. Antibacterial and detoxifying activity of NZ17074 analogues with multi-layers of selective antimicrobial actions against Escherichia coli and Salmonella enteritidis[J]. Scientific Report, 2017, 7(1): 1-19. DOI:10.1038/s41598-016-0028-x |
| [17] |
Przybylski R, Firdaous L, Châtaigné G, et al. Production of an antimicrobial peptide derived from slaughterhouse by-product and its potential application on meat as preservative[J]. Food Chemistry, 2016, 211: 306-313. DOI:10.1016/j.foodchem.2016.05.074 |
| [18] |
Rahnamaeian M, Vilcinskas A. Short antimicrobial peptides as cosmetic ingredients to deter dermatological pathogens[J]. Appl Microbiol Biotechnol, 2015, 99(21): 8847-8855. DOI:10.1007/s00253-015-6926-1 |
| [19] |
Piper C, Draper LA, Cotter PD, et al. A comparison of the activities of lacticin 3147 and nisin against drug-resistant Staphylococcus aureus and Enterococcus species[J]. Journal of Antimicrobial Chemotherapy, 2009, 64(3): 546-551. DOI:10.1093/jac/dkp221 |
| [20] |
刘志皋. 食品添加剂基础[M]. 北京: 中国轻工业出版社, 1994.
|
| [21] |
Tramer J. The inhibitory action of nisin on bacillus stearothermopi-lus[M]//Molin N: Microbial Inhibitions in Food. Stockholm Almgvist and Wiksell, 1964: 25.
|
| [22] |
Margarete Niebuhr MD, Helena Scharonow MS, Merle Gathmann MS, et al. Staphylococcal exotoxins are strong inducers of IL-22:A potential role in atopic dermatitis[J]. Retour Au Numéro, 2010, 126(6): 1176-1183. |
| [23] |
陈倩, 陈昭斌. 抗微生物技术在化妆品生产中的应用[J]. 中国消毒学杂志, 2017, 34(1): 65-68. |
| [24] |
刘文娟, 常志英. 无防腐剂护肤化妆品体系的防腐效能及安全性评价[J]. 日用化学工业, 2015, 45(4): 214-217. |
| [25] |
Morrison DC, Ryan JL. Endotoxins and disease mechanisms[J]. Annual Review of Medicine, 1987, 38(1): 417. DOI:10.1146/annurev.me.38.020187.002221 |
| [26] |
何唯平, 刘梅森. 食品防腐剂概念[J]. 中国食品添加剂, 2004(5): 37-40. DOI:10.3969/j.issn.1006-2513.2004.05.010 |
| [27] |
Pugazhendhi D, Pope GS, Darbre PD. Oestrogenic activity of p-hydroxybenzoic acid(common metabolite of paraben esters)and methylparaben in human breast cancer cell lines[J]. Journal of Applied Toxicology, 2005, 25(4): 301-309. DOI:10.1002/(ISSN)1099-1263 |
| [28] |
Oishi S. Effects of butyl paraben on the male reproductive system in mice[J]. Archives of Toxicology, 2002, 76(7): 423-429. DOI:10.1007/s00204-002-0360-8 |
| [29] |
胡璇子. 2017年北京市科学技术奖一等奖—抗菌肽让"替抗"梦想照进现实[N].中国科学报, 2018-4-4.
|
| [30] |
杨舒.我国科学家研究成果引起全球关注—饲用抗生素替代品有望找到[N].光明日报, 2017-1-4.
|