资源、能源和环境是当前人类社会发展面临和必须解决的三大难题。目前,我国能源短缺,形势严峻,石油等化石能源储备严重不足,远远不能满足经济和社会高速发展的需要,迫切需要从战略角度发展新的可再生能源[1]。微藻已被作为重要的可再生能源资源,并已经有许多研究报道了有关微藻的生物学特性。例如,运用双向电泳技术(2-DE)、研究了集胞藻(Synechocystis sp. PCC 6803)的蛋白质[2],不同浓度NaCl胁迫下鱼腥藻(Anabaena doliolum)蛋白质组学差异[3]以及纺锤形马尾藻在镉胁迫下的蛋白质组分的差异[5]。利用2-DE、Western-blot等技术研究热休克蛋白在逆境中诱导表达并证实了chaperonin家族的一员HSP60蛋白可通过热激的方式进行诱导[7]。通过挑选单克隆及多克隆抗体来分析强壮前沟藻(Amphidinium carterae)膜骨架中两种不同类型的骨架蛋白[8]。此外,Song等[4]研究了在正常和缺氮组球等鞭金藻在油脂积累过程中的蛋白组学变化。Simon等[6]通过质谱分析鉴定了聚胞藻的192种可溶性蛋白。
综上可知,国内外有关微藻蛋白质组学的研究已有较大的突破,这不仅提高了人们认识微藻及其生命过程的能力,也促进了微藻生物柴油制备的产业化发展。与高等植物相比,有关微藻抗逆的蛋白组学研究就相对滞后;并且有关微藻蛋白组学研究大多集中在海洋藻类,对于沙漠藻类的干旱胁迫蛋白组学研究还未见报道。本研究基于前期建立了沙漠小球藻蛋白质组双向电泳体系[9],以小球藻为研究对象,改进研究方法,从蛋白质组学水平研究干旱胁迫下小球藻的蛋白质表达特点,旨在为探索沙漠小球藻应答干旱胁迫的分子机制提供试验依据,为沙漠微藻制备生物柴油的工厂化生产奠定基础。
1 材料与方法 1.1 材料所用藻种(Chlorella sp.)由石河子大学生命科学学院细胞与分子生物学实验室从新疆塔克拉玛干沙漠沙样中分离、纯化并鉴定。将藻种接种于BBM液体培养基中进行活化,取活化后处于对数生长期的藻液以10%的接种量分别接种至BBM液体培养基和PEG6000添加量为20%的BBM液体培养基中培养,光照强度4 000 lx,12 h光照,温度为23℃。
1.2 方法 1.2.1 蛋白质提取和定量试验采用Trisol法[9-10]提取蛋白质。取适量培养至对数生长期的藻液4℃ 6 000 r/min离心5 min,所得藻泥用ddH2O清洗3次,得鲜藻泥;经液氮研磨,装入1.5 mL离心管中,加入1 mL Trisol试剂,震荡混匀,室温静置5 min;加入200 μL氯仿,充分混匀后静置5 min,4℃ 12 000 r/min离心15 min;弃上层无色液体后加入300 μL无水乙醇悬浮下层深红色液体,4℃ 12 000 r/min离心5 min;转移上清液至新的离心管中,加入1 mL异丙醇混匀,静置20 min以沉淀蛋白,4℃ 12 000 r/min离心10 min,沉淀用95%乙醇清洗后空气中干燥,待蛋白表面光滑后加入一定比例的裂解液溶解蛋白(干粉5 mg:50 μL),于30℃水浴中孵育2-4 h;4℃ 12 000 r/min离心30 min,所得上清液即为蛋白溶液。采用2D Quant Kit[10]定量蛋白质。分别制备干旱后0、6、12、18、24和30 d的沙漠小球藻全蛋白,备用。
1.2.2 双向电泳检测双向电泳体系为24 cm IPG胶条水化上样量450 μg,在泡胀盘中对胶条进行过夜被动泡胀后,使用Ettan IPGphor3等电聚焦仪进行第一向等电聚焦,程序设定为100 V 2 h;300 V 3 h;1 000 V 3 h;3 000 V 3 h;8 000 V 3 h;8 000 V,分别聚焦600 000 Vh、70 000 Vh、80 000 Vh;500 V,任意时间。分两步平衡,每次15 min(平衡液Ⅰ含6 mol/L尿素、2%SDS、75 mmol/L Tris-HCL(pH8.8)、20% Glycetol(甘油)、0.0002%溴酚蓝和1% DTT,平衡液Ⅱ含6 mol/L尿素、2%SDS、75 mmol/L Tris-HCL(pH8.8)、20% Glycetol(甘油)和2.5% Lodacetamide(碘乙酰胺)。使用EttanDaltSix垂直板电泳系统,采用厚度为1 mm 12.5%SDS-PAGE分离胶进行第二向SDS-PAGE蛋白电泳。按照以上方法对干旱胁迫后0、6、12、18、24和30 d的蛋白样品进行双向电泳[9-10]。以AgNO3染色法染色[11]。每个样品进行3次重复,以获得稳定的差异电泳图谱。
1.2.3 差异蛋白的筛选使用ImageScannerⅢ对图像进行扫描,并用Labscan软件进行照相,图像分辨率300 dpi;用ImageMaster Platinum 7.0对扫描结果进行分析,通过背景消减、蛋白质点的检测与匹配及差异表达量的比较后,将表达量上调或下调2倍以上的蛋白点视作表达量差异点,经ANOVA分析(P < 0.05)且重复性较好的蛋白差异点。
1.2.4 质谱分析和数据库检索从凝胶上挖去差异表达蛋白点,委托上海生工生物工程股份有限公司完成胶内酶解及质谱分析;将得到的肽质量指纹图提交到Mascot(www.matrixscience.com)蛋白数据库进行搜索参数设定如下:(1)Database:NCBInr;(2)species:Green plants;(3)Enzyme hydrolysates:Trypsin;(4)Fixed modification:Carbamidomethyl(C);(5)Variable modification:Acetyl(Protein N-term)、Deamidated(NQ)、Dioxidation(W)、Oxidation(M);(6)Peptide segment deviation:100 ppm[9]。符合质谱要求的蛋白质序列在Gene ontology数据库中(http://amigo1.geneontology.org/cgi-bin/amigo/go.cgi)进行功能分类。
1.2.5 差异表达蛋白的生物信息学分析根据小球藻NA64数据库和网络数据库,BLAST鉴定所获得的差异表达蛋白。用Agri GO进行Gene Ontology(GO)注释和富集分析[12],用OBAS进行京都基因与基因组百科全书(Kyoto encyclopedia of genes and genomes,KEGG)代谢通路富集分析[13]。对没有获得GO注释的蛋白,于文献搜索和蛋白质同源物手动注释。因单一工具分类并不能完全诠释蛋白质的功能,研究参照Bevan等[14]的标准对这些蛋白质进行分类。用STRING v10进行protein-protein interaction(PPI)网络互作分析差异表达蛋白质之间的关系[15],使用Cytoscape 2.8.3对网络图进行编辑[16]。
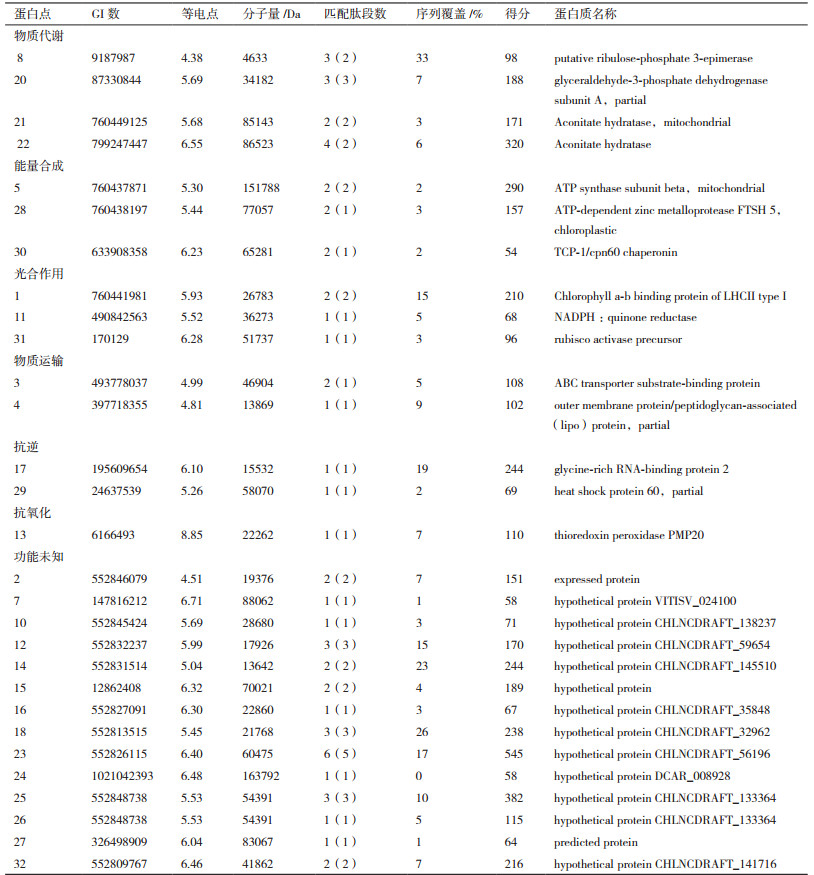
2 结果 2.1 沙漠小球藻双向蛋白质电泳分析基于前期的宏观生理指标和转录组组学的研究结果,沙漠小球藻在干旱胁迫后0、6、12、18、24和30 d存在较大的差异,其中第18天沙漠小球藻生长情况和油脂的合成明显的升高。因此,以20% PEG 6000模拟干旱处理沙漠小球藻,选取0、6、12、18、24和30 d 6个时间点,对干旱胁迫这6个时间点进行全蛋白的提取并使用蛋白样品进行双向电泳(图 1),在干旱胁迫后0、6、12、18、24和30 d,分别检测到(1 098±21)、(1 033±19)、(1 036±32)、(1 026±22)、(1 021±16)、(1 030±25)个蛋白点,同一处理的3块重复胶之间蛋白点的匹配率高达90%。
|
| 图 1 沙漠小球藻蛋白质双向电泳图谱 A-F分别为干旱胁迫后0、6、12、18、24和30 d沙漠小球藻的2-DE图谱。32个差异蛋白点使用数字标注 |
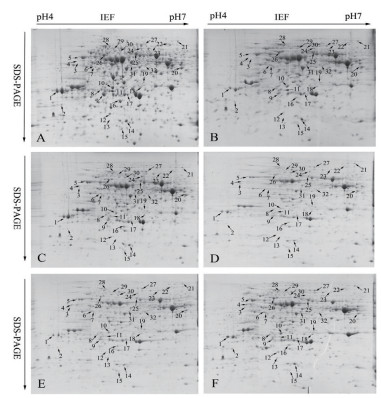
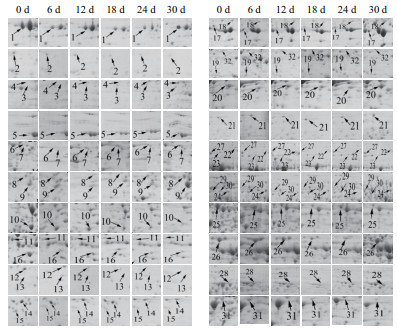
采用ImageMaster Platinum 7.0软件分析干旱胁迫0、6、12、18、24和30 d的小球藻蛋白组学变化,发现有32个具有统计学显著差异的蛋白点(图 2)。其中丰度上调的有12个(点3、4、5、6、7、18、19、20、21、22、24及29),丰度下调的有12个(点2、10、11、12、13、14、15、16、23、25、31及32),丰度先下调后上调的有8个(点1、8、9、17、26、27、28及30)。采用ImageMaster Platinum 7.0软件对差异表达的蛋白进行分析,差异蛋白相对表达量按Vol%提取,并进行统计(图 3)。
|
| 图 2 不同时间的干旱胁迫条件下蛋白质表达的动态变化 箭头指示差异的蛋白点 |
|
| 图 3 差异蛋白的相对表达量 A:上调表达的蛋白点;B:波状变化的蛋白点;C:下调表达的蛋白点 |
采用MALDI-TOF-MS对32个表达差异的蛋白进行分析,发现均具有差异显著性,其中丰度上调的有12个,丰度下调的有12个,丰度先下调后上调的8个,通过MASCOT软件对蛋白进行鉴定,获得29个蛋白点(表 1)。
质谱分析确定的32个差异表达蛋白点的身份,涉及29个差异蛋白。GO功能分析(图 4)表明,获得的差异表达蛋白参与的生物过程主要有应激反应(Response to stress,GO:0006950)和小分子代谢过程(small molecule metabolic process,GO:004-4281);细胞组成主要有线粒体(Mitochondrion,GO:0005739)和类囊体(thylakoid,GO:0009579);分子功能主要有离子结合(GO:0043167)和氧化还原酶活性(Oxidoreductase activity,GO:0016491)。
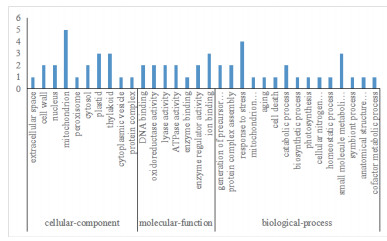
|
| 图 4 差异表达蛋白的GO分析 |
KEGG途径富集分析(图 5)表明,获得的差异表达蛋白主要参与光合作用、氧化磷酸化、柠檬酸循环(TCA循环)等途径。
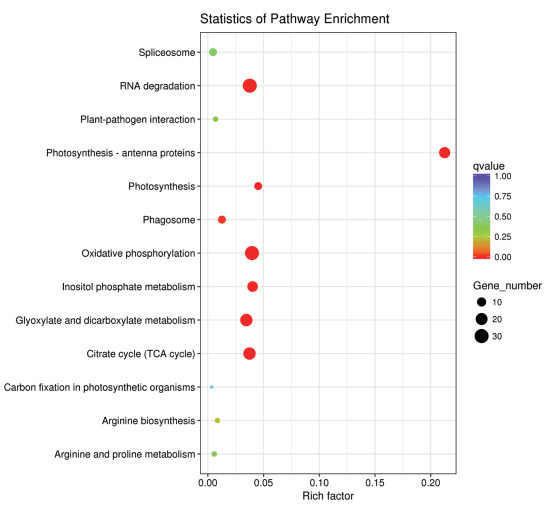
|
| 图 5 差异表达蛋白的KEGG分析 |
根据差异表达蛋白序列在Gene ontology中功能分析的结果,按参与生物代谢过程被分为7类:物质代谢相关蛋白(13.79%)、能量生成与转化相关蛋白(10.34%)、光合作用相关蛋白(10.34%)、抗逆相关蛋白(6.89%)、转运与细胞结构相关蛋白(6.89%)、抗氧化相关蛋白(3.45%)和其他未知功能蛋白(48.28%)(图 6-A)。
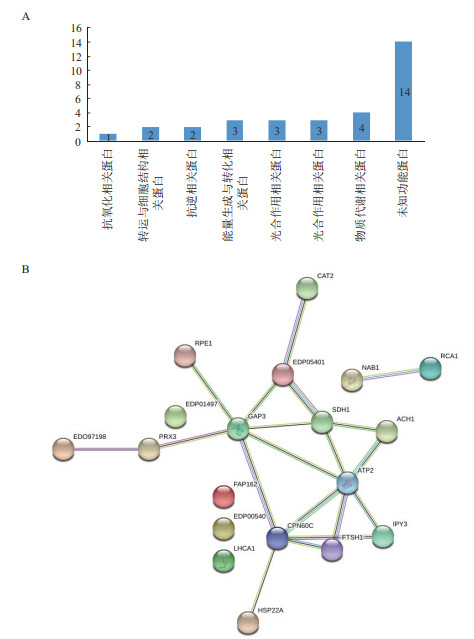
|
| 图 6 沙漠小球藻差异蛋白的功能分类(A)与蛋白质互作网络图(B) |
PPI分析结果(图 6-B)显示,部分表达差异蛋白构成一个结构复杂的多中心互作网络,该网络含19个蛋白质节点,有19种互作关系,各差异表达蛋白质间通过多条通路进行调节。在PPI网络中,相互作用较强的蛋白质主要为光合作用、物质代谢、转运与细胞结构、能量生成与转化、物质代谢及抗逆等相关的蛋白。
3 讨论本研究采用蛋白质组学方法研究干旱胁迫下沙漠小球藻蛋白表达特点。对获得的29个差异表达蛋白分析表明,干旱胁迫影响了沙漠小球藻的多个生物学过程,其中光合作用、物质代谢和能量合成受到的影响最大,此外抗逆、抗氧化和转运过程也受到影响。
3.1 光合作用相关蛋白叶绿体是光合作用的重要场所,捕光叶绿素a/b结合蛋白(点1)是高等植物和藻类中类囊体膜上接收太阳能最终同化CO2的一类蛋白,其通常与叶绿素和叶黄素形成捕光色素蛋白复合体[17]。绿色植物中大部分的叶绿素分子都被光系统Ⅰ(PSI)和光系统ⅡPSII)上的天然捕光色素复合体结合,其中光系统Ⅱ捕光色素复合体的含量最为丰富。有研究表明,捕光叶绿素a/b结合蛋白不仅可以行使光能传递、转化和分配的功能,其在适应环境胁迫中也起到了重要的作用[18-19],并且其表达受ABA信号调控[20]。Fan等[21]通过双向电泳技术研究了耐盐植物海蓬子在高盐条件下的蛋白组学差异,结果发现位于PSI和PSII上的捕光叶绿素a/b结合蛋白的表达量均明显上调。NADPH:醌还原酶(点11)能够还原多种电子受体,具有NADPH的底物特异性。本研究中发现干旱胁迫下一个捕光叶绿素a/b结合蛋白的表达上调,说明胁迫条件一定程度上提高了光合系统的光合能力,促进机体的物质代谢,从而来抵抗干旱胁迫。干旱、高盐等胁迫会导致植物机体受到损伤,高等植物和藻类能通过多种途径减少这种损伤。光捕获复合物的调节就是一种有效的光保护途径。NADPH:醌还原酶(点11)能够还原多种电子受体,具有NADPH的底物特异性。核酮糖-1,5-二磷酸羧化/加氧酶(点31)不仅能在光合作用中固定CO2,还能催化二磷酸核酮糖加氧反应[22]。Agrawal等[23]发现水稻幼苗在臭氧胁迫下,核酮糖-1,5-二磷酸羧化/加氧酶表达受到抑制。本研究中发现干旱胁迫下该蛋白的表达量下调,其抗旱机制还有待于进一步研究。
3.2 物质代谢和抗逆相关蛋白核酮糖磷酸异构酶(点8)是参与碳水化合物代谢和其他有机复合物生成的一类重要酶。甘油醛-3-磷酸脱氢酶(GAPDH,点20)不仅催化二羟丙酮磷酸(DHAP)转化为3-磷酸甘油酸,也催化3-磷酸甘油醛(GAP)转化为1,3-二磷酸甘油酸;是生物体内糖酵解和糖异生过程中的关键酶[24],也是维持生命基本活动的酶之一。同时,GAPDH还具有抵抗外界逆境胁迫的功能,Khanna等[25]研究干旱胁迫下鹰嘴豆GAPDH等基因的表达,结果表明干旱胁迫下GAPDH表达的转录水平明显提高;Ahsan等[26]运用双向电泳技术研究了砷胁迫下水稻叶片的蛋白组学变化,发现砷胁迫下GAPDH的表达量上调2倍以上。本研究中发现此蛋白表达量上调,说明GAPDH可使植物体内新陈代谢加快,从而提供更多的能量抵御外界胁迫环境。乌头酸水合酶(点21、22)参与三羧酸循环,可催化柠檬酸和异柠檬酸之间的相互转化。
胁迫环境下,富含甘氨酸RNA结合蛋白2(GRP2,点17)是一种植物首先参与信号转导的响应蛋白。研究发现GRPs的表达可受干旱、高盐、植物激素等因素的诱导[27-28]。本研究中GRP2在干旱胁迫下先下调后上调表达,说明干旱胁迫诱导该蛋白的表达。热休克蛋白60(HSP60,点29)属于热休克蛋白家族,其作为分子伴侣广泛分布于线粒体中,主要参与蛋白质折叠、移位和降解等过程,对抑制细胞凋亡也有重要作用。该蛋白在细胞处于应激条件时(如热休克、高盐及干旱等)表达量明显提高[29-31]。Sato等[32]在研究水稻抗寒性时发现该蛋白的上调表达。本研究中干旱胁迫下该蛋白的表达量上调,可能是因为其与变性蛋白质结合形成聚合体从而而减少对小球藻的伤害。
干旱胁迫条件下,核酮糖磷酸异构酶这类基础代谢有关酶的表达量先下调后上调,甘油醛-3-磷酸脱氢酶、乌头酸水合酶的表达量上调。说明胁迫条件下小球藻的新陈代谢速度加快,将储备的能量及时转化为各种细胞活动所需的动力,从而使机体正常生长以抵御外界胁迫。
3.3 能量生成与转化相关蛋白ATP合成酶广泛分布于线粒体内膜、叶绿体类囊体和细胞核中,参与氧化磷酸化和光合磷酸化反应,在跨膜质子动力势的推动下催化合成ATP,是生物体能量代谢的关键酶,又称三磷酸腺苷合成酶[33]。本研究鉴定的蛋白点5为ATP合成酶相关蛋白,其表达量在干旱胁迫下上调,为各类代谢活动提供能量。ATP依赖的锌金属蛋白酶FTSH5(点28)具有ATP酶活性、蛋白水解活性和分子伴侣活性,还与热激、高盐、病害等胁迫响应有关[34]。Zhang等[35]从磷酸化蛋白组水平探究了干旱胁迫对两种小麦的影响,结果表明干旱胁迫下两种小麦的ATP依赖的锌金属蛋白酶FTSH 5表达均下调。Das等[36]在研究大豆叶片对干旱胁迫及热激的响应时发现该蛋白在2种胁迫下的表达均下调。本研究中也发现此蛋白表达量先下调后上调,但对于其在沙漠小球藻中油脂积累机制中的作用有待进一步的探究和验证。分子伴侣TCP-1/cpn60(点30)主要在ATP水解时帮助蛋白质的折叠和组装,本研究中干旱胁迫能诱导分子伴侣TCP-1/cpn60表达量先下调后上调可能是因为其参与了小球藻干旱胁迫相关蛋白的折叠与组装,并与小球藻干旱胁迫相关蛋白的合成密切相关。
3.4 转运与细胞结构、抗氧化相关蛋白ABC转运蛋白底物结合蛋白(点3)通过水解ATP产生的能量对溶质中各种生物分子(如氨基酸、蛋白质、糖等)进行跨膜运输[37]。干旱胁迫条件下,该蛋白的表达上调,组织中的糖类、蛋白质的运输可能受到抑制,其抗旱机制还有待于进一步的研究。外膜蛋白/肽聚糖结合(脂)蛋白(点4)具有为外膜提供通透性,维持外膜结构稳定的作用。小球藻可能通过调节细胞内外渗透压,从而抵御干旱胁迫。
硫氧还蛋白过氧化物酶PMP20(点13)在进化中高度保守,从低等原核生物到高等生物人类中均有表达。该蛋白具有过氧化物酶和分子伴侣的双重性能,不仅可以参与细胞内抗氧化物代谢,还可以调节细胞内信号转导[38]。研究发现,其在不同物种中都可以发挥抗逆特性来维持体内氧化还原平衡。本研究中干旱胁迫条件下其表达量下调,其作用机制还有待于进一步研究。
除以上具有已知信息的蛋白外,2-DE中检测的差异蛋白中有53.13%的未知功能蛋白,主要因为小球藻不属于模式植物,其蛋白数据库还不完善。而其中必定蕴藏着和抗旱胁迫相关的蛋白和基因,这将是以后具有研究价值的方向。
3.5 蛋白质互作网络呈现的整体调控机制在PPI调控网络中,具有19个蛋白节点。干旱胁迫下差异表达的蛋白中,光合作用有关蛋白、能量生成与转化相关蛋白和抗逆相关的蛋白普遍上调。说明干旱胁迫影响了叶绿体、线粒体,其干旱的核心是叶绿体结构和光合作用的维持。此外,其他的细胞器和细胞质的蛋白也发生了变化,这些蛋白的变化说明沙漠小球藻可以通过细胞中各细胞器的协同变化以应对干旱胁迫。
3.6 干旱胁迫下沙漠小球藻蛋白质组和转录组的结果比较本课题组此前已对干旱和盐胁迫下沙漠小球藻开展了转录组学的研究,两者都显示胁迫18天比第0天胁迫得到的差异表达基因/蛋白数量更多,基因/蛋白在功能分类上差异较大。蛋白质组学发现,大量的蛋白质定位在叶绿体中,转录研究也发现了光合作用相关基因。在GO分析中,细胞组分的结果也发现基因在叶绿体中明显富集。蛋白质组学研究结果显示物质代谢相关蛋白、能量生成与转化相关蛋白和光合作用相关蛋白数目最多,转录组结果中次生代谢物的生物合成、生物过程调节、代谢过程和油脂的合成富集最多。两种方法在研究结果上的差异反映研究水平不同,合二者获得的数据,从不同水平、不同角度为沙漠小球藻抗逆机制的研究提供依据。
4 结论干旱胁迫影响沙漠小球藻部分蛋白的表达,共获得29个差异表达蛋白,主要涉及光合作用、物质代谢和抗逆、能量生成与转化等相关蛋白。沙漠小球藻能够通过改变不同功能蛋白的表达来维持光合作和脂质代谢的过程,以适应干旱胁迫。
| [1] |
黄英明, 王伟良, 李元广, 等. 微藻能源技术开发和产业化的发展思路与策略[J]. 生物工程学报, 2010, 26(7): 907-913. |
| [2] |
Sazuka T, Yamaguchi M, Ohara O. Cyano2Dbase updated:Linkage of 234 protein spots to corresponding genes through N-terminal microsequencing[J]. Electrophoresis, 2015, 20(11): 2160-2171. |
| [3] |
Srivastava AK, Bhargava P, Thapar R, et al. Salinity-induced physiological and proteomic changes in Anabaena doliolum[J]. Environmental & Experimental Botany, 2008, 64(1): 49-57. |
| [4] |
Song P, Li L, Liu J. Proteomic analysis in nitrogen-deprived Isochrysis galbana during lipid accumulation[J]. PLoS One, 2013, 8(12): 82188-82196. DOI:10.1371/journal.pone.0082188 |
| [5] |
Zhang A, Xu T, Zou H, et al. Comparative proteomic analysis provides insight into cadmium stress responses in brown algae Sargassum fusiforme[J]. Aquatic Toxicology, 2015, 16(3): 1-15. |
| [6] |
Simon WJ, Hall JJ, Suzuki I, et al. Proteomic study of the soluble proteins from the unicellular cyanobacterium Synechocystis sp. PCC6803 using automated matrix-assisted laser desorption/ionization-time of flight peptide mass fingerprinting[J]. Proteomics, 2002, 2(12): 1735-1742. DOI:10.1002/1615-9861(200212)2:12<1735::AID-PROT1735>3.0.CO;2-K |
| [7] |
Wolfe MF, Olsen HE, Gasuad KA, et al. Induction of heat shock protein(hsp)60 in Isochrysis galbana exposed to sublethal preparations of dispersant and Prudhoe Bay crude oil[J]. Marine Environmental Research, 1999, 47(5): 473-489. DOI:10.1016/S0141-1136(98)00132-9 |
| [8] |
Huttenlauch I, Peck RK, Stick R. Articulins and epiplasmins:two distinct classes of cytoskeletal proteins of the membrane skeleton in protists[J]. Journal of Cell Science, 1998, 111(22): 3367-3378. |
| [9] |
牟云, 汪文伦, 严国, 等. 沙漠小球藻的蛋白双向电泳分析[J]. 西北植物学报, 2016, 36(9): 1905-1911. |
| [10] |
牟云.沙漠小球藻(Chlorella sp.)产油性能及其调控机制的研究[D].石河子: 石河子大学, 2016.
|
| [11] |
Rabilloud T. Silver staining of 2D electrophoresis gels[J]. Quantitative Methods in Proteomics, 2012, 893: 61-73. DOI:10.1007/978-1-61779-885-6 |
| [12] |
Du Z, Zhou X, Ling Y, et al. agriGO:a GO analysis toolkit for the agricultural community[J]. Nucleic Acids Research, 2010, 38: W64-W70. DOI:10.1093/nar/gkq310 |
| [13] |
Xie C, Mao X, Huang J, et al. KOBAS 2.0:a web server for annotation and identification of enriched pathways and diseases[J]. Nucleic Acids Research, 2011, 39: W316-W322. DOI:10.1093/nar/gkr483 |
| [14] |
Bevan M, Bancroft I, Bent E, et al. Analysis of 1.9 Mb of contiguous sequence from chromosome 4 of Arabidopsis thaliana[J]. Nature, 1998, 391(6666): 485-488. DOI:10.1038/35140 |
| [15] |
Szklarczyk D, Franceschini A, Wyder S, et al. STRING v10:protein-protein interaction networks, integrated over the tree of life[J]. Nucleic Acids Research, 2014, 43: D447-D452. |
| [16] |
Smoot ME, Ono K, Ruscheinski J, et al. Cytoscape 2. 8:new features for data integration and network visualization[J]. Bioinformatics, 2011, 27(3): 431-432. DOI:10.1093/bioinformatics/btq675 |
| [17] |
Jansson S. A guide to the Lhc genes and their relatives in Arabidopsis[J]. Trends in Plant Science, 1999, 4(6): 236-240. DOI:10.1016/S1360-1385(99)01419-3 |
| [18] |
Wientjes E, Amerongen HV, Croce R. LHCⅡ is an antenna of both photosystems after long-term acclimation[J]. Biochimica Et Biophysica Acta, 2013, 1827(3): 420-426. DOI:10.1016/j.bbabio.2012.12.009 |
| [19] |
Ganeteg U, Külheim C, Andersson J, et al. Is each light-harvesting complex protein important for plant fitness?[J]. Plant Physiology, 2004, 134(1): 502-509. DOI:10.1104/pp.103.033324 |
| [20] |
Roberto J, Staneloni, Maria J, et al. Abscisic acid, high-light, and oxidative stress down-regulate a photosynthetic gene via a promoter motif not involved in phytochrome- mediated transcriptional regulation[J]. Molecular Plant, 2008, 1(1): 75-83. DOI:10.1093/mp/ssm007 |
| [21] |
Fan PX, Feng JJ, Jiang P, et al. Coordination of carbon fixation and nitrogen metabolism in Salicornia europaea under salinity:Comparative proteomic analysis on chloroplast proteins[J]. Proteomics, 2011, 11(22): 4346-4367. DOI:10.1002/pmic.201100054 |
| [22] |
Xu C, Huang B. Differential proteomic response to heat stress in thermal Agrostis scabra and heat-sensitive Agrostis stolonifera[J]. Physiologia Plantarum, 2010, 139(2): 192-204. DOI:10.1111/ppl.2010.139.issue-2 |
| [23] |
Agrawal GK, Rakwal R, Yonekura M, et al. Proteome analysis of differentially displayed proteins as a tool for investigating ozone stress in rice(Oryza sativa L.)seedlings[J]. Proteomics, 2002, 2(8): 947-959. DOI:10.1002/1615-9861(200208)2:8<947::AID-PROT947>3.0.CO;2-J |
| [24] |
Zaffagnini M, Fermani S, Costa A, et al. Plant cytoplasmic GAPDH:redox post-translational modifications and moonlighting properties[J]. Frontiers in Plant Science, 2013, 4(20): 450. |
| [25] |
Khanna SM, Taxak PC, Jain PK, et al. Glycolytic enzyme activities and gene expression in cicer arietinum exposed to water-deficit stress[J]. Applied Biochemistry & Biotechnology, 2014, 173(8): 1-13. |
| [26] |
Ahsan N, Lee DG, Kim KH, et al. Analysis of arsenic stress-induced differentially expressed proteins in rice leaves by two-dimensional gel electrophoresis coupled with mass spectrometry[J]. Chemosphere, 2010, 78(3): 224-231. DOI:10.1016/j.chemosphere.2009.11.004 |
| [27] |
Kim JY, Su JP, Jang B, et al. Functional characterization of a glycine-rich RNA-binding protein 2 in Arabidopsis thaliana under abiotic stress conditions[J]. The Plant Journal, 2007, 50(3): 439-451. DOI:10.1111/j.1365-313X.2007.03057.x |
| [28] |
Kim JS, Park SJ, Kwak KJ, et al. Cold shock domain proteins and glycine-rich RNA-binding proteins from Arabidopsis thaliana can promote the cold adaptation process in Escherichia coli[J]. Nucleic Acids Research, 2007, 35(2): 506-516. |
| [29] |
Queitsch C, Hong SW, Vierling E, et al. Heat shock protein 101 plays a crucial role in thermotolerance in Arabidopsis[J]. The Plant Cell, 2000, 12(4): 479-492. DOI:10.1105/tpc.12.4.479 |
| [30] |
Ruibal C, Castro A, Carballo V, et al. Recovery from heat, salt and osmotic stress in Physcomitrella patens requires a functional small heat shock protein PpHsp16. 4[J]. Bmc Plant Biology, 2013, 13(2): 56-60. |
| [31] |
Hong SL, Bhagat L, Frossard JL, et al. Water immersion stress induces heat shock protein 60 expression and protects against pancreatitis in rats[J]. Gastroenterology, 2000, 119(1): 220-229. DOI:10.1053/gast.2000.8551 |
| [32] |
Sato Y, Yokoya S. Enhanced tolerance to drought stress in transgenic rice plants overexpressing a small heat-shock protein, sHSP17. 7[J]. Plant Cell Reports, 2008, 27(2): 329-334. DOI:10.1007/s00299-007-0470-0 |
| [33] |
Katam R, Basha SM, Suravajhala P, et al. Analysis of peanut leaf proteome[J]. Journal of Proteome Research, 2010, 9(5): 2236-2254. DOI:10.1021/pr901009n |
| [34] |
孙爱清, 刘箭, 张杰道. 植物中的金属蛋白酶FTSH[J]. 植物生理学报, 2006, 42(1): 148-154. |
| [35] |
Zhang M, Lv D, Ge P, et al. Phosphoproteome analysis reveals new drought response and defense mechanisms of seedling leaves in bread wheat(Triticum aestivum L.)[J]. Journal of Proteomics, 2014, 10(9): 290-308. |
| [36] |
Das A, Eldakak M, Paudel B, et al. Leaf proteome analysis reveals prospective drought and heat stress response mechanisms in soybean[J]. Biomed Research International, 2016, 16(8): 602-617. |
| [37] |
Hung MC, Humbert MV, Laver JR, et al. A putative amino acid ABC transporter substrate-binding protein, NMB1612, from Neisseria meningitidis, induces murine bactericidal antibodies against meningococci expressing heterologous NMB1612 proteins[J]. Vaccine, 2015, 33(36): 4486-4494. DOI:10.1016/j.vaccine.2015.07.032 |
| [38] |
Grunewald W, De SI, Lewis DR, et al. Transcription factor WRKY23 assists auxin distribution patterns during Arabidopsis root development through local control on flavonol biosynthesis[J]. Proceedings of the National Academy of Sciences of the United States of America, 2012, 109(5): 1554-1559. DOI:10.1073/pnas.1121134109 |