2. 中国热带农业科学院环境与植物保护研究所,海口 571101;
3. 澄迈县农业局,澄迈 571900
2. Environment and Plant Protection Institute, Chinese Academy of Tropical Agricultural Sciences, Key Laboratory of Integrated Pest Management on Tropical Crops, Ministry of Agriculture, Haikou 571101;
3. Chengmai County Agriculture Bureau, Chengmai 571900
胶孢炭疽菌(Colletotrichum gloeosporioides)广泛分布在热带和亚热带区域,侵染芒果、香蕉、橡胶、荔枝等多种植物,引起叶部和果实炭疽病。病菌以分生孢子侵染寄主的嫩叶、嫩梢、花、果等部位,引起落叶、落花、落果,以及贮藏期的果实腐烂[1-2]。目前,防治芒果炭疽病的方法主要为化学防治,但随着化学农药的大量施用,许多地区的芒果炭疽病菌出现不同程度地耐药性或抗药性,如代森锰锌在芒果园内的长期使用,增加了病原菌对药剂的选择压[3-4];丙环唑的长期使用使众多作物产生抗药性[5],多菌灵[6]、甲基硫菌灵[7]、苯醚甲环唑[8]、咪鲜胺[9]等农药也是如此。田间芒果炭疽病成为生产中较为难防治的病害之一,为更好地解决该问题,有必要从分子水平上探究芒果炭疽病的致病机理,寻找新的农药靶标位点,为开发新型农药提供参考。
通过分析病原菌侵染寄主过程中基因的差异表达,可以较好地辨析出致病相关基因在侵染过程中的作用[10-12]。胶孢炭疽菌致病相关基因主要调控孢子萌发,附着胞的形成、黑化、穿透,活体与死体营养阶段的转换及相关蛋白分泌,酶活性及产孢等。如,漆酶基因LAC1在菌丝生长、发育、分化、黑色素沉淀,以及分生孢子的形成,对寄主的致病力、对环境的适应能力等方面起着重要的调控作用[13]。
本实验以芒果炭疽病菌的PL(果胶裂解酶,Pectase Lyase)、PG(多聚半乳糖醛酸酶,Endopolygalacturonas-F)、ECH(烯酰-coA水合酶/异构酶蛋白,EnoyL-coA-hydratase/isomerase-F)、LIP(分泌脂肪酶,Secretory lipase-F)、PKS(聚酮合成酶,Polyketide synthase-F)、SCD(小柱孢酮脱水酶,Scytalone dehydratase)、CRAT(肉毒碱乙酰转移酶,Carnitine acetyl transferase-F)、HMT(组蛋白甲基转移酶,Histone methyltransferase)、SIN3P(组蛋白脱乙酰酶,Histone deacetylase)、NRPS(非核糖体多肽合成酶,Nonribosomal peptide synthetase-F)和MEP2(铵转运蛋白mep2,Ammonium transporter mep2-F)等11个致病相关基因为研究对象,通过实时荧光定量PCR,分析致病相关基因在病原菌侵染叶片和果实过程中的表达量变化,揭示芒果炭疽病菌侵染过程中致病相关基因的差异表达,辨析出各个侵染阶段的致病相关基因,旨在为后续基因功能解析奠定基础。
1 材料与方法 1.1 材料供试芒果炭疽病菌由中国热带农业科学院环植所提供。供试材料贵妃芒的嫩叶和成熟果,采自中国热带农业科学院品资所芒果苗圃。
E.Z.N.A.® Fungal RNA Kit购于Omega生物技术公司、荧光定量PCR试剂盒UltraSYBR Mixture(Low Roe)购于康为世纪生物科技有限公司、反转录试剂盒Revert Aid First Strand cDNA Synthesis Kit购于天根生化科技有限公司,其它试剂均为常规试剂。
1.2 方法 1.2.1 病原菌接种叶片和果实参考张贺等[14]人的方法制备芒果炭疽病菌(Colletotrichum gloeosporioides)A2的分生孢子悬浮液,使其浓度为4×106个/mL,用于接种芒果嫩叶和成熟果。
用清水将贵妃芒的嫩叶、成熟果实冲洗干净,然后浸泡在1% NaClO溶液中15 min,再用超纯水冲洗3遍后置于保鲜盒中,保持相对湿度为100%,备用。
采用束针刺伤嫩叶和成熟果实表皮,接种20 µL分生孢子悬浮液,28℃下恒温黑暗培养,以接菌0 h的为对照。用直径为1 cm的打孔器取10个接种点,按照不同的时间点取样后至于液氮速冻、-80℃保存、备用。
接种叶片后的取样时间点:0 h、6 h、12 h、24 h、36 h、48 h、72 h;接种果实后的取样时间点:0 h、12 h、24 h、36 h、48 h、72 h和96 h。
1.2.2 病原菌总RNA的提取和cDNA第一链的反转录参照E.Z.N.A.® Fungal RNA Kit中的方法提取不同时间点的病原菌总RNA,参照Fast Quant RT Kit(with gDNase)试剂盒完成第一链cDNA的合成,反转录后的cDNA稀释10倍,备用。采用超微量紫外分光光度计和1%的琼脂糖凝胶电泳两者相结合的方法检验总RNA的提取效果,确保RNA的提取质量满足实验需要。
1.2.3 实时荧光定量PCR以病原菌PL、PG、ECH、LIP、PKS、SDH、CRAF、HMT、SIN3P、NRPS和MEP2 11个致病相关基因为对象,以ACT作为内参基因,所用基因引物序列参考Alkan等[15],由北京华大生物科技有限公司合成,PAGE纯化,详细引物序列见表 1。
实时荧光定量PCR反应体系为20 μL:ddH2O 8 μL,cDNA 1 μL,引物各0.5 μL,2×UltraSYBR Mixture 10 μL,检测系统为Quant Studio 6 Flex。
PCR反应程序:95℃ 10 min;95℃ 15 s,60℃ 1 min,72℃ 30 s,40个循环;16℃保存,在72℃时收集荧光信号。
1.2.4 数据分析运用2-ΔΔCt法进行数据计算[16],实时荧光定量PCR仪(QuantStudioTM 6 Flex Real-Time PCR System Software)系统导出各样品的Ct值,以接菌0 h的为对照,以基因表达量增加2倍以上为上调,降低50%为下调。参考Deng等[17]的方法,采用HemI 1.0.3.3软件绘制热度图,研究分析各致病相关基因在不同组织的侵染过程中的表达差异情况。
2 结果 2.1 病原菌侵染叶片时相关基因表达量分析病原菌侵染嫩叶时,11个致病相关基因的表达量差异明显,PL、PG在整个侵染过程中持续高效表达、各个时间点的表达量高于0 h的5倍以上,PKS、NRPS、MEP2、HMT、ECH、SDH、LIP和CRAT等8个基因在接种6 h后明显上调表达,随后则不同程度地下调表达,仅CRAT在24 h时、HMT和LIP在72 h时的表达量达2倍以上;SIN3P基因则持续下调表达(图 1)。
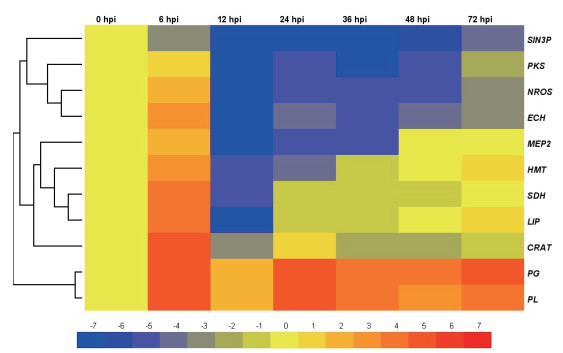
|
| 图 1 病原菌侵染叶片时基因差异表达的热度图 注:数值以Log2为底的对数。红色表示为上调表达,黄色为不表达,蓝色表示为下调表达。下同 |
以病原菌侵染叶片时的不同基因不同时间点的基因表达量的两两差异程度进行层级聚类分析,结果表明,11个基因共聚为3个大的分支,持续性高效表达的PG和PL基因聚为1个分支,表达量较低的SIN3P、PKS、NROS和ECH 4个基因聚为一个分支,介于二者之间的其余5个基因聚为1个分支,这说明表达量相近的基因会聚类在同一个分支上。
2.2 病原菌侵染果实时相关基因表达量分析病原菌侵染成熟果时,11个致病相关基因的表达量差异明显,PL、PG、SDH和ECH基因高效表达、各个时间点的表达量高于0 h的3倍以上,其他基因则有不同程度的上调表达(图 2)。
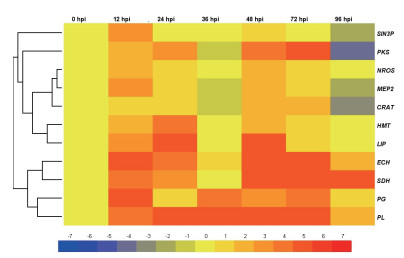
|
| 图 2 病原菌侵染果实时基因差异表达的热度图 |
以病原菌侵染果实时的不同基因不同时间点的基因表达量的两两差异程度进行层级聚类,结果表明,11个基因共聚为2个大的分支5个小的分支,持续高效表达的PL、PG、SDH、ECH基因聚为1个大分支,其中PG和PL聚为1个小分支,ECH和SDH聚为1个小的分支,说明4个基因虽持续上调表达,但仍有所差异;SIN3P和PKS基因分别单独聚为一个小的分支,SIN3P仅在12 h和48 h是上调表达,表达量分别为13.34和2.62倍,96 h为下调表达,其余3个时间点的表达量介于1.10-1.89倍之间,PKS在12 h、24 h、48 h和72 h上调表达,表达量分别为4.92、15.22、16.35和46.49倍,36 h的为0.68倍,96 h为下调表达。
3 讨论病原菌在侵染寄主的过程中,会调控自身的致病相关基因进行高效表达,从而调控分生孢子或菌丝朝着有利于自身侵染的方向生长,实现病原菌的顺利侵染,造成寄主感病。分析致病相关基因在侵染过程中的差异表达,可为揭示基因功能提供借鉴,也可为施加药剂阻碍致病基因的高效表达、降低病原菌的侵染效率提供参考。Alkan等[15]在研究胶孢炭疽菌侵染番茄果实的过程中发现多聚半乳糖醛酸酶基因PG和果胶裂解酶基因PL在侵染过程中持续高效上调表达,这与本文研究发现芒果胶孢炭疽菌侵染叶片和果实时PG和PL持续性地高效上调表达,具有很好的一致性,这两个基因能降解寄主细胞壁中的果胶,促使其成功地定殖于寄主内,其单基因突变或双基因突变均能明显地降低病原菌的致病力[16]。ECH基因则是先上调再下调的表达方式[17],与本文结果有差异;PKS基因在胶孢炭疽菌侵染番茄果实时为下调表达,而本实验中PKS基因的表达方式为先上调再下调表达,与Alkan等[18]的研究结果有所不同。
附着胞在胶孢炭疽菌的侵染过程中起到重要的作用,黑色素的合成积累能增加附着胞的膨压,从而促进病原菌的成功侵染,而小柱孢酮脱水酶SCD基因则是黑色素合成途径中的多个关键酶之一[19-20],该基因表达活性的强弱会影响到胶孢炭疽菌的侵染效率。本研究发现小柱孢酮脱水酶(SDH)在病原菌接种叶片6 h时、接种果实12 h是上调表达,而这个时期则是病原菌分生孢子侵染的时期[21],这说明小柱孢酮脱水酶SCD参与了分生孢子侵染寄主的过程中。氰菌胺(Fenxanil)和环丙酞菌胺(Carpropamid)[22-23]是以小柱孢酮脱水酶为靶标的杀菌剂,通过阻断脱水步骤而限制黑色素DHN的合成,从而抑制病原菌的侵染,但针对不同的病原菌,其杀菌效果差异较大,鉴于SDH在胶孢炭疽菌侵染芒果叶片和果实种发挥重要作用,有必要对氰菌胺(Fenxanil)和环丙酞菌胺(Carpropamid)优化,而得到杀菌效果更好的杀菌剂,应用于芒果炭疽病的防治过程中。
4 结论芒果胶孢炭疽菌侵染芒果叶片和果实过程中,病原菌的PL、PG、ECH、LIP、PKS、SDH、CRAF、HMT、SIN3P、NRPS和MEP2等11个致病相关基因的表达量发现明显变化。病原菌侵染叶片时,PG和PL基因均持续高效表达,SIN3P基因表达较低,其余基因在侵染6 h时表达量较高,随后下降;病原菌侵染果实时,PL、PG、SDH和ECH等基因高效表达,其余基因则有升有降。
| [1] |
黄忠兴, 安玉兴, 黄锦福, 等. 海南芒果炭疽病的发生规律与综合防治[J]. 热带农业科技, 2008, 31(2): 20-23. |
| [2] |
于海英, 兰建强, 王晓燕, 等.芒果胶孢炭疽菌致病性的初步研究[C].中国植物病理学会2012年学术年会, 2012.
|
| [3] |
张胡焕. 20%咪鲜胺.三唑酮微乳剂的研制及其对芒果炭疽病的防治效果测定[D].海口: 海南大学, 2011.
|
| [4] |
Chanchaichaovivat A, Ruenwongsa P, Panijpan B, et al. Screening and identification of yeast strains from fruits and vegetables:Potential for biological control of postharvest chilli anthracnose(Colletotrichum capsici)[J]. Biological Control, 2007, 42(3): 326-335. |
| [5] |
蒲金基, 张贺, 杨石有, 等. 芒果炭疽病菌对丙环唑的敏感性基线及抗药性评价[J]. 中国果树, 2014(6): 24-27. |
| [6] |
陈功友, 张传伟, 吴金成, 等. 苹果炭疽病菌对多菌灵抗药性研究[J]. 果树学报, 1993(3): 150-153. |
| [7] |
成禄艳.芒果炭疽病菌对几种杀菌剂的抗药性研究[D].广州: 华南农业大学, 2016.
|
| [8] |
侯欣, 陈国庆, 王兴红, 等. 3种柑橘病原真菌对苯醚菌酯和苯醚甲环唑敏感基线研究[J]. 浙江大学学报:农业与生命科学版, 2013, 39(1): 62-68. |
| [9] |
王小琴.芒果炭疽病菌对咪鲜胺的室内抗药性研究[D].福州: 福建农林大学, 2013.
|
| [10] |
韩长志. 胶孢炭疽菌侵染过程相关基因研究进展[J]. 广东农业科学, 2014, 41(9): 165-169. |
| [11] |
张楠, 柳志强, 吴曼莉, 等. 胶孢炭疽菌CgSho1基因的克隆与功能分析[J]. 植物病理学报, 2017(1): 40-49. |
| [12] |
韩秀秀, 李晓宇, 何朝族. 稻瘟病菌MoCOS1基因调控MoCMR1基因表达的研究[J]. 植物病理学报, 2014, 44(3): 239-246. |
| [13] |
Wei YX, Pu JJ, Zhang H, et al. The laccase gene(LAC1)is essential for Colletotrichum gloeosporioides, development and virulence on mango leaves and fruits[J]. Physiological & Molecular Plant Pathology, 2017, 99: 55-64. |
| [14] |
张贺, 韦运谢, 漆艳香, 等. 温湿度对芒果炭疽病病原菌分生孢子萌发及附着胞形成的影响[J]. 中国植保导刊, 2015, 35(1): 10-13. |
| [15] |
Alkan N, Friedlander G, Ment D, et al. Simultaneous transcriptome analysis of Colletotrichum gloeosporioides and tomato fruit pathosystem reveals novel fungal pathogenicity and fruit defense strategies[J]. New Phytologist, 2015, 205(2): 801. |
| [16] |
Livak KJ, Schmittgen TD. Analysis of relative gene expression data using real-time quantitative PCR and the 2(-Delta Delta C(T))Method[J]. Methods, 2001, 25(4): 402-408. |
| [17] |
Deng W, Wang Y, Liu Z, et al. HemI:a toolkit for illustrating heat maps[J]. PLoS One, 2013, 9(11): e111988. |
| [18] |
Kubo Y, Takano Y. Dynamics of infection-related morphogenesis and pathogenesis in Colletotrichum orbiculare[J]. Journal of General Plant Pathology, 2013, 79(4): 233-242. |
| [19] |
Nosanchuk JD, Casadevall A. Impact of melanin on microbial virulence and clinical resistance to antimicrobial compounds[J]. Antimicrob Agents Chemother, 2006, 50(11): 3519-3528. |
| [20] |
王利国, 李玲, 彭永宏. 植物真菌致病基因的研究进展[J]. 华南师范大学学报:自然科学版, 2003(1): 135-142. |
| [21] |
张贺, 韦运谢, 漆艳香, 等. 温湿度对芒果炭疽病病原菌分生孢子萌发及附着胞形成的影响[J]. 中国植保导刊, 2015, 35(1): 10-13. |
| [22] |
Rohilla R, Singh US, Singh RL. Uptake and translocation of carpropamid in rice(Oryza sativa L)[J]. Pest Management Science, 2001, 57(3): 239-47. |
| [23] |
方敏彦.稻瘟菌对三唑类杀菌剂丙环唑敏感性检测及农杆菌介导的稻瘟菌转化—致病缺陷突变体筛选[D].兰州: 甘肃农业大学, 2009.
|





