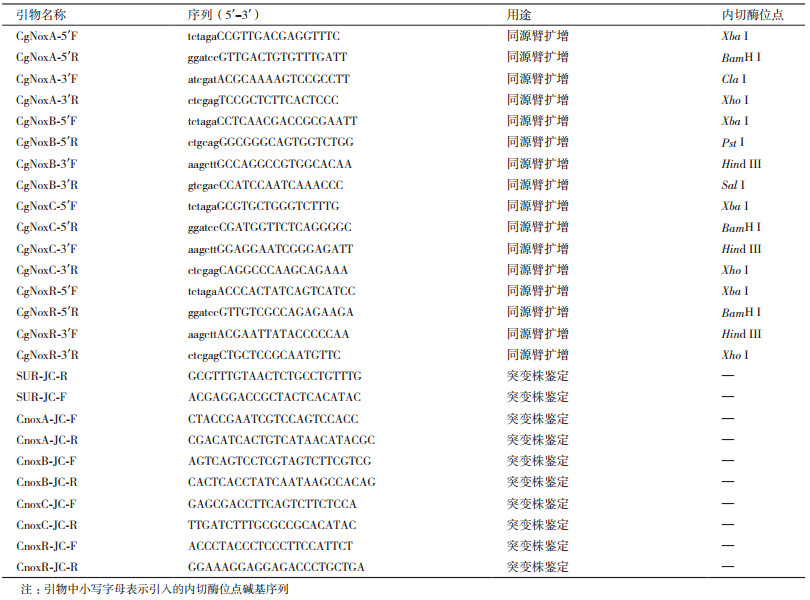
橡胶树炭疽病害是海南省橡胶园区主要的真菌病害之一,主要由胶孢炭疽菌(Colletotrichum gloeosporioides)引起。该病原菌能够侵染橡胶树叶片、叶柄及果实,引起橡胶树嫩梢回枯及重复落叶,推迟开割时间,从而影响胶乳产量[1-2]。目前对于该病害的防治主要依靠喷施化学农药,虽然短期内效果显著,但是容易对环境造成污染,也会引起病原菌产生抗药性。因此,从分子水平上研究胶孢炭疽菌的致病机制,有助于新型农药的开发。
烟酰胺腺嘌呤二核磷酸(Nicotinamide adenine dinucleotide phosphate,NADPH)氧化酶(Nox)是一类定位于细胞膜上的特殊蛋白,它们是真核生物细胞内氧化还原信号的关键酶,也是细胞内活性氧(Reactive oxygen species,ROS)的主要来源。在动物细胞中,Nox通过控制细胞内ROS水平,参与调控机体免疫反应及一系列生理功能[3]。在植物细胞中,Nox参与调控植物生长发育及生物或非生物胁迫应答反应[4]。近年来,研究者们在真菌中也发现了一系列Nox蛋白,它们在真菌的生长和分化过程中起着重要作用[5]。在构巢曲霉(Aspergillus nidulans)中,NoxA与子实体的形成密切相关[6]。进一步研究表明,NoxA主要通过调控构巢曲霉菌丝尖端ROS的代谢来维持菌丝的顶端优势[7]。在粗糙脉孢菌(Neurospora crassa)中,Nox1的缺失会导致雌性不育、降低分生孢子的形成、并且降低菌丝生长的速度;而Nox2的缺失会导致接合孢子失去萌发能力[8]。此外,在病原真菌中,Nox也与病原真菌对寄主的致病力有着密切关系。在稻瘟菌中,Nox与附着胞侵入水稻叶片的能力密切相关[9]。在腐生型植物病原菌灰霉菌(Botrytis cinerea)中,Nox与灰霉菌的生长发育以及致病力密切相关[10]。在人体病原菌白色念珠菌(Candida albicans)中,Nox参与调控病原菌的形态转变及对寄主的致病力[11]。
通过蛋白序列比对发现,在橡胶树胶孢炭疽菌基因组中存在着3个编码Nox蛋白的基因,分别命名为CgNoxA、CgNoxB、CgNoxC。此外,在基因组中还存在一个编码Nox调节蛋白的基因,命名为CgNoxR。至今为止,尚未有关橡胶树胶孢炭疽菌Nox功能的研究报道。在本研究中,通过构建这4个基因的敲除突变株及对敲除突变株的生理表型的分析,初步阐明了Nox在胶孢炭疽菌中的功能。
1 材料与方法 1.1 材料 1.1.1 供试菌株橡胶树胶孢炭疽菌野生型菌株由本实验室分离保存,并在前期工作中完成该菌株的基因组测序工作。
1.1.2 实验试剂实验所用基因敲除载体pBS-SUR由本实验室改造,以pBluescript Ⅱ KS(+)为骨架,在Pst Ⅰ,EcoR Ⅰ位点处连入氯嘧磺隆抗性基因(稻瘟菌乙酰乳酸合成酶基因,SUR)。PCR引物合成及DNA测序由华大基因公司完成,DNA聚合酶、DNA Marker及大肠杆菌感受态均购自北京全式金公司,限制性内切酶及T4 DNA连接酶购自Fermentas公司,羧苄青霉素、卡那霉素、氯嘧磺隆均购自Sigma公司,裂解酶(Lysing enzyme)及聚乙二醇(PEG 3350)购自Sigma公司,其它化学试剂采用国产分析纯。采用土豆浸膏培养基(PDA)培养基,完全培养基(CM)及麦芽提取物培养基(MEA)培养菌株。采用再生培养基(含1 g/L酵母浸粉,1 g/L酸水解酪蛋白以及6 mol/L蔗糖)培养真菌原生质体。
1.2 方法 1.2.1 橡胶树胶孢炭疽菌Nox预测应用BioEdit软件,以胶孢炭疽菌Colletotrichum gloeosporioides strain Nara gc5的Nox蛋白序列为模板,在本实验室测序拼接的橡胶树胶孢炭疽菌基因组数据库中进行Blast-P,检索同源序列。
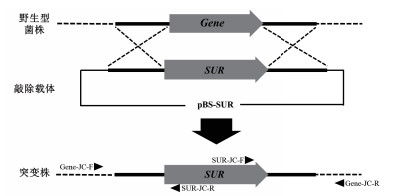
1.2.2 敲除载体的构建本实验中采用同源重组原理进行目的基因的敲除,具体策略如图 1所示:以野生型菌株基因组DNA为模板,分别扩增待敲除基因序列的上下游片段,作为同源重组所需的同源臂;经测序分析正确后,将上下游片段分别用对应的限制性内切酶(表 1)进行双酶切,并依次连入敲除载体pBS-SUR的SUR基因的左右两侧,完成敲除载体的构建。之后以敲除载体为模板,利用上游同源臂的正向引物及下游同源臂的反向引物,用高保真酶扩增基因敲除所需的DNA片段,回收备用。
|
| 图 1 敲除原理图 Gene表示待敲除的目标基因,SUR为氯嘧磺隆抗性基因,三角符号表示检测突变株所用引物 |
橡胶树胶孢炭疽菌原生质体的制备及转化参照文献[12]所述方法进行。将野生型菌株接种到PDA培养基上,28℃培养7 d。然后使用无菌水收集分生孢子,并使用无菌滤膜除去菌丝体。再将孢悬液接种于200 mL液体完全培养基中,使得孢子初始浓度为105个/mL,将孢子在28℃,160 r/min震荡培养14-16 h。采用无菌滤膜收集菌丝体,并将菌丝体转移到含10 mg/mL裂解酶的1 mol/L山梨醇缓冲液中,在28℃,100 r/min培养3 h以降解菌丝体细胞壁。然后在冰浴条件下,使用无菌滤膜过滤收集原生质体,在4℃、2 000×g条件下离心10 min收集原生质体,并用冰冷的1 mol/L山梨醇缓冲液冲洗2次除去残余酶液。最后,用山梨醇缓冲液将原生质体浓度调整至108个/mL。在上述制备好的200 μL原生质体中,加入100 μL重组DNA片段,缓慢吸打混匀,于冰上放置20 min。然后在混合物中缓慢加入1 mL含40% PEG的山梨醇缓冲液,并颠倒混匀,于28℃放置20 min。待转化完成后,在转化混合物中加入5 mL液体再生培养基,在28℃,100 r/min再生培养4 h。之后在培养物中加入处于熔化状态、温度在50℃左右、含1%琼脂的固体再生培养基,颠倒混匀后平铺于培养皿中。待培养基凝固后,再在其上平铺含100 μg/mL氯嘧磺隆的固体再生培养基。培养皿置于28℃培养3-4 d。
1.2.4 敲除突变株的鉴定本实验中采用氯嘧磺隆筛选转化子。待转化、再生培养后,将阳性转化子转接到PDA培养基进行扩大培养,并提取其基因组DNA进行PCR鉴定。为了检测基因敲除片段是否正确重组到目标基因位点,本实验中采用两轮PCR检测方法鉴定转化子,具体策略如图 1所示:在重组片段中的上游同源臂的外侧及抗性基因SUR序列中设计一对检测引物;同理,再在下游同源臂的外侧及抗性基因SUR序列中设计一对检测引物;通过PCR扩增检测重组片段是否正确整合到目标基因的位点。获得正确的敲除突变株后,通过单孢分离对筛选到的突变株进行分离纯化。将检测正确的突变体菌株接种到PDA培养基上,28℃培养7 d。然后使用无菌水收集分生孢子,使用无菌滤膜除去菌丝体,计算孢子浓度,配置成浓度为103个/mL的孢悬液,并取100 μL均匀涂布在含100 μg/mL氯嘧磺隆的MEA平板上,放置于28℃培养箱中培养。待长出菌落后,提取其基因组DNA进行检测。
1.2.5 产孢量检测及孢子形态观察将野生型菌株与4种敲除突变株分别接种到PDA培养基上,28℃培养7 d。然后使用无菌水收集分生孢子,并使用无菌滤膜除去菌丝体。然后使用血球计数板于光学显微镜下计算孢子浓度,接种于30 mL的液体完全培养基之中,使得孢子初始浓度为103个/mL。将菌株置于28℃,160 r/min震荡培养3 d之后,统计孢子浓度[9]。取上述重悬于新鲜完全培养基中的孢子悬浮液,滴加在干净的载玻片上,于28℃、湿润环境下培养6 h,利用显微镜定时观察孢子形态。
1.2.6 致病力分析采集生长正常、没有损伤的嫩绿期的橡胶树叶片用于致病力分析。如上所述,收集不同菌株的分生孢子,用新鲜完全培养基重悬,制备成浓度为2×105个/mL的孢子悬浮液。之后在叶片上滴加5 μL孢子悬浮液,并将接种后的离体叶片置于光照培养箱中,28℃、湿润环境下培养5 d,观察叶片发病情况,统计发病率,记录叶片病斑直径。每个处理共包含30片叶片,分为3组。本实验共重复两次。
1.2.7 菌丝尖端活性氧代谢检测如上所述,收集不同菌株的分生孢子,用新鲜完全培养基重悬,制备成浓度为2×105个/mL的孢子悬浮液备用。将无菌玻璃纸覆于PDA培养基上,并在玻璃纸上滴加孢子悬浮液,于28℃、湿润环境下培养12 h。之后将玻璃纸及玻璃纸上的菌丝体转移到载玻片上,并在菌丝体上滴加约50 μL的0.4%硝基蓝四氮唑(Nitroblue tetrazolium,NBT)染液。染色10 min后,使用蒸馏水漂洗,于显微镜下观察并记录。
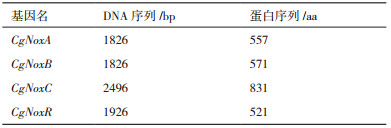
2 结果 2.1 橡胶树胶孢炭疽菌Nox基因信息通过与基因组进行比对,分别搜索到3个Nox同源蛋白,分别命名为CgNoxA、CgNoxB、CgNoxC。此外,在基因组中检索到一个编码Nox调节蛋白(NoxR)的基因,命名为CgNoxR。这4个蛋白及其编码基因的具体信息如表 2所示。
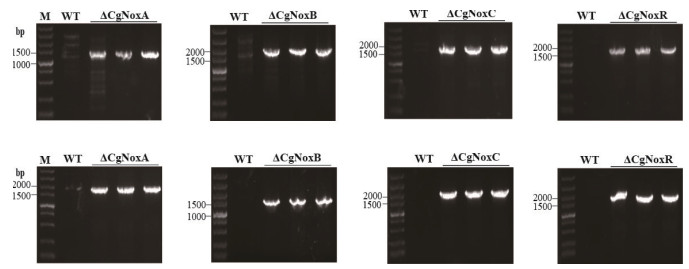
利用同源重组原理,通过原生质体转化法分别获得了多个具有氯嘧磺隆抗性的阳性转化子。利用PCR扩增检测各转化子,结果如图 2所示。CgNoxA敲除转化子成功扩增出约1 393 bp、1 741 bp大小的目标条带;CgNoxB敲除转化子成功扩增出约1 885 bp、1 497 bp大小的目标条带;CgNoxC敲除转化子成功扩增出约1 666 bp、1 630 bp bp大小的目标条带;CgNoxR敲除转化子成功扩增出约1 863 bp、1 593 bp大小的目标条带。经测序分析,表明扩增的条带为目标条带,表明基因敲除片段成功整合到目标基因的位点,敲除突变株构建成功。
|
| 图 2 敲除突变株的PCR鉴定 M:DNA marker;WT:野生型菌株 |
进一步通过单孢分离,获得了4个基因的敲除突变株纯合体菌株。将这4个敲除突变株分别命名为ΔCgNoxA、ΔCgNoxB、ΔCgNoxC和ΔCgNoxR。
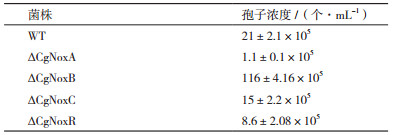
2.3 突变株产孢量检测在液体培养基中培养3 d后,统计不同菌株培养物中孢子浓度。结果如表 3所示,在培养3 d后,野生型菌株培养物中孢子浓度约为21×105个/mL;在4个敲除突变株中,ΔCgNoxA的孢子浓度仅为1.1×105个/mL,远远低于野生型菌株;ΔCgNoxB的孢子浓度仅为116×105个/mL,孢子产量提高了约5倍;ΔCgNoxB和ΔCgNoxR的产孢量与野生型菌株相比略有下降,分别为15×105个/mL及8.6×105个/mL。
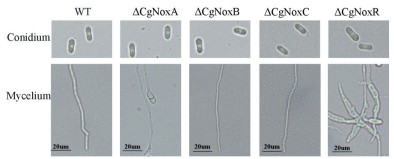
将4个基因的敲除突变株及野生型菌株的孢子进行培养,并对其孢子形态及萌发过程进行观察。结果(图 3)表明,4种突变株的孢子形态与野生型菌株相比没有明显差异,但是ΔCgNoxR突变株的孢子萌发过程明显异常,其孢子芽管长度明显短于其它菌株,且芽管形态发生变异。
|
| 图 3 野生型与4种突变体孢子形态与菌丝差异 Conidium:孢子;Mycelium:萌发后的菌丝 |
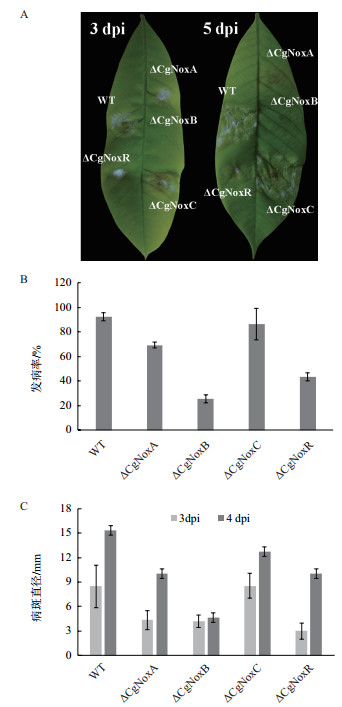
将4个基因的敲除突变株与野生型菌株同时接种橡胶树叶片,结果(图 4-A)发现,在接种3 d后,与野生型菌株相比,ΔCgNoxB的发病率明显下降,约为25%;ΔCgNoxA和ΔCgNoxR的发病率也有不同程度的下降(图 4-B)。此外,ΔCgNoxB侵染叶片后产生的病斑直径明显小于野生型菌株;ΔCgNoxA和ΔCgNoxR产生的病斑直径出现了一定下降(图 4-C)。
|
| 图 4 致病力检测 A:橡胶树接种病原菌3 d及5 d后的发病情况(dpi:接种后天数);B:橡胶树叶片接种不同菌株3 d后的发病率统计结果,WT:野生型菌株;C:橡胶树叶片接种不同菌株3-4 d后的病斑直径统计结果 |
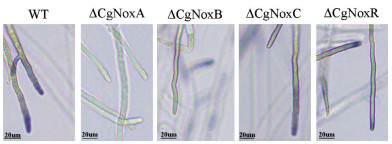
为了检测菌丝尖端活性氧代谢情况,本实验中采用硝基四氮唑染色法对各菌株进行了检测。如图 5所示,在染色10 min后,野生型菌株的菌丝尖端产生了密集的甲月替(Formazan)沉淀,说明在野生型菌丝尖端存在着明显的活性氧代谢。而ΔCgNoxA菌丝尖端几乎没有形成沉淀,说明其活性氧代谢出现异常;在ΔCgNoxB和ΔCgNoxR突变株中,活性氧代谢水平与野生型菌株相比也出现一定程度的下降。而ΔCgNoxC中活性氧代谢没有受到影响。
|
| 图 5 不同菌株的菌丝中活性氧代谢情况检测 |
在植物与病原菌互作的过程中,ROS作为一种信号分子起着重要作用。在受到病原菌侵染时,寄主植物通过激活一系列信号通路、调节自身代谢,从而产生大量ROS。一方面,这些ROS能够作为信号分子激活植物的抗病反应,另一方面,这些ROS能够直接对病原菌产生氧化损伤[13]。近年来的研究表明,在入侵植物的过程中,病原真菌自身也能够产生ROS,这些ROS能够作为信号分子调节病原真菌的生长、发育及致病力[5]。而在真菌中,Nox蛋白就是ROS的主要来源之一[7, 10]。
在橡胶树胶孢炭疽菌中,存在3个编码Nox的基因CgNoxA、CgNoxB及CgNoxC。通过检测这3个基因敲除突变株的表型发现,CgNoxA与胶孢炭疽菌分生孢子的产生密切相关,该基因的缺失导致病原菌在离体培养条件下孢子生成受到影响;而CgNoxB与病原菌对橡胶树叶片的致病力密切相关,该基因的缺失突变株对叶片的侵染能力、以及侵染后病斑的扩展能力显著下降。Nox蛋白主要通过调节ROS的代谢来控制病原真菌的表型[7, 10]。
为了检测CgNox蛋白是否与橡胶树胶孢炭疽菌的ROS代谢相关,本研究中检测了这3个突变株菌丝中的ROS代谢情况。结果发现,CgNoxA缺失突变株中ROS代谢受到明显影响,NBT染色法很难检测到ROS,说明CgNoxA是橡胶树胶孢炭疽菌中ROS的主要来源。此外,在橡胶树胶孢炭疽菌基因组中还发现了一个编码Nox调节蛋白的基因CgNoxR。该调节蛋白在调控Nox蛋白活性中起着重要作用[14-16],在橡胶树胶孢炭疽菌中,敲除该基因会导致分生孢子萌发过程产生异常、致病力下降等现象,说明该调节蛋白对病原菌的正常的生理功能有着重要作用。
4 结论本研究通过构建橡胶树胶孢炭疽菌中CgNoxA、CgNoxB、CgNoxC及CgNoxR的缺失突变株,以及对突变株表型的分析发现,Nox蛋白在调节该病原菌的孢子产生、致病力过程中起着重要作用。这4个基因可能通过参与调节真菌细胞内活性氧代谢途径,调控病原菌的生理功能。
| [1] |
蔡志英, 黄贵修. 巴西橡胶树炭疽病研究进展[J]. 西南林业大学学报, 2011, 31(2): 89-93. |
| [2] |
黄贵修, 许灿光. 中国天然橡胶病虫草害识别与防治[M]. 北京: 中国农业出版, 2012.
|
| [3] |
Lalucque H, Silar P. NADPH oxidase:an enzyme for multicellularity?[J]. Trends in Microbiology, 2003, 11(1): 9-12. DOI:10.1016/S0966-842X(02)00007-0 |
| [4] |
Fluhr R. Reactive oxygen-generating NADPH oxidases in plants[M]. Reactive Oxygen Species in Plant Signaling. Springer Berlin Heidelberg, 2009: 1-23.
|
| [5] |
Heller J, Tudzynski P. Reactive oxygen species in phytopathogenic fungi:signaling, development, and disease[J]. Annual Review of Phytopathology, 2011, 49(1): 369-390. DOI:10.1146/annurev-phyto-072910-095355 |
| [6] |
Lara-Ortíz T, Riveros-Rosas H, Aguirre J. Reactive oxygen species generated by microbial NADPH oxidase NoxA regulate sexual development in Aspergillus nidulans[J]. Molecular Microbiology, 2003, 50(4): 1241-1255. DOI:10.1046/j.1365-2958.2003.03800.x |
| [7] |
Semighini CP, Harris SD. Regulation of apical dominance in Aspergillus nidulans hyphae by reactive oxygen species[J]. Genetics, 2008, 179(4): 1919-1932. DOI:10.1534/genetics.108.089318 |
| [8] |
Cano-Domínguez N, Álvarez-Delfín K, Hansberg W, et al. NADPH oxidases NOX-1 and NOX-2 require the regulatory subunit NOR-1 to control cell differentiation and growth in Neurospora crassa[J]. Eukaryotic Cell, 2008, 7(8): 1352-1361. DOI:10.1128/EC.00137-08 |
| [9] |
Egan MJ, Wang ZY, Jones MA, et al. Generation of reactive oxygen species by fungal NADPH oxidases is required for rice blast disease[J]. Proceedings of the National Academy of Sciences of the United States of America, 2007, 104(28): 11772-11777. DOI:10.1073/pnas.0700574104 |
| [10] |
Segmuller N, Kokkelink L, Giesbert S, et al. NADPH Oxidases are involved in differentiation and pathogenicity in Botrytis cinerea[J]. Molecular Plant-Microbe Interactions, 2008, 21(6): 808-819. DOI:10.1094/MPMI-21-6-0808 |
| [11] |
Rossi DCP, Gleason JE, Sanchez H, et al. Candida albicans FRE8 encodes a member of the NADPH oxidase family that produces a burst of ROS during fungal morphogenesis[J]. PLoS Pathogens, 2017, 13(12): e1006763. DOI:10.1371/journal.ppat.1006763 |
| [12] |
Wang Q, An B, Hou X, et al. Dicer-like proteins regulate the growth, conidiation, and pathogenicity of Colletotrichum gloeosporioides from Hevea brasiliensis[J]. Frontiers in Microbiology, 2018, 8: 2621. DOI:10.3389/fmicb.2017.02621 |
| [13] |
Torres MA, Jones JD, Dangl JL. Reactive oxygen species signaling in response to pathogens[J]. Plant Physiology, 2006, 141(2): 373-378. DOI:10.1104/pp.106.079467 |
| [14] |
Kayano Y, Tanaka A, Takemoto D. Two closely related Rho GTPases, Cdc42 and RacA, of the en-dophytic fungus Epichloë festucae have contrasting roles for ROS production and symbiotic infection synchronized with the host plant[J]. PLoS Pathogens, 2018, 14(1): e1006840. DOI:10.1371/journal.ppat.1006840 |
| [15] |
Zhang C, Lin Y, Wang J, et al. FgNoxR, a regulatory subunit of NADPH oxidases, is required for female fertility and pathogenicity in Fusarium graminearum[J]. FEMS Microbiology Letters, 2016, 363(1): fnv223. DOI:10.1093/femsle/fnv223 |
| [16] |
Li H, Zhang Z, He C, et al. Comparative proteomics reveals the potential targets of BcNoxR, a putative regulatory subunit of NADPH oxidase of Bortytis cinerea[J]. Molecular Plant-Microbe Interactions, 2016, 29(12): 990-1003. DOI:10.1094/MPMI-11-16-0227-R |