2. 中国医学科学院基础医学研究所,北京 100005
2. Institute of Basic Medical Science, Chinese Academy of Medical Science, Beijing 100005
中东呼吸综合征(Middle East respiratory syndr-ome,MERS)是一种新型的冠状病毒引发的急性、高致命性的呼吸道传染性疾病。中东呼吸综合征冠状病毒(Middle East respiratory syndrome coronavirus,MERS-Co Ⅴ)能够感染人类和动物,引发呼吸道感染,伴发多器官功能衰竭等一系列疾病[1]。该病毒于2012年首次在中东沙特阿拉伯地区被发现,2013年世界卫生组织(WHO)命名该种传染性疾病为“中东呼吸综合征”(MERS)[2-3]。据世界卫生组织统计资料显示,自2012年发现MERS-Co Ⅴ至今,全球检测出MERS-Co Ⅴ病毒感染的病例与日趋增,且致死率极高。病例主要集中在中东地区,但在西亚、欧洲、非洲和北美洲等地区也有发现,病史记录表明中东地区以外国家报告的原发病例均有与中东通过商务、宗教、旅游等不同形式的密切交流史[4]。蝙蝠可能是MERS-Co Ⅴ的天然储库,并在传播中起关键作用[5-6]。另外,根据研究报道,骆驼也是MERS-Co Ⅴ的重要储库寄主,它们似乎是导致人类感染的唯一动物宿主[7]。
MERS-Co Ⅴ是由一条正链RNA组成、具有包膜的β型冠状病毒,其基因组全长30 kb,编码多种结构蛋白和非结构蛋白[8]。其中刺突蛋白(Spike,S)是病毒表面重要的结构蛋白之一,在侵染靶细胞过程中起重要作用。MERS-Co Ⅴ的S蛋白是Ⅰ型跨膜糖蛋白,包含1 353个氨基酸残基,主要由S1亚基和S2亚基构成,并以三聚体状态呈现在病毒表面。MERS-Co Ⅴ利用二肽基肽4(Dipeptidyl peptidase-4,DPP4,也称为CD26)作为其在宿主细胞上的受体[9-10]。MERS-Co Ⅴ S1亚基的C端含有结合DPP4的受体结合结构域(Receptor binding domain,RBD),功能是与受体结合和识别后,介导病毒与靶细胞的结合[11-14]。S蛋白质、S1亚基及S2亚基均是可作为MERS-Co Ⅴ疫苗研究的主要对象[13]。
现今,尚无临床验证有效的抗MERS-Co Ⅴ的疫苗和治疗药物。大多数的疫苗和药物研究仍还只停留在实验室阶段或动物试验阶段,其主要原因是目前对中东呼吸综合征病毒的传播途径和致病性尚未明了,且该病毒的高致病性和危险性,使得人类临床试验较难开展。因此,高效抗体的研制,对于中东呼吸综合征病毒的预防和控制具有至关重要的作用。本研究意在克隆MERS-Co Ⅴ表面刺突S蛋白S1亚基基因,构建重组真核表达载体,获得S1-Fc重组融合蛋白,分别通过克隆了S1亚基基因的重组质粒接种,重组S1-Fc融合蛋白接种以及重组质粒和重组S1-Fc融合蛋白联合接种小鼠,以检测小鼠是否发生免疫反应,并检测接种小鼠产生的抗S1血清滴度是否存在区别,为研制预防中东呼吸综合征病毒的疫苗提供技术支持。
1 材料与方法 1.1 材料 1.1.1 细胞株人胚肾细胞(HEK293E)(中国医学科学院基础医学研究所细胞中心)。
1.1.2 菌株与质粒大肠杆菌感受态(DH5α),购于北京天根有限公司;Peak13CD5LTEVhIgGFc(中国医学科学院基础医学研究所蒋澄宇课题组提供);pcDNA3.1(+)-S质粒(苏州泓迅生物科技有限公司)。
1.1.3 实验动物SPF级6-8周龄雌性BALB /C小鼠(编号:ACUC-A02-2017-008,北京药品生物制品鉴定所实验动物资源中心)。
1.1.4 试剂耗材IgG Fc抗体,细胞筛选抗性抗生素Puromycin,弗氏完全佐剂(Sigma公司);山羊抗小鼠二抗(杭州联科生物技术有限公司);限制性内切酶Nhe Ⅰ、BamH Ⅰ、Avr Ⅱ,T4 DNA连接酶(New Englan BioLabs公司);Protein A蛋白柱(GE医疗集团);0.45 μm多孔滤膜(Millipore公司);BCA蛋白质定量试剂盒(天根生化科技有限公司);1×TMB ELISA Substrate Solution(R & D Systems);5 mL EDTA抗凝采血管(BD公司);Opti-MEM®Ⅰ Reduced Serum Medium(1X)liquid(cat. no. 31985-062),DMEM液体培养基,胎牛血清(Invitrogen公司);脂质体NeofectTM DNA transfection reagent(零客创智北京生物科技有限公司)。
1.2 方法 1.2.1 Peak13CD5LS1TEVhIgGFc质粒的构建ME-RS Co Ⅴ表面刺突蛋白(S)基因来源于从NCBI基因数据库(登录号:KF961222.1),共编码1 353个氨基酸,S1为S蛋白的亚基,共编码751个氨基酸。首先通过替换高频密码子的方法进行序列优化,再用次高频密码子替换序列中间可能出现的Nhe Ⅰ、BamH Ⅰ、EcoR Ⅰ及Not Ⅰ酶切位点;最后将S基因的核苷酸序列的前后两端连接上Nhe Ⅰ、BamH Ⅰ、EcoR Ⅰ及Not Ⅰ酶切位点,由苏州泓迅生物科技有限公司合成。将合成的S基因作为模板,采用PCR扩增、纯化、回收S1基因片段,通过BamH Ⅰ和Nhe Ⅰ限制性内切酶双酶切后插入Peak13CD5LTEVhIgGFc真核表达载体,构建Peak13CD5LS1TEVhIgGFc重组质粒,并添加便于蛋白纯化的Fc标签,克隆片段通过序列分析进行验证。
1.2.2 稳定表达克隆细胞株的构建与重组蛋白的纯化重组Peak13CD5LS1TEVhIgGFc质粒用Avr Ⅱ酶切线性化后纯化回收,用脂质体(NeofectTM DNA transfection reagent)转染至HEK293E细胞中。转染48 h后,将其换至终浓度分别为0.6 μg/mL、0.8 μg/mL、1.0 μg/mL和1.2 μg/mL嘌呤霉素药物培养液中继续培养,3-4 d后将存活的转染重组质粒的细胞转至新的细胞培养液中,继续加入高浓度嘌呤霉素药物培养,并挑选单个细胞转至96孔培养板中培养。培养7 d后,取克隆细胞株的上清液进行Western blotting检测,分析不同克隆细胞株的融合蛋白表达情况,将筛选出的高表达融合蛋白的阳性克隆细胞株进行扩增培养。
阳性克隆细胞株大量扩增培养2-3 d后,回收细胞上清液,4℃,4 000 r/min离心30 min,取上清,采用0.45 μm滤膜进行过滤。重组S1-Fc融合蛋白利用Protein A亲和柱进行纯化,同时,AcTEV蛋白酶切重组S1-Fc融合蛋白,酶切后的蛋白溶液流过Protein A亲和柱,收集流出液获得切除Fc标签的S1蛋白。向纯化的蛋白溶液中添加苯甲基磺酰氟(Phenylmethanesulfonane fluoride,PMSF)与二硫苏糖醇(Dithiothreitol,DTT)至终浓度分别为1.0 mmol/L,超滤浓缩后,进行SDS-PAGE与Western blotting分析,用BCA法来测定蛋白浓度,蛋白保存于-80℃备用。
1.2.3 动物接种取6-8周龄的BALB /C小鼠,随机分为4组,每组5只。其中,第1组,每只小鼠腹腔注射20 μg重组S1-Fc融合蛋白与等体积的弗氏完全佐剂的混合物;第2组,每只小鼠后腿肌肉内侧注射100 μg重组Peak13CD5LS1TEVhIgGFc质粒;第3组,每只小鼠腹腔注射20 μg重组S1-Fc融合蛋白与等体积的弗氏完全佐剂的混合物,同时后腿肌肉内侧注射100 μg重组Peak13CD5LS1TEVhIgGFc质粒;第4组,小鼠腹腔注射200 μL生理盐水作为对照组。每隔1周用同样剂量的样品再次接种,共接种3次,每次接种1周后小鼠尾静脉取血,4℃,2 000 r/min离心10 min,分离血清并保存于-80℃。
1.2.4 Western blotting验证接种小鼠是否产生抗S1血清将不同接种方式接种28 d后获得的小鼠血清分别稀释成1 000倍和2 000倍,以10 pmol和1 pmol重组S1-Fc融合蛋白作为抗原,通过Western blotting检测接种小鼠血清中是否存在抗S1血清。以人源IgG Fc抗体作为抗S1血清的阳性对照,埃博拉病毒GP1-Fc融合蛋白作为抗原的阴性对照。
1.2.5 ELISA检测抗S1血清的滴度用PBS将抗原(重组S1-Fc融合蛋白)稀释成50 μg/mL的包被液,包被96孔酶标板,每孔100 μL,4℃冷室静置过夜,移去包被液,用PBS清洗检测板3次,3 min/次;用pH 7.4,5%浓度的BSA进行室温封闭,1 h后移去封闭液,用PBS清洗检测板3次,3 min/次;用人源IgG Fc抗体作为抗S1血清阳性对照,取接种生理盐水组小鼠的血清作为抗S1血清阴性对照,将接种小鼠血清以1: 500开始采用pH7.4,含5%浓度BSA的PBS梯度稀释,室温孵育2 h。移去待测抗S1血清,用PBS清洗检测板3次,3 min/次;加入1: 10 000稀释的辣根过氧化物酶标记的山羊抗小鼠IgG抗体,室温孵育2 h,移去山羊抗小鼠IgG抗体,用PBS清洗检测板3次,3 min/次;加入100 μL 1×YMB ELISA Substrate Solution于室温下避光显色反应5 min,5 min后每孔加入50 μL终止液终止反应。于450 nm波长处测定吸光度值,630 nm作为参考波长。采用单因素方差分析组内样本间显著性,P < 0.05为差异显著,采用GraphPad Prism 7软件作图。
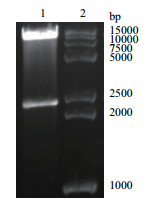
2 结果 2.1 包含MERS-Co Ⅴ S1基因的Peak13重组表达载体的构建及酶切鉴定用限制性内切酶Nhe Ⅰ和BamH Ⅰ双酶切鉴定克隆了MERS-Co Ⅴ S1基因的Peak13CD5LTEVhIgGFc重组质粒,结果如图 1所示,克隆片段大小符合插入目的基因的大小,DNA测序结果证实MERS-Co Ⅴ S1基因序列成功插入了载体的正确位置,且没有突变发生。
|
| 图 1 重组表达质粒pEAK13CD5LS1TEVhIgGFc的双酶切鉴定 1:重组表达质粒,2:D15000+2000 DNA Marker |
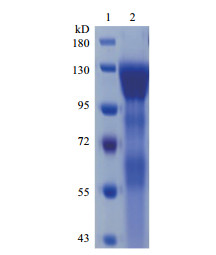
采用限制性内切酶Avr Ⅱ酶切Peak13CD5LS1T-EVhIgGFc重组质粒,使其线性化,载体与切下条带已完全分开,切胶纯化回收线性化质粒载体。用脂质体(NeofectTM DNA transfection reagent)线性化重组质粒至已长至80%的HEK293E细胞。将转染后的细胞转移至新的培养液,并加入不同浓度的嘌呤霉素以筛选稳定表达的克隆细胞株。终浓度为0.8 μg/mL嘌呤霉素筛选得到的克隆细胞株表达量最高,大规模的培养0.8 μg/mL嘌呤霉素筛选得到的稳定表达的克隆细胞株。利用Protein A亲和柱对细胞培养液中的重组进行S1-Fc融合蛋白进行纯化。考马斯亮蓝染色结果(图 2)显示,纯化获得蛋白大小为122 kD,与预期的重组S1-Fc融合蛋白的大小一致。
|
| 图 2 重组S1-Fc融合蛋白纯化的SDS-PAGE分析 1:标准蛋白;2:纯化的重组S1-Fc蛋白 |
分别接种了重组Peak13CD5LS1TEVhIgGFc质粒、重组S1-Fc融合蛋白、重组S1-Fc融合蛋白和重组Peak13CD5LS1TEVhIgGFc质粒3次后的小鼠,尾静脉取血并分离血清,按照1: 1 000和1: 2 000的稀释条件下检测10 pmol和1 pmol的S1-Fc融合蛋白抗原。结果(图 3-A)显示,3种不同接种方法均可以诱导小鼠产生抗S1血清,但不同的方法诱导的抗S1血清浓度存在差异。接种重组S1-Fc融合蛋白及同时接种S1-Fc融合蛋白和重组Peak13CD5LS-1TEVhIgGFc质粒的小鼠血清在1: 1 000的稀释条件下可以通过Western blotting法明显检测10 pmol和1 pmol的S1-Fc融合蛋白抗原,但仅接种了重组Peak13CD5LS1TEVhIgGFc质粒小鼠所取得血清与10 pmol重组S1 -Fc融合蛋白抗原可以明显反应,但与1 pmol S1-Fc融合蛋白抗原反应较弱。
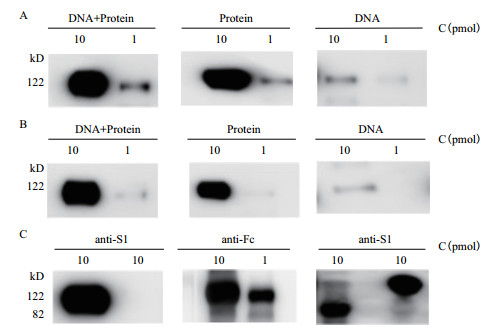
|
| 图 3 Western blotting分析接种小鼠的抗S1-Fc抗血清滴度与特异性 A:各实验组抗S1血清在1: 1 000的稀释条件下检测10 pmol和1 pmol重组S1-Fc抗原的特异性;B:各实验组抗S1血清在1: 2 000的稀释条件下检测10 pmol和1 pmol重组S1-Fc抗原的特异性;C:在1: 1 000稀释条件下,S1-Fc蛋白免疫组抗S1血清检测10 pmol S1-Fc和10 pmol GP1-Fc抗原的特异性,GP1-Fc分子量约170 kD(左),IgG Fc抗体检测10 pmol S1-Fc和1 pmol S1-Fc抗原的特异性(中)和S1-Fc蛋白免疫组抗S1血清检测10 pmol S1蛋白和10 pmol S1-Fc抗原的特异性(右) |
接种重组S1-Fc融合蛋白及同时接种重组S1-Fc融合蛋白和重组Peak13CD5LS1TEVhIgGFc质粒小鼠的血清在1: 2 000稀释条件下可以通过Western blotting法明显检测到与10 pmol的S1-Fc融合蛋白抗原的反应条带,与1 pmol重组S1-Fc融合蛋白反应较弱,而仅接种了重组Peak13CD5LS1TEVhIgGFc质粒所取得的小鼠血清在1: 2 000的稀释条件下能与10 pmol S1-Fc融合蛋白轻微反应,完全检测不到与1 pmol重组S1-Fc融合蛋白的反应(图 3-B)。因此,重组S1-Fc融合蛋白接种和重组S1-Fc融合蛋白及重组Peak13CD5LS1TEVhIgGFc质粒联合接种小鼠的免疫效果明显优于单纯只接种重组Peak13CD5LS1TEVhIgGFc质粒的免疫效果。
图 3-C结果显示,接种重组S1-Fc融合蛋白后的小鼠抗血清在1: 1 000的稀释条件下通过Western blotting法检测只能特异性的检测到重组S1-Fc融合蛋白和S1蛋白,无法与埃博拉GP1-Fc融合蛋白发生反应。而在相同条件下,IgG Fc抗体能够明显检测到10 pmol和1 pmol的重组S1-Fc融合蛋白。说明接种小鼠体内产生了抗S1蛋白的特异性抗体。
2.4 ELISA检测小鼠免疫后抗S1血清滴度小鼠接种不同成分后定期取血并分离血清,用纯化的S1-Fc融合蛋白作为抗原,ELISA检测接种小鼠血清中抗S1血清的滴度。从图 4可以看出,接种7 d后,质粒Peak13CD5LS1TEVhIgGFc接种组小鼠的血清中均未检测出抗S1血清,接种14 d后出现了少量抗S1血清,但与对照组比浓度未达到显著水平,接种28 d后,该组小鼠血清中才出现了显著高于对照组的抗S1血清浓度(P < 0.05)。而重组S1-Fc融合蛋白接种组、重组S1-Fc融合蛋白和重组Peak13CD5LS1TEVhIgGFc联合接种组小鼠在接种7 d后均产生了明显的抗S1血清,接种21 d后,两组小鼠血清中抗S1血清滴度达到极高的水平,极显著的高于对照组(P < 0.0001)。接种重组S1-Fc融合蛋白与共同接种重组S1-Fc融合蛋白和重组Peak13CD5LS1TEVhIgGFc组的数值未见显著差异,故而两者的接种效果相同,但该两种接种方法产生的抗S1血清滴度高于只接种重组Peak13CD5LS1TEVhIgGFc的数值。因此,在短期内为达到高水平抗S1血清应答,综合考虑成本等因素,接种重组S1-Fc融合蛋白的效果较好。
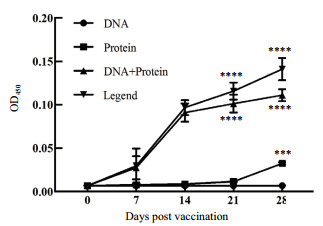
|
| 图 4 初次接种不同时间小鼠抗血清的ELISA检测 *P < 0.05,**P < 0.01,***P < 0.001,****P < 0.0001 |
刺突蛋白是中东呼吸综合征病毒表面重要的结构蛋白之一。S蛋白在病毒的吸附和穿入过程中发挥着重要作用,是MERS-Co Ⅴ疫苗研究的主要靶抗原[13, 15-16]。在感染过程中,MERS-Co Ⅴ的S蛋白被切割成受体结合亚基S1和膜融合亚基S2[12, 17-19]。MERS-Co Ⅴ S1亚基含有与宿主细胞表面蛋白二肽基肽酶4(DPP4)的受体结合的结构域(RBD),介导病毒与靶细胞的结合[12, 15, 17, 23],引导MERS-Co Ⅴ进入宿主细胞。MERS-Co Ⅴ RBD可以结合包括人,骆驼,白鼬和蝙蝠等在内的不同宿主细胞的DPP4。但MERS-Co Ⅴ的易感性与宿主物种存在极大关系[6, 20-21]。
本文通过比较研究了接种重组S1-Fc融合蛋白、重组质粒Peak13CD5LS1TEVhIgGFc以及二者联合接种小鼠的抗S1血清水平,证实3种接种方式均可诱导小鼠产生抗S1血清,接种重组S1-Fc融合蛋白组和联合接种重组S1-Fc融合蛋白和重组质粒Peak13CD5LS1TEVhIgGFc组小鼠产生了高水平的抗S1血清,而只接种重组质粒Peak13CD5LS1TEVhIg-GFc组的小鼠的抗S1血清水平明显不如前两者高。其原因可能是单纯的重组质粒接种小鼠后,小鼠体内并不存在质粒DNA的主动运输过程,即重组质粒不能主动进入细胞,而重组质粒必须输到细胞核内才能被转录成mRNA,进而诱导小鼠产生对该抗原蛋白的体液免疫和细胞免疫,小鼠体内合成抗原蛋白需要一定时间过程[22]。因此,短时间内DNA接种所激发的免疫反应强度相对较弱,不足以引起足够的免疫保护效果,在小型动物的试验中可能会检测到免疫反应,但会因实验动物体型的增大,而DNA接种的免疫效果会降低,尤其对人类以及大动物的免疫实验[24]。
此外,DNA接种免疫存在一定的不安全性,DNA接种的导入有可能会发生基因整合,激活内源性原癌基因,或诱发染色体的不稳定性,产生遗传性或致癌反应,该方法更适合在体外难以表达的蛋白,较多的适用于小型动物[24-26]。蛋白质疫苗抗S1血清稀释1: 2 000时仍能够很好的检测到1 pmol的S1-Fc抗原蛋白,结果显示蛋白疫苗产生体液免疫的免疫效果更为快速,该蛋白质疫苗在MERS CoV研究中具有潜在的应用价值。
4 结论本研究构建了高效表达重组S1-Fc融合蛋白的重组Peak13CD5LS1TEVhIgGFc质粒,转染HEK293E细胞后获得了可稳定表达重组S1-Fc融合蛋白的克隆细胞株,并通过Protein A亲和柱纯化获得了高浓度的重组S1-Fc融合蛋白。小鼠分别接种重组S1-Fc融合蛋白、重组质粒Peak13CD5LS1TEVhIgGFc以及重组S1-Fc融合蛋白和Peak13CD5LS1TEVhIgGFc后,在小鼠血清中均检测到了特异性抗S1血清。但仅接种重组质粒的小鼠体内在第3次接种后才产生较高浓度的抗S1血清,而两种包含S1-Fc融合蛋白的接种方式在首次注射后就出现了高滴度的抗S1血清,而且显著高于只接种了重组Peak13CD5LS1TEVhIgGFc质粒小鼠的抗S1血清水平。
| [1] |
Yusof MF, Eltahir YM, Serhan WS, et al. Prevalence of Middle East respiratory syndrome coronavirus(MERS-CoV)in dromedary camels in Abu Dhabi Emirate, United Arab Emirates[J]. Virus Genes, 2015, 50(3): 509-513. DOI:10.1007/s11262-015-1174-0 |
| [2] |
Zaki AM, van Boheemen S, Bestebroer TM, et al. Isolation of a novel coronavirus from a man with pneumonia in Saudi Arabia[J]. N Engl J Med, 2012, 367(19): 1814-1820. DOI:10.1056/NEJMoa1211721 |
| [3] |
de Groot RJ, Baker SC, Baric RS, et al. Middle Eastrespiratory syndrome coronavirus(MERS-CoV):announcement of the Coronavirus Study Group[J]. J Virol, 2013, 87(14): 7790-7792. DOI:10.1128/JVI.01244-13 |
| [4] |
http://www.Who.int/csr/don/2014_05_15_mers/en/Middle East respiratory syndrome coronavirus(MERS- Co Ⅴ)summary and literature update-as of 9 May 2014[R].
|
| [5] |
Yang Y, Liu C, Du L, et al. Two mutations were critical for bat-to-human transmission of Middle East respiratory syndrome coronavirus[J]. J Virol, 2015, 89(17): 9119-9123. DOI:10.1128/JVI.01279-15 |
| [6] |
Yang Y, Du L, Liu C, et al. Receptor usage and cell entry of bat coronavirus HKU4 provide insight into bat-to-human transmission of MERS coronavirus[J]. Proc Natl Acad Sci USA, 2014, 111(34): 12516-12521. DOI:10.1073/pnas.1405889111 |
| [7] |
Mohd HA, Al-Tawfiq JA, Memish ZA. Middle East respiratory syndrome coronavirus(MERS-Co Ⅴ)origin and animal reservoir[J]. J Virol, 2016, 13: 87. DOI:10.1186/s12985-016-0544-0 |
| [8] |
Cotton M, Lam TT, Watson SJ, et al. Full-genome deep sequencing and phylogenetic analysis of novel human betacoronavirus[J]. Emerg Infect Dis, 2013, 19(5): 736-742. |
| [9] |
Li W, Moore MJ, Vasilieva N, et al. Angiotensin-converting enzyme 2 is a functional receptor for the SARS coronavirus[J]. Nature, 2003, 426(6965): 450-454. DOI:10.1038/nature02145 |
| [10] |
Raj VS, Mou H, Smits SL, et al. Dipeptidyl peptidase 4 is a functional receptor for the emerging human coronavirus-EMC[J]. Nature, 2013, 495(7440): 251-254. DOI:10.1038/nature12005 |
| [11] |
Li F. Receptor recognition mechanisms of coronaviruses:a decade of structural studies[J]. J Virol, 2015, 89(4): 1954-1964. DOI:10.1128/JVI.02615-14 |
| [12] |
Lu G, Hu Y, Wang Q, et al. Molecular basis of binding between novel human coronavirus MERS-CoV and its receptor CD26[J]. Nature, 2013, 500(7461): 227-231. DOI:10.1038/nature12328 |
| [13] |
Zhang N, Jiang S, Du L. Current advancements and potential strategies in the development of MERS-CoV vaccines[J]. Expert Rev Vaccines, 2014, 13(6): 761-774. DOI:10.1586/14760584.2014.912134 |
| [14] |
Du L, Zhao G, Kou Z, et al. Identification of a receptor-binding domain in the S protein of the novel human coronavirus Middle East respiratory syndrome coronavirus as an essential target for vaccine development[J]. J Virol, 2013, 87(17): 9939-9942. DOI:10.1128/JVI.01048-13 |
| [15] |
Song F, Fu XR, Provacia LB, et al. Middle East respiratory syndrome coronavirus spike protein delivered by modified vaccinia virus Ankara efficiently induces virus-neutralizing antibodies[J]. J virol, 2013, 87(21): 11950-11954. DOI:10.1128/JVI.01672-13 |
| [16] |
Coleman CM, Liu YV, Mu H, et al. Purified coronavirus spike protein nanoparticles induce coronavirus neutralizing antibodies in mice[J]. Vaccine, 2014, 32(26): 3169-3174. DOI:10.1016/j.vaccine.2014.04.016 |
| [17] |
Li F. Receptor recognition mechanisms of coronaviruses:a decade of structural studies[J]. J Virol, 2015, 89(4): 1954-1964. DOI:10.1128/JVI.02615-14 |
| [18] |
Gao J, Lu G, Qi J, et al. Structure of the fusion core and inhibition of fusion by a heptad-repeat peptide derived from the S protein of MERS-Co Ⅴ[J]. J Virol, 2013, 87: 13134-13140. DOI:10.1128/JVI.02433-13 |
| [19] |
Wang N, Shi X, Jiang L, et al. Structure of MERS-Co Ⅴ spike receptor binding domain complexed with human receptor DPP4[J]. Cell Res, 2013, 23(8): 986-993. DOI:10.1038/cr.2013.92 |
| [20] |
Barlan A, Zhao J, Sarkar MK, et al. Receptor variation and susceptibility to Middle East respiratory syndrome coronavirus infection[J]. J Virol, 2014, 88(9): 4953-4961. DOI:10.1128/JVI.00161-14 |
| [21] |
Van DN, Miazgowicz KL, Milne-Price S, et al. Host species restriction of Middle East respiratory syndrome coronavirus through its receptor, dipeptidyl peptidase 4[J]. J Virol, 2014, 88(16): 9220-9232. DOI:10.1128/JVI.00676-14 |
| [22] |
Wolff J A, Malone RW, Williams P, et al. Direct gene transfer into mouse muscle in vivo[J]. Science, 1990, 2(17): 1465-1468. |
| [23] |
Egan MA, Israel ZR. The use of cytokines and chemokines as genetic adjuvants for plasmid DNA vaccines[J]. Ciin Appl Immunol Rev, 2002, 2: 255-287. DOI:10.1016/S1529-1049(02)00051-X |
| [24] |
Pilling AM, Harman RM, Jones SA, et al. The assessment of local tolerance, acute toxicity, and DNA biodistribution following particle-mediated delivery of a DNA vaccine to minipigs[J]. Toxicol Pathol, 2002, 30(3): 298-305. DOI:10.1080/01926230252929864 |
| [25] |
Schroder AR, Shinn P, Chen H, et al. HIV21 integration in the human genome favors active genes and local hotspots[J]. Cell, 2002, 110(4): 521-529. DOI:10.1016/S0092-8674(02)00864-4 |
| [26] |
Lewinskim K, Bushman FD. Retroviral DNA integration-mechanism and consequences[J]. Adv Genet, 2005, 55: 147-181. |




