2. 农业部农业微生物资源收集与保藏重点实验室,北京 100081
2. Key Laboratory of Microbial Resources Collection and Preservation, Ministry of Agriculture, Beijing 100081
马铃薯是世界第四大粮食作物,在全球各地均有广泛栽培,我国是世界最大的马铃薯生产国。马铃薯疮痂病是马铃薯的主要病害之一,近年来在我国各马铃薯种植区普遍发生。该病可由多种链霉菌引起,主要包括Streptomyces scabies、S. acidiscabies和S. turgidiscabies等[1],并且不断有新的病原链霉菌被报道[2-4]。感病马铃薯块茎表面形成凸起状、凹陷状或平状的病斑,病斑区域的细胞木栓化,呈痂状[5]。马铃薯疮痂病可影响薯块的外观和品质,降低其商品价值[6-7],病情严重时影响马铃薯出苗,导致减产[8],给我国的马铃薯生产造成了极大的经济损失。目前对于该病还缺少很好的防治方法,而探索有效的生物防治方法正逐渐引起人们的重视。本研究以马铃薯疮痂病病原菌Streptomyces bottropensis AMCC400023为靶标菌株,从山东省高密市马铃薯种植地采集的土壤中分离筛选对马铃薯疮痂病有拮抗作用的菌种,通过菌体形态观察、革兰氏染色、生理生化测定及16S rDNA基因序列分析对一株拮抗能力较强的菌株进行鉴定,并进行盆栽防病效果测定,旨在为马铃薯疮痂病的生物防治奠定基础。
1 材料与方法 1.1 材料 1.1.1 培养基LB液体培养基:胰蛋白胨10.0 g、酵母浸膏5.0 g、NaCl 10.0 g、水1 000 mL,pH 7.0-7.4。LB固体培养基:每1 000 mL LB液体培养基加入琼脂20.0 g。高氏Ⅰ号培养基:可溶性淀粉20.0 g、KNO3 1.0 g、K2HPO4 0.5 g、MgSO4·7H2O 0.5 g、NaCl 0.5 g、FeSO4·7H2O 0.01 g、琼脂20.0 g、水1 000 mL,pH 7.2-7.4。燕麦琼脂培养基:燕麦片20.0 g加入水中煮沸约20 min,经纱布过滤,加水定容至1 000 mL,加入琼脂20.0 g,pH 7.2。柠檬酸盐培养基:柠檬酸钠2.0 g、K2HPO4 1.0 g、NH4H2PO4 1.0 g、NaCl 5.0 g、MgSO4 0.2 g、琼脂20.0 g、1%溴麝香草酚蓝水溶液10.0 mL,pH 6.8。阿拉伯糖培养基:胰蛋白胨2.7 g、NaCl 5.0 g、K2HPO4 0.3 g、1%溴麝香草酚蓝水溶液3.0 mL、琼脂5.0 g、水1 000 mL,pH 7.0。木糖-明胶培养基:0.2%酚红溶液25 mL、明胶120 g、水1 000 mL,pH 7.6。以上培养基于121℃灭菌30 min后使用。
1.1.2 供试菌株马铃薯疮痂病病原菌:Streptomy-ces bottropensis AMCC400023,来源于山东农业大学山东农业微生物菌种保藏中心。
1.1.3 土壤样品土壤样品采集于山东省高密市李家营镇、孟家庄、张家庄、城律村、祝家庄的马铃薯疮痂病病发地。采集时除去发病地块表层5 cm土壤,取5-15 cm深层土壤,每份样品10 g。
1.1.4 供试马铃薯拮抗菌的盆栽防效测定试验中所用马铃薯品种为荷兰15号。
1.2 实验方法 1.2.1 病原菌孢子悬液的制备将马铃薯疮痂病病原菌Streptomyces bottropensis AMCC400023接种于燕麦琼脂培养基上,28℃培养3-5 d。用无菌水冲洗下孢子,转入100 mL离心管中,4℃、8 000 r/min离心20 min,弃上清,用20%的甘油液重悬孢子,分装于2 mL离心管中,于-20℃冰箱中保存备用。
1.2.2 拮抗菌的分离与初筛取1.0 g土壤样品加入99 mL无菌水,37℃、180 r/min充分振荡30 min,后80℃水浴20 min。取适量土壤悬浊液梯度稀释后涂布于LB培养基平板,37℃培养24 h。挑取单菌落,纯化,接种至LB培养基斜面,37℃培养24 h,菌种于4℃冰箱中保存备用。采用平板对峙生长法进行拮抗菌的初筛。取100 μL病原菌孢子悬液涂布于高氏Ⅰ号培养基平板,并将已活化的待筛选菌种点接至培养基上,28℃培养3-5 d,观察是否产生抑菌圈,比较抑菌圈的大小,选择抑菌圈较大的菌株进行复筛试验。
1.2.3 拮抗菌的复筛采用牛津杯法进行复筛试验。将纯化后的待筛选拮抗菌分别接入等量LB液体培养基,37℃震荡培养48 h,将培养好的菌液12 000 r/min离心20 min,收集上清液,经0.22 μm水系微孔滤膜过滤除去菌体,制得拮抗菌的无菌上清液。吸取适量无菌上清液涂布于高氏一号培养基平板,将3个无菌牛津杯置于培养基上,使3个牛津杯围绕培养基中心点呈三角形。在其中两个牛津杯中各加入200 μL无菌上清液,另一个牛津杯加入等体积的无菌LB液体培养基作为对照。28℃培养5-7 d后查看结果,对有拮抗效果的菌株使用游标卡尺通过十字交叉法测量并记录其抑菌圈直径,根据抑菌圈直径大小衡量各菌株的拮抗能力,并重复3次复筛试验以确认结果。选择一株拮抗能力优良的菌株进行后续实验。
1.2.4 菌体形态观察将拮抗菌接种于LB培养基平板,37℃培养24 h,观察菌落的形态特征(包括形态、大小、颜色、边缘、表面、透明度等),并对菌株进行革兰氏染色并油镜镜检。
1.2.5 生理生化测定参照《伯杰细菌鉴定手册》[9]和《常见细菌系统鉴定手册》[10]的实验方法,对拮抗菌的接触酶试验、V-P试验、柠檬酸盐利用、阿拉伯糖利用、木糖利用以及耐盐性等生理生化指标进行测定。
1.2.6 16S rDNA基因序列分析使用细菌基因组DNA提取试剂盒提取拮抗菌DNA。选用16S rDNA通用引物(27F/1 492R)进行PCR扩增。正向引物(27F):5'-AGAGTTTGATCCTGGCTCAG-3',反向引物(1 492R):5'-CTACGGCTACCTTGTTACA-3'。PCR反应体系(25 μL)为:DNA模板2 μL10×PCR buffer 2.5 μL,正向引物(27F)0.5 μL,反向引物(1 492R)0.5 μL,10 mmol/L dNTP 0.25 μL,Taq酶(5 U/μL)0.25 μL,ddH2O补足25 μL。PCR结束后,采用1%琼脂糖凝胶电泳对扩增产物进行检测,将扩增产物送交铂尚生物技术有限公司进行测序。将菌株的16S rDNA基因序列与NCBI已知的核酸序列进行BLAST比对,获得相近属种菌株的相应基因序列,使用Clustal X、MEGA 7软件构建系统发育树。
1.2.7 拮抗菌对马铃薯疮痂病的盆栽防效测定选取健康的荷兰15号马铃薯,用75%乙醇对其表面消毒,清水洗净,置于28℃光照培养箱中催芽。待出芽后取出,将马铃薯切成留有一个芽眼的三角块,选取芽长相近的薯块置于滤纸上晾1 d(若马铃薯较小则直接栽种)。然后将薯块芽眼朝上,播至混配蛭石和土壤(1:1)的花盆中,于田间种植培养。
其中CK表示仅浇清水;SB表示铃薯疮痂病病原菌Streptomyces bottropensis发酵液;BM(单)表示拮抗菌Bacillus methylotrophicus发酵液一次浇灌;BM(双)表示拮抗菌Bacillus methylotrophicus发酵液两次浇灌。分别制备病原菌与拮抗菌的发酵液(108 CFU/mL),在马铃薯新生薯块刚刚形成时采取灌根法接种病原菌孢子悬液,每盆100 mL;在接种后的第7、14和21 d别接入100 mL拮抗菌的孢子悬液,并设仅浇灌清水对照、仅接种病原菌对照以及接种病原菌并浇灌LB液体培养基对照,每处理重复3次。
待马铃薯收获后,进行病害分级鉴定,计算病情指数与防治效果。马铃薯疮痂病分级标准及统计方法病害分级标准[11]为:0级,无病斑;1级,有病斑1%-5%;2级,有病斑5%-10%;3级,有病斑10%-20%;4级,有病斑20%-40%;5级,有病斑40%-60%;6级,病斑60%以上。发病率=发病粒数/收获小薯粒数×100%,病情指数=∑(病级粒数×发病级别)/(收获小薯粒数×最高级别)×100%,防治效果=(对照病情指数-处理病情指数)/照病情指数×100%[11]。使用R软件对数据进行差异显著性分析。
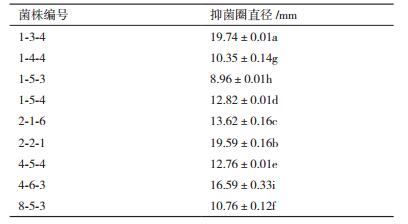
2 结果 2.1 拮抗菌发酵液对病原菌的拮抗效果初筛得到15株拮抗效果较好的菌株,并从其中挑选了9株菌进行复筛试验。复筛试验中各菌株的发酵液液所产生的抑菌圈直径如表 1所示,说明各菌株的发酵液中可能含有多种抑菌活性物质,对马铃薯疮痂病病原菌Streptomyces bottropensis AMCC400023均具有一定拮抗作用。其中菌株1-3-4的抑菌圈直径为20.74 mm,对病原菌的拮抗能力最强(图 1)。

|
| 图 1 菌株1-3-4拮抗菌发酵液对病原菌的拮抗效果 |
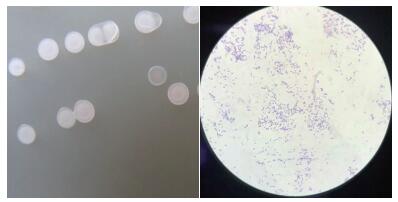
经37℃培养24 h后,菌株1-3-4的菌落在LB培养基平板上呈圆形,乳白色,略有隆起,表面褶皱干燥,不透明,边缘不整齐,革兰氏染色呈阳性,菌体杆状(图 2)。
|
| 图 2 菌株1-3-4在LB培养基平板上的菌落形态(左)与革兰氏染色实验结果(右) |
菌株1-3-4的生理生化鉴定结果如表 2所示。菌株1-3-4的接触酶实验反应呈阳性,V-P测定反应呈阴性,能够分解利用柠檬酸盐、阿拉伯糖、木糖,对2%、5%、7%和10%盐浓度具有耐受性。
以菌株1-3-4的DNA为模板,PCR扩增得到该菌株约1.4 kb的特异性片段。经测序后,用MEGA 7构建的系统发育树如图 3所示。根据菌株1-3-4的16S rDNA基因序列分析结果,结合其培养形态特征和生理生化特性,将该菌株鉴定为甲基营养型芽孢杆菌(Bacillus methylotrophicus)。

|
| 图 3 基于菌株1-3-4 16S rDNA序列构建的系统发育树 |
通过温室盆栽试验测定了菌株1-3-4对马铃薯疮痂病的防治效果。结果(图 4)显示接种疮痂病病原菌的薯块发病情况较为严重,菌株1-3-4在盆栽试验中防治效果约为40.27%与48.66%(表 3),显著降低了马铃薯疮痂病的发病程度。说明菌株1-3-4对于马铃薯疮痂病具有较好的防治作用。

|
| 图 4 马铃薯疮痂病拮抗菌盆栽防效试验 A:接种马铃薯疮痂病病原菌Streptomyces bottropensis AMCC400023的薯块;B:经菌株1-3-4防治马铃薯疮痂病后的薯块 |
马铃薯疮痂病是一种较难防治的农业病害,随着马铃薯种植的不断推广,其为农业生产带来的危害也逐渐加重。传统的应对方法是采用多种化学药剂进行防治,但化学防治存在着诱发微生物抗药性、毒害农作物、环境污染等问题[12]。而利用拮抗菌进行生物防治具有防病效果好、绿色无污染、对生态环境影响较小等优点,正逐渐引起人们的重视。刘大群等[13]报道了利用拮抗链霉菌防治马铃薯疮痂病的大田试验研究,不同接种量和接种方法均显著地影响防治效果。Hiltunen等[14]利用淀粉酶产色链霉菌(S. diastatochromogenes)PonSSII等非致病性链霉菌防治马铃薯疮痂病,田间试验结果表明防治效果较好。
国内外学者对针对马铃薯疮痂病进行生物防治研究时采用的病原菌多为S. scabies、S. acidiscabies和S. turgidiscabies等菌株[11],而对于Streptomyces bottropensis病原菌防治方面的报道较少。本研究以马铃薯疮痂病病原菌Streptomyces bottropensis AMCC400023为靶标菌株,从山东省高密市马铃薯种植地采集的土壤中分离筛选得到了1株对马铃薯疮痂病病原菌具有较强有拮抗作用的菌株1-3-4,其抑菌圈直径达19.74 mm。根据该菌株的16S rDNA基因序列分析结果,结合其培养形态特征和生理生化特性,将其鉴定为甲基营养型芽孢杆菌(Bacillus methylotrophicus)。
近年来关于该类菌株应用于植物病害生物防治的报道较多。刘利强等[17]通过田间药效试验确定了30亿个/g甲基营养型芽孢杆菌可湿性粉剂的对于防治黄瓜灰霉病的最佳使用剂量。谢学文等[18]从连作多年的黄瓜根际土样中筛选得到1株甲基营养型芽孢杆菌WF-3,田间试验表明其对黄瓜炭疽病具有良好的防治效果。周登博等[19]分离得到一株甲基营养型芽孢杆菌4-L-16,其对香蕉枯萎病在内的9种病原菌真菌具有广谱抑菌活性。目前国内外还少有关于甲基营养型芽孢杆菌用于防治马铃薯疮痂病的报道。本研究拓展了甲基营养型芽孢杆菌的应用范围,为新型微生物制剂的开发提供了良好资源。
为了初步探明该菌株对马铃薯疮痂病的实际防治效果,进行了盆栽防效测定试验,结果显示菌株1-3-4可显著降低马铃薯疮痂病的发病程度,防治效果约为40.27%与48.66%,具有良好的应用前景。而该菌株在实际生物防治过程中的最佳施用方法、施用浓度、在土壤及马铃薯植株内的定殖情况以及对生态环境的影响等还需要进一步的研究以明确。
4 结论以山东省高密市马铃薯种植地采集的土壤为研究对象,马铃薯疮痂病病原菌Streptomyces bottropensis AMCC400023为靶标菌,筛选获得较强有拮抗作用的菌种1-3-4,将其鉴定为甲基营养型芽孢杆菌(Bacillus methylotrophicus)。盆栽防效测定试验结果显示,菌株1-3-4对于马铃薯疮痂病具有较好的防治作用。
| [1] |
Loria R, Bukhalid RA, Fry BA, et al. Plant pathogenicity in the genus Streptomyces[J]. Plant Disease, 1997, 81(8): 836-846. DOI:10.1094/PDIS.1997.81.8.836 |
| [2] |
Hiltunen LH, Kelloniemi J, Valkonen JPT. First report of Streptomyces europaeiscabiei causing common scab on potato in Finland[J]. Plant Disease, 2014, 98(9): 1267-1267. |
| [3] |
Zhou B, Zhang MS, Ma XK. First Report of Streptomyces bottropensis causing potato common Scab in Hebei province, China[J]. Plant Disease, 2016, 101(3). |
| [4] |
Sarwar A, Latif Z, Cabaleiro C. First report of Streptomyces turgidiscabies causing potato common scab in Spain[J]. Plant Disease, 2017, 101(9). |
| [5] |
赵伟全, 杨文香, 刘大群, 等. 中国马铃薯疮痂病研究初报[J]. 河北农业大学学报, 2004, 27(6): 74-77. DOI:10.3969/j.issn.1000-1573.2004.06.018 |
| [6] |
Hiltunen LH, Laakso I, Chobot V, et al. Influence of thaxtomins in different combinations and concentrations on growth of micropropagated potato shoot cultures[J]. Journal of Agricultural & Food Chemistry, 2006, 54(9): 3372-3379. |
| [7] |
King RR, Lawrence CH, Clark MC. Correlation of phytotoxin production with pathogenicity of Streptomyces scabies isolates from scab infected potato tubers[J]. American Potato Journal, 1991, 68(10): 675-680. DOI:10.1007/BF02853743 |
| [8] |
Hiltunen LH, Weckman A, Ylhainen A, et al. Responses of potato cultivars to the common scab pathogens, Streptomyces scabies and S. turgidiscabies[J]. Annals of Applied Biology, 2015, 146(3): 395-403. |
| [9] |
布坎南.伯杰. 细菌鉴定手册[M]. 北京: 科学出版社, 1984.
|
| [10] |
蔡妙英, 东秀珠. 常见细菌系统鉴定手册[M]. 北京: 科学出版社, 2001.
|
| [11] |
李勇, 郭凤柳, 赵伟全, 等. 马铃薯疮痂病菌拮抗菌ZWQ-1的鉴定及防效测定[J]. 河南农业科学, 2012, 41(10): 94-99. DOI:10.3969/j.issn.1004-3268.2012.10.022 |
| [12] |
Chen S, Zhang M, Wang J, et al. Biocontrol effects of Brevibacillus laterosporus AMCC100017 on potato common scab and its impact on rhizosphere bacterial communities[J]. Biological Control, 2017, 106: 89-98. DOI:10.1016/j.biocontrol.2017.01.005 |
| [13] |
Liu DQ, Anderson NA, Kinkel LL. Field evaluation of antagonistic Streptormyces strains on biocontrol of potato scab[J]. Acta Phytopa Thologica Sinica, 2000, 30(3): 237-244. |
| [14] |
Hiltunen LH, Ojanpera TH, Richter E, et al. Interactions and biocontrol of pathogenic Streptomyces strains co-occurring in potato scab lesions[J]. Journal of Applied Microbiology, 2009, 106(1): 199. DOI:10.1111/jam.2008.106.issue-1 |
| [15] |
李勇, 郭凤柳, 赵伟全, 等. 马铃薯疮痂病菌拮抗菌ZWQ-1的鉴定及防效测定[J]. 河南农业科学, 2012, 41(10): 94-99. DOI:10.3969/j.issn.1004-3268.2012.10.022 |
| [16] |
徐红艳, 王卫, 王彬, 等. 刺五加内生放线菌对马铃薯疮痂病菌拮抗作用初探[J]. 西北农业学报, 2016, 25(11): 1742-1748. DOI:10.7606/j.issn.1004-1389.2016.11.023 |
| [17] |
刘利强, 杨士玲, 陈强, 等. 30亿个/g甲基营养型芽孢杆菌可湿性粉剂防治黄瓜灰霉病田间药效试验[J]. 现代农业科技, 2014(9): 130-130. DOI:10.3969/j.issn.1007-5739.2014.09.085 |
| [18] |
谢学文, 董瑞利, 石延霞, 等. 黄瓜炭疽病拮抗细菌的筛选及其抑制效果[J]. 中国生物防治学报, 2016, 32(2): 215-220. |
| [19] |
周登博, 陈宇丰, 井涛, 等. 抗香蕉枯萎病甲基营养型芽孢杆菌的鉴定及定殖[J]. 中国农学通报, 2017(36): 145-151. |