2. 中国农业科学院蔬菜与花卉研究所,北京100081
2. Institute of Vegetables and Flowers, Chinese Academy of Agricultural Sciences, Beijing 100081
淡紫拟青霉是子囊菌门、肉座菌目、蛇形虫草科、Purpureocillium属的一种丝状真菌,分布范围广,可从线虫、土壤、腐烂的植物、昆虫、人类和空气中分离到,是一种寄主范围较广的真菌[1]。淡紫拟青霉对人类具有致病作用,可感染人类导致角膜发炎。但对植物寄生线虫、蚜虫[2]、红蜘蛛[3]、温室粉虱和切叶蚁[4]等都有很好的防治作用。除此之外,淡紫拟青霉对多种植物病原细菌、真菌和病毒也有抑制作用。淡紫拟青霉QLP12对真菌菌丝生长,尤其是梨形毛霉、粉红单端胞霉、立枯丝核菌和黄萎病菌有较强的抑制作用。淡紫拟青霉能够减少侵染大豆根部的镰刀菌、菜豆壳球孢菌和立枯丝核菌,但是对于这些菌的抗性却随着时间而降低。由此可见,淡紫拟青霉为一种广谱性很强的生防菌,展开对淡紫拟青霉生物防治机制的研究有利于改善食品安全、提高粮食产量、保护生态环境和保持农业可持续发展。
淡紫拟青霉能寄生于线虫卵,孙漫红等[5-6]发现淡紫拟青霉可以抑制大豆胞囊2龄线虫对大豆根部的趋化性,且其发酵液对大豆胞囊2龄线虫有很好的抑杀作用。淡紫拟青霉能够分泌几丁质酶和丝氨酸蛋白酶,从而降解线虫表皮的几丁质和蛋白质成分,利于侵入并破坏细胞成分。同时,研究发现几丁质酶有助于根结线虫卵的孵化,其浓度越高孵化率越高,而且对根结线虫幼虫有毒杀作用[7];也能内生于植物,产生效应物对其它真菌产生拮抗作用;也能定殖于植物根际,产生次级代谢产物,对真菌、线虫等产生抑杀作用。但当前对淡紫拟青霉与植物的直接作用研究得较少。2006年,李芳等[8]研究发现淡紫拟青霉产生的存在于胞外和胞内的次级代谢产物对尖孢镰刀菌的孢子萌发有抑制作用;2015年,杨婷等[9]发现淡紫拟青霉产生的胞外蛋白有类似于生长素的作用,对植物有高浓度抑制低浓度促进作用;2017年,胡海岩等[10]发现红树林淡紫拟青霉产生的胞外多糖在一定浓度下可抑制疱疹Ⅰ型病毒吸附到非洲绿猴肾细胞,并抑制疱疹Ⅰ型病毒的生物合成,同年11月发现红树林淡紫拟青霉产生的胞外多糖可以刺激小鼠骨髓源性树突细胞分化成熟[11]。由此可知,淡紫拟青霉产生的代谢产物在防治病害、促进植物生长和医学方面都有重要意义,因此,淡紫拟青霉的代谢产物研究越来越受到科研工作者的关注。
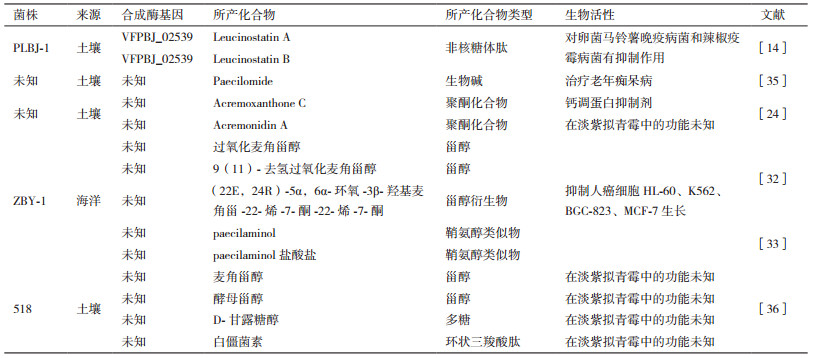
次级代谢产物在植物与微生物的某一生长期产生,是一类生长繁殖非必需的化学结构复杂的小分子物质,如色素、激素、毒素和抗生素等。真菌是产生有活性次级代谢产物的重要生物,不同种类的真菌所产生的次级代谢产物不同。真菌次级代谢产物的发现已成为新药的重要来源[12]。对于次级代谢产物合成与调控的研究,有助于开发新的活性化合物,并提高活性化合物的产量。真菌常见的次级代谢产物有聚酮类、非核糖体肽类、甾醇、生物碱和萜类化合物等多种。淡紫拟青霉目前已发现的次级代谢产物有以下几种(表 1)。
本文综述了淡紫拟青霉次级代谢产物的研究进展,讨论了淡紫拟青霉次级代谢产物的研究意义。最后展望了淡紫拟青霉的研究前景,以期为相关研究者了解淡紫拟青霉提供参考。
1 淡紫拟青霉基于基因组的次级代谢产物的预测2015年,Prasad等[13]利用Illumina Hiseq技术对淡紫拟青霉TERIBC 1菌株进行测序,基因组大小为40.02 Mb,运用SMURF预测了30个次级代谢产物合成基因:12个聚酮化合物合成酶(Polyketide synthase,PKS)、2个PKS-like、7个非核糖体肽合成酶(Non-ribosomal peptide synthetases,NRPS)、7个NRPS-like、1个PKS-NRPS、1个二甲基丙烯基色氨酸合成酶(Dimethylally tryptophan synthases,DMATS)基因。2017年,王刚等[14]利用Illumina Hiseq技术对淡紫拟青霉PLBJ-1和PLFJ-1菌株进行测序,两个菌株的基因组大小分别为38.14 Mb和38.53 Mb。用SMURF和antiSMASH软件预测次级代谢产物合成基因簇,比较发现淡紫拟青霉PLBJ-1和PLFJ-1菌株编码次级代谢产物基因的数量和种类相似,都编码了13个PKS、2个PKS-like、10个NRPS、10个NRPS-like和1个PKS-NRPS、4个(Terpene synthase,TS)和1个DMATS基因。由此可以看出,淡紫拟青霉在次级代谢产物合成方面有很大的挖掘潜力。
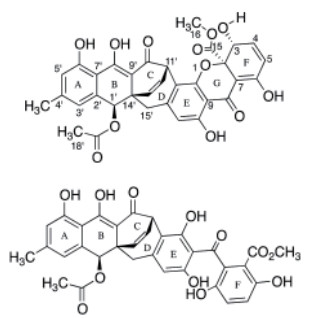
2 非核糖体肽化合物非核糖体肽类化合物由非核糖体肽合成酶(NRPS)催化合成,组成非核糖体肽的氨基酸包括蛋白氨基酸和非蛋白氨基酸。每个NRPS可划分为一个或多个模块(Module),每个模块含有多个结构域,其中有3个结构域是必不可少的,包括:具有腺苷酰化作用(Adenylation,A)的结构域,其作用是激活特异的氨基酸;硫醇化作用(Thiolation,T)或者肽基载体蛋白(Peptidyl carrier protein,PCP)结构域,其作用是转运肽链;缩合(Condensation,C)结构域,其作用是催化氨基酸形成肽键[15]。1973年,Arai等[16]首次发现淡紫拟青霉能产生一种抗生素白灰制菌素(Leucinostatins),它是一种非核糖体肽类化合物,对肿瘤细胞、真菌和革兰氏阳性菌有抑杀作用,且对兔子血压有一定的降压作用,但对肾上腺素和乙酰胆碱反应没有影响。从P.lilacinus A257、P.marquandi和Acremonium sp.中也可以分离到Leucinostatin[17],它们结构相似,只在少数几个氨基酸位点上有差异。2004年,Park等[18]研究了淡紫拟青霉不同菌株Leucinostatins的产生和其活性作用发现,LS91、LS92和LS103菌株也能产生Leucinostatins产物,且对线虫都有毒杀作用。淡紫拟青霉对线虫的防治是否与Leucinostatin有关,Leucinostatin在防治过程中具体有何作用,这些问题到目前为止仍然是个未解之谜。2017年,王刚等[14]对淡紫拟青霉进行了全基因组测序和分析,对预测出的NRPS合成基因酶基因lcsA、PKS合成酶(LcsC)、Acyl-CoA连接酶(LcsD)和硫酯酶(LcsE)分别进行同源敲除,对野生型淡紫拟青霉和突变型淡紫拟青霉的发酵液粗提物进行高效液相色谱法(High performance liquid chromatography,HPLC)比较发现,突变体△LcsA、△LcsC、△LcsD和△LcsE的发酵液粗提物都缺少Leucinostatins A和Leucinostatins B,随后在Leucinostatin的合成途径发现这些酶起到了关键性作用,对淡紫拟青霉的Leucinostatins合成途径做了推理。又进一步用淡紫拟青霉与辣椒疫霉病菌和马铃薯晚疫病菌分别对峙培养,发现淡紫拟青霉对它们的生长都有抑制作用,并且在涂满马铃薯晚疫病菌的平板上放置牛津杯,往各个牛津杯中加入Leucinostatin A和B混合物,发现有抑菌圈,说明淡紫拟青霉对辣椒疫霉病菌和马铃薯晚疫病菌的菌丝生长的抑制作用是由于代谢产生了Leucinostatins而起作用。但由于目前发现淡紫拟青霉只对G418有较弱的敏感性导致有很多假阳性转化子,所以建立一个新的有多个抗性标记筛选体系或开发淡紫拟青霉的营养缺陷型菌株很有必要。Ishiyama等[19]发现Leucinostatin A和B对引起非洲人类锥虫病的锥形虫有很好的抑制作用,锥形虫ATP合成酶的不完整会减慢细胞生长,而Leucinostatin A和B是线粒体解偶联剂、ATP合成的抑制剂,同时Leucinostatin A是离子载体,可以破坏寄生虫体内平衡,因此对锥形虫有很好的抑制作用。肿瘤细胞总是被基质细胞围绕着,并不单独存在,Leucinostatin A是肿瘤-基质细胞互作的调节子。2008年,对前列腺DU-145癌细胞与前列腺基质细胞共培养时发现,Leucinostatin A对前列腺癌细胞有更好的抑制作用比前列腺DU-145癌细胞单独存在时[20]。但当时对Leucinostatin A的抑制机理并不明白,2010年,Kawada等[21]通过RT-PCR揭示了Leucinostatin A是通过减少前列腺基质细胞中胰岛素生长因子类似物来抑制前列腺DU-145癌细胞生长。但前列腺癌细胞的生长是否受Leucinostatin A浓度影响,在体内使用时Leucinostatin A的浓度应保持在何范围,这些问题仍值得研究。2017年9月,Abe等[22]通过非对称全合成Leucinostatin A,并结合核磁共振数据、高效液相色谱和生物活性分析表明Leucinostatin A的正确结构是之前已经报道结构的差向异构体。Leucinostatin A的结构是当下一个颇具争议的焦点(图 1)。
|
| 图 1 Leucinostatins的分子结构 (之前报道的Leucinostatins A,R1=OH,R2=H,R=CH3;报道的Leucinostatins B,R1=OH,R2=H,R=H;最近报道的Leucinostatins A,R1=H,R2=OH,R=CH3) |
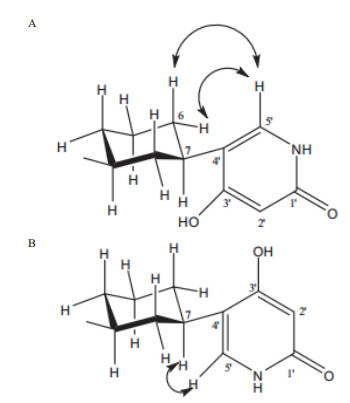
聚酮化合物(Polyketide)是一种常见的次级代谢产物,它通过乙酸、丙二酸或丁酸等脱羧缩合而成,其PKS的合成机制和脂肪酸合酶相似。常见的聚酮化合物有具有降胆固醇作用的洛伐他丁,具有抗真菌作用的两性霉素与灰黄霉素,具有抗细菌作用的红霉素和四环素以及具有免疫抑制作用的雷帕霉素等。PKS可分为3类:Ⅰ型PKS为模块型,是由线性排列并且共价结合的几个功能结构域构成的酶,任何功能结构域在链的合成延伸过程中非重复使用,主要合成聚醚类、多烯类和大环内酯类聚酮化合物。Ⅱ型PKS为芳香族型,起始单位均为乙酰CoA,以丙二酰辅酶A为延伸单位合成具有芳香环结构的聚酮类化合物。Ⅲ型PKS为查尔酮合成酶类,为一类能够重复利用的同源二聚体酶,催化泛酰辅酶A间的缩合,合成一环或者多环类芳香聚酮化合物[23]。Acremoxanthone C和Acremonidin A是淡紫拟青霉产生的聚酮化合物类次级代谢产物,是氧杂蒽酮-蒽醌异二聚体,属钙调蛋白抑制剂,Acremoxanthone C是由非还原型聚酮化合物合成酶(NR-PKS)合成,已通过生物信息学预测出4个淡紫拟青霉Acremoxanthone C的候选合成基因簇。Acremoxanthone C与钙调蛋白的亲和性很高,Acremoxanthone C和Acremonidin A与典型的钙调蛋白抑制子CPZ相比,它的结合位点不同于常见的典型抑制子,但和KAR-2与钙调蛋白的结合位点相似[24](图 2)。钙调蛋白与不同的靶细胞相互作用,调节钙离子依赖的信号转导的通路,包括基因调控、蛋白质合成、离子通道功能、细胞运动、细胞器、趋药性和平滑肌肉收缩。这种有新颖结合模型的钙调蛋白抑制剂的发现可能导致新的研究工具的发现,且利于新药的发现。2015年,Melendez-Gonzalez等[25]从Acremonium camptosporum中分离到一种新的Acremoxanthone类似物、Acremoxanthone C、Acremonidins A和B、以及Acremoxanthones A和B六种化合物,它们对卵菌P. aphanidermatum、P. cinnamomi、P. capsici、P. parasitica均有抑制作用。Isaka等[26]发现Acremonium sp.产生的Acremoxanthones A有抗金黄色葡萄球菌和蜡样芽孢杆菌活性,Acremoxanthones B有抗白色念珠菌活性。Intaraudom等[27]发现Verticillium sp.产生的Acremoxanthones F、G有抗蜡样芽孢杆菌的活性、对癌细胞和非癌细胞有低毒性和抗恶性疟原虫K1的活性;Acremoxanthones A和B有抗金黄色葡萄球菌和蜡样芽孢杆菌活性。而淡紫拟青霉产生的Acremoxanthone C是否具有抗细菌和真菌活性,与植物信号通路到底有何关系仍不清楚。
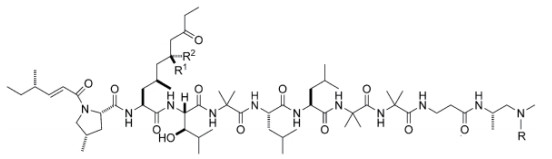
4 生物碱生物碱多指生物体内含复杂氮环的碱性化合物,有明显的生理效应。Teles等[28]在淡紫拟青霉的生长期间添加有活性的鼠伤寒沙门氏菌、经微波炉照射的鼠伤寒沙门氏菌和经高压灭菌失活的鼠伤寒沙门氏菌1 mL或10 mL,以不添加鼠伤寒沙门氏菌为对照,比较发现鼠伤寒沙门氏菌的大量添加产生的提取物失活,鼠伤寒沙门氏菌的小量添加可以产生有活性的提取物,且淡紫拟青霉与少量经高压灭菌失活的鼠伤寒沙门氏菌共培养时产生的提取物对乙酰胆碱酯酶的抑制率最高。核磁共振技术和质谱技术分析该提取物,得知添加1 mL经高压灭菌失活的鼠伤寒沙门氏菌可诱导淡紫拟青霉产生一种新的化合物Paecilomide,它是乙酰胆碱酯酶抑制剂,属于吡啶酮生物碱(图 3)。乙酰胆碱为大脑神经传导物质,它的减少可引起老年痴呆症,乙酰胆碱酯酶可作用于突出间隙,使乙酰胆碱减少,而乙酰胆碱酯酶抑制剂则有利于大脑中乙酰胆碱的积聚,能提高认知能力,改善行为和功能障碍,对老年痴呆症的治疗是有效的[29-31]。
5 淡紫拟青霉其他次级代谢产物2013年,崔香等[32]采用活性跟踪方法和各种色谱技术从深海淡紫拟青霉ZBY-1分离出具有抑制人癌细胞HL-60、K562、BGC-823、MCF-7生长的过氧化麦角甾醇、9(11)-去氢过氧化麦角甾醇、(22E,24R)-5α、6α-环氧-3β-羟基麦角甾-22-烯-7-酮,还有脑苷脂A、B、C、D。同年,该团队再次从该菌株分离到paecilaminol、paecilaminol盐酸盐、油酸、亚油酸、3-吲哚甲酸、3-吲哚甲醛、1(2)-linolyl-2(1)-palmityl-glycero-O-4'-(N,N,N-trimethyl)homoserine、对羟基苯甲酸、1,2-dilinolylglycero-O-4'-(N,N,N-trimethyl)homoserine、肉豆蔻酸甲酯、亚油酸甲酯等化合物,paecilaminol对猪肾上皮PK(15)细胞和大鼠肝肿瘤H4IIE-W细胞有细胞毒活性,paecilaminol和paecilaminol盐酸盐对人癌细胞HL-60、K562、BGC-823、MCF-7都有抑制作用[33]。李小龙等[34]从淡紫拟青霉518菌株中分离到麦角甾醇、麦角甾-7、22(E)-二烯-3β、5α、6β-三醇(又称酵母甾醇)、D-甘露糖醇和白僵菌素等,但其活性作用仍值得进一步研究。
6 展望综上所述,淡紫拟青霉寄主范围广泛,对植物寄生线虫、蚜虫[2]、红蜘蛛[3]、温室粉虱、切叶蚁[4]及植物病原真菌、细菌、病毒均具有很好的抑制作用,其产生的次级代谢物对治疗老年痴呆及防治植物病害均有显著作用,因而展开对淡紫拟青霉次级代谢产物的发现、结构、功能及合成途径的研究对生物医药及农业病害防治均具有重要意义。长期以来,由于真菌中多数基因簇在常见培养基中培养时表现出的基因沉默或表达量很低,导致真菌次级代谢物的研究受到一定阻碍,对淡紫拟青霉次级代谢产物的相关研究仅有Leucinostatins、Acremoxanthone Che Paecilomide三种,且它们的合成途径及调控机制仍不明确。因而需要利用超表达转录因子,用可诱导强启动子替换合成基因簇内启动子,对组蛋白修饰,对基因簇进行异源表达等方法激活沉默基因簇进一步发现结构新颖、有生物活性的次级代谢产物;需要通过改变培养条件来提高次级代谢产物产量;需要采用基因敲除的方法进一步明确次级代谢产物的合成机制。此外,需要不断提高化学物质分离检测的效率与精度,才能更加有利于次级代谢产物的分离与结构功能的鉴定。
| [1] |
Luangsa-Ard J, Houbraken J, van Doorn T, et al. Purpureocillium, a new genus for the medically important Paecilomyces lilacinus[J]. FEMS Microbiology Letters, 2011, 321(2): 141-149. DOI:10.1111/j.1574-6968.2011.02322.x |
| [2] |
Diana Castillo L, Zhu-Salzman K, Maria Julissa E, et al. The entomopathogenic fungal ndophytes Purpureocillium lilacinum (Formerly Paecilomyces lilacinus) and Beauveria bassiana negatively affect cotton aphid reproduction under both greenhouse and field conditions[J]. PLoS One, 2014, 9(8): e103891. DOI:10.1371/journal.pone.0103891 |
| [3] |
Fiedler Ż, Sosnowska D. Nematophagous fungus Paecilomyces lilacinus (Thom) Samson is also a biological agent for control of greenhouse insects and mite pests[J]. BioControl, 2007, 52(4): 547-558. DOI:10.1007/s10526-006-9052-2 |
| [4] |
Goffré D, Folgarait PJ. Purpureocillium lilacinum, potential agent for biological control of the leaf-cutting ant Acromyrmex lundii[J]. Journal of Invertebrate Pathology, 2015, 130: 107-115. DOI:10.1016/j.jip.2015.07.008 |
| [5] |
孙漫红, 刘杏忠, 晋治波. 淡紫拟青霉对大豆胞囊线虫卵及龄2幼虫的影响[J]. 植物保护学报, 2002, 29(1): 57-61. DOI:10.3321/j.issn:0577-7518.2002.01.011 |
| [6] |
孙漫红, 刘杏忠. 淡紫拟青霉发酵滤液对大豆胞囊线虫趋化性的影响[J]. 植物病理学报, 2004, 34(4): 376-379. DOI:10.3321/j.issn:0412-0914.2004.04.015 |
| [7] |
肖炎农, 王明祖, 王道本. 淡紫拟青霉几丁质酶对南方根结线虫的影响[J]. 中国生物防治, 1997(1): 30-32. |
| [8] |
李芳, 葛慈斌, 刘波, 等. 淡紫拟青霉次生代谢物质的抑菌效应[J]. 植物保护学报, 2006(1): 94-98. DOI:10.3321/j.issn:0577-7518.2006.01.019 |
| [9] |
杨婷, 廖美德, 贺玉广, 等. 淡紫拟青霉PL-HN-16促进植物生长活性因子的初步研究[J]. 华北农学报, 2015(6): 170-175. |
| [10] |
胡海岩, 王华民, 林英姿, 等. 红树林淡紫拟青霉胞外多糖对小鼠DCs吞噬功能的影响[J]. 重庆医学, 2017(31): 4321-4324. DOI:10.3969/j.issn.1671-8348.2017.31.001 |
| [11] |
李国军, 常城, 葛婷婷, 等. 红树林淡紫拟青霉胞外多糖分离提取及体外抗HSV-1活性初探[J]. 山西医药杂志, 2017(2): 123-126. |
| [12] |
Bode HB, Bethe B, HÖfs R, et al. Big effects from small changes:possible ways to explore nature's chemical diversity[J]. Chem-biochem, 2002, 3(7): 619-627. |
| [13] |
Prasad P, Varshney D, Adholeya A. Whole genome annotation and comparative genomic analyses of bio-control fungus Purpureocillium lilacinum[J]. BMC Genomics, 2015, 16: 1004. DOI:10.1186/s12864-015-2229-2 |
| [14] |
Wang G, Liu Z, Lin R, et al. Biosynthesis of antibiotic leucinostatins in bio-control fungus purpureocillium lilacinum and their inhibition on phytophthora revealed by genome mining[J]. PLoS Pathogens, 2016, 12(7): e1005685. DOI:10.1371/journal.ppat.1005685 |
| [15] |
Newald JG, Marahiel MA. Chemoenzymatic and template-directed synthesis of bioactive macrocyclic peptides[J]. American Society for Microbiology, 2006, 70(1): 121-146. |
| [16] |
Arai T, Mikami Y, Fukushima K, et al. A new antibiotic, leucinostatin, derived from Penicillium lilacinum[J]. J Antibiot (Tokyo), 1973, 26(3): 157-161. DOI:10.7164/antibiotics.26.157 |
| [17] |
Ricci M, Sassi P, Nastruzzi C, et al. Liposome-based formulations for the antibiotic nonapeptide leucinostatin A:fourier transform infrared spectroscopy characterization and in vivo toxicologic study[J]. AAPS PharmSciTech, 2000, 1(1): E2. |
| [18] |
Park JO, Hargreaves JR, Mcconville EJ, et al. Production of leucinostatins and nematicidal activity of Australian isolates of Paecilomyces lilacinus (Thom) Samson[J]. Letters in Applied Microbiology, 2004, 38(4): 271-276. DOI:10.1111/lam.2004.38.issue-4 |
| [19] |
Ishiyama A, Otoguro K, Iwatsuki M, et al. In vitro and in vivo antitrypanosomal activities of three peptide antibiotics:leucinostatin A and B, alamethicin I and tsushimycin[J]. The Journal of Antibiotics, 2009, 6(62): 303-308. |
| [20] |
Kawada M, Inoue H, Momose I, et al. Leucinostatins suppress prostate cancer cell growth through the tumour-stromal cell interactions[J]. European Journal of Cancer Supplements, 2008, 6(12): 59-60. |
| [21] |
Kawada M, Inoue H, Ohba S, et al. Leucinostatin A inhibits prostate cancer growth through reduction of insulin-like growth factor-I expression in prostate stromal cells[J]. International Journal of Cancer, 2010, 126(4): 810-818. |
| [22] |
Abe H, Ouchi H, Sakashita C, et al. Catalytic asymmetric total synthesis and stereochemical revision of leucinostatin A:A modulator of tumor-stroma interaction[J]. Chemistry, 2017, 23(49): 11792-11796. DOI:10.1002/chem.201703239 |
| [23] |
孙宇辉, 邓子新. 聚酮化合物及其组合生物合成[J]. 中国抗生素杂志, 2006, 31(1): 6-14, 18. DOI:10.3969/j.issn.1001-8689.2006.01.002 |
| [24] |
Madariaga-Mazón A, González-Andrade M, González MDC, et al. Absolute configuration of acremoxanthone C, a potent calmodulin inhibitor from Purpureocillium lilacinum[J]. Journal of Natural Products, 2013, 76(8): 1454-1460. DOI:10.1021/np4002477 |
| [25] |
Melendez-Gonzalez C, Muria-Gonzalez MJ, Anaya AL, et al. Acremoxanthone E, a novel member of heterodimeric polyketides with a bicyclo[3. 2. 2]nonene ring, produced by Acremonium camptosporum W. GAMS (Clavicipitaceae) endophytic fungus[J]. Chem Biodivers, 2015, 12(1): 133-147. DOI:10.1002/cbdv.v12.1 |
| [26] |
Isaka M, Palasarn S, Auncharoen P, et al. Acremoxanthones A and B, novel antibiotic polyketides from the fungus Acremonium sp. BCC 31806[J]. Tetrahedron Letters, 2009, 50(3): 284-287. DOI:10.1016/j.tetlet.2008.10.146 |
| [27] |
Intaraudom C, Bunbamrung N, Dramae A, et al. Acremonidins F-H and acremoxanthones F-G, antimicrobial substances from the insect fungus Verticillium sp. BCC33181[J]. Tetrahedron, 2016, 72(10): 1415-1421. DOI:10.1016/j.tet.2016.01.043 |
| [28] |
Teles APC, Takahashi JA. Paecilomide, a new acetylcholinesterase inhibitor from Paecilomyces lilacinus[J]. Microbiological Research, 2013, 168(4): 204-210. DOI:10.1016/j.micres.2012.11.007 |
| [29] |
Bolognesi ML, Minarini A, Tumiatti V, et al. Progress in acetylcholinesterase inhibitors for Alzheimer's disease[J]. Expert Opinion on Therapeutic Patents, 2006, 16(6): 811-823. DOI:10.1517/13543776.16.6.811 |
| [30] |
Kulshreshtha A, Piplani P. Current pharmacotherapy and putative disease-modifying therapy for Alzheimer's disease[J]. Neurological Sciences, 2016, 37(9): 1403-1435. DOI:10.1007/s10072-016-2625-7 |
| [31] |
Ferreira ND, Alencar LJ, Sobreiro FDDA, et al. New semicarbazones as gorge-spanning ligands of acetylcholinesterase and potential new drugs against Alzheimer's disease:Synthesis, molecular modeling, NMR, and biological evaluation[J]. J Biomol Struct Dyn, 2017, 1-15. |
| [32] |
崔香, 李长伟, 吴长景, 等. 深海来源淡紫拟青霉ZBY-1的代谢产物及其抗肿瘤活性[J]. 国际药学研究杂志, 2013, 40(2): 177-186. |
| [33] |
崔香, 李长伟, 吴长景, 等. 淡紫拟青霉ZBY-1的次级代谢产物及其抗肿瘤活性[J]. 国际药学研究杂志, 2013, 40(6): 765-771. |
| [34] |
李小龙.淡紫拟青霉518的抗菌活性及其次生代谢产物研究[D].南京: 南京农业大学, 2012. http: //cdmd.cnki.com.cn/Article/CDMD-10307-1016024953.htm
|
| [35] |
Teles APC, Takahashi JA. Paecilomide, a new acetylcholinesterase inhibitor from Paecilomyces lilacinus[J]. Microbiological Research, 2013, 168(4): 204-210. DOI:10.1016/j.micres.2012.11.007 |
| [36] |
李小龙, 王超, 郭坚华. 菌株518鉴定及其次生代谢产物的生防特性与分离[J]. 浙江农业学报, 2013(3): 537-542. DOI:10.3969/j.issn.1004-1524.2013.03.22 |