海藻糖是由两个葡萄糖分子通过半缩醛羟基缩合而成的非还原性双糖[1],在真菌、细菌、藻类、动物和植物中广泛存在,是天然双糖中最稳定的糖质。海藻糖具有生物抗逆性,其含量在胁迫环境下被大量积累[2],对植物抵抗干旱、低温、高盐和营养胁迫等非常重要。植物中海藻糖主要经TPS/TPP途径合成,即尿苷二磷酸葡萄糖和6-磷酸葡萄糖在海藻糖-6-磷酸合成酶(trehalose-6-phosphate synthase,TPS)催化作用下生成6-磷酸海藻糖,之后在海藻糖-6-磷酸酯酶(trehalose-6-phosphate phosphatase,TPP)的水解作用下生成海藻糖[3]。由此可见,TPP参与海藻糖生物合成催化反应的最后一步,是植物海藻糖生物合成途径的关键酶。
植物中TPP基因以基因家族的形式存在,拟南芥中有10 TPP基因(AtTPPA-AtTPPJ)[4-5],水稻中有13个TPP基因(OsTPP1-OsTPP13)[6],它们都含有TPP基因家族保守结构域。通过酵母互补实验,Vogel等[7]最早鉴定并克隆了两个拟南芥TPP成员——AtTPPA和AtTPPB。他们发现,AtTPPA和AtTPPB基因表达后可以互补tps2突变体的功能,并能够在体内(in vivo)和体外(in vitro)实验中检测到TPP活性。随后的研究表明,拟南芥TPP基因的表达受到低温、干旱、盐、渗透胁迫和激素(包括ABA、JA等)处理的调控[5]。水稻OsTPP1基因是拟南芥AtTPPA基因的同源基因。表达分析显示,OsTPP1的表达也受到低温、盐、渗透胁迫和ABA处理诱导,并伴随着TPP活性和海藻糖含量的提高[8]。在水稻中超表达OsTPP1基因后,转基因植株对盐和低温的耐受性增强[6]。进一步分析表明,OsTPP1可以激活胁迫相关基因的表达(如冷胁迫响应基因Lip5、Lip9、DREB1B和非生物胁迫信号基因OsMPK3、OsMPK4),这可能是OsTPP1超表达植株抗逆性增强的主要原因[6]。值得注意的是,Nuccio等[9]在玉米中超表达OsTPP1基因后,多年份多地点田间试验表明,转基因植株在正常和干旱条件下均可以增加玉米结实率和收获指数,进而增加产量。由此可见,OsTPP1是一个可用于作物抗逆遗传改良的重要候选基因。然而,目前这些研究还主要集中在模式植物拟南芥和水稻中,在热带作物(如木薯)中的研究还很少。
木薯(Manihot esculenta Crantz)是热带和亚热带地区重要的粮食和经济作物,与甘薯和马铃薯并称为世界三大薯类作物,在现代农业和工业中占有非常重要的地位。木薯具有较好的抗旱特性,然而在长时间或较为严重的干旱条件下,其块根产量会显著下降[10]。作为典型的热带作物,木薯对低温反应非常敏感,极端的低温天气可以造成木薯大幅减产甚至绝收[11]。因此,提高木薯对干旱和低温等非生物胁迫的耐受性,使其在恶劣环境下维持原有产量或是减少产量损失具有重要意义。
至今为止,木薯中尚没有关于TPP基因克隆及其参与非生物胁迫调控的研究报道。本研究以OsTPP1基因为切入点,采用同源基因克隆的方法从木薯品种Ku50叶片中克隆了一个海藻糖-6-磷酸酯酶基因(命名为MeTPP1),分析其在木薯野生种和栽培种之间的结构变异,并通过荧光定量PCR(qRT-PCR)分析了其在野生种和栽培种之间、以及在干旱、低温和ABA胁迫处理下的表达水平,旨在为进一步研究MeTPP1在木薯抗逆中的功能提供理论参考。
1 材料与方法 1.1 材料本研究所用材料包括木薯主推广栽培品种Ku50(高淀粉、抗逆性较好)和野生种W14(低淀粉),由中国热带农业科学院热带生物技术研究所提供。植物RNA提取试剂盒(货号:DP437)购自天根生化科技有限公司,cDNA反转录试剂盒(货号:K1622)购自Fermentas公司。PCR引物在上海生工生物工程股份有限公司合成。
1.2 方法 1.2.1 木薯种植与处理木薯种植按照丁泽红等[12]方法进行:在木薯种植季节,将木薯Ku50种茎切成15 cm左右的茎段,选择粗细匀称且具有3-4个芽眼的茎段种植于塑料盆(上直径18.5 cm,下直径14.8 cm,高18.8 cm)中,每盆1茎段。木薯基质采用蛭石与营养土按照1:1的体积比进行混合。种植大约10 d后进行间苗,每盆保留1棵苗。木薯种植60 d后,分别进行干旱、低温和ABA处理。(1)干旱处理:采用PEG-6000进行干旱模拟处理。处理植株浇灌20%的PEG-6000溶液,对照植株不施PEG(用浇灌自来水代替)。在处理0、3、和24 h后,分别收集第一片完全展开叶、未展开叶、老叶、和根的样品,液氮速冻、-80℃保存待用;(2)低温处理:选取生长状况一致的植株放置于光照培养箱,进行4℃低温胁迫处理。在处理0、6、和24 h后,分别收集第一片完全展开叶、未展开叶、和根的样品,液氮速冻、-80℃保存待用;(3)ABA处理:采用100 μmol/L ABA溶液进行浇灌处理,在处理0、3、5、和7 d后收集第一片完全展开叶的样品,液氮速冻、-80℃保存待用。
为了比较木薯野生种W14和栽培种Ku50中MeTPP1基因的表达情况,我们收集了正常大田种植环境下木薯叶片(90 d)和储藏根(150 d)的样本,用于qRT-PCR分析。
1.2.2 引物合成及qRT-PCR本研究所用引物包括MeTPP1基因qRT-PCR引物(qMeTPP1-L:5' -GGC-TTGACGCCATGAAATCC-3' ;qMeTPP1-R:5' -TACT-TAAGCGTCCAGGTGGC-3' ),actin内参基因引物(qActin-L:5' -TGATGAGTCTGGTCCATCCA-3' ;qActin-R:5' -CCTCCTACGACCCAATCTCA-3' ),和MeTPP1基因全长扩增引物(gMeTPP1-L:5' -ATGG-ACCTTAAATCGAATCACACTG-3' ;gMeTPP1-R:5' -CTTCACTTCTTCCACATCACAAGAT-3' )。采用SYBR Green Ⅱ试剂盒进行qRT-PCR分析,每个样品含有3次生物学重复。qRT-PCR反应在Mx 3005P荧光定量PCR仪(Stratagene,美国)上进行qRT-PCR分析。基因相对表达量按照2-ΔΔCt进行计算[13]。
1.2.3 生物信息学分析生物信息学分析方法参照丁泽红等[12]进行,具体描述如下:用BLASTP搜索Phytozome数据库,根据序列相似性获取其他物种中与MeTPP1同源的蛋白质序列;用ExPASy ProtParam软件计算蛋白质的分子量和等电点;用Plant-mPLoc软件预测亚细胞定位情况;用NCBI-CDD数据库预测保守结构域;用ClustalX软件进行序列比对;用DnaSPv5进行SNP分析及ka/ks计算;用MEGA5.2软件构建Neighbor-joining系统进化树(bootstrap = 1 000);用PlantCARE分析启动子元件;用Primer 5.0软件设计PCR引物。
木薯野生种W14和栽培种Ku50中MeTPP1基因序列由前期全基因组测序确定[14];栽培种AM560中MeTPP1序列从Phytozome数据库下载。
2 结果 2.1 MeTPP1基因克隆以水稻OsTPP1(LOC_Os02g44230)蛋白质序列为查询序列,通过BLASTP搜索Phytozome木薯数据库获得与OsTPP1同源的序列(cassava4.1_0098-37m.g),之后根据数据库提供的参考序列,设计引物进行PCR扩增(图 1)。测序后获得一个全长为1 131 bp的序列,编码376个氨基酸(图 2),根据其与水稻OsTPP1基因的同源性将其命名为MeTPP1。通过序列比对发现,MeTPP1与参考序列之间共有2个碱基差异,它们均可导致氨基酸编码的改变。将MeTPP1与基因组序列比对得知,该基因含有11个外显子和10个内含子。ProtParam预测MeTPP1蛋白的分子式为C1890H2959N505O564S15,总原子数目为5 933,分子量为42 261.2 Da,理论等电点(pI)为7.05,不稳定系数为38.03,属于稳定蛋白。亚细胞定位预测该蛋白质定位于叶绿体或液泡。NCBI-CDD保守结构域分析表明,MeTPP1编码的蛋白含有TPP基因家族保守结构域(PLN02580,图 3),进一步表明克隆到的基因为木薯MeTPP1基因。
|
| 图 1 MeTPP1基因cDNA电泳图 M:DNA marker;1:MeTPP1基因cDNA |

|
| 图 2 木薯MeTPP1及其推导的氨基酸序列 |

|
| 图 3 MeTPP1蛋白质结构域分析 |
通过BlastP搜索Phytozome数据库获取其他物种中与MeTPP1具有较高同源性的蛋白质序列,之后构建系统进化树。分析结果表明,这些基因大致上被聚类为3组(图 4):木薯MeTPP1基因聚类在第Ⅰ组,它与杨树(Potri.015G126900.1)和杞柳(SapurV1A.0129s0190.1)中同源基因的亲缘关系较近,序列相似性分别为77.8%和74.5%。大豆和雷蒙德氏棉中的同源基因也聚类在第Ⅰ组。拟南芥AtTPPA聚类在第Ⅱ组,同时还包含了其他十字花科的物种,如琴叶拟南芥、鼠耳芥、荠菜花和白菜型油菜。水稻OsTPP1聚类在第Ⅲ组,它与二穗短柄草的同源基因亲缘关系较近。此外,许多C4植物包括玉米、高粱、小米、狗尾草、黍羊和柳枝稷也被聚类在第Ⅲ组。
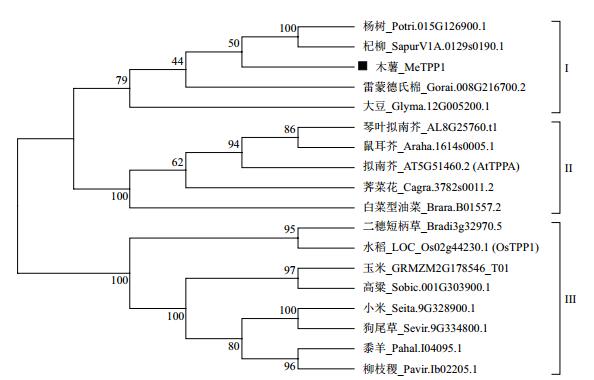
|
| 图 4 木薯MeTPP1基因与其他物种TPP基因系统进化树 |
为了揭示MeTPP1在基因组结构上的变异,本研究将野生种W14、栽培种Ku50和AM560(Phyto-zome木薯数据库测序品种)中MeTPP1的DNA序列进行比对分析,共发现5个插入/缺失(Indel)和43个SNP,其中有9个SNP属于错义突变,可引起氨基酸编码的改变(图 5)。
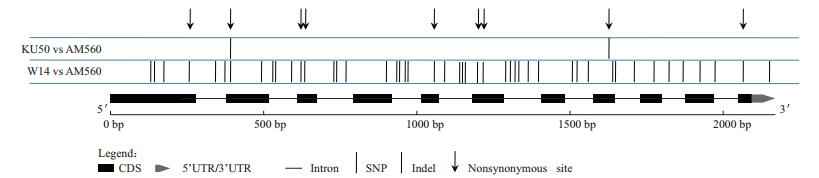
|
| 图 5 MeTPP1基因结构变异 |
序列两两比较表明,MeTPP1的结构变异主要来自于栽培种与野生种之间的差异,而栽培种与栽培种之间的差异很小,仅有2个SNP。野生种与栽培种ka/ks比值接近于0.43,暗示MeTPP1基因在进化过程中受到了纯化选择。
2.4 MeTPP1基因启动子分析启动子是影响基因表达的重要调控元件,与基因的转录起始和表达程度息息相关。本研究选取MeTPP1起始密码子(ATG)上游1 500 bp的序列进行启动子元件分析,发现了一系列与胁迫相关的元件,如干旱诱导元件MBS、热胁迫响应元件HSE、以及防御与胁迫相关元件TC-rich repeats。脱落酸(Abscisic acid,ABA)是一种非常重要的植物激素,处于植物响应干旱、低温、热胁迫等非生物逆境的信号传导中枢,在非生物逆境条件下可调控基因的表达。值得指出的是,本研究在MeTPP1启动子区域发现了一个ABA响应元件ABRE,暗示MeTPP1可能通过ABA介导的信号通路参与木薯非生物胁迫响应。除此之外,我们还发现了茉莉酸响应元件CGTCA-motif和TGACG-motif、水杨酸响应元件TCA-element、赤霉素响应元件P-box、和许多与光响应相关的元件,包括G-Box、GT1-motif、和Sp1等。这些结果表明,MeTPP1可能参与木薯干旱、低/高温、激素和光照相关的基因表达调控。
2.5 MeTPP1基因表达分析首先,我们考察了MeTPP1基因在木薯野生种W14和栽培种Ku50中的表达情况。结果表明,叶片中MeTPP1在W14中的表达量要显著的高于Ku50;而根中的表达趋势正好相反,但表达量无显著差异(图 6-A)。
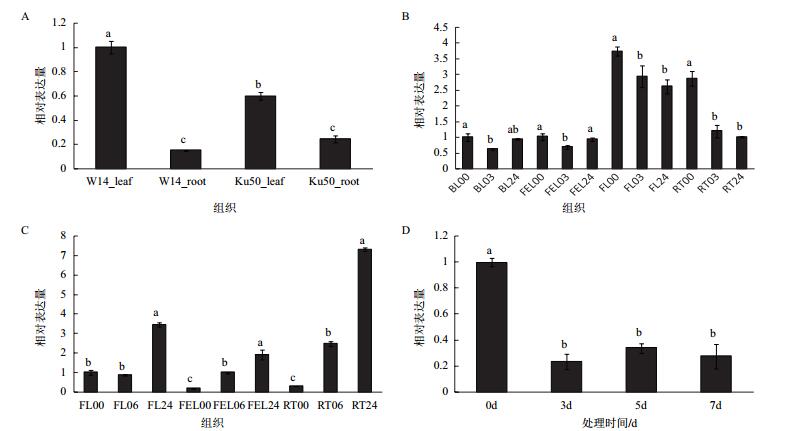
|
| 图 6 MeTPP1基因的表达分析 A:野生种W14与栽培种Ku50比较;B:干旱处理;C:低温处理;D:ABA处理。BL:老叶;FEL:第一片完全展开叶;FL:未展开叶;RT:根。00、03、06和24分别代表胁迫处理0、3、6和24 h。数据用均值±标准差表示,不同的字母表示Duncan’s多重比较显著(P < 0.05) |
其次,我们考察了MeTPP1基因在不同胁迫条件下的表达情况。在PEG-6000胁迫条件(模拟干旱)下,MeTPP1的表达量在老叶和第一片完全展开叶中均呈现先下降后上升的变化趋势,而在未展开叶和根中均呈现持续下降的变化趋势(图 6-B),表明在木薯不同组织中MeTPP1可能采取不同的表达策略来响应干旱胁迫。在低温胁迫下,无论是在未展开叶、第一片完全展开叶、还是在根中,MeTPP1的表达量均呈现持续上升的变化趋势,其表达量在低温处理24 h后分别上升了3.5、11.6和24.2倍(图 6-C)。在ABA处理条件下,MeTPP1在叶片中的表达量显著下降了,在处理3 d、5 d、7 d后分别下降了76.6%、66.2%和72.7%(图 6-D)。
这些结果充分表明,MeTPP1基因在转录水平受到干旱、低温和ABA处理显著诱导,可进一步研究其在木薯非生物胁迫中的功能。
3 讨论海藻糖是重要的渗透调节物质,增加植物体内海藻糖含量可以提高植物抵御干旱和低温等胁迫的抗性[15]。TPP负责催化海藻糖生物合成途径的最后一步反应,是海藻糖生物合成途径中的一个关键酶。植物中TPP以基因家族的形式存在,拟南芥中有10个TPP基因,水稻中有13个TPP基因,它们都含有TPP基因家族保守结构域[4, 6]。研究表明,增加TPP基因的表达可以提高植物对非生物逆境胁迫的抗性。例如,在拟南芥中超表达AtPPD基因后,转基因植株抗盐能力增强[16];在水稻中超表达OsTPP1基因后,转基因植株体内OsTPP1表达量上升,对低温、盐和干旱胁迫的抗性增强[6, 8]。进一步实验表明,OsTPP1基因的表达调控与ABA代谢相关[8]。最近,研究人员将OsTPP1基因在玉米中进行超表达后发现,转基因植株在正常和干旱条件下均可以增加玉米产量[9]。不难看出,TPP是一个重要的抗逆候选基因,可用于作物遗传改良育种。目前有关TPP基因功能的研究主要集中在模式植物拟南芥和水稻中,在热带作物(如木薯)中尚无TPP基因克隆的相关报道,对其功能也知之甚少。本研究采用同源基因克隆的方法,从木薯叶片中克隆了OsTPP1的同源基因,将其命名为MeTPP1。序列分析表明MeTPP1编码376个氨基酸,含有TPP基因家族保守结构域,具有11个外显子和10个内含子。进化树分析表明,它与杞柳和杨树中TPP基因的亲缘关系较近。
基因结构变异可以引起基因表达量的改变[17]。本研究发现,MeTPP1的表达量在野生种W14和栽培种Ku50之间存在显著差异;而序列比对发现,MeTPP1在木薯野生种W14和栽培种Ku50之间存在大量的碱基变异,其中仅有9个SNP会引起氨基酸编码的改变,推测这9个错义突变可能与野生种和栽培种之间MeTPP1的表达差异有关。
TPP基因的表达受到干旱、低温、盐、机械损伤和渗透胁迫等调控,且不同TPP成员对各种胁迫的响应不一样。例如,在拟南芥幼苗中,AtTPPE、AtTPPF、AtTPPG和AtTPPJ的表达均受到低温、盐和渗透胁迫的诱导;而AtTPPA和AtTPPH的表达仅受到低温胁迫诱导但被盐和渗透胁迫抑制[5]。另外,不同TPP成员对激素的响应也不一样。AtTPPD和AtTPPI的表达均受到ABA处理诱导,AtTPPA和AtTPPB的表达受到ABA处理抑制,而AtTPPE、AtTPPF和AtTPPG的表达则同时受到ABA和JA处理诱导[5]。在水稻中,OsTPP1基因表达也受到低温、盐、干旱和ABA处理的诱导[6, 8]。启动子是调控基因表达的重要元件。本研究在MeTPP1启动子区域发现了干旱诱导元件MBS和温度(热胁迫)响应元件HSE,这与MeTPP1基因在干旱和低温胁迫条件下的表达分析结果是吻合的。植物响应外界非生物胁迫的信号传导路径大致上可以分为两种:一种是依赖于ABA信号通路的;另一种是不依赖于ABA信号通路的[18]。本研究在MeTPP1启动子区域发现了一个与ABA响应相关的元件ABRE,而且表达分析结果显示MeTPP1的表达也是受到ABA信号响应的。因此,本研究推测MeTPP1可能是通过依赖于ABA的信号通路参与木薯干旱和低温等非生物胁迫响应。然而,具体有哪些基因参与了MeTPP1介导的分子调控网络尚不清楚,还需要进一步研究。
4 结论本研究通过同源基因克隆的方法从木薯叶片中克隆了一个海藻糖-6-磷酸酯酶基因MeTPP1,该基因编码376个氨基酸,含有TPP家族保守结构域。序列比对分析表明,MeTPP1在木薯野生种和栽培种之间共有9个错义突变,它们可能与MeTPP1的表达有关。实时荧光定量PCR分析表明,MeTPP1表达量受到干旱、低温和ABA处理的响应,可作为候选基因进一步研究其在木薯抗逆中的功能。
| [1] |
张雯, 王宇斐, 郭延平. 高等植物6-磷酸海藻糖信号调控研究进展[J]. 植物生理学报, 2016, 52(4): 394-400. |
| [2] |
张建波, 王莎莎, 郝大海, 等. 干旱和低温胁迫影响烟草幼苗海藻糖代谢的差异比较[J]. 生物技术通报, 2015, 31(10): 111-118. |
| [3] |
史健志, 等. 坛紫菜6-磷酸海藻糖合成酶(TPS)家族基因的克隆及表达特征分析[J]. 水产学报, 2015, 39(4): 485-495. |
| [4] |
Vandesteene L, Dijck PV. Expansive evolution of the trehalose-6-phosphate phosphatase gene family in Arabidopsis[J]. Plant Physiology, 2012, 160(2): 884. DOI:10.1104/pp.112.201400 |
| [5] |
Li P, Ma S, Bohnert HJ. Coexpression characteristics of trehalose-6-phosphate phosphatase subfamily genes reveal different functions in a network context[J]. Physiol Plant, 2008, 133(3): 544-556. DOI:10.1111/j.1399-3054.2008.01101.x |
| [6] |
Ge LF, Chao DY, Shi M, et al. Overexpression of the trehalose-6-phosphate phosphatase gene OsTPP1 confers stress tolerance in rice and results in the activation of stress responsive genes[J]. Planta, 2008, 228(1): 191-201. DOI:10.1007/s00425-008-0729-x |
| [7] |
Vogel G, Aeschbacher RA, Müller J, et al. Trehalose-6-phosphate phosphatases from Arabidopsis thaliana:identification by functional complementation of the yeast tps2 mutant[J]. Plant Journal for Cell & Molecular Biology, 1998, 13(5): 673-683. |
| [8] |
Pramanik MHR, Imai R. Functional identification of a trehalose 6-phosphate phosphatase gene that is involved in transient induction of trehalose biosynthesis during chilling stress in rice[J]. Plant Molecular Biology, 2005, 58(6): 751-762. DOI:10.1007/s11103-005-7404-4 |
| [9] |
Nuccio ML, Wu J, Mowers R, et al. Expression of trehalose-6-phosphate phosphatase in maize ears improves yield in well-watered and drought conditions[J]. Nat Biotechnol, 2015, 33(8): 862. DOI:10.1038/nbt.3277 |
| [10] |
Okogbenin E, Setter TL, Ferguson M, et al. Phenotypic approaches to drought in cassava:review[J]. Front Physiol, 2013, 4: 93. |
| [11] |
卢赛清, 盘欢, 马崇熙, 等. 2008年广西木薯低温冻害情况及应对措施[J]. 广西热带农业, 2009(1): 21-22. |
| [12] |
丁泽红, 付莉莉, 等. 木薯MeNCED3基因克隆、结构变异及其表达分析[J]. 生物技术通报, 2016(10): 148-153. |
| [13] |
Fu L, Ding Z, et al. Physiological investigation and transcriptome analysis of Polyethylene Glycol(PEG)-induced dehydration stress in cassava[J]. Int J Mol Sci, 2016, 17(3): 283. DOI:10.3390/ijms17030283 |
| [14] |
Wang W, Feng B, et al. Cassava genome from a wild ancestor to cultivated varieties[J]. Nat Commun, 2014, 5: 5110. DOI:10.1038/ncomms6110 |
| [15] |
Garg AK, Kim JK, Owens TG, et al. Trehalose accumulation in rice plants confers high tolerance levels to different abiotic stresses[J]. Proc Natl Acad Sci USA, 2002, 99(25): 15898. DOI:10.1073/pnas.252637799 |
| [16] |
Krasensky J, et al. The redox-sensitive chloroplast trehalose-6-pho-sphate phosphatase AtTPPD regulates salt stress tolerance[J]. Antioxid Redox Signal, 2014, 21(9): 1289-1304. DOI:10.1089/ars.2013.5693 |
| [17] |
Hao GP, et al. Nucleotide variation in the NCED 3 region of Arabidopsis thaliana and its association study with abscisic acid content under drought stress[J]. J Integr Plant Biol, 2009, 51(2): 175-183. DOI:10.1111/jipb.2009.51.issue-2 |
| [18] |
Shinozaki K. Gene networks involved in drought stress response and tolerance[J]. J Exp Bot, 2007, 58(2): 221-227. |




