2. 齐齐哈尔医学院临床生化教研室,齐齐哈尔 161006;
3. 齐齐哈尔医学院第一附属医院医学影像CT室,齐齐哈尔 161041
2. Department of Clinical Biochemistry, Qiqihar Medical College, Qiqihar 161006;
3. Medical Imaging Department, the First Affiliated Hospital of Qiqihar Medical College, Qiqihar 161041
血清和糖皮质激素诱导的蛋白激酶3(serum-and glucocorticoid regulated protein kinase 3,SGK3)是PI3K信号通路中的下游分子,近年来研究发现该激酶可诱导肿瘤血管生成,与多种肿瘤的发生发展关系密切,是某些肿瘤分子诊断、治疗的潜在靶点[1-2]。SGK3可促进黑色素瘤、前列腺癌细胞增殖,靶向抑制SGK3可降低GBM细胞的增殖活性,SGK3的异位表达增强乳腺癌细胞侵袭性迁移,相反,SGK3 shRNA则减弱肿瘤细胞迁移[3-4, 9],而本课题组前期研究显示,SGK3在乳腺癌组织中的表达高于正常组织,且与ER等临床病理特征相关,过表达SGK3可促进乳腺癌细胞增殖,抑制其凋亡和侵袭转移[5-6]。本研究在此基础上,构建SGK3基因RNAi慢病毒载体,并进一步在细胞水平观察SGK3基因沉默对人乳腺癌细胞MB-474增殖等生物学行为的影响。
1 材料与方法 1.1 材料MB-474细胞、293T细胞购自上海中科院细胞库,重组穿梭质粒和包装质粒pGag/Pol、pRev、pVSV-G、RNAi-Mate转染试剂购自上海吉玛构建制备,SYBR Premix Ex TaqTM、Prime Script TM RT reagent Kit购自TaKaRa公司,胞培养瓶、培养板为Nunc公司产品,胎牛血清购自Gibco公司,GAPDH、SGK3引物由上海生工公司合成,辣根酶标记山羊抗兔IgG购自SANTA CRUZ公司,GAPDH、SGK3 antibody购自Proteintech公司、蛋白抽提、定量试剂盒购自碧云天生物技术公司、Annexin V-FITC/PI凋亡检测试剂盒购自北京嘉美生物技术有限公司。
1.2 方法 1.2.1 靶向SGK3基因的shRNA慢病毒表达载体的构建及包装从GenBank查找SGK3基因序列(NM_001033578.2),设计4条针对人SGK3基因的特异性shRNA序列(表 1),以通用序列(Negative control,NC)作为阴性对照,由苏州吉玛基因股份有限公司构建,靶向SGK3基因的shRNA慢病毒表达载体,菌落PCR筛选重组阳性克隆进行测序鉴定; 对数生长期的293T细胞4×106接种于15 cm培养皿中,含10% FBS的DMEM培养液,37℃、5% CO2培养过夜,弃去培养液,将pGC-LV-GFP-SGK3和包装质粒pGag/Pol、pRev、pVSV-GD及无血清DMEM混匀后,RNAi-Mate介导转染293T细胞,37℃温育6 h后更换为含10% FBS的DMEM培养液继续培养72 h,收集细胞上清液,4℃,4 000 r/min,离心4 min,0.45 μm过滤器过滤上清,与4℃,20 000 r/min,离心2 h后收集、分装病毒液,-80℃冰箱中保存备用。
293T细胞以1×104细胞/孔接种于96孔板,培养24 h后弃去培养基,将慢病毒原液用DMEM培养液10倍稀释4个梯度,每个稀释度3个复孔,在孔板中加入100 μL慢病毒稀释液培养24 h,更换为DMEM培养基继续培养72 h,荧光显微镜下观察GFP表达情况,并计算病毒原液滴度:病毒滴度(TU/mL)=荧光细胞个数×1 000/每病毒原液量(μL)。
1.2.3 Real-time PCR检测MB-474细胞SGK3 mRNA表达收集各组慢病毒转染和对照组细胞,提取细胞总RNA逆转录,以GAPDH为内参照,定量分析SGK3基因mRNA表达(按说明书操作),SGK3引物序列为:上游5'-GATCCGGCGCCTTCCC-3',下游5'-CCATCATGCAACCTGGCCC-3';GAPDH引物序列为:上游5'-GAAGGTGAAGGTCGGAGTC-3',下游:5'-GAAGATGGTGATGGGATTTC-3',反应条件如下:95℃预变性30 s; 95℃变性5 s,60℃退火30 s,共40个循环,计算2-△△Ct值比较各目的基因初始模板量差别。
1.2.4 Western blot检测MB-474细胞SGK3蛋白表达收集各组细胞,进行细胞总蛋白提取及含量测定,取40 μg总蛋白进行10% SDS-PAGE电泳,转NC膜,5%脱脂牛奶室温封闭2 h,分别用SGK3抗体(1:1 000)、GAPDH抗体(1:2 000),4℃孵育过夜,辣根酶标记的羊抗兔二抗(1:5 000)室温孵育1.5 h,TBST洗膜后ECL显色成像后,凝胶成像分析系统扫描分析蛋白条带,以SGK3与GAPDH条带积分光密度比值表示蛋白表达。
1.2.5 MTT方法检测SGK3基因沉默对细胞增殖的影响取对数生长期的MB-474细胞、474-LV3-VC细胞和PGC-LV3-SGK3-1组细胞,按1×103细胞/孔接种于96孔培养板,每组设4个平行孔,于37℃、5% CO2孵箱中培养,每天取出一块培养板,加MTT 20 μL,继续培养2 h后弃培养液,加150 μL DMSO,震荡15 min后用酶标仪在570 nm测定吸光度值,做细胞增长曲线,观察细胞的增殖情况。
1.2.6 流式细胞术检测SGK3基因沉默对细胞周期的影响细胞培养48 h后0.25%胰酶消化处理各组培养细胞,1 000 r/min离心10 min收集细胞,用冰预冷的PBS洗两次,PI染色30 min后上流式细胞仪检测细胞周期,以标准程序用FACS(Becton-DickinsonUSA)检测,记录激发波长488 nm处的红色荧光,资料经ModFitL T软件分析。
1.2.7 统计学分析应用SPSS 20.0软件进行统计学分析,计量资料以x±s表示; 多组间资料相互比较进行方差分析,LSD检验,结果以P<0.05为具有统计学意义。
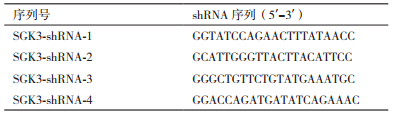
2 结果 2.1 重组慢病毒载体的测序鉴定将4组构建的表达载体的阳性克隆行DNA测序,测序结果如图 1所示与设计的shRNA核苷酸序列完全一致,说明已成功构建针对SGK3基因的重组慢病毒载体pGC-LV3-GFP-SGK3。
|
| 图 1 pGC-LV3-GFP-SGK3测序结果 A:SGK3-shRNA-1;B:SGK3-shRNA-2;C:SGK3-shRNA-3;D:SGK3-shRNA-4 |
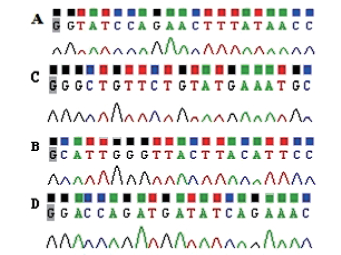
各组慢病毒载体转染293T细胞72 h后,荧光显微镜均可见较强绿色荧光(图 2),将病毒原液梯度稀释并感染293T细胞后,计数各孔中表达绿色荧光的细胞数,最终测得pGC-LV-GFP-SGK3-1、2、3、4病毒原液滴度值分别为4×108、3×108、4×108和8×108 TU/mL,提示病毒包装成功。
|
| 图 2 将重组病毒载体转染后293T细胞后荧光显微镜下观察GFP(40×) A:转染pGC-LV-GFP-SGK3-1组,B:转染pGC-LV-GFP-SGK3-2组,C:转染pGC-LV-GFP-SGK3-3组; D:转染pGC-LV-GFP-SGK3-4组 |
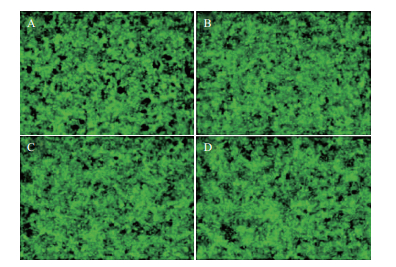
Real-time PCR检测MB-474细胞转染外源基因SGK3特异性shRNA后,474-LV3-VC对照组SGK3 mRNA表达抑制率为0.943 8±0.092 7。与其相比,PGC-LV3-SGK3-1、2、3、4实验组的SGK3 mRNA表达水平均有不同程度降低,各组SGK3 mRNA的抑制率分别为0.233 0±0.072 9、0.307 2±0.072 1、0.514 9±0.035 7和0.597 2±0.096,其中PGC-LV3-SGK3-1在mRNA表达水平抑制效果最为显著(#▽P<0.01)(图 3)。
|
| 图 3 转染慢病毒后各组细胞SGK3 mRNA水平 #与对照组比较P<0.01,▽与其他组比较P<0.01 |
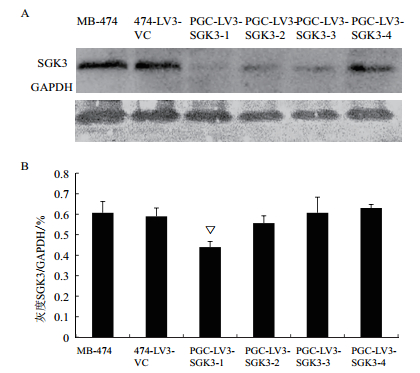
Western blot结果(图 4-A)表明,与MB-474细胞和474-LV3-VC组相比,其他各组细胞SGK3蛋白表达量虽均有不同程度降低,但其中PGC-LV3-SGK3-1蛋白表达水平抑制具有统计学意义(▽P<0.01)(图 4-B)。
|
| 图 4 染慢病毒后各组细胞SGK3蛋白的达 A:Western blot检测MB-474细胞SGK3蛋白表达; B:染慢病毒后各组细胞SGK3蛋白表达情况; ▽P<0.01 |
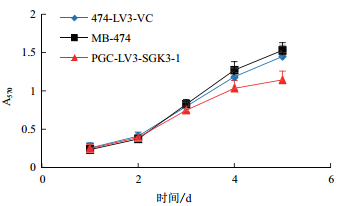
MTT实验结果(图 5)显示,MB-474细胞和474-LV3-VC细胞生长增殖速度无明显差异(P>0.05),而PGC-LV3-SGK3-1细胞在接种3 d后生长增殖较前二者速度明显减慢(P<0.01),各组细胞倍增时间分别为(36.752 3±2.880 05)h、(35.278 9±5.629 52)h和(44.490 7±9.328 99)h。
|
| 图 5 各组MB-474细胞生长曲线 |
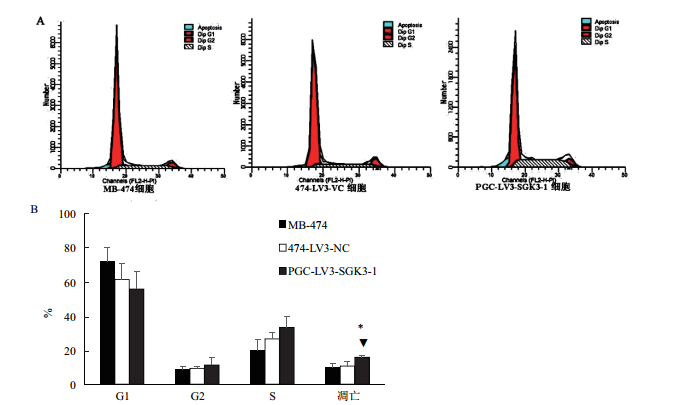
流式细胞术检测细胞周期结果(图 6)显示:MB-474细胞和474-LV3-VC和PGC-LV3-SGK3-1组细胞的G1期比例分别为(71.867±7.882)%、(61.203±9.623)%、(55.617±10.171)%; G2期比例分别为(8.5167±1.580)%、(9.283±0.799)%、(11.253±4.197)%; S期所占比列为(19.6133±10.171)%、(26.5133±3.904)%、(33.220±6.570)%; 细胞凋亡比例为(9.807±2.072)%、(10.613±2.905)%、(15.767±1.185)%,即各组细胞在细胞周期G1、G2、S期的比例大致相近,无明显差异(P>0.05); PGC-LV3-SGK3-1细胞细胞凋亡比例却增加(*▼P<0.05)。
|
| 图 6 SGK3基因沉默对乳腺癌MB-474细胞周期的影 A:流式细胞术检测各组MB-474细胞周期和凋亡; B:SGK3基因沉默对MB-474细胞周期的影响(*▼P<0.05) |
1999年SGK3作为SGK家族的新成员被发现以来,学者们对该激酶的功能、与人类疾病及肿瘤的相关性等进行了积极的研究和探索[7-9],有观点认为,SGK3可以作为某些肿瘤治疗的靶点及预后标志物[10],近年来,有关SGK3与乳腺癌发生发展的关系也逐渐引起重视。有报道指出,SGK3与乳腺癌雌激素(ER)受体表达相关、具有介导乳腺癌中INPP4B依赖性PI3K信号传导的功能[4, 11]。本课题组近年来研究结果显示,SGK3在浸润性乳腺癌中的表达较正常乳腺组织增高,SGK3过表达会影响乳腺癌细胞增殖、凋亡、侵袭迁移等恶性生物学行为[12],而SGK3基因沉默对乳腺癌细胞的生物学行为是否也会产生影响,本实验研究构建SGK3基因RNAi慢病毒载体,沉默MB-474乳腺癌细胞SGK3基因表达。结果表明SGK3基因沉默可抑制MB-474细胞增殖,延长其倍增时间虽然对MB-474细胞周期无明显影像(P>0.05),但可促进其凋亡(P<0.05),提示SGK3基因沉默能有效抑制乳腺癌的部分恶性生物学行为。
值得一提的是,虽然Akt在乳腺癌的作用已被广泛研究,但SGK3作为PI3K下游的独立信号分子[13-14],其在乳腺癌中的作用发挥的作用和机制目前仍不清楚,研究者们也在力求从多角度阐述SGK3与乳腺癌的关系及其作用机制[8, 15]。本课题前期研究结果表明,SGK3过表达会影响乳腺癌细胞凋亡、侵袭相关基因的表达,同时对PI3K/AKT细胞信号转导通路的某些关键因子如GSK3β等的表达产生影响,SGK3基因沉默是否会乳腺癌细胞凋亡、侵袭相关基因的表达,其抑制乳腺癌细胞生物学行为具体的信号转导机制如何,需要在后续研究工作中进一步探讨和研究。此外,SGK3与乳腺癌TNM分级、AR、Ki67等影响乳腺癌发生、发展、预后的临床病理特征是否相关; 是否可以作为乳腺癌治疗的靶点及预后标志物等问题将是今后的研究方向。
4 结论成功构建靶向人SGK3基因的RNAi慢病毒载体,筛选出高效干扰MB-474细胞SGK3基因表达的有效靶点,初步证实SGK3基因沉默可对乳腺癌细胞周期无明显影响,但可抑制其增殖,促进其凋亡。
| [1] |
Liu H, Li C, Shen C, et al. MiR-212-3p inhibits glioblastoma cell proliferation by targeting SGK3[J]. J Neurooncol, 2015, 122(3): 431-439. DOI:10.1007/s11060-015-1736-y |
| [2] |
Hou M, Lai Y, He S, et al. SGK3(CISK)may induce tumor angiogenesis(Hypothesis)[J]. Oncol Lett, 2015, 10(1): 23-26. DOI:10.3892/ol.2015.3182 |
| [3] |
Wang Y, Zhou D, Chen S. SGK3 is an androgen-inducible kinase promoting prostate cancer cell proliferation through activation of p70 S6 kinase and up-regulation of cyclin D1[J]. Mol Endocrinol, 2014, 28(6): 935-948. DOI:10.1210/me.2013-1339 |
| [4] |
Gasser JA, Inuzuka H, Lau AW, et al. SGK3 mediates INPP4B-dependent PI3K signaling in breast cancer[J]. Mol Cell, 2014, 56(4): 595-607. DOI:10.1016/j.molcel.2014.09.023 |
| [5] |
郭红艳, 孙晓杰, 刘秀财, 等. 蛋白激酶SGK3与乳腺癌临床病理相关性研究[J]. 现代预防医学, 2016, 43(6): 1142-1145. |
| [6] |
郭红艳, 孙晓杰, 刘秀财, 等. 蛋白激酶SGK3过表达对乳腺癌细胞株MDA-MB-231影响的研究[J]. 中华肿瘤防治杂志, 2016, 23(24): 1601-1606. |
| [7] |
Hausmann S, Brandt E, Köchel C, et al. Loss of serum and glucocorticoid-regulated kinase 3(SGK3)does not affect proliferation and survival of multiple myeloma cell lines[J]. PLoS One, 2015, 10(4): e0122689. DOI:10.1371/journal.pone.0122689 |
| [8] |
Bago R, Sommer E, Castel P, et al. The hVps34-SGK3 pathway alleviates sustained PI3K/Akt inhibition by stimulating mTORC1 and tumour growth[J]. EMBO J, 2016, 35(17): 1902-1922. DOI:10.15252/embj.201693929 |
| [9] |
Liu M, Chen LL, Chan TH, et al. Serum and glucocorticoid kinase 3 at 8q13. 1 promotes cell proliferation and survival in hepatocellular carcinoma[J]. Hepatology, 2012, 55(6): 1754-1765. DOI:10.1002/hep.25584 |
| [10] |
Scortegagna M, Lau E, Zhang T, et al. PDK1 and SGK3 contribute to the growth of BRAF mutant melanomas and are potential therapeutic targets[J]. Cancer Res, 2015, 75(7): 1399-1412. DOI:10.1158/0008-5472.CAN-14-2785 |
| [11] |
Xu J, Wan M, He Q, et al. SGK3 is associated with estrogen receptor expression in breast cancer[J]. Breast Cancer Res Treat, 2012, 134(2): 531-541. DOI:10.1007/s10549-012-2081-x |
| [12] |
Sun XJ, Liu XC, Liu B, et al. Serum-and glucocorticoid-regulated protein kinase 3(SGK3)overexpression promotes tumor development and aggression in breast cancer cells[J]. ONCOL LETTERS, 2016, 12: 437-444. DOI:10.3892/ol.2016.4638 |
| [13] |
Bruhn MA, Pearson RB, Hannan RD, et al. AKT-independent PI3-K signaling in cancer-emerging role for SGK3[J]. Cancer Manag Res, 2013, 5: 281-292. |
| [14] |
Bruhn MA, Pearson RB, Hannan RD, Sheppard KE. Second AKT:the rise of SGK in cancer signaling[J]. Growth Factors, 2010, 28(6): 394-408. DOI:10.3109/08977194.2010.518616 |
| [15] |
Wang Y, Zhou D, Phung S, et al. SGK3 sustains ERα signaling and drives acquired aromatase inhibitor resistance through maintaining endoplasmic reticulum homeostasis[J]. Proc Natl Acad Sci U S A, 2017, 114(8): E1500-E1508. DOI:10.1073/pnas.1612991114 |