雨生红球藻(Haematococcus pluvialis)是绿藻纲(Chlorophyceae)、团藻目(Volvocales)、红球藻科(Haematococceae)的一种单细胞绿藻。它的生活周期可分为营养细胞和厚壁孢子两个时期,环境有利时主要以绿色游动细胞的形式存在,环境不利时形成厚壁孢子并大量累积虾青素[1]。其最高虾青素含量可达到干重的5%以上[2],且所含虾青素在结构、功能、应用和安全性上优于人工合成的,被认为是天然虾青素含量最高的生物,是虾青素的最好生物来源[3]。虾青素(Astaxanthin)是一种具强抗氧化活性的红色类胡萝卜素酮化物,也是迄今为止人类发现的自然界最强的抗氧化剂,在全球市场有很大的潜力和很高的市场价值,被广泛应用于饲料、食品添加剂和营养保健品等方面[4]。
目前,雨生红球藻生产虾青素的研究趋势是采用两步培养法[5],根据雨生红球藻生长周期的特性可将虾青素的生产分为利于营养细胞生长、生物量积累的绿色营养阶段和利于虾青素积累的红色孢子阶段。与低生产成本的化学合成法相比,雨生红球藻生长速度缓慢,生产成本较高,在虾青素的批量生产上不占优势[6]。目前,国内外对雨生红球藻的研究主要集中于优化其生长和虾青素积累条件上,如光照、温度、pH、氮源、碳源等[7-11]。已有研究表明高CO2浓度能促进雨生红球藻生长和虾青素积累[12-14],因此研究雨生红球藻对高浓度CO2的生理响应具有重要的理论和实践意义。
本文主要研究了空气CO2浓度和4倍空气CO2浓度对雨生红球藻生长、色素含量、叶绿素荧光参数、碳酸酐酶(carbonic anhydrase,CA)和核酮糖-1,5-二磷酸羧化酶/加氧酶(ribulose-1,5-bisphosphate carboxylase/oxygenase,Rubisco)活性的影响,旨在了解雨生红球藻几种生理指标在不同CO2浓度下的变化规律,进一步揭示红球藻对高浓度CO2的响应机制,为雨生红球藻生产虾青素的规模化养殖和利用提供参考。
1 材料与方法 1.1 材料 1.1.1 藻种雨生红球藻由宁波大学海洋生物工程重点实验室微藻室提供。
1.1.2 培养条件以NMB3#加富的过滤除菌自然水制成基础培养基[15],培养温度为(25±1)℃、光照强度为100 μmol/(m2·s)(D:L=12 h:12 h)。实验使用CO2光照培养箱控制CO2浓度,未通入CO2时,培养箱内CO2浓度为空气CO2浓度,显示值为0.04%;通入CO2后,设置培养箱CO2浓度为0.16%,即4倍空气CO2浓度。将对数生长期的藻液接种到盛有300 mL新鲜培养基的500 mL锥形瓶中培养,接种密度大约为2×104 cells/mL,培养过程中每天在固定的时间摇瓶2次,防止细胞贴壁。
虾青素的诱导阶段:在低光强100 μmol/(m2·s)下培养8 d后,分别离心收集空气CO2浓度和4倍空气CO2浓度下培养的雨生红球藻,用去离子水洗涤2次后离心,然后重新悬浮于缺氮的NMB3#培养基中。光照强度调整为200 μmol/(m2·s)(D:L=12 h:12 h),以1.3×105 cells/mL的密度接种继续培养。
1.2 方法 1.2.1 藻细胞密度测定每天定时取3 mL藻液,于680 nm处测定其OD值。依据藻的细胞密度和OD680关系的回归方程y=7.973 3x+0.032 9(R2=0.990 1)计算雨生红球藻的细胞密度。
1.2.2 叶绿素、类胡萝卜素含量测定叶绿素和类胡萝卜素含量测定参照Cheng等[13]的方法,计算公式如下:
C叶绿素(mg/L)=4.35A663+19.34A645
C类胡萝卜素(mg/L)=4×A480
式中,A645、A663与A480,分别为波长645 nm、663 nm与480 nm时色素提取液的OD值。
1.2.3 叶绿素荧光参数测定测量前藻样品先暗适应15 min,使用Water-PAM水样叶绿素荧光仪(Walz,Germany)进行叶绿素荧光参数的测定。设定测量光强度为0.1 μmol/(m2·s),光化光强度为113 μmol/(m2·s),饱和脉冲强度为10 000 μmol/(m2·s)。叶绿素荧光参数PS Ⅱ最大光能转化效率(Fv/Fm)、实际光化学量子效率(ФPSⅡ)、光化学淬灭(qP)和非光化学淬灭(NPQ)可在叶绿素荧光仪中直接读出。
1.2.4 胞外碳酸酐酶活性测定采用pH的方法[16-17]。离心收集藻细胞,使用4℃预冷的20 mmol/L巴比妥钠缓冲液(pH 8.4)2 mL洗涤一次后,再用2 mL巴比妥缓冲液悬浮藻细胞。迅速向悬浮藻液中加入1 mL 0℃饱和CO2的蒸馏水,用pH计监测反应体系pH值的变化,记录pH下降一个单位所需的时间。
CA活性(WA)计算公式为:WA =(T0/T-1)×10
其中,T0和T分别为反应体系中未加和加入藻细胞悬浮液时pH值下降一个单位所需的时间。
1.2.5 Rubisco活性测定Rubisco的活性测定参照Jin等[18]的方法。
Rubisco活性[CO2 μmol/(g·FW·min)]=[(∆OD×Vt)/(ξ×d×∆t×Vs)×10]/2
其中,∆OD为反应前后340 nm吸光度的差,Vt为提取酶液总体积(mL),ξ为1 μmol NADH2的消光系数,d为比色杯光径(cm),∆t为测定时间(min),Vs为参加反应的酶液体积(mL),10为重量换算系数,2表示每固定1 mol CO2有2 mol NADH被氧化。
1.2.6 虾青素含量测定虾青素含量测定参照Boussiba和Vonshak[19]的方法并加以改进,按下式计算:C(mg/L)= 4.5×A490。式中:A490为波长490 nm下的OD值。
1.2.7 数据处理实验数据使用SPSS 13.0软件进行分析,以P<0.05作为显著差异水平。
2 结果 2.1 CO2浓度对雨生红球藻生长的影响在绿色营养阶段,经过2 d的延滞期后,4倍空气CO2浓度下的雨生红球藻迅速进入对数生长期,而在空气CO2浓度下的藻生长缓慢,到第10天,4倍空气CO2浓度培养藻密度约为空气CO2浓度的3.08倍(P<0.05)(图 1-A)。在红色孢子阶段,除第4天和第6天外,藻细胞密度无明显差异,藻细胞增殖速度随培养时间的延长逐渐变缓,6 d过后藻细胞几乎停止生长(图 1-B)。
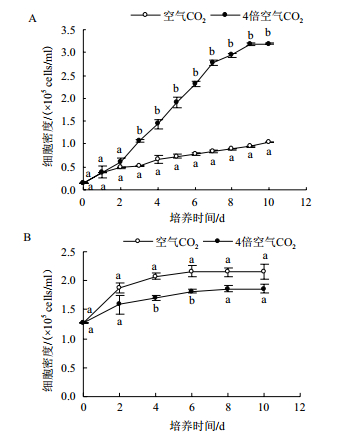
|
| 图 1 CO2浓度对雨生红球藻生长的影响 A:绿色营养阶段; B:红色孢子阶段 |
在绿色营养阶段,空气CO2浓度下藻细胞叶绿素和类胡萝卜素含量从第4天之后快速增加,而在4倍空气CO2浓度下增长幅度不大。从第4天开始,雨生红球藻在空气CO2浓度下藻细胞叶绿素和类胡萝卜素含量均显著高于4倍空气CO2浓度下的(图 2-A、2-B)。在不同CO2浓度培养条件下,雨生红球藻中类胡萝卜素/叶绿素随时间增加而不断升高,仅在第2天和第6天,低CO2浓度藻中类胡萝卜素/叶绿素高于高CO2浓度培养藻(P<0.05)(表 1)。
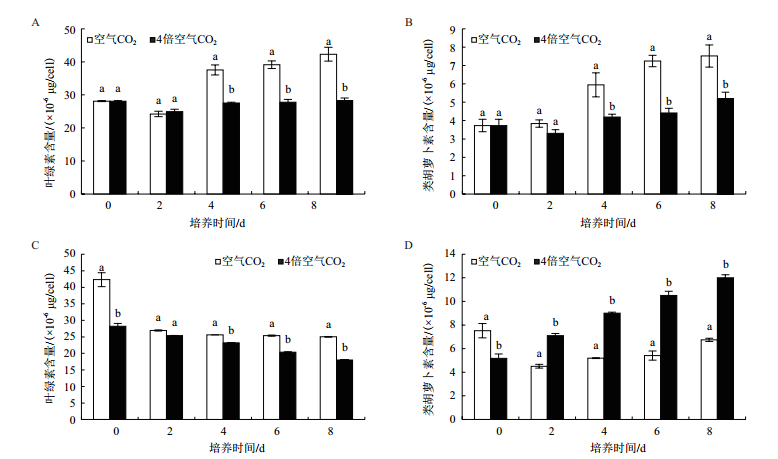
|
| 图 2 CO2浓度对雨生红球藻叶绿素和类胡萝卜素含量的影响 A、B:绿色营养阶段; C、D:红色孢子阶段 |
在红色孢子阶段,不同CO2浓度下培养雨生红球藻叶绿素含量均随培养时间增加而逐渐降低。除第2天外,4倍空气CO2浓度下藻的叶绿素含量均显著低于空气CO2浓度培养藻(图 2-C)。自第2天起,4倍空气CO2浓度下类胡萝卜素含量、类胡萝卜素与叶绿素比值增加,且显著高于低CO2浓度组(图 2-D、表 2)。在第8天,4倍空气CO2浓度下类胡萝卜素含量是空气CO2浓度类胡萝卜素含量的1.78倍,类胡萝卜素/叶绿素是空气CO2浓度的2.47倍。
如图 3所示,在绿色营养阶段,雨生红球藻的Fv/Fm、ФPSⅡ、qP随着培养时间变化而上下波动,但差别不大; NPQ在个别时间点变化较大。4倍空气CO2浓度下雨生红球藻的NPQ和大部分ФPSⅡ都高于空气CO2浓度培养藻,而Fv/Fm仅在第3天和第7天与低CO2浓度组差异显著,但qP对两种不同CO2浓度的响应无显著差异(图 3-C)。
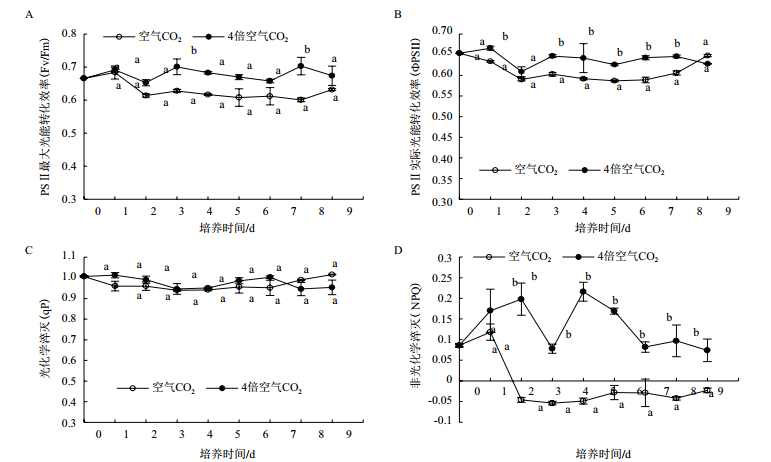
|
| 图 3 CO2浓度对绿色营养阶段雨生红球藻叶绿素荧光参数的影响 |
CO2浓度对营养阶段雨生红球藻碳酸酐酶活性的影响显著(图 4)。从第4天到第8天,空气CO2浓度下和4倍空气CO2浓度下的雨生红球藻碳酸酐酶活性都呈逐渐下降的趋势。4倍空气CO2浓度培养藻的碳酸酐酶活性约为空气CO2培养的0.55-0.75倍(P<0.05),该结果说明较高浓度CO2会抑制碳酸酐酶活性。
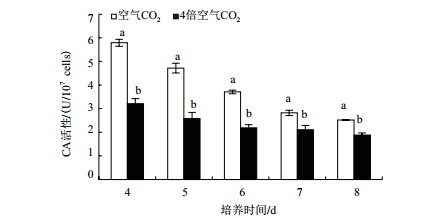
|
| 图 4 CO2浓度对绿色营养阶段雨生红球藻碳酸酐酶活性的影响 |
在绿色营养阶段,不同CO2浓度下的雨生红球藻Rubisco初始活性随着培养时间的变化呈现先略有上升然后下降的趋势。除在第6天,4倍空气CO2浓度下培养藻Rubisco初始活性显著高于空气CO2浓度下培养藻之外,其余时间点的雨生红球藻Rubisco初始活性在两种CO2浓度培养组均无显著变化(图 5-A)。在第4、5天,空气CO2浓度下雨生红球藻Rubisco总活性略大于4倍空气CO2浓度下的,而在后3 d则相反,但不同CO2浓度下红球藻的Rubisco总活性无显著差异(图 5-B)。
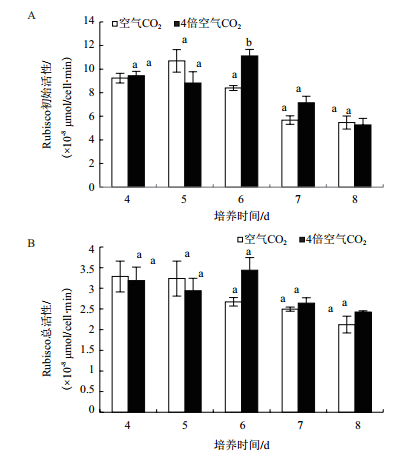
|
| 图 5 CO2浓度对绿色营养阶段雨生红球藻Rubisco活性的影响 A:绿色营养阶段,B:红色孢子阶段 |
不同CO2浓度培养雨生红球藻虾青素含量都随培养时间的延长而逐渐升高。在第8天,4倍空气CO2浓度下单个藻细胞虾青素含量达到6.35×10-6 μg,比空气CO2浓度下虾青素含量增加了20.23%(P<0.05)(图 6)。可见,在缺氮高光培养条件下,CO2浓度显著影响了雨生红球藻虾青素含量。
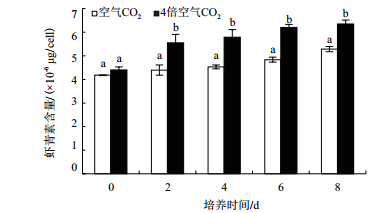
|
| 图 6 CO2浓度对红色孢子阶段雨生红球藻虾青素含量的影响 |
CO2是植物生长的重要影响因子之一。在一定范围内,提高CO2浓度可以促进藻类植物的生长,例如龙须菜、小球藻、等鞭金藻等[20-22]。适宜的高CO2浓度也能促进雨生红球藻生长,但过高CO2浓度对其生长、光合作用、碳同化无益[14]。本文研究结果表明,4倍空气CO2浓度是一个适宜的高CO2浓度,极大地促进了绿色营养期雨生红球藻细胞密度的提高; 但该CO2浓度显著抑制了红色孢子期雨生红球藻生物量积累。据报道,高浓度CO2对雨生红球藻虾青素积累也有很大的影响,如0.06%、6%、10%和20%CO2均能有效促进雨生红球藻中虾青素的积累[12-14]。本研究中4倍空气CO2(0.16%CO2)浓度,同样促进了雨生红球藻中虾青素含量的升高。
高CO2浓度会降低藻类的色素含量[23]。本实验结果表明,高CO2浓度下雨生红球藻中叶绿素和类胡萝卜素含量都显著降低,这与韦韬等[12]结论相似。本研究中,红色孢子阶段红球藻细胞叶绿素含量显著降低,类胡萝卜素大量合成,这与受到环境胁迫时,雨生红球藻可以通过积累虾青素等来保护细胞有关[24]。而类胡萝卜素与叶绿素比值越高就越适宜雨生红球藻虾青素的积累[14, 25]。高CO2浓度下类胡萝卜素/叶绿素显著增加,这说明高光缺氮胁迫与高CO2浓度共同作用能有效促进雨生红球藻虾青素合成。
Fv/Fm是PS Ⅱ最大光能转化效率,反映了藻类进行光合作用的最大潜力,同时也是反映藻类生长环境良好与否的重要指标,在非胁迫条件下该参数变化较小[26]。ФPSⅡ是实际光化学量子效率,反映PS Ⅱ反应中心在有部分关闭情况下的实际原初光能捕获率。在本研究中,绿色营养阶段4倍空气CO2浓度下雨生红球藻的Fv/Fm、ФPSⅡ多升高,说明4倍空气CO2浓度下藻细胞光能转化效率和光利用水平较高。光化学淬灭(qP)是反映PS Ⅱ天线色素吸收的光能用于光化学电子传递的份额; 而非光化学淬灭(NPQ)则表示的是PS Ⅱ天线色素吸收的光能中不用于光合电子传递而以热形式耗散的部分[27]。本研究结果中高浓度CO2促进了雨生红球藻NPQ的显著升高,而qP值与低CO2相比无显著变化。推测,在正常空气CO2水平下,雨生红球藻已经适应了这种低CO2条件,没有过多的热能耗散。而在4倍CO2下雨生红球藻受到了较高CO2胁迫,热形式耗散的能量增加,因此4倍CO2下该藻的NPQ比正常空气CO2浓度要高。但在4倍CO2条件下,该藻在热形式耗散和光合作用效率两方面达到了平衡,Fv/Fm、ФPSⅡ和NPQ都升高,最终光合效率提高,生长加快。
CA是一种负责CO2转运的酶,能够可逆地催化CO2与HCO3-之间的转化,重新固定呼吸释放的CO2并用于光合作用[28]。本实验结果显示4倍空气CO2浓度下培养藻的CA活性显著低于空气CO2浓度,这与微藻细胞内存在的二氧化碳浓缩机制(CO2 concentrating mechanism,CCM)有关,说明高浓度CO2会抑制无机碳的转运,而低浓度CO2可以通过诱导CCM机制来增强胞外CA活性,提高胞内CO2水平从而维持较高的光合固碳能力[29]。Rubisco是催化光合CO2固定和光呼吸最初步骤的关键酶,藻类中95%以上的有机碳是由Rubisco固定的,但是Rubisco对CO2的亲和力较低,且水体中可溶性CO2不足使得水体中藻类光合固碳受限[30]。CO2浓度是影响植物Rubisco活性的一个重要因素。有研究表明,CO2加富处理会显著提高黄瓜Rubisco活性[31]。然而并不是所有植物在高CO2环境中Rubisco活性都会增加,在对多种不同植物进行的研究中,Rubisco活性平均下降了24%[32]。在本研究中高CO2浓度下雨生红球藻Rubisco活性升高并不显著,这可能与高浓度CO2引起的二磷酸核酮糖(RuBP)羧化限制和RuBP再生限制有关[33]。
4 结论本研究表明相比于空气CO2浓度,4倍空气CO2浓度条件下雨生红球藻生长加快,叶绿素和类胡萝卜素含量及其比值、叶绿素荧光参数、CA活性、虾青素含量均变化显著。4倍空气CO2浓度更利于雨生红球藻生长、光合作用中光能转化效率和光利用水平的提高及虾青素的合成。
| [1] |
Hagen C, Siegmund S, Braune W. Ultrastructural and chemical changes in the cell wall of Haematococcus pluvialis(Volvocales, Chlorophyta)during aplanospore formation[J]. European Journal of Phycology, 2002, 37(2): 217-226. DOI:10.1017/S0967026202003669 |
| [2] |
Wayama M, Ota S, Matsuura H, et al. Three-dimensional ultrastructural study of oil and astaxanthin accumulation during encystment in the green alga Haematococcus pluvialis[J]. PLoS One, 2013, 8(1): 1-9. |
| [3] |
Pérez-López P, González-García S, Jeffryes C, et al. Life-cycle assessment of the production of the red antioxidant carotenoid astaxanthin by microalgae:from lab to pilot scale[J]. Journal of Cleaner Production, 2014, 64: 332-344. DOI:10.1016/j.jclepro.2013.07.011 |
| [4] |
Koller M, Muhr A, Braunegg G. Microalgae as versatile cellular factories for valued products[J]. Algal Research, 2014, 6: 52-63. DOI:10.1016/j.algal.2014.09.002 |
| [5] |
高桂玲, 成家杨, 马炯. 雨生红球藻和虾青素的研究[J]. 水产学报, 2014, 38(2): 297-304. |
| [6] |
Kang CD, Han SJ, Choi SP, et al. Fed-batch culture of astaxanthin-rich Haematococcus pluvialis by exponential nutrient feeding and stepwise light supplementation[J]. Bioprocess and Biosystems Engineering, 2010, 33(1): 133-139. DOI:10.1007/s00449-009-0362-5 |
| [7] |
Park JC, Choi SP, Hong ME, et al. Enhanced astaxanthin production from microalga, Haematococcus pluvialis by two-stage perfusion culture with stepwise light irradiation[J]. Bioprocess and Biosystems Engineering, 2014, 37(10): 2039-2047. DOI:10.1007/s00449-014-1180-y |
| [8] |
Yoo JJ, Choi SP, Kim BW, et al. Optimal design of scalable photobioreactor for phototropic culturing of Haematococcus pluvialis[J]. Bioprocess and Biosystems Engineering, 2012, 35(1-2): 309-315. DOI:10.1007/s00449-011-0616-x |
| [9] |
Hata N, Ogbonna JC, Hasegawa Y, et al. Production of astaxanthin by Haematococcus pluvialis in a sequential heterotrophic-photoautotrophic culture[J]. Journal and Applied Phycology, 2001, 13(5): 395-402. DOI:10.1023/A:1011921329568 |
| [10] |
Göksan T, İlknur Ak, Kılıç C. Growth characteristics of the alga Haematococcus pluvialis flotow as affected by nitrogen source, vitamin, light and aeration[J]. Turkish Journal of Fisheries and Aquatic Sciences, 2011, 11(3): 377-383. |
| [11] |
Jeon YC, Cho CW, Yun YS. Combined effects of light intensity and acetate concentration on the growth of unicellular microalga Haematococcus pluvialis[J]. Enzyme and Microbial Technology, 2006, 39(3): 490-495. DOI:10.1016/j.enzmictec.2005.12.021 |
| [12] |
韦韬, 顾文辉, 李健, 等. 不同碳氮浓度对雨生红球藻生长及虾青素累积的影响[J]. 海洋科学, 2012, 36(11): 55-61. |
| [13] |
Cheng J, Li K, Yang Z, et al. Enhancing the growth rate and astaxanthin yield of Haematococcus pluvialis by nuclear irradiation and high concentration of carbon dioxide stress[J]. Bioresource Technology, 2016, 204: 49-54. DOI:10.1016/j.biortech.2015.12.076 |
| [14] |
Chekanov K, Schastnaya E, Solovchenko A, et al. Effects of CO2 enrichment on primary photochemistry, growth and astaxanthin accumulation in the chlorophyte Haematococcus pluvialis[J]. Journal of Photochemistry and Photobiology, 2017, 117: 58-66. |
| [15] |
王建沅, 周成旭, 严小军, 等. 雨生红球藻在红光下的生长及营养盐消耗特征[J]. 水生生物学报, 2014, 38(6): 1135-1141. DOI:10.7541/2014.165 |
| [16] |
Wilbur KM, Anderson NG. Electrometric and colorimetric determination of carbonic anhydrase[J]. J Biol Chem, 1948, 176(1): 147-154. |
| [17] |
Moskvin OV, Razguliayeva AY, Shutova TV, et al. Carbonic anhydrase activity of different photosystem Ⅱ preparations[J]. Photosynthesis Mechanisms and Effects, 1998, 11(7): 1201-1204. |
| [18] |
Jin SH, Hong J, Li XQ, et al. Antisense inhibition of Rubisco activase increases Rubisco content and alters the proportion of Rubisco activase in stroma and thylakoids in chloroplasts of rice leaves[J]. Annals of Botany, 2006, 97(5): 739-744. DOI:10.1093/aob/mcl025 |
| [19] |
Boussiba S, Vonshak A. Astaxanthin accumulation in the green alga Haematococcus pluvialis[J]. Plant and Cell Physiology, 1991, 32(7): 1077-1082. DOI:10.1093/oxfordjournals.pcp.a078171 |
| [20] |
Chen BB, Zou DH, Zhu MJ, et al. Effects of CO2 levels and light intensities on growth and amino acid contents in red seaweed Gracilaria lemaneiformis[J]. Aquaculture Research, 2017, 48(6): 1-8. |
| [21] |
Cheng J, Lu HX, Huang Y, et al. Enhancing growth rate and lipid yield of Chlorella with nuclear irradiation under high salt and CO2 stress[J]. Bioresource Technology, 2016, 203: 220-227. DOI:10.1016/j.biortech.2015.12.032 |
| [22] |
Sun YY, Wang CH. The optimal growth conditions for the biomass production of Isochrysis galbana and the effects that phosphorus, Zn2+, CO2, and light intensity have on the biochemical composition of Isochrysis galbana and the activity of extracellular CA[J]. Biotechnology and Bioprocess Engineering, 2009, 14(2): 225-231. DOI:10.1007/s12257-008-0013-8 |
| [23] |
包楠欧, 史定刚, 关万春, 等. CO2及光强对南麂列岛铜藻生长的影响[J]. 浙江农业学报, 2014, 26(3): 649-655. |
| [24] |
Shah MR, Liang Y, Cheng JJ, et al. Astaxanthin-producing green microalga Haematococcus pluvialis:from single cell to high value commercial products[J]. Frontiers in Plant Science, 2016, 7: 531. |
| [25] |
陶云莹, 王巧晗, 赫勇, 等. 光照强度和温度对雨生红球藻生长、虾青素及内源脱落酸积累的影响[J]. 中国海洋大学学报, 2016, 46(7): 54-62. |
| [26] |
梁英, 冯力霞, 尹翠玲, 等. 叶绿素荧光技术在微藻环境胁迫研究中的应用现状及前景[J]. 海洋科学, 2007, 31(1): 71-76. |
| [27] |
Snel JFH, Kooten OV. The use of chlorophyll fluorescence and other non-invasive spectroscopic techniques in plant stress physiology[J]. Photosynthesis Research, 1990, 25: 147-150. DOI:10.1007/BF00033156 |
| [28] |
Badger MR, Price GD. The role of carbonic anhydrase in photosynthesis[J]. Annual Review of Plant Biology, 2003, 45(1): 369-392. |
| [29] |
Bozzo GG, Colman B, Matsuda Y. Active transport of CO2 and bicarbonate is induced in response to external CO2 concentration in the green alga Chlorella kessleri[J]. J Exp Bot, 2000, 51(349): 1341-1348. |
| [30] |
黄瑾, 夏建荣, 邹定辉. 微藻碳酸酐酶的特性及其环境调控[J]. 植物生理学通讯, 2010, 46(7): 631-636. |
| [31] |
潘璐, 刘杰才, 李晓静, 等. 高温和加富CO2温室中黄瓜Rubisco活化酶与光合作用的关系[J]. 园艺学报, 2014, 41(8): 1591-1600. |
| [32] |
Drake BG, Azc6n-Bieto J, Berry JA, et al. Does elevated CO2 inhibit plant mitochondrial respiration in green plants[J]. Plant, Cell and Environment, 1999, 22(6): 649-657. DOI:10.1046/j.1365-3040.1999.00438.x |
| [33] |
张道允, 许大全. 植物光合作用对CO2浓度增高的适应机制[J]. 植物生理与分子生物学学报, 2007, 33(6): 463-470. |






