2. 新疆中亚食品研发中心(有限公司),乌鲁木齐 830001
2. Xinjiang Central Asia Food Research and Development Centre, Urumchi 830001
发酵辣椒(又称剁辣椒)是我国的传统食物,主要利用乳酸菌的自然发酵和高浓度食盐的保存作用进行加工。工业发酵辣椒常在辣椒中加入约20%食盐进行盐醅发酵来保持辣椒的色泽、辣味和抑制发酵过程中杂菌的生长,但是也造成了亚硝酸盐含量过高[1],抑制乳酸菌等益生菌生长[2]等副作用。目前发酵辣椒经常通过调节食盐的用量,控制发酵时间,调节初始pH值,使用纯种乳酸菌发酵等方法来改善发酵辣椒的质量[3]。其中选育优质乳酸菌对辣椒发酵有着十分重要的作用,王雪雅等[4]通过纯种发酵研究表明,发酵乳杆菌和食果糖乳杆菌是辣椒发酵过程中综合品质较好的发酵优良菌株。邓放明等[5]发现Lact.chili6和Lact.chili8在低盐发酵过程中有着良好的优势。发酵乳杆菌、植物乳杆菌、嗜酸乳杆菌等应用于辣椒发酵的研究较多[1]。所以研究具有良好特性的乳酸菌及其在果蔬发酵中的应用十分的必要。
产马乳酒乳杆菌(Lactobacillus kefiranofaciens)属于厚壁菌门(Firmicutes),芽胞杆菌纲(Bacilli),乳杆菌目(Lactococcus),乳杆菌科(Lactobacillaceae),乳杆菌属(Lactobacillus),是一类革兰氏阳性、兼性厌氧、同型发酵的杆状乳酸菌,最初分离于开菲尔粒中,是开菲尔粒中的主要微生物[6]。目前含有Lactobacillus kefiranofaciens subsp. kefiranofaciens和Lactobacillus kefiranofaciens subsp. kefirgranum两个亚种[7]。
产马乳酒乳杆菌作为益生菌具有治疗疾病、调节体内免疫水平的功能。具有抗结肠炎的功能、调节肠道功能紊乱[8]、有效的抑制EHEC感染[9]、缓解哮喘症状等功能[10]。产马乳酒乳杆菌具有非常好的益生素活性,能够很好的吸附在肠道快速繁殖,产生益菌素,调节肠道微生物的菌群,是未来功能食品的重要选择[11]。但是目前产马乳酒乳杆菌主要应用于乳制品发酵,国内外关于产马乳酒乳杆菌做为果蔬发酵菌株研究的报道较少。本研究主要对CICC 6287进行鉴定和生物学特性研究,并将该菌株用于新疆特色辣椒发酵,评估CICC 6287的发酵生物学特性对辣椒发酵的影响。
1 材料与方法 1.1 材料 1.1.1 实验菌株与培养条件菌株CICC 6287分离于新疆特色乳制品样品,保藏于中国工业微生物菌种保藏管理中心。菌株CICC 6287在MRS培养基37℃培养48 h。
用于抑菌试验的菌种大肠杆菌(Escherichia coli)O157:H7 CICC 10907,肠沙门氏菌(Salmonella enteric)CICC 10871,金黄色葡萄球菌(Staphylococcus aureus)CICC 10790和单增李斯特菌(Listeria monocytogenes)CICC 21635均来自中国工业微生物菌种保藏管理中心。
1.1.2 实验试剂及设备MRS培养基、胰蛋白胨大豆肉汤(TSB)、胰蛋白胨大豆琼脂(TSA)、革兰氏染色试剂盒均购自北京陆桥技术有限公司;API试剂条购于生物梅里埃公司;细菌基因组DNA提取试剂盒购于OMEGA公司;GoldView购自北京赛百盛基因技术有限公司;溶菌酶购自Sigma公司;蛋白酶购自Merk公司;Taq DNA聚合酶、dNTP、DL2000 marker购自北京天根生物有限公司。
pH计FE20购于梅特勒-托利多仪器(上海)有限公司;紫外分光光度计7200购于尤尼科(上海)仪器有限公司;温度梯度PCR仪购于Biometra公司;恒温培养箱BHG-8082型购于上海一恒科学仪器有限公司。
1.2 方法 1.2.1 菌株CICC 6287多相分类学鉴定利用细菌基因组DNA提取试剂盒提取菌株CICC 6287基因组DNA,用0.8%的琼脂糖凝胶电泳进行检测。以基因组DNA为模板,利用通用引物27F和1492R对该菌株的16S rRNA基因进行PCR扩增。PCR扩增反应体系按照PCR Mixture使用说明进行配制(Tiangen公司)。反应程序为:94℃预变性2 min,94℃变性30 s,55℃复性30 s,72℃延伸1 min 30 s,30个循环后72℃延伸10 min。扩增产物用0.8%的琼脂糖进行检测后,送至北京诺赛基因组研究中心有限公司进行测序。使用ContigExpress软件对测序结果进行分析,将分析后结果递交到EzBioCloud和NCBI数据库进行比对分析,确定菌株CICC 6287与已知菌株的同源关系。采用MEGA 4软件中的Clustal功能对菌株CICC 6287与近缘种菌株的16S rRNA基因和pheS基因进行多序列比对,并使用Neighbour-Joining法进行系统发育及分子进化分析[12]。
菌株CICC 6287接种到MRS培养基上,37℃培养48 h后,观察菌落形态特征。收集新鲜菌体,加入2.5%戊二醛4℃固定过夜。离心收集菌体,100 mmoL/L磷酸盐缓冲液(pH 7.2)漂洗3次。50%,70%,85%,95%乙醇梯度脱水后100%乙醇脱水3次。脱水后使用仪器BAL-TEC CPD030进行二氧化碳临界点干燥。喷金-离子溅射仪BAL-TEC SCD005进行喷金后,使用扫描电镜Hitachi SU8010进行菌体形态观察。使用API 50 CH鉴定系统对菌株CICC 6287底物利用特征进行测定[13]。
1.2.2 菌种CICC 6287生物学特性研究挑取新鲜培养的单菌落接种到4 mL MRS液体培养基中,37℃静置培养18 h后作为接种种子液。
生长及产酸能力测定:将种子液按1%接种量接种于200 mL MRS液体培养基中培养,以不接种培养基作为对照,每隔2 h取样测定测定600 nm下吸光值(OD600),同时测定发酵液的pH值[14]。
耐盐耐酸特性测定:将种子液按1%接种量接入分别含2 g/L、4 g/L、6 g/L、8 g/L和10 g/L NaCl以及入pH 2、3、4、5、6和7的MRS液体培养基中,37℃静置培养48 h,测定600 nm下吸光值(OD600),并记录结果[15]。
亚硝酸盐降解能力测定:将种子液按1%接种量接种于含125 μg/mL NaNO2的200 mL MRS液体培养基中37℃培养,每隔24 h定时取样测定NaNO2含量。参考GB/T 5009.33-2003中的盐酸萘乙二胺法进行测定,不接种的MRS培养基(含125 μg/mL NaNO2)作为空白对照[16]。
氨基酸脱羧酶试验:挑取新鲜培养的单菌落于3 mL无菌生理盐水中研磨,制备成0.5 McFarland悬液,分别滴入氨基酸脱羧酶试验的安培瓶中,每瓶三滴,并加无菌液体石蜡覆盖培养基表面,培养24 h后,观察试验管与对照管颜色变化,试验管为紫色,对照管为黄色,结果为阳性;试验管与对照管均为黄色,结果为阴性。
抑菌试验:采用滤纸片法测定目标菌株的抑菌性能。挑取新鲜培养的指示菌株大肠杆菌O157:H7(Escherichia coli,CICC 10907),肠沙门氏菌(Salmonella enteric,CICC 10871),金黄色葡萄球菌(Staphylococcus aureus,CICC 10790)和单增李斯特菌(Listeria monocytogenes,CICC 21635),将菌悬液浓度调至0.5麦氏浊度并均匀涂布在TSA培养基上,然后将滤纸片浸泡在200 μL培养48 h的菌株CICC 6287发酵液中,置于上述培养基中,37℃培养箱中培养48 h,记录结果[17]。
1.2.3 发酵辣椒特性测定将新疆辣椒清洗干净打浆破碎后,将种子液按1%接种量接种于破碎辣椒中,同时加入3%糖和3%盐,以不接乳酸菌的自然发酵辣椒为对照组,30℃恒温连续发酵7 d。每天取样测定发酵辣椒的pH值。按照GB/T 12456-2008:《食品中总酸的测定》中酸碱滴定法测定发酵辣椒的总酸含量[18]。使用HPLC法测定有机酸的种类和含量。按照GB 5009.33-2010:《食品中亚硝酸盐与硝酸盐的测定》测定发酵辣椒的亚硝酸盐含量[19]。按照GB/T 5009.208-2008:《食品中生物胺含量的测定》使用HPLC法对发酵7 d的辣椒中生物胺的种类和含量进行测定[20]。
2 结果 2.1 菌种CICC 6287的形态学特征从新疆特色乳制品中分离得到一株细菌,在MRS琼脂培养基上37℃培养48 h,菌落为乳白色,圆形,光滑,湿润,不透明,边缘不整齐。菌体呈杆状,大小为(0.5-0.6)μm ×(1.6-5.1)μm,单个或成对排列,革兰氏阳性,表现为典型的乳杆菌菌落特征。电镜照片见图 1,保藏于中国工业微生物菌种保藏中心,菌株编号为CICC 6287。

|
| 图 1 菌株CICC 6287扫描电镜图 |
为了解菌种CICC 6287的生长特征和作为辣椒发酵菌株的生物学特性,测定CICC 6287的生长曲线和不同生长时间的产酸能力。从图 2-A中看出,菌株CICC 6287培养8 h开始进入对数期,培养36 h进入稳定期。在对数期产酸速度较快,培养28 h pH值就降到4。表明产酸速率和生长速率成正比。进入稳定期后两者都相对保持稳定。可能是较低的pH值抑制了CICC 6287的生长,使其较早的进入稳定期。通过测定菌株对酸和盐的耐受性,结果表明,CICC 6287生长最适pH值为6。随着pH值降低,菌株CICC 6287生长受到明显的抑制(图 2-B)。菌株CICC 6287对NaCl耐受范围为0-80 g/L,随着NaCl浓度的升高,乳酸菌的生长受到明显的抑制,在含80 g/L NaCl培养基中最终生长的OD600能够达到0.4(图 2-B)。

|
| 图 2 菌株CICC 6294生长和产酸特性(A)及耐酸和耐盐性(B) |
亚硝酸盐降解能力测定试验结果(表 1)表明,CICC 6287随着培养时间的延长,菌株降解的亚硝酸盐越多。培养24 h后,菌株CICC 6287的亚硝酸盐降解率可达到94.8%;培养36 h后,可达到100%。通过测定氨基酸脱羧酶的活性研究CICC 6287试验结果表明,CICC 6287四种脱羧酶活性为阴性,表明菌株CICC 6287对游离氨基酸的脱羧酶活性弱,能够较少的产生生物胺,减少发酵食品中的生物胺危害。抑菌试验结果(表 2)表明,菌株CICC 6287对致病菌肠炎沙门氏菌、大肠杆菌、金黄色葡萄球菌抑、单增李斯特菌都有抑制作用。
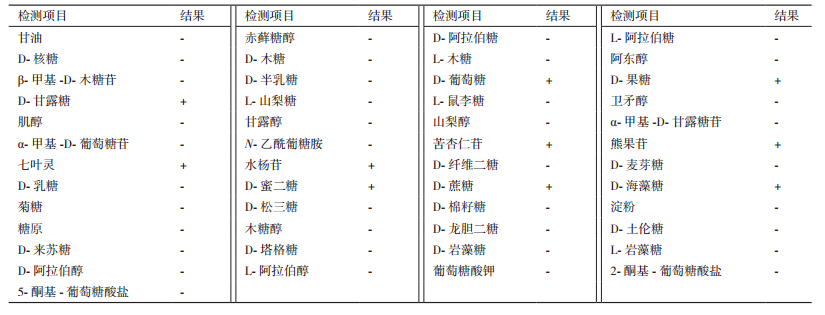
通过扩增菌株16S rRNA基因序列并经过序列比对,确定与Lactobacillus kefiranofaciens的两个亚种Lactobacillus kefiranofaciens subsp. kefiranofaciens LMG 19149T和Lactobacillus kefiranofaciens subsp. kefirgranum DSM 10550T的同源性最高。与其他菌株的同源率都低于98.65%,因此将该细菌鉴定为定为产马乳酒乳杆菌(Lactobacillus kefiranofaciens)(图 3),其16S rRNA基因序列登录号为KY694991。利用API 50 CH测定其对碳源的利用,CICC 6287可以利用D-葡萄糖、D-甘露糖、D-果糖等产酸(表 3)。

|
| 图 3 菌株CICC 6287 16S rRNA基因系统发育树 采用MEGA5.0软件,邻位连接法显示菌株与相关模式种系统发育树,进行1000次的相似度重复计算,图中发育树节点只显示Bootstrap值大于50%数值,上标的“T”表示模式菌株 |
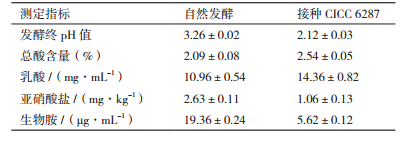
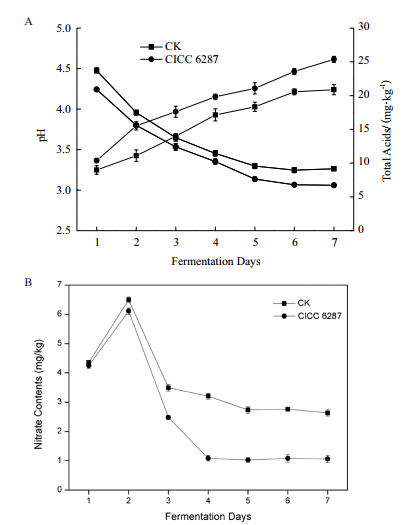
将CICC 6287作为辣椒发酵的菌种,测定其对辣椒发酵过程的影响。辣椒发酵试验结果(图 4)表明,随着发酵时间的增加,发酵辣椒的pH值不断下降,发酵7 d后,pH值不再明显下降,接种CICC 6287的辣椒最终pH值为3.03。自然发酵辣椒的最终pH值在3.26,明显低于自然发酵。总酸含量和pH值测定结果相一致,自然发酵辣椒的总酸含量仅为20.9 g/kg,接种菌株CICC 6287的发酵辣椒最终的酸含量能够达到25.4 g/kg。接种菌株CICC 6287的发酵辣椒高于自然发酵的乳酸含量(表 4),表明CICC 6287在辣椒发酵过程中对于酸的含量有重要作用。
|
| 图 4 发酵辣椒性能测定(A):pH和总酸(B)亚硝酸盐含量 |
辣椒发酵过程中,亚硝酸盐的含量呈现先增加后减少的趋势,发酵第2天亚硝酸盐的含量达到峰值,含量在5.7-6.5 mg/kg。最终入菌株CICC 6287的辣椒中亚硝酸的含量仅为1.06 mg/kg,远低于自然发酵中亚硝酸盐含量(2.63 mg/kg)。
生物胺测定结果表明,发酵辣椒中的生物胺主要为腐胺。腐胺是由鸟氨酸脱羧酶生成,接入菌株CICC 6287能够显著的降低发酵辣椒中腐胺的含量,腐胺的含量仅为5.62 μg/mL,远低于自然发酵辣椒的19.36 μg/mL,这表明菌株CICC 6287的接入能很大程度的提高发酵辣椒的安全性。
3 讨论CICC 6287作为发酵菌株,在辣椒发酵过程中有优于其它菌株的发酵特性。根据不同乳酸菌菌株发酵特性测定的报道,在菌株对食盐耐受能力方面,CICC 6287远远高于瑞士乳杆菌、植物乳杆菌等菌株[2]。在产酸能力和发酵辣椒的总酸含量方面,其产酸性能优于戊糖乳杆菌、德氏乳杆菌保加利亚亚种等菌种。在降解亚硝酸盐方面,CICC 6287的降解亚硝酸盐能力强于乳酸片球菌等菌种[4]。CICC 6287的发酵特性优于先前报道的菌株,是提高辣椒发酵综合品质的优良菌种。在后期可应用于工业化辣椒生产,提高了辣椒发酵的品质和市场竞争力。
食用安全性是目前发酵食品关注的重要问题,其中亚硝酸盐和生物胺是影响发酵果蔬安全性的重要指标。摄取过量的亚硝酸盐会引起癌变、抵抗甲状腺素和智障等危害。生物胺会导致肾上腺素和胃酸过量分泌、心跳加快、血糖含量增加或血压升高等症状[21]。亚硝酸盐和生物胺同时存在有可能生成亚硝酸铵,从而引发肝癌的可能性[22]。本研究结果表明,菌株CICC 6287具有较强的亚硝酸盐降解能力,接种该菌株的辣椒在发酵过程中表现为发酵初期亚硝酸盐含量升高,后期亚硝酸盐含量迅速降低。因为亚硝酸盐降解分为酶降解和酸降解两部分,在发酵初期较高pH的情况下主要进行酶降解。在发酵后期,pH降低到一定程度的情况下酸降解占主要部分[23]。所以在发酵初期微生物的数量较少,亚硝酸含量初步升高,随着后期乳杆菌生物量的增大,产酸能力的增强,亚硝酸含量降解速度变快。接种菌株CICC 6287的辣椒发酵生物胺含量显著降低。生物胺含量的降低,一方面与氨基酸脱羧酶活性相关,菌株CICC 6287多种氨基酸脱羧酶活性呈阴性,产生生物胺的能力降低;另一方面与乳杆菌中的SufI蛋白相关,据报道该蛋白能够降解生物胺[24]。对于菌株CICC 6287降解生物胺的机理在今后的工作中可以进一步研究。
此外,菌株CICC 6287的生长和产酸特性也是其作为果蔬发酵菌种的重要条件。研究表明,接种菌株CICC 6287的发酵辣椒产酸速率快,乳酸含量相对较高,这与菌株CICC 6287生物学特性一致,CICC 6287前期生长速度快,产酸速度快,发酵前期成为辣椒发酵过程中的优势菌种,在发酵后期由于乳酸的积累抑制乳酸菌的生长,使发酵辣椒的pH保持在稳定的水平[25],其中乳酸对发酵食品的风味具有重要作用[26]。在发酵辣椒生产过程中,可通过调节乳酸钙的含量调控辣椒中乳酸的含量[27]。
4 结论通过对新疆特色乳制品中的菌株进行分离筛选,得到一株发酵生物性能较好的菌株CICC 6287。经鉴定为产马乳酒乳杆菌,该菌种具有生长速度快、产酸效率高、盐耐受力强、降解亚硝酸盐等良好的发酵生物学特性。把菌株应用到辣椒发酵过程中,提高了发酵辣椒的酸度,降低了发酵辣椒中的亚硝酸盐、生物胺的含量。CICC 6287是未来果蔬发酵菌株的重要选择。
| [1] |
欧阳晶, 陶湘林, 李梓铭, 等. 高盐辣椒发酵过程中主要成分及风味的变化[J]. 食品科学, 2014, 35(4): 174-178. DOI:10.7506/spkx1002-6630-201404036 |
| [2] |
刘嘉, 蒋芳芳, 范琳, 等. 辣椒素对辣椒发酵中乳酸菌的影响[J]. 食品科学, 2012, 33(3): 190-193. DOI:10.7506/spkx1002-6630-201703039 |
| [3] |
杨海燕, 沙漠, 于蒙, 等. 乳酸菌纯种发酵辣椒酱工艺研究[J]. 中国食品工业, 2011(9): 55-57. |
| [4] |
王雪雅, 吴华丽, 丁筑红, 等. 纯种乳酸菌接种发酵辣椒综合品质特性研究[J]. 中国酿造, 2016, 35(9): 119-124. DOI:10.11882/j.issn.0254-5071.2016.09.027 |
| [5] |
邓放明, 李罗明, 尹华, 等. 碎鲜辣椒发酵制品发酵用乳酸菌的选育与接种发酵试验[J]. 食品科学, 2005, 26(3): 106-109. |
| [6] |
Whiteman WB. Bergey's Manual of Systematic Bacteriology Volume 3[M]. 2nd ed. New York: Springer, 2010.
|
| [7] |
李学明. 氧对马奶酒样乳杆菌ZW3代谢以及生物化学特性的影响[D]. 天津: 天津科技大学, 2014. http://d.g.wanfangdata.com.cn/Thesis_Y2755228.aspx
|
| [8] |
Chen YP, Hsiao PJ, Hong WS, et al. Lactobacillus kefiranofaciens M1 isolated from milk kefir grains ameliorates experimental colitis in vitro and in vivo[J]. J Dairy Sci, 2012, 95(1): 63-74. DOI:10.3168/jds.2011-4696 |
| [9] |
Chen YP, Lee TY, Hong WS, et al. Effects of Lactobacillus kefiranofaciens M1 isolated from kefir grains on enterohemorrhagic Escherichia coli infection using mouse and intestinal cell models[J]. J Dairy Sci, 2013, 96(12): 7467-7477. DOI:10.3168/jds.2013-7015 |
| [10] |
Hong WS, et al. Effect of heat-inactivated kefir-isolated Lactobaci-llus kefiranofaciens M1 on preventing an allergic airway response in mice[J]. J Agric Food Chem, 2011, 59(16): 9022-9031. DOI:10.1021/jf201913x |
| [11] |
Xing Z, et al. In vitro and in vivo evaluation of the probiotic attribu-tes of Lactobacillus kefiranofaciens XL10 isolated from Tibetan kefir grain[J]. Appl Microbiol Biotechnol, 2017, 101(6): 1-11. |
| [12] |
Tamura K, Dudley J, Nei M, et al. MEGA4:Molecular Evolution-ary Genetics Analysis(MEGA)software version 4.0[J]. Mol-ecular Biology and Evolution, 2007, 24(8): 1596-1599. DOI:10.1093/molbev/msm092 |
| [13] |
Ozgun D, Vural HC. Identification of Lactobacillus strains isolated from faecal specimens of babies and human milk colostrum by API 50 CHL system[J]. Journal of Medical Genetics and Genomics, 2011, 3(3): 46-49. |
| [14] |
胡书芳, 王雁萍, 洪爱俊, 等. 自然发酵酸菜中乳酸菌的分离鉴定及其生理特性研究[J]. 安徽农业科学, 2009, 37(15): 6896-6898. DOI:10.3969/j.issn.0517-6611.2009.15.035 |
| [15] |
Beganovic J, Kos B, Lebos PA, et al. Traditionally produced sauer-kraut as source of autochthonous functional starter cultures[J]. Microbiol Res, 2014, 169(7-8): 623-632. DOI:10.1016/j.micres.2013.09.015 |
| [16] |
高书锋, 陈丁贺, 莫许. 亚硝酸盐降解菌的分离鉴定及其降解特性[J]. 环境科学与技术, 2011, 34(S2): 37-41. |
| [17] |
于娜. 具有抑菌作用乳杆菌的筛选及其抑菌物质特性的研究[D]. 呼和浩特: 内蒙古农业大学, 2011. http://cdmd.cnki.com.cn/Article/CDMD-10129-1011178313.htm
|
| [18] |
龚玲娣, 徐清渠. GB/T 12456-2008食品中总酸的测定[S]. 北京: 中国标准出版社, 2008.
|
| [19] |
GB 5009. 33-2010食品中亚硝酸盐与硝酸盐的测定[S]. 北京: 中国标准出版社, 2010.
|
| [20] |
吴永宁, 赵云峰, 李志军, 等. GB/T 5009. 208-2008食品中生物胺含量的测定[S]. 北京: 中国标准出版社, 2008.
|
| [21] |
Argyri A, Zoumpopoulou G, Karatzas KA, et al. Selection of potential probiotic lactic acid bacteria from fermented olives by in vitro tests[J]. Food Microbiology, 2013, 33(2): 282-291. DOI:10.1016/j.fm.2012.10.005 |
| [22] |
李超, 董明盛. 一种改进的产生物胺乳酸菌的检测方法[J]. 食品科学, 2005, 26(6): 193-196. |
| [23] |
李泽丽. 应用植物乳杆菌降解亚硝酸盐的研究[D]. 上海: 上海师范大学, 2015. http://cdmd.cnki.com.cn/Article/CDMD-10270-1015372045.htm
|
| [24] |
佟婷婷. 四川泡菜细菌多样性分析及降生物胺菌株筛选[D]. 无锡: 江南大学, 2015. http://cdmd.cnki.com.cn/Article/CDMD-10295-1015431265.htm
|
| [25] |
闫征, 王昌禄, 顾晓波. pH值对乳酸菌生长和乳酸产量的影响[J]. 食品与发酵工业, 2003, 29(6): 35-38. |
| [26] |
陈俊亮, 田芬, 霍贵成, 等. 乳酸乳球菌对切达干酪成熟过程中质构和风味的影响[J]. 食品科学, 2013, 21: 163-167. |
| [27] |
姜爱丽, 胡文忠, 陈晨, 等. 乳酸钙处理对乳酸发酵型辣椒品质的影响[J]. 食品与发酵工业, 2014, 40(1): 80-84. |