2. 中国农业科学院植物保护研究所,北京 100193;
3. 宝鸡市农业科学院,宝鸡 722400
2. Institute of Plant Protection, Chinese Academy of Agricultural Sciences, Beijing 100193;
3. Baoji Academy of Agricultural Sciences, Baoji 722400
葡萄霜霉病是一种世界性的主要葡萄病害,是由专性活体营养寄生卵菌Plasmopara viticola造成的[1]。在过去的20年中,普遍使用铜化合物和化学农药来防治葡萄霜霉病,这导致了重金属积累和农药残留问题[2]。为解决这一问题,铜杀菌剂和化学农药在有机农业中的使用限制越来越严格。近年来,研究人员大力替代产品,以减少或消除葡萄生产中的铜基配方和化学农药的使用[1]。一些研究已经发现的天然化合物,表明在葡萄霜霉病防治方面有较好的效果,如蛋白水解物[3]、壳聚糖[4]、海带多糖[5]、微生物[6]。
解淀粉芽孢杆菌(Bacillus amyloliquefaciens)是可用于生物防治的重要生防菌之一。其作用机理主要包括分泌抗菌物质、产生拮抗作用、营养与空间的竞争及诱导寄主产生抗性和促进植物生长等[7]。解淀粉芽孢杆菌分泌的抗菌物质主要是低分子量的抗生素以及抗菌蛋白或多肽等活性物质[8]。解淀粉芽孢杆菌菌株合成的几丁质酶[9]、抗真菌肽[10-11],已经被证明是有效的抑菌蛋白,对葡萄病害有明显的防控效果。从葡萄木质组织中分离到的内生解淀粉芽孢杆菌AG1,已被证明是有效的真菌生物防治剂[12]。在对抗菌蛋白的鉴定中,蛋白质组学得到了广泛的应用。蛋白质组学是分离蛋白质复合物,研究蛋白功能的一个有力的工具,成为功能基因组学策略的重要组成部分[13]。在前期的研究中,本实验室筛选到一株解淀粉芽孢杆菌,其发酵菌液对葡萄霜霉病有抑制作用。为研究其发酵液蛋白组成,本研究采用蛋白质谱方法对筛选到的解淀粉芽孢杆菌在NA液体培养基中培养时分泌到培养基中的分泌蛋白进行鉴定,并对鉴定到的蛋白采用蛋白质组学的方法进行分析,以期发现该菌株分泌的与生物防治相关的蛋白。
1 材料与方法 1.1 材料葡萄霜霉病拮抗解淀粉芽孢杆菌N22由衡水学院微生物学实验室从葡萄叶片表面分离并保存。
1.2 方法 1.2.1 解淀粉芽孢杆菌的发酵培养将培养好的斜面解淀粉芽孢杆菌N22接入NA液体培养基中,28℃、150 r/min振荡培养72 h得发酵液后备用。NA液体培养基配方:10 g胰蛋白胨,3 g牛肉浸膏,5 g氯化钠,1 000 mL蒸馏水,1×105 Pa,121℃灭菌15 min。
1.2.2 细菌培养液的SDS-PAGE将解淀粉芽孢杆菌N22发酵液,12 000 r/min离心5 min,取上清液。1 mL上清液加入100 μL三氯乙酸(浓度为100%),-20℃放置30 min,12 000 r/min离心10 min,弃上清,加入1 mL 4℃预冷的丙酮,混匀离心,洗涤2次,干燥后加入一定量的0.1 mol/L NaOH溶解沉淀。处理好的样品采用SDS-PAGE确认蛋白纯度和大小。分离胶浓度为12%,浓缩胶浓度为5%,以低分子量标准蛋白为标准蛋白,SDS-聚丙烯酰胺凝胶凝胶电泳方法参照《蛋白质技术手册》[14]进行。
1.2.3 蛋白质谱鉴定样品的处理切下需要分析的胶点,放入干净的1.5 mL离心管中,编号。在每个离心管内加入1 mL水,清洗10 min,将水移除,重复一次。在每个离心管中加入1 mL胶内消化脱色液,清洗10 min,将脱色液移除,重复一次。胶内消化脱色液的配置:50%乙腈,25 mmol/L碳酸氢铵。加入乙腈脱水至胶粒完全变白,真空抽干乙腈。加10 mmol/L DTT,让胶粒吸收完全,放入56℃水浴锅内,孵育1 h。孵育完毕后,移除多余DTT液体,加入55 mmol/L IAM,暗室室温孵育45 min。孵育完毕后,移除多余IAM液体,加入25 mmol/L碳酸氢铵,清洗10 min,并重复清洗一次。移除碳酸氢铵,加入脱色液清洗10 min,并重复一次。乙腈脱水至胶粒完全变白,真空抽干乙腈。1 μg/μL的酶储液以25 mmol/L碳酸氢铵稀释15倍,加入脱水后的胶粒中,让胶粒充分吸收。然后加入25 mmol/L碳酸氢铵没过胶粒,37℃水浴锅消化过夜。加入终浓度0.1%的FA终止消化。取10 μL样品上机,质谱仪检测。
2 结果 2.1 分泌蛋白的提取和鉴定 2.1.1 分泌蛋白的SDS-PAGE本研究将解淀粉芽孢杆菌的培养液去菌体,浓缩后上样,进行SDS-PAGE电泳,结果如图 1所示。通过电泳结果可见,解淀粉芽孢杆菌在NA液体培养基中可分泌多种蛋白质,分泌蛋白量最大的部分集中在相对分子量35-40 kD之间。
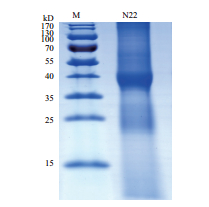
|
| 图 1 解淀粉芽孢杆菌分泌蛋白质的SDS-PAGE电泳图 |
如图 2所示,斜线阴影区域部分是显著性阈值。得分超过此区域的结果,为Mascot指认的阳性结果。得分以-log10(P)计算,P为概率。本研究中结果显示肽段得分>22的为鉴定蛋白可信(P<0.05)。
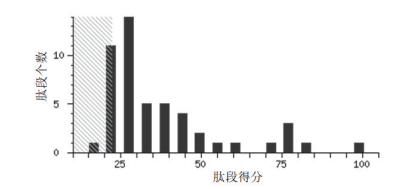
|
| 图 2 蛋白质谱中肽段得分分布 |
本研究中的解淀粉芽孢杆菌的发酵液中共可以鉴定到53个蛋白(表 1)。其中酶类共有22个,占41.51%,这22种酶类中有转移酶类5个,占蛋白总数的9.43%;氧化还原酶类7个,占蛋白总数的13.21%;水解酶类10个,占蛋白总数的18.87%。除酶类外结合蛋白共有18个,占蛋白总数的33.96%;功能蛋白13个,占蛋白总数的24.53%。
对鉴定到的53个蛋白的相对分子量进行统计分析,结果(图 3)表明,53个蛋白的相对分子量最小的为8.75 kD(G2TRL2:Histone-fold domain-containing protein new1),最大的为373.99 kD(Q756G2:Probable E3 ubiquitin-protein ligase TOM1)。共42个蛋白的相对分子量分布在0-100 kD之间,10个分布在100-200 kD之间,1个>300 kD。
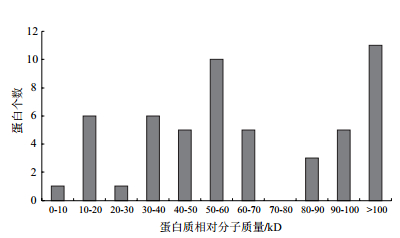
|
| 图 3 分泌蛋白的相对分子量分布 |
通过对鉴定到的53个蛋白的基本功能进行统计分析(表 2)发现,除10个结构蛋白外,其他43个蛋白分别与解淀粉芽孢杆菌的多个生理生化过程有关。其中最多的是碳水化合物代谢相关蛋白,为10个,占19%;其他如能量代谢、蛋白质代谢、核酸代谢、脂类代谢以及其他代谢涉及蛋白共18个。参与信号传递和物质运输的蛋白分别为6个和5个。防御蛋白一个,占2%。
为研究所鉴定的分泌蛋白的在解淀粉芽孢杆菌中行使的具体功能,对鉴定到的53个蛋白进行了基因本体论分析(GO分析)。结果(图 4)表明本研究中鉴定到的53个蛋白质主要参与了解淀粉芽孢杆菌的糖代谢过程、脂类代谢过程、己糖代谢过程、单一碳水化合物代谢过程、单糖代谢过程、碳水化合物代谢过程、能量代谢过程、非生物刺激反应、氧化还原过程、氨基酸代谢过程。同时作为细胞组分参与核酸组成、膜结构、细胞骨架、细胞壁的组成。还有的行使RNA结合蛋白、核酸合成与修复、DNA结合蛋白的分子功能。
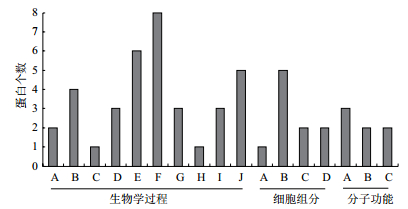
|
| 图 4 分泌蛋白的GO富集分析 生物学进程:A:糖代谢过程;B:脂类代谢过程;C:己糖代谢过程;D:单一生物碳水化合物代谢过程;E:单糖代谢过程;F:碳水化合物代谢过程;G:能量代谢过程;H:非生物刺激反应;I:氧化还原过程;J:氨基酸代谢过程;细胞组分:A:核酸组成;B:膜结构;C:细胞骨架;D:细胞壁;分子功能:A:RNA结合蛋白;B:核酸合成与修复;C:DNA结合蛋白 |
基于蛋白质参与生化过程的KEGG分析,能够分析蛋白质在生物体中参与的各种信号途径和生理生化过程。通过对本研究鉴定到的53个蛋白进行KEGG分析(表 3)表明,鉴定到的蛋白主要是参与各个代谢过程。其中,参与代谢途径的为13个,占24.53%,其他还有参与氮代谢、糖代谢、脂肪代谢、丙酮酸代谢的等等。另外还有参与磷脂酰肌醇信号系统的,参与基因表达调控的基本转录因子、RNA降解、DNA合成等。植物-病原互作的蛋白发现了6个,占11.32%,这些蛋白在解淀粉芽孢杆菌的生物防治研究中具有较大的研究价值。
多年来,芽孢杆菌已被广泛应用于植物病害生物防治、工业酶生产和抗生素生产。芽孢杆菌产生多种抗菌物质,包括挥发物,脂肽[15]和几种改性小肽和蛋白质[16-17],近年来,对于解淀粉芽孢杆菌中的抑菌蛋白的研究成为生物防治的一个研究热点。
本实验采用的我们前期的研究筛选到的解淀粉芽孢杆菌菌株,对葡萄霜霉病有很好的控制效果,其发酵液中的蛋白成分有明显的抑菌效果。参考前人研究[18],采用SDS电泳切胶后进行质谱鉴定分析蛋白,避免培养基干扰。研究发现在NA液体培养基培养的条件下,该解淀粉芽孢杆菌分泌的蛋白质中除维持本身结构和生理生化过程的信号转导蛋白、转运蛋白、参与基因调控的蛋白质等蛋白外,还有6个被推定为植物与病原互作的蛋白。其中蛋白质C7Z83和A6SDE被推定为属于氨基肽酶蛋白家族。氨基肽酶是一种外肽酶,在微生物、植物、动物中都广泛存在。前人的研究表明它参与对病原菌的抗性过程。它作用于蛋白质的N末端打开多肽链[19]。在香蕉枯萎病的生物防治的研究中发现,一株海洋细菌TC-1中表达的氨基肽酶对于病菌具有抑制作用[20]。对番茄的研究发现,番茄受创伤的后期,亮氨酸氨基肽酶在相关的信号转导过程中起作用[21]。细菌性斑点病菌会诱导番茄中氨基肽酶蛋白家族基因的激活表达,参与番茄对病菌的抗性[22]。另外4种是参与几丁质代谢过程的乙酰葡糖胺磷酸变位酶(Q09770:Phosphoacetylglucosamine mutase 2)、乙酰辅酶A乙酰转移酶(Q9UQW6:Acetyl-CoA acetyltransferase)、UDP-N-乙酰葡萄糖胺(Q8SQS1:UDP-N-acetylglucosamine)及几丁质酶(P29465:Chitinase ChiA)均被判定为参与植物与病原互作过程。几丁质是N-乙酰葡糖胺通过β连接聚合而成的结构同多糖,是自然界中丰富存在的多糖。它是真菌细胞壁和昆虫的外骨骼的主要结构成分[23-24]。几丁质酶可分解几丁质,可产生几丁质酶的生物很多,包括是动物、植物、昆虫、真菌和细菌。在酵母中,如酿酒酵母,几丁质酶在促进细胞高效分离方面起到了形态学作用[25]。植物表达几丁质酶防御有甲壳素作为一个结构成分的病原体。细菌产生几丁质酶主要用于降解几丁质作为碳源和能源[26]。几丁质酶产生菌已被报道作为不同种类真菌的生物防治剂。Driss等[27]发现Bacillus thuringiensis的含有几丁质酶的上清液对Aspergillus niger具有较高的抗真菌活性。研究发现,28-9蜡样芽孢杆菌产生几丁质酶对灰霉病菌具有明显的抑制作用[28]。de la Vega等[29]研究报道,来自于Bt. subsp. aizawai纯化的66 kD的几丁质酶,可破坏6种植物病原真菌的细胞壁,能抑制Fusarium sp.和Sclerotium rolfsii的菌丝生长。此外,两株真菌产生的几丁质酶可以降解Fusarium solani的细胞壁,并抑制其分生孢子的萌发[30]。本研究中采用的对葡萄霜霉病具有生防作用的解淀粉芽孢杆菌可以产生与几丁质代谢相关蛋白,从一个方面说明了该菌株防治葡萄霜霉病的机制,这也是下一步研究其应用的一个突破口。
4 结论本研究中从NA培养基中培养的一株生防解淀粉芽孢杆菌发酵液中筛选到53种蛋白质。其中除包含参与细胞构成以及能量和物质代谢的47种蛋白质外,还有6种蛋白质参与植物与病原菌互作的蛋白,2种属于氨基肽酶家族,其他4种(包含几丁质酶在内)参与几丁质的代谢过程。氨肽酶和几丁质酶已经被证明具有生物防治作用。
| [1] |
Gessler C, Pertot I, Perazzoli M. Plasmopara viticola:A review of knowledge on downy mildew of grapevine and effective disease management[J]. Phytopathol Mediterr, 2011, 50: 3-44. |
| [2] |
Rusjan D, Strlic M, Pucko D, et al. Copper accumulation regarding the soil characteristics in Sub-Mediterranean vineyards of Slovenia[J]. Geoderma, 2007, 141: 111-118. DOI:10.1016/j.geoderma.2007.05.007 |
| [3] |
Lachhab N, Sanzani S, Adrian M, et al. Soybean and casein hydrolysates induce grapevine immune responses and resistance against Plasmopara viticola[J]. Front Plant Sci, 2014, 5: 716. |
| [4] |
Maia AJ, Leite CD, Botelho RV, et al. Chitosan as an option to control mildew in the sustainable vinegrowing[J]. Semin Cienc Agrar Londrina, 2012, 33: 2519-2530. |
| [5] |
Aziz A, Poinssot B, Daire X. Laminarin elicits defense responses in grapevine and induces protection against Botrytis cinerea and Plasmopara viticola[J]. Mol Plant Microbe Interact, 2003, 16: 1118-1128. DOI:10.1094/MPMI.2003.16.12.1118 |
| [6] |
Alfonzo A, Piccolo SL, Conigliaro G, et al. Antifungal peptides produces by Bacillus amyloliquefaciens AG1 active against grapevine fungal pathogens[J]. Ann Microbiol, 2012, 62: 1593-1599. DOI:10.1007/s13213-011-0415-2 |
| [7] |
Wan T, Zhao H, Wang W. Effect of biocontrol agent Bacillus amyloliquefaciens SN16-1 and plant pathogen Fusarium oxysporum on tomato rhizosphere bacterial community composition[J]. Biological Control, 2017, 112: 1-9. DOI:10.1016/j.biocontrol.2017.05.014 |
| [8] |
Qaiser J, et al. Purification and antifungal characterization of Cyclo(D-Pro-L-Val)from Bacillus amyloliquefaciens Y1 against Fusarium graminearum to control head blight in wheat[J]. Biocatalysis and Agricultural Biotechnology, 2017, 10: 141-147. DOI:10.1016/j.bcab.2017.01.003 |
| [9] |
Wang SL, Shih IL, Liang TW, et al. Purification and characterization of two antifungal chitinases extracellularly produced by Bacillus amyloliquefaciens V656 in a shrimp and crab shell powder medium[J]. J Agric Food Chem, 2002, 50: 2241-2248. DOI:10.1021/jf010885d |
| [10] |
Hiradate S, Yoshida S, Sugie H, et al. Mulberry anthracnose antagonists(iturins)produced by Bacillus amyloliquefaciens RC-2[J]. Phytochemistry, 2002, 61: 693-698. DOI:10.1016/S0031-9422(02)00365-5 |
| [11] |
Pinchuk Ⅳ, et al. Amicoumacin antibiotic production and genetic diversity of Bacillus subtilis strains isolated from different habitats[J]. Res Microbiol, 2002, 153: 269-276. DOI:10.1016/S0923-2508(02)01320-7 |
| [12] |
Antonio A, Sandra LP, et al. Antifungal peptides produced by Bacillus amyloliquefaciens AG1 active against grapevine fungal pathogens[J]. Ann Microbiol, 2012, 62: 1593-1599. DOI:10.1007/s13213-011-0415-2 |
| [13] |
Mann M, Jensen ON. Proteomic analysis of post-translational modifications[J]. Nat Biotechnol, 2003, 21, 255-216. |
| [14] |
汪家政, 范明主编. 蛋白质技术手册[M]. 北京: 科学出版社, 2000.
|
| [15] |
Touré Y, et al. Role of lipopeptides produced by Bacillus subtilis GA1 in the reduction of grey mould disease caused by Botrytis cinerea on apple[J]. J Appl Microbiol, 2004, 96: 1151-1160. DOI:10.1111/jam.2004.96.issue-5 |
| [16] |
Kim PI, Chung KC. Production of an antifungal protein for control of Colletotrichum lagenarium by Bacillus amyloliquefaciens MET0908[J]. FEMS Microbiol Lett, 2004, 234: 177-183. DOI:10.1111/fml.2004.234.issue-1 |
| [17] |
Liu YF, Chen ZY, Ng TB, et al. Bacisubin, an antifungal protein with ribonuclease and hemagglutinating activities from Bacillus subtilis strain B-916[J]. Peptides, 2007, 28: 553-559. DOI:10.1016/j.peptides.2006.10.009 |
| [18] |
王智文, 陈海波, 宋福平, 等. 苏云金芽胞杆菌分泌蛋白的鉴定及分析[J]. 生物技术通报, 2017, 33(4): 169-176. |
| [19] |
须瑛敏. 枯草芽孢杆菌氨肽酶的研究[D]. 无锡: 江南大学, 2005. http://cdmd.cnki.com.cn/Article/CDMD-10295-2005104880.htm
|
| [20] |
齐希猛. 海洋细菌TC-1防治香蕉枯萎病及抗菌蛋白抑菌的机理初步研究[D]. 湛江: 广东海洋大学, 2012. http://www.wanfangdata.com.cn/details/detail.do?_type=degree&id=Y2215355
|
| [21] |
Matsui M, et al. Leucine aminopeptidases:diversity in structure and function[J]. Biol Chem, 2006, 387(12): 1535-1544. |
| [22] |
Pautot V, et al. Leucine aminopeptidase:an inducible component of the defense response in Lycopersicon esculentum(tomato)[J]. Proc Natl Acad Sci USA, 1993, 90(21): 9906-9910. DOI:10.1073/pnas.90.21.9906 |
| [23] |
Merzendorfer H, Zimoch L. Chitin metabolism in insects:structure, function and regulation of chitin syntheses and chitinases[J]. J Exp Biol, 2003, 206(24): 4393-412. DOI:10.1242/jeb.00709 |
| [24] |
Ahmadian G, Degrassi G, Venturi V, et al. Bacillus pumilus SG2 isolated from saline conditions produces and secretes two chitinases[J]. J Appl Microbiol, 2007, 103(4): 1081-1089. DOI:10.1111/jam.2007.103.issue-4 |
| [25] |
Kuranda MJ, Robbins PW. Chitinase is required for cell separation during growth of Saccharomyces cerevisiae[J]. J Biol Chem, 1991, 266(29): 19758-19767. |
| [26] |
Liu D, Cai J, Xie CC, et al. Purification and partial characterization of a 36-kDa chitinase from Bacillus thuringiensis subsp. colmeri, and its biocontrol potential[J]. Enzyme and Microbial Technology, 2010, 46: 252-256. DOI:10.1016/j.enzmictec.2009.10.007 |
| [27] |
Driss F, Kallassy-Awad M, Zouari N, et al. Molecular characterization of a novel chitinase from Bacillus thuringiensis subsp. Kurstaki[J]. J Appl Microbiol, 2005, 99(4): 945-953. DOI:10.1111/jam.2005.99.issue-4 |
| [28] |
Huang CJ, Wang TK, Chung SC, et al. Identification of an antifungal chitinase from a potential biocontrol agent, Bacillus cereus 28-9[J]. J Biochem Mol Biol, 2005, 38(1): 82-88. |
| [29] |
de la Vega LM, Barboza-Corona JE, Aguilar-Uscanga MG, et al. Purification and characterization of an exochitinase from Bacillus thuringiensis subsp. aizawai and its action against phytopathogenic fungi[J]. Can J Microbiol, 2006, 52(7): 651-657. DOI:10.1139/w06-019 |
| [30] |
Nguyen NV, Kim YJ, Oh KT, et al. Antifungal activity of chitinases from Trichoderma aureoviride DY-59 and Rhizopus microsporus VS-9[J]. Curr Microbiol, 2008, 56(1): 28-32. DOI:10.1007/s00284-007-9033-4 |