2. 遵义师范学院生命科学学院,遵义 563002
2. School of Life Sciences, Zunyi Normal College, Zunyi 563002
几丁质是一种在真菌、甲壳动物及节肢动物中广泛存在的多糖类生物高分子,是昆虫气管、表皮、围食膜等组织的重要组成部分,在对昆虫内部组织器官的保护和抵抗外源生物的侵染中发挥着非常重要的作用[1-3]。几丁质的合成和降解是昆虫生长发育的重要过程,所以也成为害虫控制的理想靶标。几丁质对昆虫具有保护作用,但同时也限制了昆虫的生长,所以当昆虫成长到一定阶段时,就需要蜕去旧表皮,合成更大的新表皮,以适应昆虫的生长。而新表皮的合成就是由几丁质合成酶(Chitin synthase,CHS)等酶系催化合成新的几丁质到新的表皮中。
CHS是几丁质合成的关键酶之一。理论分子量为160-180 kD,是糖基转移酶家族成员[4-5]。通过对不同种昆虫的CHS蛋白序列进行比对,结果发现CHS有3个相对保守的结构域:结构域A、B、C。结构域A位于CHS的N端,是一段跨膜螺旋结构;结构域B位于CHS的活性中心,含有2个保守的氨基酸组成EDR和QRRRW;结构域C位于CHS的C端,包含一段相对保守的氨基酸序列和7个跨膜螺旋,这个区域被认为参与对几丁质合成的调控。在大多数昆虫中存在两个CHS:CHS1和CHS2,这两个CHS被认为参与不同组织器官的几丁质合成。其中,CHS1主要参与表皮和气管中几丁质的合成,CHS2主要参与围食膜中几丁质的合成。另外,有研究发现在冈比亚按蚊Anopheles gambiae的复眼中可以检测到CHS1和CHS2基因的表达。赤拟谷盗中可以检测到CHS1基因主要在卵和蛹期中表达[6-7]。对不同种昆虫中CHS基因的结构研究发现,大多数昆虫的CHS1基因存在一个可变剪接的外显子,而CHS2基因中没有发现可变剪接的现象。CHS基因的序列在多种昆虫中已被陆续获得,如铜绿蝇(Lucilia cuprina)、埃及伊蚊(Aedes aegypti)、果蝇(Drosophila melanogaster)、赤拟谷盗(Tribolium castaneum)、甜菜夜蛾(Spodoptera exigua)、冈比亚按蚊(A.gambiae)等,但是还有待于更深层次的研究[8]。RNA干扰(RNAi,RNA interference)技术已被广泛应用于基因功能研究中。利用RNAi技术研究CHS1基因对东亚飞蝗(Locusta migratoria manilensis)生长发育的影响,结果发现沉默CHS1的可变外显子a会导致东亚飞蝗发育迟缓,蜕皮障碍,而沉默CHS1的可变外显子b会引起腿部畸形[9]。
白背飞虱隶属同翅目飞虱科,是危害我国水稻正常生长的主要害虫之一[10]。白背飞虱除了自身刺吸水稻汁液外,还会传播水稻病毒,给水稻的生产带来毁灭性的灾难[11-12]。本研究基于白背飞虱的转录组数据获得了白背飞虱CHS1基因的全长序列,对该基因序列的两个可变外显子进行了分析并探究了白背飞虱中CHS1基因在各龄期发育阶段及各组织器官中的表达水平。通过显微注射的方法对白背飞虱的CHS1基因进行了RNAi实验。通过上述研究,旨为阐明CHS1基因在白背飞虱中的生理作用,为利用CHS1基因治理白背飞虱奠定基础。
1 材料与方法 1.1 材料 1.1.1 实验材料白背飞虱由本实验室饲养于人工气候室无任何处理的水稻上。饲养条件:(27±1)℃,相对湿度70%,光周期16L:8D。
1.1.2 试剂PCR相关试剂,反转录RT-PCR相关试剂,荧光定量PCR相关试剂,克隆载体pMD-18T,DNA分子量标准Marker均购自TAKARA公司;动物RNA提取试剂盒,胶回收试剂盒、质粒回收试剂盒购自北京天根公司;大肠杆菌感受态细胞DH5α购自北京全式金公司;dsRNA合成试剂盒T7 RiboMax Express RNAi System购自Promega公司;引物合成及序列测定由上海生工公司完成,其它常规试剂均为国产分析纯。
1.2 方法 1.2.1 白背飞虱CHS1基因的获得通过对本课题组前期获得的白背飞虱转录组数据的分析,得到白背飞虱CHS1基因。根据这段序列设计全长扩增的验证引物SfCHS1-F和SfCHS1-R(引物序列见表 1)。PCR扩增程序:94℃预变性5 min,94℃变性30 s,56℃退火30 s,72℃延伸5 min,35个循环,72℃延伸10 min。扩增产物经凝胶回收后与pMD-18T载体连接,转化感受态细胞DH5α,菌落PCR鉴定正确后进行测序。
根据已有研究报道,昆虫CHS1基因存在可变剪接现象,所以我们对比了不同昆虫CHS1基因可变剪接出现的位置,在可变剪接位点附近设计了引物SfCHS1-YZF和SfCHS1-YZR(表 1)进行验证。PCR扩增程序:94℃预变性5 min;94℃变性30 s,56℃退火30 s,72℃延伸1 min,35个循环;72℃延伸10 min。扩增产物经凝胶回收后与pMD-18T载体连接,转化感受态细胞DH5α,菌落PCR鉴定正确后进行测序。
1.2.3 白背飞虱CHS1基因的时空表达特异性检测取4龄1-3 d,5龄1-3 d的白背飞虱若虫,羽化1 d和2 d的白背飞虱成虫,分别用RNA提取试剂盒进行RNA的提取及反转录。采用实时荧光定量PCR技术检测SfCHS1基因在白背飞虱4龄到成虫各虫期的表达情况。
取5龄1 d的白背飞虱若虫,CO2麻醉后于冰上解剖出表皮、气管和肠。分别用RNA提取试剂盒进行RNA的提取及反转录。采用实时荧光定量PCR技术检测SfCHS1基因在白背飞虱表皮,气管,肠中表达情况。用于检测SfCHS1基因时空表达特异性的引物为:SfCHS1-YGF和SfCHS1-YGR(表 1)。以白背飞虱β-actin基因为内参进行荧光定量PCR,检测引物为β-actin-YGF和β-actin-YGR。荧光定量PCR反应体系:SYBR(2×)5 μL,cDNA模板1 μL,上、下游引物各0.2 μL,ddH2O 3.6 μL。反应条件为:95℃预变性10 s,95℃变性5 s,60℃延伸30 s,35个循环。每个样品重复3次测定。
1.2.4 显微注射RNAi实验设计用于合成SfCHS1基因dsRNA的引物SfCHS1-dsRNA-F和SfCHS1-dsRNA-R及阴性对照绿色荧光蛋白GFP基因的引物GFP-dsRNA-F和GFP-dsRNA-R(表 1),按照dsRNA合成试剂盒的说明进行SfCHS1基因及GFP基因dsRNA的合成,用微量注射仪(Eppendorf公司)将dsRNA导入白背飞虱5龄1 d的若虫体内(10 ng/头,注射方法参照文献[12]),以无关dsRNA-GFP作为对照,采用实时荧光定量PCR方法检测SfCHS1基因的相对表达量。
1.2.5 序列及数据分析引物设计采用Primer 5软件,测序结果用DNAMAN软件进行拼接,SfCHS1基因开放阅读框分析采用DNAstar软件。氨基酸序列同源比对采用BLASTx程序,蛋白系统进化树构建采用MEGA 7.0软件,以Neighbor-joining算法进行分析,蛋白分子量及等电点预测采用在线软件(http://www.expasy.org),糖基化位点预测采用在线软件(http://www.cbs.dtu.dk/services/NetNGlyc/),数据的统计分析采用SPSS 19.0软件。
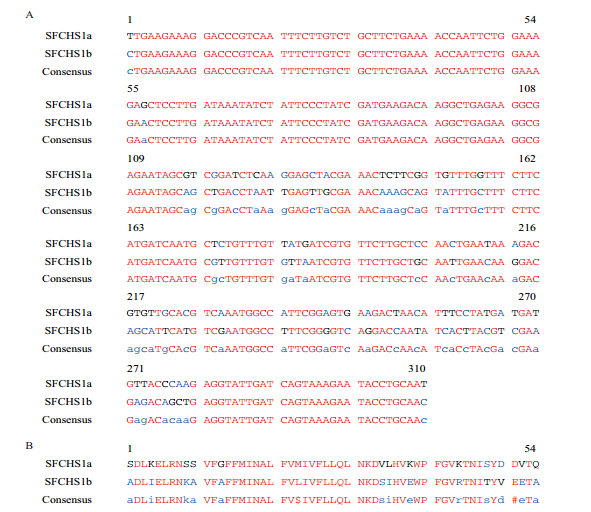
2 结果 2.1 白背飞虱CHS1基因的序列验证及分析通过对转录组测序数据的分析及全长扩增验证,获得了白背飞虱SfCHS1基因全长序列(GenBank登陆号:KY987034.1)。SfCHS1基因开放阅读框ORF长4 719 bp,编码1 572个氨基酸。预测蛋白的分子量为180.6 kD,等电点为6.72。预测有6个N-糖基化位点(18-21:NFSD;425-428:NLTI;917-920:NISL;956-959:NWTS;1 289-1 292:NSSV;1 327-1 330:NISY),有16个跨膜螺旋结构。根据已有研究报道,昆虫CHS1基因存在可变剪接现象,所以对比了不同昆虫CHS1基因可变剪接出现的位置,在可变剪接位点附近设计了引物,然后通过PCR扩增和测序,获得了白背飞虱几丁质合成酶1的两个可变外显子SfCHS1a和SfCHS1b,两个外显子区共有54个核苷酸和13个氨基酸的差异(图 1)。可变外显子包含一个跨膜区段。
|
| 图 1 白背飞虱SfCHS1基因两个可变外显子的核苷酸和蛋白序列比对结果 A:核苷酸比对结果;B:蛋白比对结果 |
利用Mega 7软件将白背飞虱CHS1基因的蛋白序列与其它昆虫的CHS1基因的蛋白序列进行进化树分析,结果(图 2)发现白背飞虱的CHS1基因与同为同翅目飞虱科的灰飞虱(L striatellus)及褐飞虱(N. lugens)的亲缘关系最近,达到97%。这个结果与Vector NTI软件分析出的白背飞虱CHS1蛋白序列与其他昆虫的CHS1蛋白序列比对的结果一致。

|
| 图 2 CHS1蛋白的进化树分析 Spodoptera exigua:甜菜夜蛾;Helicoverpa armigera:棉铃虫;Ectropis obliqua:茶尺蠖;Plutella xylostella:小菜蛾;Ostrinia furnacalis:亚洲玉米螟;Bombyx mori:家蚕;Drosophila takahashii:果蝇;Culex quinquefasciatus:致倦库蚊;Anopheles quadrimaculatus:四斑按蚊;Tribolium castaneum:赤拟谷盗;Leptinotarsa decemlineata:马铃薯甲虫;Aphis glycines:大豆蚜;Anasa tristis:南瓜缘蝽;Nilaparvata lugens:褐飞虱;Laodelphgax striatellus:灰飞虱;Sogota furcifera:白背飞虱 |
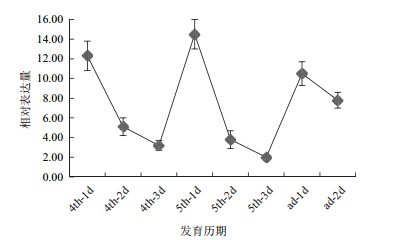
选取4龄1-3 d,5龄1-3 d,成虫1-2 d共8个时间点对SfCHS1基因的表达进行了分析,结果(图 3)发现SfCHS1基因在4龄和5龄期的第1天,也即蜕皮完成后,合成新的表皮时表达量最高,在表皮合成后的几天快速下降,在成虫期的第1天也会上升,而后逐渐下降。在4龄和5龄期的最后1 d,SfCHS1基因的表达量最低。
|
| 图 3 定量PCR检测SfCHS1 mRNA发育表达模式 4 th-1 d:4龄1 d;4 th-2 d:4龄2 d;4 th-3 d:4龄3 d;5 th-1 d:5龄1 d;5 th-2 d:5龄2 d;5 th-3 d:5龄3 d;ad-1 d:成虫第1天;ad-2 d:成虫第2天 |
选取5龄1 d的白背飞虱若虫解剖后进行组织特异性表达检测。定量PCR检测结果(图 4)表明,白背飞虱的CHS1基因主要在表皮中大量表达,相对表达量为25,其次为气管,相对表达量为7.8,在肠中也有少量表达,相对表达量为2.5。

|
| 图 4 SfCHS1基因在不同组织中的相对表达量 |
选取5龄1 d的白背飞虱若虫,用显微注射仪将SfCHS1基因的dsRNA(10 ng/头)导入白背飞虱体内,在注射后的24 h和48 h分别检测SfCHS1基因的表达量。结果如图 5所示,在注射SfCHS1基因dsRNA后的24 h,即可检测到SfCHS1基因的表达量出现显著下降,为对照组表达量的40%,注射48 h后,SfCHS1基因的表达量仅为对照的9%,均存在极显著差异(P<0.01,t-test)。

|
| 图 5 RNAi后SfCHS1基因的相对表达量 *表示与对照有极显著性差异(P<0.01),下同 |
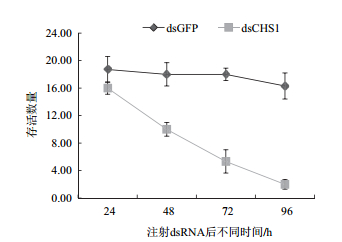
选取5龄1 d的白背飞虱若虫,用显微注射仪将SfCHS1基因及GFP基因的dsRNA(10 ng/头)导入白背飞虱体内(每组20头虫,3组重复),在注射后的24 h、48 h、72 h、96 h分别统计白背飞虱的存活率。结果如图 6所示,CHS1基因干扰后对白背飞虱的存活率有极大的影响,注射48 h后,存活率与对照相比,有极显著性差异(P<0.01,t-test),为对照的0.6倍,注射72 h后,存活率为对照的0.3倍,注射96 h后,存活率为对照的0.13倍。
|
| 图 6 RNAi后白背飞虱的存活率 |
昆虫在生长发育的过程中要经历旧表皮的蜕去和新表皮的生长,而几丁质作为昆虫表皮的主要成分,其合成和分解也是被严格调控的。在几丁质合成的过程中,CHS扮演着非常重要的作用,是几丁质合成的关键酶。通过本课题组前期的白背飞虱转录组数据分析,获得了白背飞虱CHS1基因的全长序列。目前,研究发现在很多昆虫中CHS1基因存在可变剪接的现象,如冈比亚按蚊、赤拟谷盗、桔小实蝇、褐飞虱等[13-17]。为了探究白背飞虱中是否也存在这样的可变剪接,对比了白背飞虱和褐飞虱的CHS1基因序列,在可能出现可变剪接的位置设计了引物进行序列的扩增和测序,结果发现在白背飞虱中也是存在两个可变外显子。利用进化树分析软件Mega 7分析白背飞虱与其它昆虫CHS1蛋白的进化关系,结果显示白背飞虱CHS1蛋白与同为同翅目的昆虫亲缘关系较近,聚为一小支,其中,又与飞虱科的褐飞虱及灰飞虱的关系最近。进化树分析的结果在一定程度上反映了CHS1蛋白的进化历程,为后续CHS1基因功能的研究奠定基础。然后采用荧光定量PCR的方法对白背飞虱CHS1基因在8个不同的时间点的mRNA表达量进行了检测。结果发现CHS1基因存在明显的时间表达特异性,在白背飞虱若虫4龄和5龄期的第1天表达量最高,随即快速下降,在成虫期的第1天也会上升,而后逐渐下降。这一结果表明在每个龄期初始,即需要大量几丁质参与表皮形成时,参与几丁质合成的CHS1基因的mRNA表达量会快速升高,而在每个龄期的最后1 d,即蜕皮开始时,表达量是最低的。同样,采用荧光定量PCR的方法,我们检测了CHS1基因在白背飞虱3个组织器官中mRNA的表达水平。结果发现CHS1基因在检测的3个组织即表皮、气管和中肠中都有表达,但是表达量存在极显著差异。其中,在表皮中的表达量最高。应该是在表皮合成的过程中,需要大量几丁质的原因。另外,几丁质也是气管的重要组成部分,所以在气管中也检测到了CHS1基因的表达,只是表达量显著低于表皮中。在中肠中也检测到了CHS1基因的少量表达,推测可能是在中肠中有含有几丁质的组织,也有可能是解剖中肠的时候,上面粘黏了气管组织。
目前,褐飞虱已成为我国水稻上的首要害虫,而杀虫剂大规模使用带来的害虫抗药性和对环境的污染使无害防治理念逐渐形成。目前,利用RNAi技术防治褐飞虱的研究报道已有很多,像通过饲喂法RNAi技术研究海藻糖合成酶的功能[18],构建RNAi载体转化水稻研究特定基因的功能等[19]。而RNAi转基因水稻将有可能成为防治褐飞虱的潜在方法。在本实验中,通过注射法RNAi干扰检测SfCHS1基因在mRNA表达水平上的沉默效果。结果显示,注射较低剂量(10 ng/头)的双链RNA即可产生较好的干扰效果,显著降低SfCHS1基因的表达及产生明显的死亡表型。通过本研究对SfCHS1基因的干扰研究,为探究其功能和作用机理奠定了基础。
4 结论本研究通过前期对白背飞虱进行了转录组的测序和数据分析,获得了白背飞虱几丁质合成酶1基因SfCHS1的cDNA全长序列。SfCHS1基因开放阅读框为4 719 bp,编码1 572个氨基酸。PCR扩增及测序结果表明SfCHS1基因存在两个可变剪切,产生两个转录本(CHS1a和CHS1b)。时间表达特异性分析结果表明,SfCHS1在每个龄期的第1天即几丁质合成时的表达量最高。组织特异性检测结果表明,SfCHS1主要在白背飞虱的表皮中表达,其次为气管,在中肠中也有少量表达。显微注射RNAi的结果表明该方法能显著降低SfCHS1基因的转录水平,达到良好的RNAi效果并产生显著的死亡表型。
| [1] |
Cohen E. Chitin synthesis and inhibition, a revisit[J]. Pest Mangement Science, 2001, 57(10): 946-950. DOI:10.1002/(ISSN)1526-4998 |
| [2] |
Merzendorfer H. The cellular basis of chitin synthesis in fungi and insects:common principles and differences[J]. European Journal of Cell Biology, 2011, 90(9): 759. DOI:10.1016/j.ejcb.2011.04.014 |
| [3] |
Merzendorfer H. Insect chitin synthases:a review[J]. Journal of Comparative Physiology B, 2006, 176(1): 1-15. DOI:10.1007/s00360-005-0005-3 |
| [4] |
Au-Young J, Robbins PW. Isolation of a chitin synthase gene(CHS1)from Candida albicans by expression in Saccharomyces cerevisiae[J]. Molecular Microbiology, 1990, 4(2): 197-207. DOI:10.1111/mmi.1990.4.issue-2 |
| [5] |
Yarden O, Yanofsky C. Chitin synthase plays a major role in cell wall biogenesis in Neurospora crassa[J]. Genes Dev, 1991, 5: 2420-2430. DOI:10.1101/gad.5.12b.2420 |
| [6] |
Arakane Y, Zhu YC, Kramer KJ, et al. Characterization of two chitin synthase genes of the red flour beetle, Tribolium castaneum, and alternate exon usage in one of the genes during development[J]. Insect Biochemistry and Molecular Biology, 2004, 34: 291-304. DOI:10.1016/j.ibmb.2003.11.004 |
| [7] |
Arakane Y, Muthukrishnan S, Kramer KJ, et al. The Tribolium chitin synthase genes TcCHS1 and TcCHS2 are specialized for synthesis of epidermal cuticle and midgut peritrophic matrix[J]. Insect Molecular Biology, 2005, 14: 453-463. DOI:10.1111/imb.2005.14.issue-5 |
| [8] |
Tellam R, Vuocolo T, Johnson SE, et al. Insect chitin synthase cDNA sequence, gene organization and expression[J]. European Journal of Biochemistry, 2000, 267: 6025-6043. DOI:10.1046/j.1432-1327.2000.01679.x |
| [9] |
Zhang J, Liu X, Zhang J, et al. Silencing of two alternative splicing-derived mRNA variants of chitin synthase 1 gene by RNAi is lethal to the oriental migratory locust, Locusta migratoria manilensis(Me-yen)[J]. Insect Biochem Mol Biol, 2010, 40(11): 824-833. DOI:10.1016/j.ibmb.2010.08.001 |
| [10] |
沈君辉, 尚金梅, 刘光杰. 中国的白背飞虱研究概况[J]. 中国水稻科学, 2003, 17: 7-22. DOI:10.3321/j.issn:1001-7216.2003.z1.002 |
| [11] |
周国辉, 温锦君, 蔡德江, 等. 呼肠孤病毒科斐济病毒属一新种:南方水稻黑条矮缩病毒[J]. 科学通报, 2008, 53(20): 2500-2508. DOI:10.3321/j.issn:0023-074X.2008.20.016 |
| [12] |
翟保平, 周国辉, 陶小荣, 等. 稻飞虱暴发与南方水稻黑条矮缩病流行的宏观规律和微观机制[J]. 应用昆虫学报, 2011, 48(3): 480-487. DOI:10.7679/j.issn.2095-1353.2011.085 |
| [13] |
Wang Y, Fan HW, Huang HJ, et al. Chitin synthase 1 gene and its two alternative splicing variants from two sap-sucking insects, Nilaparvata lugens and Laodelphax striatellus(Hemiptera:Delphacidae)[J]. Insect Biochem Mol Biol, 2012, 42(9): 637-646. DOI:10.1016/j.ibmb.2012.04.009 |
| [14] |
Li T, Chen J, Fan X, et al. MicroRNA and dsRNA targeting chitin synthase A reveal a great potential for pest management of the hemipteran insect Nilaparvata lugens[J]. Pest Management Science, 2017, 73(7): 1529-1537. DOI:10.1002/ps.2017.73.issue-7 |
| [15] |
Yang WJ, Xu KK, Cong L, et al. Identification, mRNA expression, and functional analysis of chitin synthase 1 gene and its two alternative splicing variants in oriental fruit fly, Bactrocera dorsalis[J]. Int J Biol Sci, 2013, 9(4): 331-342. DOI:10.7150/ijbs.6022 |
| [16] |
Zhang X, Zhu KY. Biochemical characterization of chitin synthase activity and inhibition in the African malaria mosquito, Anopheles gambiae[J]. Insect Science, 2013, 20(2): 158-166. DOI:10.1111/j.1744-7917.2012.01568.x |
| [17] |
Zhuo W, Fang Y, Kong L, et al. Chitin synthase A:a novel epidermal development regulation gene in the larvae of Bombyx mori[J]. Mol Biol Rep, 2014, 41(7): 4177-4186. DOI:10.1007/s11033-014-3288-1 |
| [18] |
Chen J, Zhang DW, Yao Q, et al. Feeding-based RNA interference of a trehalose phosphate synthase gene in the brown planthopper, Nilaparvata lugens[J]. Insect Mol Biol, 2010, 19(6): 777-786. DOI:10.1111/j.1365-2583.2010.01038.x |
| [19] |
Zha W, Peng X, Chen R, et al. Knockdown of midgut genes by dsRNA-transgenic plant-mediated RNA interference in the hemipteran insect Nilaparvata lugens[J]. PLoS One, 2011, 6(5): e20504. DOI:10.1371/journal.pone.0020504 |





