2. 沈阳农业大学植物保护学院,沈阳 110866
2. College of Plant Protection, Shenyang Agricultural University, Shenyang 110866
苯并异噻唑啉酮(1,2-benzisothiazolin-3-one,BIT)是一种人工合成的化合物,对细菌、真菌及藻类等均有优良的抑制活性,解决了一系列由微生物和藻类等引起的化工产品变质,船舶的海洋污损等问题[1-3]。因此BIT作为高效杀菌剂和防腐剂,已经被广泛应用于乳胶制品、涂料(乳胶漆)、聚氨制品、照相洗液、造纸、油墨、皮革、润滑油等工业产品中[4-6]。工业生产中的BIT随着工业废水被大量排放到环境水体中,已有研究显示,莱茵河中浓度1μL/L的BIT溶液储存在室温(23℃)下,其半衰期约为7 d在4℃下其半衰期约为22 d[7]。BIT在环境条件下的半衰期比较短,但是大量排放也导致了其在水体中的残留,有数据显示,在污水厂排污口、部分河流以及沿海水体中均有检出,其浓度为10-250 ng/L[7-9]。
随着BIT的广泛使用,其对环境和生物体的负面影响也慢慢浮现出来。近年来,很多报道显示BIT能导致人皮肤过敏和炎症效应[10-12]。然而,BIT的大量使用和排放导致其在水体中广泛存在,BIT对水生生物生存的影响也不容忽视。因此,越来越多研究证实了BIT对水生生物的毒性,对大型蚤类的LC50为1.35 mg/L[13],对虹鳟鱼的LC50为1.60 mg/L[14]。同时,实验证实BIT对黑斑蛙胚胎96 h的LC50和TC50分别为2.99 mg/L和0.60 mg/L,最小生长抑制浓度(Minimum concentration to inhibit growth,MCIG)小于0.40 mg/L; 对蝌蚪的96 h LC50为6.44 mg/L[15]。目前关于BIT暴露鱼类的毒性数据非常少,但考虑到BIT在水体中广泛存在,因此其在水生态中的毒性,特别是对水生生物的危害值得进一步关注。
斑马鱼(Danio rerio)作为毒理学研究领域中最常用的模式动物,有体型小、产卵量大、遗传背景清晰、胚胎发育迅速且早期透明、便于观察等优点[16]。斑马鱼胚胎也越来越广泛用于急性毒性实验中,评价环境污染物的急性毒性[17]。斑马鱼胚胎暴露于环境污染物时,其机体氧化与抗氧化之间的平衡被破坏,将导致胚胎体内产生过多活性氧(Reactive oxygen species,ROS)自由基[18],从而造成机体的氧化损伤。已知的机体内抗氧化系统分为酶促反应系统和非酶促系统,然而酶促反应系统中的抗氧化相关酶活性,如过氧化氢酶(Catalase,CAT),超氧化物歧化酶(Superoxide dismutase,SOD),谷胱甘肽-S转移酶(Glutathione S-transferase,GST),以及丙二醛(Malondialdehyde,MDA)和ROS含量都作为生物指标,用来衡量氧化损伤程度[19-20]。目前,对于BIT造成氧化损伤和毒理机制的研究尚不明确。
本研究以模式动物斑马鱼胚胎为受试材料,根据zFET(Zebrafish embryo toxicity test)和基于OECD(Organization for Economic Co-operation and Development)的指导[21],进行斑马鱼胚胎急性毒性实验。并通过氧化应激指标的检测以及相关基因表达量的实时荧光定量(qPCR)分析,探索其对斑马鱼胚胎的毒性机理。以此评价BIT的环境毒性效应,为BIT使用和环境管控提供数据支持和科学依据。
1 材料与方法 1.1 材料 1.1.1 实验材料实验所用AB品系斑马鱼购自国家斑马鱼资源中心(China Zebrafish Resource Center,CZRC)。
1.1.2 试剂苯并异噻唑啉酮(1,2-benzisothiazolin-3-one,BIT),纯度99%,购自Sigma-Aldrich公司(CAS:2634-33-5,分子量151.2),分子式为C7H5NOS,为白色或淡黄色针状晶体。
BIT暴露实验处理液:将8 mg BIT溶于500 μL二甲基亚砜(DMSO)中,再用养鱼水(除氯净化,pH 7.0-7.5,电导率500-550 μs/cm)将其稀释到1 L,制备8 mg/L的BIT储液。根据预实验结果,依次制备0、1.0、2.0、3.0、4.0、6.0和8.0 mg/L的梯度暴露处理液,并以稀释到0.05%的DMSO处理液作为0 mg/L对照组(预实验表明,处理液中小于0.05%的DMSO不会对实验结果产生影响)。
其他试剂:三卡因甲磺酸盐麻醉剂(TMS,CAS:886-86-2,阿达玛斯,中国); 甲醇(色谱纯,Fisher公司,美国),二甲亚砜(DMSO,CAS:67-68-5,索莱宝,中国); 氯化钠,碳酸氢钠等均为分析纯,购自国药集团化学试剂有限公司。
1.1.3 仪器斑马鱼养殖与繁育系统(北京爱生科技); 精密型PH试纸(美国Sigma)电导度测试仪(意大利哈纳公司); BPC-250F型生化培养箱(上海一恒); 荧光显微镜X83(日本奥林巴斯); Agilent高效液相色谱分析仪(美国安捷伦); Heal Force超纯水系统(香港力康); 聚合酶链式扩增(PCR)仪(Bio-Rad),iQ7实时荧光定量(qPCR)仪(Bio-Rad); 一次性吸管和培养皿(江苏康健华); 六孔细胞培养板(无锡NEST)。
1.2 方法 1.2.1 斑马鱼养殖成年斑马鱼养殖于独立的水循环系统中,系统含有净化水和水质自动控制系统,能保持系统中水的温度为(28±0.5)℃,电导率为(500-550)μs/cm,pH为7.0-7.5,同时保持光周期为14 h(光):10 h(暗)。根据斑马鱼生长状态,每天喂食2-3次新鲜的丰年虫幼虫。
1.2.2 斑马鱼繁殖和胚胎收集提前一个晚上将成年种鱼按照雌雄比例2:2装入交配盒中,并用隔板将雌雄鱼分开。第二天早上光周期开始后0.5 h将隔板抽出,待雌雄鱼追尾交配0.5 h后收集胚胎,此时收集到的胚胎处于同一发育时期。将所有胚胎混合均匀,更换干净的养鱼水于培养皿中,受精3 h后(3 hours post-fertilization,3 hpf),选出存活且发育正常的胚胎,作为受试对象。
1.2.3 BIT工作液稳定性检测采用高效液相色谱(high performance liquid chromatography,HPLC)进行溶液稳定性检测,液相色谱条件,色谱柱(5 μm,4.6 mm×250 mm),流动相体积比(甲醇:水=20:80),流速为1.0 mL/min,柱温30℃,检测波长为254 nm,进样量2 μL。
BIT标准溶液制备:准确称取10 mg的BIT溶于500 μL DMSO中,用超纯水进行梯度稀释,依次稀释得到2、200和100 mg/L储备溶液。再用100 mg/L的储备液进行标准品准备,即稀释到浓度为5、10、15、20、25 mg/L的标准溶液。对照组为0 mg/L,含0.05%的DMSO。
BIT标准溶液测定:取标准溶液1.2 mL于1.5 mL的离心管中,以12 000×g离心5 min,取1mL上清液,经0.22 μm的滤膜过滤后加入液相色谱进样瓶中。调好参数仪器,色谱工作站会自动输出色谱曲线和色谱参数,输出结果中色谱峰保留时间(t0)与峰面积(area)对应BIT标准溶液的浓度,由此绘制BIT溶液标准曲线。
BIT暴露溶液稳定性检测; 使用液相色谱工作站,对配制好的BIT处理液进行检测,得到的结果于标准曲线进行比对。对比后,配制处理液与标准溶液浓度差异不显著的,进行后续暴露实验。
1.2.4 BIT暴露实验将收集到的正常3 hpf的胚胎根据处理液浓度分成7组,每组设置3个平行。暴露处理在6孔板中进行,每个孔中加入10枚胚胎,每个处理包含60枚胚胎,并倒入10 mL处理液。采用半静态暴露的方式进行处理,将培养皿置于恒温生化培养箱中,暴露总时间为96 h(即从3-99 hpf),培养箱孵化度为(28±0.5)℃,处理液pH维持在7.0,电导率约510 μs/cm,溶氧量>6 mg/L,胚胎处理过程中光:暗=14:10。每隔24 h更换2/3的处理液(吸出2/3,再加入2/3新鲜处理液),关注处理过程中处理液性质,及时挑出死亡的胚胎,同时进行记录。根据统计数据计算96-LC50。
1.2.5 胚胎发育形态学观察根据急性暴露试验得到的96 h-LC50设立3个BIT处理组,分别是0.75,1.50和3.0 mg/L(1/5 LC50、2/5 LC50、4/5 LC50),1组溶剂对照组0 mg/L。胚胎发育过程中每隔12 h取胚胎样品进行无伤镜检,统计并拍照记录畸形,发育不良的胚胎。处理48 h,统计胚胎孵化情况,计算48 h孵化率。处理96 h,统计胚胎畸形情况,计算96 h-TC50,并从处理组中挑选10个发育正常的胚胎(n=3),测量体长数据。
1.2.6 氧化应激分析分别设置0,0.75、1.50和3.0 mg/L的BIT暴露组。暴露96 h后,每个处理组下选取胚胎20枚,每组3个平行。收集胚胎,液氮速冻,放于-80℃保存。
氧化应激指标检测:GST测定试剂盒(比色法)、CAT测定试剂盒(可见光法)、MDA测定试剂盒(TBA法)、T-SOD测试盒(羟胺法)、ROS测定试剂盒(DCFH-DA法)、总蛋白(TP)测定试剂盒(带标准品,考马斯亮蓝法)试剂盒均购自南京建成生物研究所。将收集到的样品制备成5%的组织匀浆液,根据说明书进行CAT、GST、SOD酶活和TP、ROS、MDA含量检测。
基因表达分析:总RNA提取采用TRIzol试剂盒(TaKaRa)。在OD260nm下估算总RNA浓度,OD260/280和1.2%琼脂糖凝胶电泳评估RNA质量。使用反转录试剂盒,PrimeScriptTM RT reagent Kit with gDNA Eraser(TaKaRa)进行总RNA的cDNA制备,待检测的目标基因引物由上海生工公司合成(表 1),所有引物经验证后得到扩增效率在90%-110%之间。QPCR使用SYBR Premix Ex Taq Ⅱ试剂盒(TaKaRa)。三步法QPCR程序为:95℃ 10 min; 95℃ 30s,60℃ 30 s,72℃ 20 s,共34个循环; 72℃ 5 min,。每组包含3个生物学重复和3个孔重复,基因表达的差异倍数通过2t-ΔΔC方法计算。
胚胎急性毒性实验过程中,每隔24 h记录胚胎死亡数,处理48 h后统计胚胎孵化率,处理96 h后统计胚胎存活率和畸形率,并在显微镜下观察畸形状况,测量正常胚胎96 h的体长数据,并分析胚胎运动,反应等行为学特征。数据统计使用SPSS22,方差齐性通过Levene方法检测,并进行单因素方差分析(one-way ANOVA),Tukey’s检验进行事后多重检验。P < 0.05表示差异显著,P < 0.01表示差异极显著,数据表示方法均为平均值±标准误(SE)。
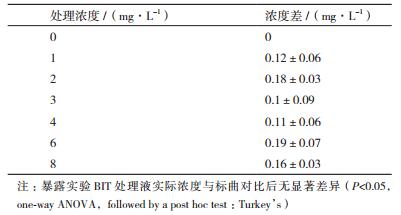
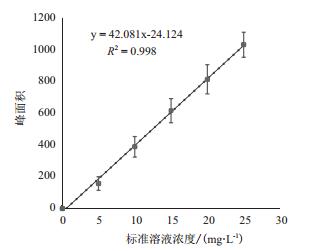
2 结果 2.1 BIT标准曲线及处理液稳定性标准溶液浓度为0、5、10、15、20和25 mg/L,HPLC分析得到BIT的保留时间为3.72 min,峰面积(x),质量浓度(y),得到其回归方程:y = 42.081x -24.124,R2=0.998,(图 1)所示。配制的处理液检测结果与标准曲线对比后,差异不显著(P < 0.05,单因素方差分析,Turkey’s事后多重检验)(表 2)。
|
| 图 1 BIT水溶液标准曲线 液相色谱分析结果得到BIT标准液峰面峰面积-浓度线性拟合积结果,算出回归方程y = 42.081x-24.124,R2=0.998 |
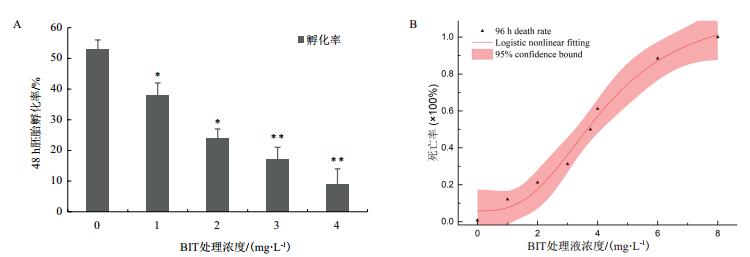
对斑马鱼胚胎进行BIT暴露处理48 h(51 hpf)后,发现BIT对斑马鱼毒性效应符合剂量-效应曲线。胚胎孵化率在所有处理组中都显著降低了(图 2-A),统计48 h存活率高于50%的处理组(1.0、2.0、3.0和4.0 mg/L),其中1.0 mg/L和2.0 mg处理组显著降低,分别为38%和24%(P < 0.05)。3.0 mg/L和4.0 mg/L处理组极显著降低,分别为17%和9%(P < 0.01)。对照组胚胎的死亡率低于1%,表明胚胎质量较高,得到的数据经logistic非线性拟合后,得到拟合曲线(图 2-B),R2=0.987 8,计算得到BIT对斑马鱼胚胎96h-LC50为3.65 mg/L。安全浓度采用通用算法:96h-LC50×0.01=0.03 mg/L。
|
| 图 2 BIT暴露对胚胎孵化率(A)和存活率(B)的影响 A:48 h(51 hpf)BIT对斑马鱼胚胎孵化影响,不同浓度处理组胚胎孵化率,数据表示为平均值±SE(n = 3),差异显著性用星号表示,*P < 0.05,** P < 0.01(单因素方差分析,Turkey’s事后多重检验)。B:BIT对斑马鱼胚胎致死效应拟合曲线,R2=0.9878 |
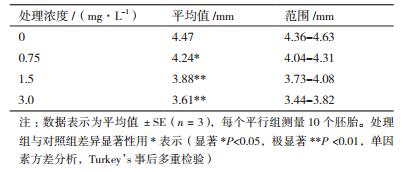
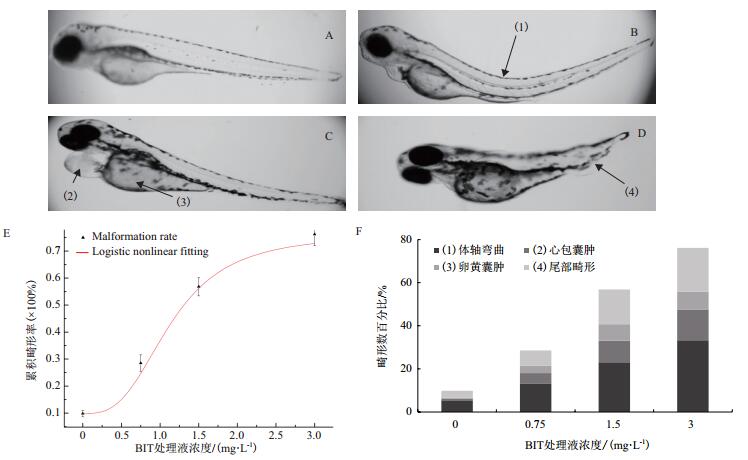
根据急性毒性实验结果,将斑马鱼胚胎暴露于0、0.75、1.5和3.0 mg/L的BIT处理液中。与对照组相比,暴露组中胚胎畸形率显著提高(P < 0.05,单因素方差分析,Turkey’s事后多重检验),正常发育的胚胎(图 3-A),体轴弯曲(图 3-B),心包囊肿和卵黄囊肿(图 3-C),尾部畸形(图 3-D)所示。根据所得到的畸形率数据,进行了logistic拟合,计算得到96 h-TC50为1.31 mg/L。同时,测量了96 h斑马鱼的体长数据(表 3)所示,结果显示BIT对斑马鱼胚胎的发育具有抑制作用,0.75 mg/L浓度下胚胎体长显著下降,1.5 mg/L和3.0 mg/L浓度下胚胎体长极显著降低(单因素方差分析,Turkey’s事后多重检验)。
|
| 图 3 BIT致畸效应分析、镜检和数据统计分析 A:96 h发育正常的胚胎; B:体轴弯曲(1);C:心包囊肿(2)和卵黄囊水肿(3);D:为尾部畸形(4);E:96 h胚胎发育累积畸形率logistic非线性拟合,R2=0.994 2;F为不同种类畸形胚胎所占百分比。数据表示为平均值±SE(n = 3) |
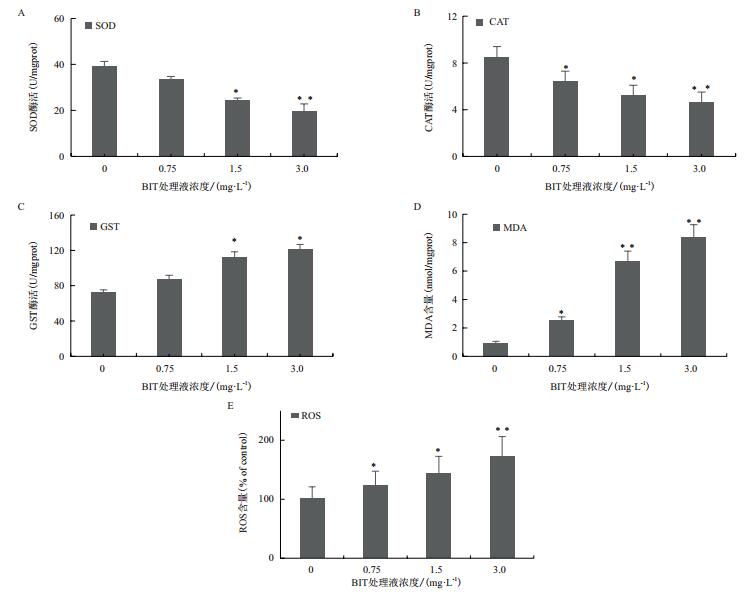
BIT处理到96h后,和对照组相比SOD的酶活在处理组1.5 mg/L和3.0 mg/L中都显著下降了(* P < 0.05,**P < 0.01,Turkey’s)(图 4-A)。CAT酶活随着BIT处理浓度增加而显著下调,3.0 mg/L处理组中极显著下调(图 4-B)。GST酶活在处理组1.5 mg/L和3.0 mg/L中都显著上调(图 4-C)。MDA含量则显著升高了,且在1.5 mg/L和3.0 mg/L处理组中极显著升高(图 4-D)。经BIT暴露后,ROS在斑马鱼体内的含量呈现递增趋势,和对照组相比,在0.75 mg/L和1.5 mg/L处理组中显著增加到122.8%和144.2%,在3.0 mg/L处理组中极显著增加到172.3%(图 4-E)。
|
| 图 4 氧化应激指标生化检测 A:SOD酶活; B:CAT酶活; C:GST酶活; D:MDA含量; E:ROS百分比含量。数据表示为x±s(n = 3),单因素方差分析,Turkey’s事后多重检验,*表示显著性(*P < 0.05,** P < 0.01,Turkey’s) |
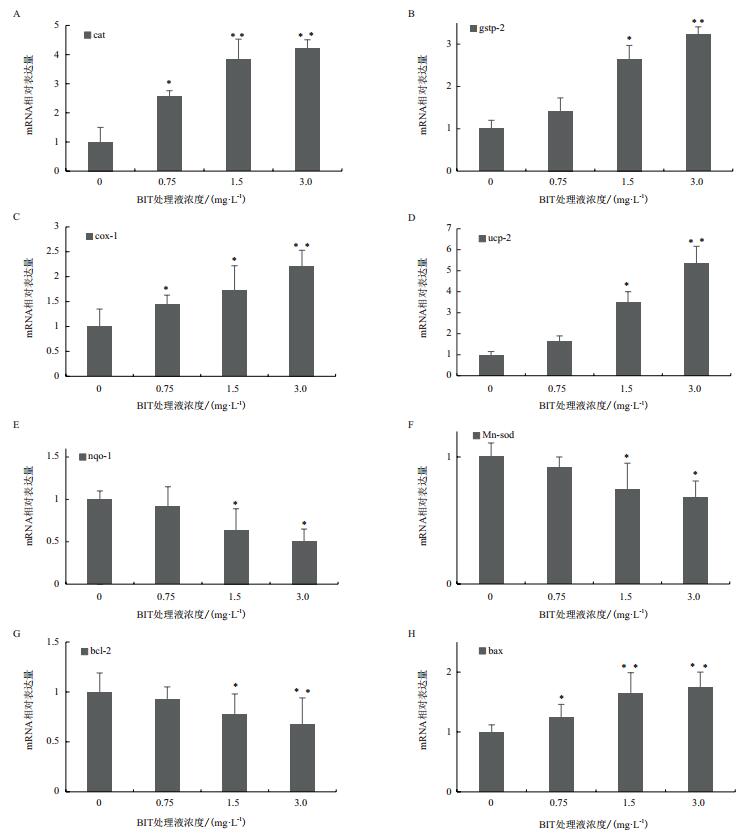
BIT暴露后,斑马鱼胚胎体内的抗氧化相关基因的表达量受到了干扰。和对照组相比,CAT基因的表达量在0.75 mg/L处理组中显著上调到2.56倍,在1.5 mg/L和3.0 mg/L处理组中极显著上调到3.83和4.21(图 5-A)。GSTP2的表达水平也在1.5 mg/L处理组中显著上调到2.65,3.0 mg/L处理组中极显著上调到3.22(图 5-B)。COX1的表达量在0.75 mg/L和1.5 mg/L处理组中显著上调到1.45和1.72,在3.0 mg/L处理组中极显著上调到2.21(图 5-C)。UCP2基因的表达量在1.5 mg/L处理组中显著上调到3.48,在3.0 mg/L处理组中极显著上调到5.36(图 5-D)。NQO1的表达量在1.5 mg/L和3.0 mg/L处理组中显著下调到0.64和0.51倍(图 5-E)。Mn-SOD的表达量在1.5 mg/L和3.0 mg/L处理组中显著下调到了0.74和0.68(图 5-F)。
|
| 图 5 氧化应激效应相关基因表达量 BIT暴露96 h后,斑马鱼胚胎体内mRNA相对表达量差异(A:cat; B:gstp-2; C:cox-1; D:ucp-2; E:nqo-1; F:Mn-sod; G:bcl-2; H:bax。数据表示为平均值±SE(n = 3),单因素方差分析,Turkey’s事后多重检验,*表示显著性(*P < 0.05,**P < 0.01,Turkey’s) |
抗细胞凋亡基因BCL2和促细胞凋亡基因BAX相互拮抗,在调节细胞凋亡中起着重要作用。BIT暴露处理后,BCL2基因表达量在1.5 mg/L处理组中显著下调到0.78,在3.0 mg/L处理组中极显著下调到0.68(图 5-G)。BAX基因表达量在0.75 mg/L处理组中显著上调到1.25,在1.5 mg/L和3.0 mg/L处理组中极显著上调到1.64和1.76(图 5-H)。
3 讨论工业防腐剂在日常生产和生活中使用量巨大,特别是近年来新兴的异噻唑啉酮类化合物及其衍生物,苯并异噻唑啉酮(BIT)正是其中一种广泛使用的防腐剂。随着这类化合物越来越多的导致过敏反应和疾病,使人们开始关注其危害。本研究主要关注其对水生生物的毒性作用,通过对斑马鱼胚胎的急性暴露实验,分析BIT的毒性和毒理机制。
在本研究中,首先对BIT水溶液和处理液的稳定性进行了评估。HPLC的结果显示,每次暴露实验处理液的浓度没有显著的差异,且浓度保持恒定,说明在整个斑马鱼胚胎暴露实验过程中,处理液性质是稳定的。而且使用DMSO作为助溶剂,在其浓度保持在0.05%以下,对实验结果无显著影响。有报道显示,助溶剂如甲醇,乙醇,DMSO等含量低于0.1%时,其对实验结果不会产生显著影响[22-23]。
急性暴露实验采用梯度浓度的BIT对3 hpf的斑马鱼胚胎进行处理,96 h的暴露周期内,持续对胚胎死亡数和发育状况进行统计分析。研究发现,BIT对斑马胚胎孵化具有强烈抑制作用,当浓度≥1.0 mg/L时,就能显著抑制胚胎孵化,而且不能在暴露72 h前顺利孵化的胚胎全部死亡。与具有环境雌激素效应能促进胚胎孵化的污染物如乙二醇等不同[24],BIT表现出强烈孵化抑制,同时阻碍胚胎正常发育。致死率拟合曲线表现出明显的剂量-效应曲线关系,同时得到BIT对斑马鱼胚胎的96 h-LC50为3.65 mg/L,根据《全球化学品统一分类和标签制度》(Globally Harmonized System of Classification and Labeling of Chemicals,GHS)以及“危险化学品鱼类急性毒性分级试验方法”,判定BIT具有高毒[25]。
根据BIT对斑马鱼胚胎的96 h半致死浓度,设计了3个浓度梯度(1/5LC50、2/5LC50和4/5LC50,即0.75、1.5和3.0 mg/L)用于发育毒性和生理生化指标检测。结果表明,与对照组相比,暴露组胚胎畸形率随BIT浓度增加,呈现出升高趋势。在所有的畸形中,体轴弯曲和尾部畸形是主要形式。导致体轴畸形的主要原因可能是,细胞增殖出现异常[26],而且在最近的研究中发现col8a1a和stat1a基因表达受到干扰,将导致斑马鱼脊椎出现畸形发育[27-28],BIT可能干扰了此类基因的表达。经统计拟合分析未成功孵化、畸形和发育不良的胚胎后,得到了96 h-TC50为1.31 mg/L。同时,测量BIT暴露96 h后斑马鱼胚胎体长数据,体长显著变短说明BIT对斑马鱼胚胎生长具有很强的抑制作用,能抑制体轴纵向发育,这种抑制效应可能与叶酸代谢受到影响有关[29-30]。
斑马鱼胚胎在不同浓度BIT暴露96 h后,通过检测抗氧化生理指标以及相关酶编码基因的表达来研究BIT对斑马鱼胚胎氧化应激的影响。ROS在机体内一般处于稳定的动态平衡中,同时有传导信号的功能,机体在面临氧化应激过程中,会产生过多的ROS从而导致机体的氧化损伤[31]。BIT诱导了ROS的产生,说明其造成了斑马鱼体内的氧化压力。抗氧化第一道方向由SOD和CAT共同组成,Mn-sod是编码SOD的重要基因之一,可以衡量SOD的表达量,主要功能是清除O2-生成H2O2和O2[32]。CAT能够将H2O2分解成O2和H2O,编码基因是cat[33]。在本研究中,两种酶活性呈现了不同程度的下调,表明第一道抗氧化防线受到了抑制,过量的ROS抑制了这两种酶的活性。GST可以催化亲核性的谷胱甘肽GS(H)与各种亲电子外源化学物的结合反应,是一类具有Ⅱ相解毒酶和抗氧化酶的双重功能的抗氧化酶,其编码基因为gstp-2。许多外源化学物在生物转化第一相反应中极易形成某些生物活性中间产物,它们可与细胞生物大分子重要成分发生共价结合,对机体造成损害。谷胱甘肽与其结合后,可防止发生此种共价结合,起到解毒作用[34]。BIT能够显著提高GST活力,表明BIT能诱导胚胎产生解毒反应,同时说明机体内产生了过量的氧化代谢有害物。但是,当BIT浓度达到3.0 mg/L时,GST活力增量变小了,可能是在此浓度下,产生过量的ROS对GST的解毒能力产生了抑制效应。过量的ROS还能引起脂质过氧化反应,MDA是膜脂过氧化反应后的重要产物之一,它能间接反映机体细胞受自由基攻击的程度[35]。BIT处理后的胚胎中MDA含量都显著高于对照组,并随浓度呈现剂量-效应关系,此现象表明BIT诱导机体产生的ROS引起了脂质过氧化,随后可能引起细胞凋亡。
为了进一步阐述BIT导致斑马鱼胚胎氧化应激的机理和毒理效应,本研究通过qPCR检测了相关基因的表达量。结果表明,高浓度的BIT暴露96h后能够下调Mn-sod的表达量,这说明高浓度BIT导致过量的ROS产生,同时抑制了该基因的表达。过氧化氢酶编码基因cat在BIT胁迫下显著上调,表明机体在BIT胁迫下代谢产生的过量H2O2能诱导cat的表达。gstp-2的表达显著上调了,这说明高浓度BIT的暴露导致机体产生了氧化应激反应,产生了很多氧化应激代谢副产物,gstp-2基因表达上调以此产生更多的GST作用于解毒过程。
细胞色素c氧化酶亚基Ⅰ的编码基因是cox-1,是线粒体内呼吸链电子传递的终末复合物,也是线粒体氧化能力的关键调节物[36]。解偶联蛋白2的编码基因是ucp-2,可以让氧化磷酸化过程解偶联,从而减少ATP的合成[37]。细胞色素c氧化酶和解偶联蛋白2编码基因的上调,说明了BIT暴露下可以促进呼吸链的活性,同时能够提高ROS产生,过量的ROS可能导致细胞的凋亡[31, 34]。基因ucp-2表达的上调,能促进氧化磷酸化过程,以此抵抗BIT造成氧化损伤。NAD(P)H脱氢酶1的编码基因是nqo-1,是一种位于线粒体内膜催化电子从NADH传递给辅酶Q的酶[38]。在BIT暴露实验中,nqo-1基因表达量显著下调了,表明机体产生的过量ROS对nqo-1的表达具有抑制作用。总的来说,BIT暴露后的斑马鱼胚胎,其体内呼吸链的活性增强,但是呼吸链中产生的过量ROS反作用于相关基因,导致基因表达量受到干扰,在高浓度BIT暴露下,最终导致不能承受氧化损伤,从而引起细胞凋亡等一系列机体功能性障碍。
细胞凋亡调控基因bcl-2编码抗凋亡调控因子BCL2,而bax基因编码促凋亡因子BCL2偶联蛋白X,两种基因相互作用,维持着体内细胞凋亡的平衡[39]。BIT暴露后的胚胎,其体内bcl-2表达量显著下调,bax显著上调,表明机体调节细胞凋亡的动态平衡向着促凋亡方向移动了。细胞凋亡的平衡被打破,但是正常的细胞凋亡程序可以清除体内受损或完成了作用的细胞,是机体的一种自我保护措施[40]。
4 结论本研究表明,BIT对斑马鱼胚胎为高毒性,并造成氧化损伤。其中,CAT、SOD、GST和MDA,以及相关基因都可作为氧化损伤检测的有效生物指标。MDA和ROS含量在一定的程度上相互补充,BIT暴露下,它们在斑马鱼胚胎中含量表现出明显的剂量-效应关系。BIT破坏机体内ROS的平衡,使机体受到严重损害。细胞凋亡相关基因(bcl-2和bax)表达受到干扰,说明斑马鱼胚胎暴露于BIT,其引起了细胞凋亡,最终引起胚胎死亡。但是,其中一些生物指标在低浓度BIT暴露下表现出了不一致性,这可能与机体自我调节和卵膜保护有关。BIT暴露下对斑马鱼和其他水生生物的毒害作用不容忽视,同时需要进一步研究其长期暴露下的生态风险
| [1] |
魏婕, 王旭裕, 王向辉, 等. 苯并异噻唑啉酮甲酸酯类衍生物的海洋防污性能研究[J]. 海南大学学报:自然科学版, 2014, 32(2): 129-133. |
| [2] |
郑洪辉, 王向辉, 杨建新, 等. 苯并异噻唑啉酮类化合物的生物活性研究[J]. 生物学杂志, 2011, 28(4): 7-9. |
| [3] |
许凤玲, 林强, 张树芳, 等. 苯并异噻唑啉酮衍生物的合成及其抑菌性能[J]. 海洋科学, 2008, 32(5): 62-66. |
| [4] |
Alexander BR. An assessment of the comparative sensitization potential of some common isothiazolinones[J]. Contact Dermatitis, 2002, 46: 191-196. DOI:10.1034/j.1600-0536.2002.460402.x |
| [5] |
Aalto-Korte K, Ackermann L, Henriks-Eckerman ML, et al. 1, 2-Benzisothiazolin-3-one in disposable polyvinyl chloride gloves for medical use[J]. Contact Dermat, 2007, 57: 365-370. DOI:10.1111/cod.2007.57.issue-6 |
| [6] |
梁爽. 苯并异噻唑啉酮在水性涂料防腐中的应用[J]. 上海涂料, 2008, 46(10): 32-34. DOI:10.3969/j.issn.1009-1696.2008.10.010 |
| [7] |
Rafoth A, Gabriel S, Sacher F, et al. Analysis of isothiazolinones in environmental waters by gas chromatography-mass spectrometry[J]. Journal of Chromatography A, 2007, 1164(1-2): 74-81. DOI:10.1016/j.chroma.2007.07.040 |
| [8] |
卢昕博, 肖卫强, 许高燕, 等. LC-MS/MS法测定水基胶中的3种异噻唑啉酮类防腐剂[J]. 中国烟草学报, 2015, 21(4): 7-13. |
| [9] |
Scientific Committee on Consumer Safety. Opinion on benzisothiazo-linone. Available at: http://ec.europa.eu/health/scientific_committees/consumer_safety/docs/sccs_o_099.pdf(last accessed 7 March 2016).
|
| [10] |
Ana M. Giménez-Arnau. Hand Eczema in the Hospital and Medical Industry[M]// Textbook of Hand Eczema. Springer Berlin Heidelberg, 2014: 185-195.
|
| [11] |
Schwensen JF, Lundov MD, Bossi R, et al. Methylisothiazolinone and benzisothiazolinone are widely used in paint:a multicentre study of paints from five European countries[J]. Contact Dermatitis, 2015, 72(3): 127-138. DOI:10.1111/cod.12322 |
| [12] |
Geier J, Lessmann H, Schnuch A, et al. Concomitant reactivity to methylisothiazolinone, benzisothiazolinone, and octylisothiazolino-ne. International Network of Departments of Dermatology data, 2015[J]. Contact Dermatitis, 2015, 72(5): 337-339. DOI:10.1111/cod.2015.72.issue-5 |
| [13] |
Rafoth A, Gabriel S, Sacher F. Analysis of isothiazolinonesin environmental waters by gas chromatographymassspectrometry[J]. Journal of Chromatography A, 2007, 1164(1-2): 74-81. DOI:10.1016/j.chroma.2007.07.040 |
| [14] |
张硕慧, 陈轩. 异噻唑啉酮的灭藻效应和生物毒性试验[J]. 海洋环境科学, 2004, 23(4): 464-466. |
| [15] |
付旭锋, 李圆圆, 苏红巧, 等. 异噻唑啉酮类杀菌剂对黑斑蛙胚胎和蝌蚪的急性毒性[J]. 生态毒理学报, 2014, 9(6): 1097-1103. |
| [16] |
王佳佳, 徐超, 屠云杰, 等. 斑马鱼及其胚胎在毒理学中的实验研究与应用进展[J]. 生态毒理学报, 2007, 2(2): 123-135. |
| [17] |
Hermsen SA, van den Brandhof EJ, van den Ven LT, et al. Relative embryotoxicity of two classes of chemicals in a modified zebrafish embryotoxicity test and comparison with their in vivo, potencies[J]. Toxicology in Vitro, 2011, 25(3): 745-753. DOI:10.1016/j.tiv.2011.01.005 |
| [18] |
Ko JY, Kim EA, Lee JH, et al. Protective effect of aquacultured flounder fish-derived peptide against oxidative stress in zebrafish[J]. Fish & Shellfish Immunology, 2014, 36(1): 320-323. |
| [19] |
Zhao X, Wang S, Wu Y, et al. Acute ZnO nanoparticles exposure induces developmental toxicity, oxidative stress and DNA damage in embryo-larval zebrafish[J]. Aquatic Toxicology, 2013, s 136-137(14): 49-59. |
| [20] |
Wu S, Ji G, Liu J, et al. TBBPA induces developmental toxicity, oxidative stress, and apoptosis in embryos and zebrafish larvae(Danio rerio)[J]. Environmental Toxicology, 2016, 31(10): 1241-1249. DOI:10.1002/tox.v31.10 |
| [21] |
OECD. OECD Guidelines for the Testing of Chemicals 236 -Fish Embryo Acute Toxicity(FET)Test[M]. 2013: 1-22.
|
| [22] |
Liu L, Yan Y, Wang J, et al. Generation of mt:egfp transgenic ze-brafish biosensor for the detection of aquatic zinc and cadmium[J]. Environmental Toxicology & Chemistry, 2016. |
| [23] |
张家禹, 刘丽丽, 李国超, 等. 毒死蜱对斑马鱼胚胎氧化应激效应研究[J]. 中国环境科学, 2016, 36(3): 927-934. |
| [24] |
Fuzzen MLM, Bernier NJ, Kraak GVD. Differential effects of 17β-estradiol and 11-ketotestosterone on the endocrine stress response in zebrafish(Danio rerio)[J]. General & Comparative Endocrinology, 2011, 170(2): 365. |
| [25] |
沈敏, KatherineCoady, 董晶, 等. 化学品生态毒性测试鱼类模式生物的应用与展望[J]. 生态毒理学报, 2017, 12(2). DOI:10.7524/AJE.1673-5897.20161126004 |
| [26] |
胡玮, 程露阳, 宋韫韬, 等. 硫代硫酸钠干扰斑马鱼胚胎发育并致畸[J]. 中国生物化学与分子生物学报, 2009, 25(9): 861-866. |
| [27] |
Gray RS, Wilm TP, Smith J, et al. Loss of col8a1a function during zebrafish embryogenesis results in congenital vertebral malformations[J]. Developmental Biology, 2014, 386(1): 72-85. DOI:10.1016/j.ydbio.2013.11.028 |
| [28] |
Song H, Yan YL, Titus T, et al. The role of stat1b, in zebrafish hematopoiesis[J]. Mechanisms of Development, 2011, 128(7): 442-456. |
| [29] |
Nourizadeh-Lillabadi R, Lyche JL, Almaas C, et al. Transcriptional regulation in liver and testis associated with developmental and reproductive effects in male zebrafish exposed to natural mixtures of persistent organic pollutants(POP)[J]. Journal of Toxicology & Environmental Health, 2009, 72(3-4): 112-130. |
| [30] |
孙淑娜, 桂永浩, 蒋璆, 等. 叶酸缺乏对斑马鱼体轴发育的影响[J]. 复旦学报:医学版, 2009, 36(6): 663-669. |
| [31] |
Ray PD, Huang BW, Tsuji Y. Reactive oxygen species(ROS)homeostasis and redox regulation in cellular signaling[J]. Cell Signal, 2012, 24(5): 981-990. DOI:10.1016/j.cellsig.2012.01.008 |
| [32] |
Zhang H, Liu Y, Liu R, et al. Molecular mechanism of lead-induced superoxide dismutase inactivation in zebrafish livers[J]. J Phys Chem B, 2014, 118(5): 14820-14826. |
| [33] |
Khazri A, Sellami B, Dellali M, et al. Acute toxicity of cypermethrin on the freshwater mussel unio gibbus[J]. Ecotox Environ Safe, 2015, 115: 62-66. DOI:10.1016/j.ecoenv.2015.01.028 |
| [34] |
Zhao X, Wang S, Wu Y, et al. Acute ZnO nanoparticles exposure induces developmental toxicity, oxidative stress and DNA damage in embryo-larval zebrafish[J]. Aquat Toxicol, 2013, 136-137: 49-59. DOI:10.1016/j.aquatox.2013.03.019 |
| [35] |
李红, 王克跃, 石修权. 锌对镉所致大鼠肝脏脂质过氧化损伤的保护作用研究[J]. 遵义医学院学报, 2004, 27(4): 322-323. |
| [36] |
Sarkar S, Mukherjee S, Chattopadhyay A, et al. Low dose of arsenic trioxide triggers oxidative stress in zebrafish brain:expression of antioxidant genes[J]. Ecotox Environ Safe, 2014, 107: 1-8. DOI:10.1016/j.ecoenv.2014.05.012 |
| [37] |
Saleh MC, Wheeler MB, Chan CB. Uncoupling protein-2:evidence for its function as a metabolic regulator[J]. Diabetologia, 2002, 45(2): 174-187. DOI:10.1007/s00125-001-0737-x |
| [38] |
Lim JH, Kim KM, Kim SW, et al. Bromocriptine activates NQO1 via Nrf2-PI3K/Akt signaling:novel cytoprotective mechanism against oxidative damage[J]. Pharmacol Res, 2008, 57(5): 325-331. DOI:10.1016/j.phrs.2008.03.004 |
| [39] |
Czabotar PE, Lee EF, Thompson GV, et al. Mutation to bax beyond the bh3 domain disrupts interactions with pro-survival proteins and promotes apoptosis[J]. J Biol Chem, 2011, 286(9): 7123-7131. DOI:10.1074/jbc.M110.161281 |
| [40] |
李超, 伏圣博, 刘华玲, 等. 细胞凋亡研究进展[J]. 世界科技研究与发展, 2007, 29(3): 45-53. |