成纤维细胞生长因子家族(Fibroblast growth factors,FGFs)是一类小型分泌信号蛋白[1],广泛参与众多重要的生物学进程,其中包括生长、发育、性别决定与分化、细胞分化、增殖、迁移与凋亡等[2-7]。FGFs基因家族的主要特征为与肝素具有较高亲和性,并与细胞表面肝素硫酸蛋白聚酶相互作用[8]。FGF21作为FGFs基因家族较晚发现的成员,是2000年Nishimura等[9]利用同源PCR技术从小鼠胚胎中分离提取出。FGF21同家族基因相比,它不与肝素相结合,并无促细胞分裂作用[10],而是调控葡萄糖和脂质体内平衡的重要有益调节因子[11-13]。Santoso等[14]研究发现小鼠脑室内注射FGF21后可显著抑制高血糖小鼠的食物摄入,并激活下丘脑室旁核神经元,作为肝-下丘脑网络的血糖监测信使调节能量和葡萄糖代谢。Yang等[15]研究喂食低脂肪、高脂肪和补充鱼油高脂肪饮食小鼠过程中发现,FGF21基因参与鱼油介导的肝脏脂质调节和高脂肪饮食喂养小鼠的抗炎作用。
克隆FGF21基因cDNA序列并揭示其在各组织中的表达情况,是进行该基因表达研究的基础。近年来,在斑马鱼[16]、双色雀鲷、青鳉[17]、虹鳟等鱼类中陆续完成了FGF21基因注释,并对亚洲鲈鱼FGF21基因进行了分子特征和定位研究[18]。而对传统养殖鱼类FGF21基因的研究报道较少。本研究以草鱼(Ctenopharyngodon idellus)为实验动物,采用RT-PCR技术克隆出草鱼FGF21基因cDNA序列,并运用生物信息学方法分析其氨基酸序列与其他物种的同源性,构建NJ系统进化树,并检测草鱼幼鱼不同组织中FGF21基因表达情况,将为今后进一步研究草鱼FGF21基因在关键组织中的作用机制提供重要参考。
1 材料与方法 1.1 材料试验所用材料取自安徽省农业科学院水产研究所试验基地。草鱼幼鱼在200 L养殖缸中进行饲养,其中水温20℃。挑选个体湿重59.96±1.08 g草鱼3尾进行试验。
1.2 方法 1.2.1 草鱼FGF21基因全长cDNA克隆根据GenBank中登录的斑马鱼(NP_001038789.1)FGF21基因序列设计PCR扩增引物P1和P2,根据鲤(XP_018926023.1)FGF21基因序列设计PCR扩增引物P3,均用于克隆草鱼FGF21基因保守区; 引物P4用于克隆草鱼FGF21 mRNA全长; P5为定量表达的基因特异性引物,P6为定量表达的内参引物,以上引物均采用Primer Premier 5.0设计,由上海生工生物技术有限公司合成(表 1)。草鱼活体解剖,快速分离出肝脏组织,液氮研磨至粉末状,使用RNeasy Lipid Tissue Mini Kit(QIAGEN,Germany)试剂盒,按推荐方法提取肝脏总RNA。1%的琼脂糖凝胶电泳检测RNA质量,GeneQuant核酸定量仪(Biochrom,England)检测RNA的浓度后-80℃保存备用。PCR扩增FGF21基因序列,25 μL反应体系含:PCR Master Mix(TaKaRa,China)12.5 μL,模板cDNA 1.0 μL,上、下游引物各1.0 μL,ddH2O 9.5 μL。扩增条件为:94℃变性40 s、52℃退火40 s、72℃延伸60 s,共35个循环; 反应前95℃预变性5 min; 反应后72℃充分延伸10 min。2%琼脂糖凝胶电泳检测,切胶回收,克隆测序。
利用NCBI(http://www.ncbi.nlm.nih.gov)的BLAST在线工具进行同源性比对; 用EditSeq对序列进行编辑和分析,寻找开放阅读框,并翻译成氨基酸序列; 利用MEGA 7.0采用邻接(Neighbor joining,NJ)法构建基于FGF21氨基酸序列的分子系统发育树; 利用ProtParam(http://web.expasy.org/protparam/)分析推导蛋白质的基本理化性质; 利用PSORT II Prediction(https://psort.hgc.jp/form2.html)进行亚细胞定位; 利用TMHMM 2.0(http://www.cbs.dtu.dk/services/TMHMM/)预测跨膜结构域; 利用SignalP 4.1(http://www.cbs.dtu.dk/services/SignalP/)预测信号肽序列; 利用NetPhos 2.0(http://www.cbs.dtu.dk/services/NetPhos-2.0/)、NetOGlyc 4.0(http://www.cbs.dtu.dk/services/NetOGlyc/)、NetNGlyc 1.0(http://www.cbs.dtu.dk/services/NetNGlyc/)分析预测FGF21蛋白磷酸化位点、O糖基化位点、N糖基化位点; 采用PRABI预测蛋白二级结构(http://www.prabi.fr); 采用STRING(https://string-db.org)交互式数据库搜索可能的相互蛋白。
1.2.3 草鱼FGF21基因实时荧光定量PCR采用SYBR Green实时荧光定量PCR方法,对FGF21基因表达进行定量研究。从GenBank中获得内参基因β-actin,登录号为NC_007112.6,内参基因引物见表 1。实时荧光定量PCR反应在CFX96 TouchTM(BIO-RAD,USA)PCR仪上进行。采用QuantiFast SYBR Green PCR Kit(QIAGEN,Germany)定量试剂盒,20 μL的反应体系中包含2×PCR Master Mix 10.0 μL,10 μmol /L的上、下游引物各1.0 μL和模板cDNA 1.0 μL,ddH2O 7.0 μL。采用2步PCR法进行扩增,首先95℃预变性5 min,然后是40个循环,每个循环包括95℃变性10 s和60℃延伸30 s,循环结束后,从60℃缓慢升温到95℃,制备熔解曲线。每次反应都设置无模板对照,每个样品设3个技术重复。草鱼活体解剖,快速分离肝脏、肠道、心脏、肌肉、肾脏和全脑等组织,采用QuantiTect Reverse Transcription Kit(QIAGEN,Germany)反转录试剂盒分别提取总RNA,以Primer Mix为引物,按试剂盒推荐方法去除DNA污染并反转录合成cDNA第1链,稀释10倍用于荧光定量分析。
1.2.4 基因定量数据分析使用2-ΔΔCt法对定量数据进行统计学分析。目的基因的相对表达量为2-ΔΔCt,ΔΔCt表示内参基因,其中以β-Actin为内参基因,以对照组目标基因与内参基因的Ct差值平均值做为参照值,x表示任意一样本,其公式如下:
ΔΔCt=(Ct.Target gene-Ct. Reference gene)x-(Ct.Target gene-Ct. Reference gene)control
上述公式计算了每一个样本目标基因的表达量,通过内参基因校正后,数据用“平均值±标准差(Mean±SD)”表示。采用GraphPad Prism 6软件对实验数据结果进行统计学分析和作图,均值差异显著性用t-test方法进行分析比较。
2 结果 2.1 草鱼FGF21基因全长cDNA结构采用RT-PCR技术获得草鱼FGF21基因扩增序列,通过比对分析扩增序列得到该基因保守区片段,进而获得其cDNA全长(GenBank登录号为MF_094727),共615 bp,其中5'端非翻译区51 bp,开放阅读框564 bp,编码187个氨基酸,A+T含量53.9%,G+C含量46.1%(图 1)。

|
| 图 1 草鱼FGF21基因核苷酸及推测的氨基酸序列 *表示终止密码子 |
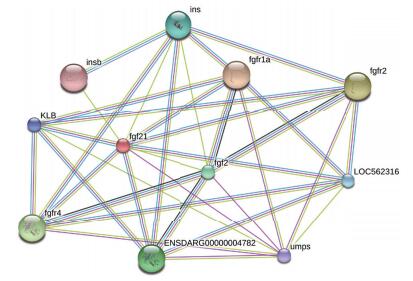
采用ProParam在线软件对草鱼FGF21基因编码的蛋白质结构进行分析,结果显示其编码的蛋白质由187个氨基酸组成,分子质量为21.25 kD,理论等电点pI为5.86,酸性氨基酸占12.83%,碱性氨基酸占10.70%,极性氨基酸占31.02%,疏水性氨基酸占27.81%,为不稳定亲水性蛋白。该蛋白具有10个丝氨酸磷酸化位点、2个苏氨酸磷酸化位点和3个络氨酸磷酸化位点,在第139个氨基酸残基有一个O-糖基化位点,无N-糖基化位点。该蛋白不具有信号肽结构和跨膜结构域。亚细胞定位发现其主要在细胞核(65.2%)发挥生物学功能,部分在线粒体(30.4%)和细胞骨架(4.3%)中发挥生物学功能。草鱼FGF21蛋白二级结构预测显示,38(20.32%)个氨基酸可能形成α-螺旋(h),40(21.39%)个氨基酸可能形成β-折叠(e),109(58.29%)个氨基酸可能形成无规则卷曲(c)。采用STRING交互式数据库搜索FGF21蛋白的可能相互作用蛋白,结果显示该蛋白可能和FGFR1A、FGFR4、FGF2、INSB和INS等蛋白存在相互作用(图 2)。
|
| 图 2 与草鱼FGF21蛋白相互作用蛋白预测 |
Blast发现,草鱼FGF21基因氨基酸序列与其他物种的同源性较高,其中,与斑马鱼(Danio rerio,NP_001038789.1)FGF21基因的氨基酸序列同源性最高,为78.86%;与犀角金线鲃(Sinocyclocheilus rhinocerous,XP_016399769.1)、鲤(Cyprinus carpio,XP_018926023.1)、虹鳟(Oncorhynchus mykiss,CD-Q66092.1)、大西洋鲑(Salmo salar,XP_014014670.1)、罗非鱼(Oreochromis niloticus,XM_003438468.3)和日本青鱂(Oryzias latipes,NC_019877.1)的同源性分别为77.66%、73.94%、53.29%、52.41%、43.71%和35.96%;与小鼠(Mus musculus,NC_000073.6)和人(Homo sapiens,NC_000019.10)的同源性最低,分别为30.39%和31.87%,氨基酸序列比较结果见图 3。

|
| 图 3 草鱼与其他物种FGF21氨基酸序列比较 阴影表示氨基酸相同; “-”表示氨基酸缺失 |
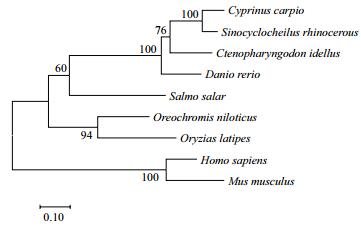
根据以上物种FGF21基因氨基酸序列运用MEGA 7.0软件构建NJ系统进化树(图 4),可以看出,草鱼与鲤、犀角金线鲃和斑马鱼聚为一支,亲缘关系最近,与人和小鼠的亲缘关系最远,与其他鱼类的亲缘关系介于两者之间。
|
| 图 4 FGF21基因氨基酸序列的NJ系统树 所引用序列均来自GenBank数据库。登录号:鲤(XP_018926023.1)、犀角金线鲃(XP_016399769.1)、斑马鱼(NP_001038789.1)、大西洋鲑(XP_014014670.1)、罗非鱼(XM_003438468.3)、日本青鳉(NC_019877.1)、人(NC_000019.10)和小鼠(NC_000073.6)。节点上的数值表示1 000次重复抽样检查后得到的支持率,标尺为基于泊松校正模型计算的相对遗传距离 |
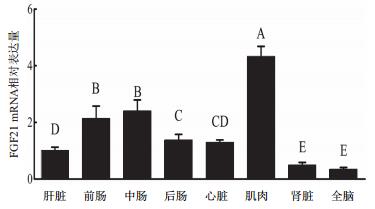
以β-actin为内参基因,采用qPCR方法对草鱼FGF21 mRNA在肝脏、前肠、中肠、后肠、心脏、肌肉、肾脏和全脑等组织中的表达进行了研究。结果(图 5)表明,所有组织中均检测到FGF21 mRNA的表达,肌肉的相对表达量极显著高于其他组织(P < 0.01),中肠和前肠组织次之,极显著高于后肠、心脏、肝脏、肾脏和全脑(P < 0.01)。
|
| 图 5 草鱼FGF21基因在不同组织中的表达水平 β-actin为内参基因; 不同大写字母表示差异极显著(P < 0.01) |
FGF21作为肝合成的一种多肽,其在调控脂肪分解与合成[19-20],促进葡萄糖转运[10, 21],增加肝脏酮生产[22-23],胰岛素抵抗[24-25]等生命活动发挥重要作用。本研究首先克隆获得草鱼FGF21基因全长序列615 bp,包括完整的ORF区564 bp,编码187个氨基酸,与NCBI上登录的斑马鱼、犀角金线鲃和鲤FGF21氨基酸序列同源性分别为78.86%、77.66%和73.94%,表明FGF21氨基酸序列在上述物种中具有较高保守性。草鱼FGF21蛋白不具有信号肽结构,对斑马鱼、鲤、犀角金线鲃和大西洋鲑等物种FGF21蛋白信号肽进行预测,均不具有信号肽结构,说明鱼类FGF21蛋白信号肽结构具有相似性,但与李倩等[26]在山羊中的研究结果不同,说明鱼类与哺乳类动物FGF21蛋白信号肽结构差别较大。亚细胞定位结果显示FGF21基因主要在细胞核发挥生物学功能,这与其不具有信号肽的预测结果相一致。
为了确定草鱼FGF21基因的组织表达特性,本研究采用qPCR技术检测了FGF21基因在草鱼幼鱼时期各组织中的表达情况,结果显示FGF21基因主要在肌肉中高水平表达,其次是前肠、中肠、后肠和心脏组织,而在肾脏和全脑中低水平表达。这与前人研究结果存在相似和不同之处,Izumiya等[27]研究发现FGF21蛋白在禁食小鼠骨骼肌和肝脏中大量表达。Wang等[18]在研究亚洲鲈鱼FGF21基因组织表达特性的时候发现,该基因在肾脏、小肠组织中表达,而肝脏、脾脏、心脏、脂肪和肌肉等组织中未检测到表达。Thomou等[28]研究发现FGF21基因在小鼠肝脏、脂肪、胰腺中高水平表达,而在肾脏和肌肉中低水平表达。综合以上研究结果表明FGF21基因的组织表达具有物种特异性。
FGF21基因在草鱼肌肉和肠道组织中的高表达提示其可能在草鱼上述组织中具有重要调控作用。而Izumiya等[27]指出小鼠骨骼肌FGF21基因表达受到PI3 /Akt1信号通路调控。Wang等[18]指出FGF21基因在亚洲鲈鱼肠道等组织特异性表达可能与禁食和急性期反应应答相关。这些研究结果提示,FGF21基因在草鱼肌肉和肠道组织可能会行使相似的生物学功能,但FGF21基因如何在草鱼各组织器官中发挥功能,仍需要进一步的试验解析。
4 结论本研究克隆获得草鱼FGF21基因全长序列615 bp(GenBank登录号为MF_094727),包括完整的ORF区564 bp,编码187个氨基酸。FGF21基因在草鱼肝脏、前肠、中肠、后肠、心脏、肌肉、肾脏和全脑等组织中存在广泛表达,且在肌肉、前肠和中肠组织中存在较高水平表达,推测该基因可能在草鱼肌肉和肠道等组织中发挥重要生物学功能。
| [1] |
Ornitz DM, Itoh N. The fibroblast growth factor signaling pathway[J]. Wiley Interdisciplinary Reviewa Devvelopmental Biology, 2015, 4(3): 215-266. DOI:10.1002/wdev.2015.4.issue-3 |
| [2] |
Araújo MR, Kyrylenko S, Spejo AB, et al. Transgenic human embryonic stem cells overexpressing FGF2 stimulate neuroprotection following spinal cord ventral root avulsion[J]. Experimental Neurology, 2017, 294: 45-57. DOI:10.1016/j.expneurol.2017.04.009 |
| [3] |
Hu M, Bai Y, Zhang C, et al. Liver-enriched gene 1, a glycosylated secretory protein, binds to FGFR and mediates an anti-stress pathway to protect liver development in zebrafish[J]. PLoS Genetics, 2016, 12(2): e1005881. DOI:10.1371/journal.pgen.1005881 |
| [4] |
Sun YL, Zeng S, Ye K, et al. Involvement of FGF9/16/20 subfamily in female germ cell development of the Nile tilapia, Oreochromis niloticus[J]. Fish Physiology and Biochemistry, 2012, 38(5): 1427-1439. DOI:10.1007/s10695-012-9630-4 |
| [5] |
Guibert M, Gasser A, Kempf H, et al. Fibroblast-growth factor 23 promotes terminal differentiation of ATDC5 cells[J]. PLoS One, 2017, 12(4): e0174969. DOI:10.1371/journal.pone.0174969 |
| [6] |
Guo DD, Guan WZ, Sun YW, et al. Comparative expression and regulation of duplicated fibroblast growth factor 1 genes in grass carp(Ctenopharyngodon idella)[J]. General and Compatative Endocrinology, 2017, 240: 61-68. DOI:10.1016/j.ygcen.2016.09.014 |
| [7] |
Lin CH, Hu HJ, Hwang PP. Molecular physiology of the hypocalce-mic action of fibroblast growth factor 23 in zebrafish(Danio rerio)[J]. Endocrinology, 2017, 158(5): 1347-1358. DOI:10.1210/en.2016-1883 |
| [8] |
Orinitz DM. FGFs, heparan sulfate and FGFRs:complex interacti-ons essential for development[J]. Bioessays, 2000, 22(2): 108-112. DOI:10.1002/(SICI)1521-1878(200002)22:2<>1.0.CO;2-O |
| [9] |
Nishimura T, Nakatake Y, Konishi M, et al. Identification of a novel FGF, FGF-21, preferentially expressed in the liver[J]. Biochimica et Biophysica Acta, 2000, 1492(1): 203-206. DOI:10.1016/S0167-4781(00)00067-1 |
| [10] |
Kharitonenkov A, Shiyanova TL, Kaester A, et al. FGF-21 as novel metabolic regulatur[J]. J Clinl lnvest, 2005, 115(6): 1627-1635. DOI:10.1172/JCI23606 |
| [11] |
Berglund ED, Li CY, Bina HA, et al. Fibroblast growth factor 21 controls glycemia via regulation of hepatic glucose flux and insulin sensitivity[J]. Endocrinology, 2009, 150(9): 4084-4093. DOI:10.1210/en.2009-0221 |
| [12] |
Kim KH, Lee MS. FGF21 as a Stress Hormone:The roles of FGF21 in stress adaptation and the treatment of metabolic diseases[J]. Diabetes & Metabolism Journal, 2014, 38(4): 245-251. |
| [13] |
Giralt M, Gavaldà-Navarro A, Villarroya F. Fibroblast growth factor-21, energy balance and obesity[J]. Molecular and Cellular Endocrinology, 2015, 418 Pt: 66-73. |
| [14] |
Santoso P, Nakata M, Shiizaki K, et al. Fibroblast growth factor 21, assisted by elevated glucose, activates paraventricular nucleus NUCB2/Nesfatin-1 neurons to produce satiety under fed states[J]. Scientific Report, 2017, 7: 45819. DOI:10.1038/srep45819 |
| [15] |
Yang W, Chen X, Liu Y, et al. N-3 polyunsaturated fatty acids increase hepatic fibroblast growth factor 21 sensitivity via a PPARγ-β-klotho pathway[J]. Molecular Nutrition Food Research, 2017. DOI:10.1002/mnfr |
| [16] |
Howe K, Clark MD, Torroja CF, et al. The zebrafish reference genome sequence and its relationship to the human genome[J]. Nature, 2013, 496(7446): 498-503. DOI:10.1038/nature12111 |
| [17] |
Reichwald K, Petzold A, Koch P, et al. Insights into sex chromoso-me evolution and aging from the genome of a short-lived fish[J]. Cell, 2015, 163(6): 1527-1538. DOI:10.1016/j.cell.2015.10.071 |
| [18] |
Wang L, Xia JH, Liu XJ, et al. Molecular characterization and mapping of Fgf21 gene in a foodfish species asian seabass[J]. PLoS One, 2014, 9(2): e90172. DOI:10.1371/journal.pone.0090172 |
| [19] |
Cantó C, Auwerx J. FGF21 takes a fat bite[J]. Science, 2012, 336(6082): 675-676. DOI:10.1126/science.1222646 |
| [20] |
Seo JA, Kim NH. Fibrobalst growth factor 21:a novel metabolic regulator[J]. Diabetes & Metabolism Journal, 2012, 36(1): 26-28. |
| [21] |
Kharitonenkov A, Wroblewski VJ, Koester A, et al. The metabolic state of diabetic monkeys is regulated by fibroblast growth factor-21[J]. Endocrinology, 2007, 148(2): 774-781. DOI:10.1210/en.2006-1168 |
| [22] |
Inagaki T, Dutchak P, Zhao G, et al. Endocrine regulation of the fasting response by PPARalpha-mediated induction of fibroblast growth factor 21[J]. Cell Metabolism, 2007, 5(6): 415-425. DOI:10.1016/j.cmet.2007.05.003 |
| [23] |
Estall JL, Ruas JL, Choi CS, et al. PGC-1alpha negatively regulates hepatic FGF21 expression by modulating the heme/Rev-Erb(alpha)axis[J]. Proc Natl Acad Sci USA, 2009, 106(52): 22510-22515. DOI:10.1073/pnas.0912533106 |
| [24] |
Xu J, Stanislaus S, Chinookoswong N, et al. Acute glucose-lowering and insulin-sensitizing action of FGF21 in insulin-resistant mouse models--association with liver and adipose tissue effects[J]. American Journal of Physiology Endocrinology and Metabolism, 2009, 297(5): E1105-E1114. DOI:10.1152/ajpendo.00348.2009 |
| [25] |
Cicione C, Degirolamo C, Moschetta A. Emerging role of fibroblast growth factors 15/19 and 21 as metabolic integrators in the liver[J]. Hepatology, 2012, 56(6): 2404-2411. DOI:10.1002/hep.25929 |
| [26] |
李倩, 林亚秋, 朱江江, 等. 山羊FGF21基因克隆及其在肌内脂肪细胞中的表达模式研究[J]. 畜牧兽医学报, 2017, 48(1): 31-38. |
| [27] |
Izumiya Y, Bina HA, Ouchi N, et al. FGF21 is an Akt-regulated myokine[J]. FFBS lettetrs, 2008, 582(27): 3805-3810. DOI:10.1016/j.febslet.2008.10.021 |
| [28] |
Thomou T, Mori MA, Dreyfuss JM, et al. Adipose-derived circulating miRNAs regulate gene expression in other tissues[J]. Nature, 2017, 542(7642): 450-455. DOI:10.1038/nature21365 |