茶树(Camellia sinensis(L.)O. Kuntze)是叶用多年生木本植物。香气成分是决定茶叶品质的重要物质。萜类化合物是茶叶香气的重要成分之一,约占春季茶叶香气挥发物总量的52.2%[1]。萜类化合物以异戊二烯为基本单位聚合而成,根据所含异戊二烯单位数目可分为单萜、倍半萜、双萜、四萜及多萜等。其中芳樟醇、香叶醇、橙花醇等单萜类化合物赋予茶叶怡人的花果香,四萜类化合物类胡萝卜素降解生成的紫罗酮类化合物及其衍生物也是茶叶香气的重要组分[2]。萜类化合物的合成受到多种关键酶的调控,其合成途径根据是否含有甲羟戊酸中间产物而分为甲羟戊酸(Mevalonate pathway,MVA)途径和2-甲基-4-磷酸赤藓糖(Methylerythritol 4-phosphate pathway,MEP)途径,这两个途径同时存在于真核生物体内,分别定位于细胞质基质和质体[3]。
1-脱氧-D-木酮糖-5-磷酸合成酶(1-deoxy-D-xylulose 5-phosphate synthase,DXS)是MEP途径的第一个酶也是该途径的关键调控酶,对单萜和双萜类香气化合物以及类胡萝卜素、叶绿素等重要物质的合成具有关键调控作用[4],DXS将MEP途径的初始底物丙酮酸和3-磷酸甘油醛转化成1-脱氧-D-木酮糖-5-磷酸(1-deoxy-D-xylulose 5-phosphate,DXP),DXP再经由后续的反应生成所有萜类化合物的合成前体异戊烯基焦磷酸(Isopentenylallyl diphosphate,IPP)和二甲烯丙基焦磷酸(Dimethylallyl diphosphate,DMAPP)[5]。以往茶叶的萜类研究多集中在香气物质的理化分析和鉴定以及栽培、加工技术对香气成分的影响方面[6-7],而有关萜类化合物代谢途径分子生物学方面的研究开展较少。本研究在课题组前期转录组测序的基础上,从福鼎大白茶中成功克隆茶树CsDXS1基因的完整开放阅读框(ORF),对该基因的生物信息学特征进行了全面的分析,并进一步对其在茶树不同组织中和激素水平处理下的表达水平进行了检测,以期为下一步深入研究CsDXS1的生物学功能提供一定参考。
1 材料与方法 1.1 材料实验材料为5年生国家茶树品种福鼎大白茶无性系,种植于湖北省武汉市华中农业大学种质资源圃。选取福鼎大白茶的一芽一叶,作为后续基因克隆的材料。
激素处理:分别以乙烯利(1 mmol/L ETH)、脱落酸(0.1 mmol/L ABA)、生长素(1 mmol/L IAA)、赤霉素(1 mmol/L GA3)、水杨酸(1 mmol/L SA)和茉莉酸甲酯(1 mmol/L MeJA)激素处理处理长势一致、生长健康、正常、无病虫侵害的植株,分别在处理后0 h(作为对照)、2、4、8和24 h采样,液氮速冻于-80℃储藏备用。
基因组织表达特异性:分别取多株茶树的第一叶混样、第二叶混样、第三叶混样、第四叶混样、老叶混样、嫩茎混样和老茎混样,取样后迅速置液氮中冷冻后,于-80℃冰箱保存备用。
1.2 方法 1.2.1 总RNA的提取和cDNA合成使用EASYspin Plus Plant RNA kit试剂盒(北京艾德莱生物科技有限公司)提取茶树一芽一叶的总RNA,提取的总RNA样品浓度和质量用微量分光光度计和1%凝胶电泳进行检测。以质量符合要求的RNA样品为模板,参照TRUEscript RT MasterMix说明书(北京艾德莱生物科技有限公司)进行反转录反应,合成的cDNA第一链,作为后续PCR扩增的模板。
1.2.2 茶树DXS基因克隆根据课题组茶树转录组数据中CsDXS1基因的转录本序列,设计特异性引物(表 1),以上述合成的福鼎大白茶一芽一叶cDNA为模板进行PCR扩增。扩增体系:模板1 μL、2×Ultra-Pfu Master Mix 12.5 μL、ddH2O 9.9 μL、正反引物各0.8 μL。扩增程序:94℃预变性3 min; 94℃变性20 s,61℃退火20 s,72℃延伸2 min,共38个循环; 72℃补充延伸7 min后终止反应。用1%凝胶电泳进行目的扩增产物的分离和回收纯化。将回收产物与载体pTOPO-Blunt Simple(北京艾德莱生物科技有限公司)相连并成功转化到大肠杆菌中,筛选阳性克隆并送至北京擎科新业生物技术有限公司进行测序。
利用DNAMAN软件分析预测其编码的蛋白; 利用NCBI中的BlastP在线工具(https://blast.ncbi.nlm.nih.gov/Blast.cgi)进行蛋白序列的同源比对; 利用MEGA 7.0软件的NJ法对茶树CsDXS1蛋白序列进行聚类分析; 运用序列处理在线工具包ExPASy-Protparam(http://web.expasy.org/protparam/)分析茶树CsDXS1蛋白的氨基酸组成及其理化性质; 运用在线工具NetPhos3.1 server(http://www.cbs.dtu.dk/services/NetPhos/)分析和预测磷酸化修饰位点; 运用ProtScale(http://web.expasy.org/protscale/)分析和预测茶树CsDXS1蛋白的亲水性/疏水性; 运用在线工具TMHMM server 2.0(http://www.cbs.dtu.dk/services/TMHMM/)进行跨膜结构域的分析和预测; 运用NCBI上的CDD(https://www.ncbi.nlm.nih.gov/Structure/cdd/wrpsb.cgi)和ExP-ASy-Prosite(http://prosite.expasy.org/)分析蛋白质的保守域和功能位点。
1.2.4 茶树CsDXS1基因的表达特性分析实时荧光定量PCR(Quantitative real time RT-PCR)实验按照TRUEscript RT MasterMix(北京艾德莱生物科技有限公司)试剂盒的操作说明进行。ABI StepOne Plus real-time PCR system作为荧光定量PCR平台。根据CsDXS1全长cDNA序列设计荧光定量PCR引物(表 1)。以茶树GAPDH 作为内参基因,检测CsDXS1在茶树不同组织部位以及不同激素处理条件下的相对表达量变化。荧光定量反应体系为:5×TRUE RT MasterMix 4 μL、上下游引物(10 μmol/L)各0.8 μL、ROX Dye II 0.4 μL、cDNA 2 μL,加水至终体积20 μL。反应程序为:94℃预变性3 min; 94℃预变性20 s,60℃退火20 s,72℃延伸30 s,40个循环。每份样品设置4个技术性重复,采用2-∆∆CT 方法分析基因的表达水平。利用SPSS Statistics 19软件对数据进行显著性检验(P < 0.05)。
2 结果 2.1 茶树CsDXS1基因的克隆对扩增片段进行测序拼接后得到的ORF全长序列为2 154 bp,编码717个氨基酸,具有两个转酮醇酶功能位点(图 1)。

|
| 图 1 茶树CsDXS1基因的ORF及其推导的氨基酸序列 黑框内的两段序列为两个转酮醇酶功能位点 |
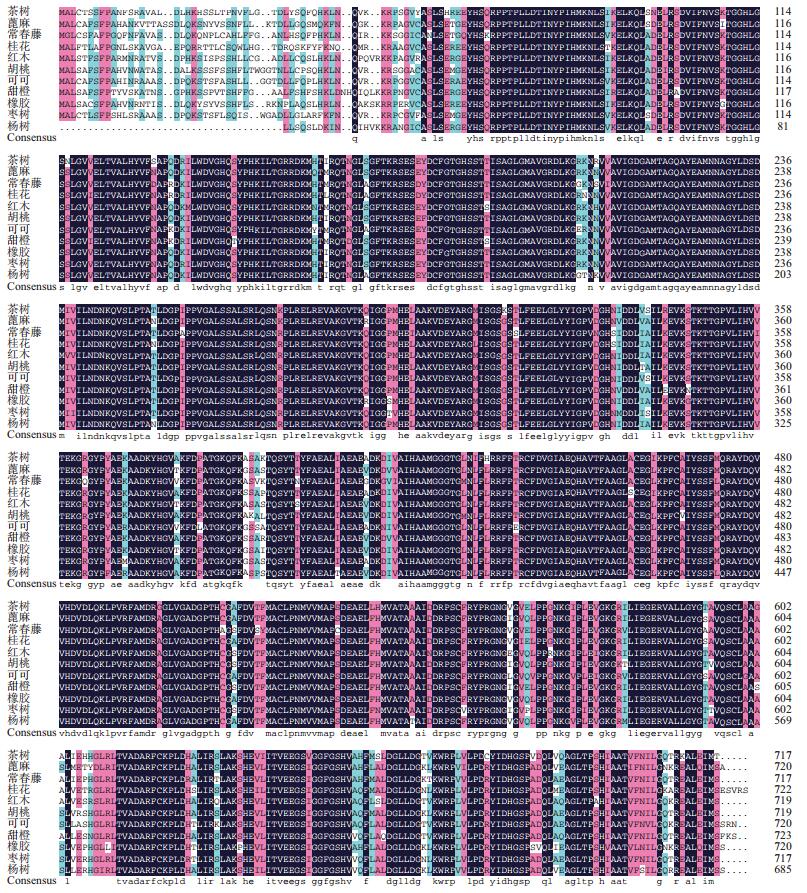
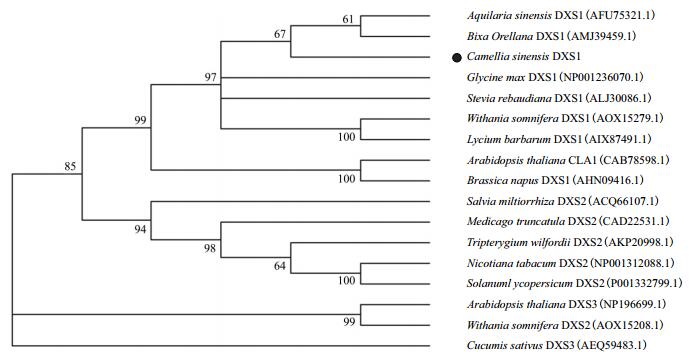
将茶树CsDXS1氨基酸序列进行BlastP同源比对,结果(图 2)显示茶树CsDXS1蛋白与葡萄、杨树、橡胶、可可、蓖麻、胡桃等多个物种的DXS蛋白的相似性都在85%以上,其中与葡萄DXS蛋白的相似性高达90%,说明茶树CsDXS1蛋白在进化过程中的保守性强。从同源比对结果中还可以看出不同植物DXS氨基酸序列差异主要来源于N端的1-60个氨基酸,许多植物DXS蛋白的N端普遍具有一段由几十个氨基酸组成的质体转运肽序列[8],恰好包含于这段保守性弱的N端序列中。但是茶树CsDXS1蛋白并没有预测到可能存在质体转运肽序列。为进一步研究茶树CsDXS1基因在DXS家族中的聚类关系,将茶树CsDXS1蛋白与其他植物的DXS蛋白进行聚类分析,结果(图 3)表明茶树CsDXS1蛋白与沉香、拟南芥、甜叶菊等植物的DXS1蛋白聚为一类,且与木本植物红木以及沉香的DXS蛋白的亲缘关系最近; 蒺藜苜蓿、雷公藤、烟草等植物的DXS2聚为一类; 而拟南芥DXS3同南非醉茄DXS在一个新的大分支。
|
| 图 2 茶树CsDXS1蛋白的多序列比对 |
|
| 图 3 植物DXS家族的系统发育分析 |
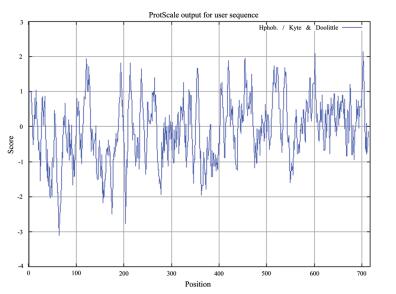
经ExPASy-ProtParam分析预测,茶树CsDXS1蛋白的分子量为77.48 kD,理论等电点为7.4,氨基酸组成中丙氨酸(Ala)、谷氨酸(Glu)、亮氨酸(Leu)、缬氨酸(Val)的比例较高,分别为9.5%、9.5%和9.6%,可能与CsDXS1的功能结构和酶学特性有关。茶树CsDXS1蛋白的不稳定系数达到了41.94,表明该蛋白的性质不是很稳定。总平均疏水系数为-0.090,结合ProtScale在线工具的亲水性/疏水性的预测结果(图 4),显示茶树CsDXS1蛋白的N端前部分序列表现出明显的疏水性,而且整体的趋势是越靠近N端,疏水性氨基酸的比例越高,而越靠近C端,亲水性氨基酸的比例更高,其中疏水性和亲水性最强的位点分别是第64位和707位,这很可能与茶树CsDXS1蛋白在细胞中的空间结构有关。茶树CsDXS1蛋白整体趋向于亲水性质。运用NetPhos3.1 server分析和预测蛋白的磷酸化位点,结果表明茶树CsDXS1蛋白中共有15个可信度高的磷酸化位点,预测值均大于0.9,其中包含丝氨酸(Ser)磷酸化位点有11个,苏氨酸(Thr)和络氨酸(Tyr)的磷酸化位点各2个。这些可信度高的磷酸化位点都没有特定的修饰激酶,说明很可能茶树CsDXS1蛋白不仅有较多的磷酸化位点而且修饰类型丰富,这可能与茶树CsDXS1蛋白的调控方式有关。
|
| 图 4 茶树CsDXS1亲水性和疏水性的预测 |
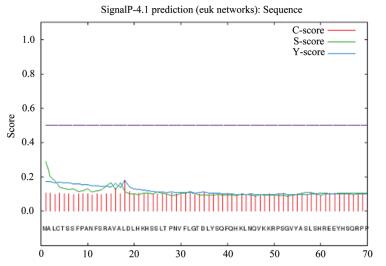
综合C值、Y值、S值的取值可以较为确切地反映信号肽的信息,从图 5中可见茶树CsDXS1蛋白的预测结果中信号肽可能位点的3个值都低于0.2,说明其不存在信号肽位点,属于非分泌蛋白。跨膜结构域的预测结果(图 6)显示,茶树CsDXS1蛋白的整个序列都在膜外,说明该蛋白不存在跨膜结构域,不是跨膜蛋白。
|
| 图 5 茶树CsDXS1氨基酸序列的信号肽分析结果 |
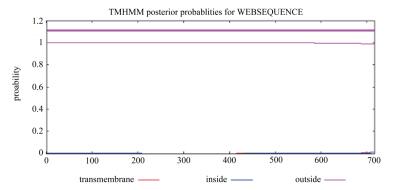
|
| 图 6 茶树CsDXS1跨膜结构域分析与预测 |
运用NCBI上的CCD在线工具分析茶树DXS蛋白的保守域,结果(图 7)显示CsDXS1蛋白含有典型的转酮醇酶的保守域,是转酮醇酶亚家族中的一类基因,说明茶树CsDXS1蛋白与转酮醇酶可能具有相似的功能,而且两者的进化过程密切相关。结合在线工具Prosite对蛋白质功能位点的预测分析结果,发现茶树CsDXS1蛋白中含有两段转酮醇酶的特征序列(图 1),其中一段位于靠近N端的位置,含有一个组氨酸残基,可能在酶催化过程中负责质子转移; 另一端序列比较靠近中间部位,包含保守的酸性氨基酸残基,形成蛋白质中的活性裂缝,很可能与底物结合有关。

|
| 图 7 茶树CsDXS1的功能结构域分析结果 |
实时荧光定量PCR检测显示(图 8),茶树CsDXS1基因在不同组织中的表达丰度差异很大。CsDXS1 在第三叶中的表达量最高,随着叶片的发育,其表达量呈现先升高后降低的趋势。CsDXS1 在幼嫩叶片中的表达量显著高于成熟叶片、嫩茎和老茎,在第三叶中的表达量分别是老叶、嫩茎和老茎中的4.1倍、3.4倍和3.6倍。在不同组织中CsDXS1基因的表达水平从高到低依次为:第三叶 > 第四叶 > 第二叶 > 第一叶 > 嫩茎 > 老茎 > 老叶。
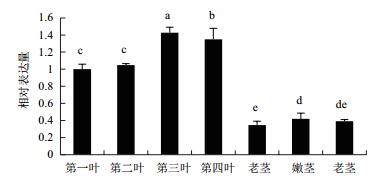
|
| 图 8 CsDXS1基因在茶树不同组织中的表达分析 |
用水杨酸、赤霉素、茉莉酸甲酯、乙烯、脱落酸、吲哚乙酸6种激素分别处理无病虫害、状态良好且比较一致的福鼎大白茶植株,并在处理后0(CK)、2、4、8和24 h分别采集茶树叶片提取RNA,利用实时定量PCR分析CsDXS1基因对不同激素的响应模式。结果(图 9)显示,CsDXS1 基因在不同激素处理条件下的表达模式有很大的不同。用1 mmol/L SA和1 mmol/L ETH处理后,CsDXS1 基因表达呈现出上升-下降-上升的趋势,并在处理后2 h表达量达到最高,分别为CK表达量的1.3倍和1.2倍。用1 mmol/L IAA、0.1 mmol/L ABA处理后的表达模式与SA和ETH处理后的表达模式相似,但却在4 h处理后表达量达到最大,均为CK表达量的1.5倍。在1 mmol/L MEJA处理下CsDXS1基因的呈现先降低后升高的趋势,在24 h表达量达到最高,仅为CK的1.1倍; 在1 mmol/L GA3 处理下的表达模式与MEJA处理下的表达模式完全相反,呈现先升高后降低的趋势,在4 h处理后表达量达到最大,为CK表达量的1.3倍。
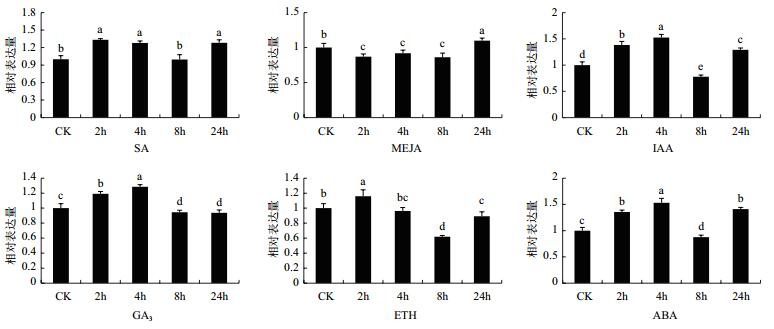
|
| 图 9 CsDXS1基因在茶树不同激素处理下的表达分析 |
萜类是一类广泛存在于植物体内的化学物质,以异戊二烯(Isoprene)为骨架。由异戊二烯为单位构成的类萜化合物,是迄今发现在功能和结构上种类最多、分布最广泛的一类植物代谢物,已鉴定出上万个。DXS在萜类化合物合成质体途径中发挥关键作用,催化丙酮酸和3-磷酸-甘油醛发生缩合反应形成MEP途径中的重要前体物质DXP[9],因此该反应是前体IPP与DMAPP的MEP合成途径中的限速反应,同时该反应会影响植物中萜类化合物的含量[10]。Battilana等[11]通过QTL定位发现DXS 基因是影响葡萄中单萜含量的主要位点。在拟南芥中过表达DXS基因会显著增加转基因植株中类胡萝卜素、维生素E、脱落酸和赤霉素等萜类物质的含量[12],而将拟南芥中的DXS 基因在宽叶薰衣草中过量表达后,其叶片和花中单萜及倍半萜类挥发油含量也大幅的提高[13]。超量表达DXS 同样能够显著增加长春花中萜类物质的积累[14]。在油棕和番茄果实中,萜类物质类胡萝卜素含量与DXS基因的表达量一致[15-17]。上述的研究结果均表明,DXS是MEP途径的关键酶,其活性的有无及高低与萜类成分的积累量有着直接的关系。茶树是重要的叶用经济植物,其叶片含有大量的萜类物质,其中挥发性萜类化合物是茶叶香气的重要组成成分,因此DXS 对茶叶品质成分中萜类化合物的合成具有极其重要的意义。
刘晶晶等[18]针对不同发育阶段鲜叶的气相色谱和质谱分析表明,茶树叶片萜类化合物含量受到叶片发育阶段影响,表现为幼叶中多,老叶中少。茶树不同组织中的定量表达数据表明,CsDXS1 基因的表达水平在第三叶中表达量最高,在幼叶中的表达水平显著高于老叶、嫩茎和老茎。推测CsDXS1基因存在组织特异性,在幼叶中的表达较高。这说明本研究中CsDXS1基因的表达模式与萜类化合物的积累模式十分一致。植物DXS蛋白的聚类分析表明,茶树CsDXS1基因属于DXS 家族的Ⅰ类基因,结合前期茶树转录组数据的结果,推测茶树可能至少含有2个DXS 基因,这与已有研究发现玉米[19]、水稻[20]中有多个DXS基因的结果相一致。DXS 的生理生化功能与其组织表达特性密切相关。对辣椒[21]中两个转酮醇酶编码基因的表达分析以及油棕[15]DXS 基因的研究发现,不同DXS 基因的表达量以及相应的萜类物质含量在果实发育过程中具有明显变化,DXS 基因家族不同成员基因的时空表达模式也在玉米等模式植物中得到了详细的阐明[22]。本研究中得到的CsDXS1表达量在幼嫩叶片中的表达量显著高于其他组织,结合上述DXS 基因的组织表达特性以及茶树萜类物质的积累特点,推测其可能在叶片萜类物质的合成中发挥了十分重要的作用。
植物激素不仅能够影响茶树生长,还使得茶树内含物质发生变化,其主要通过信号转导启动或调控下游相关基因的表达来发挥其作用[23]。已有研究表明GA处理能够显著提高茶树中包括香气在内的成茶品质[24]。定量结果表明,在外源GA的处理下,CsDXS1 的表达水平在短时间内被诱导并显著上调表达。而CsDXS1基因在外源IAA和ETH的处理下也呈现出相似的趋势。我们推测CsDXS1基因可能在激素显著提高茶树香气品质的过程中发挥了一定的作用。不同程度的非生物胁迫和生物胁迫等防御作用是影响萜类物质合成的主要因素。赤松[25]DXS 的研究中发现植株茎表的伤口会导致DXS 基因表达量的升高以及萜类物质含量的上升。Cho等[26]研究发现台湾乌龙茶“东方美人茶”鲜叶只有经过小绿叶蝉吸食后,方可导致不同应激蛋白基因表达并正调节转录编码,促使叶内各种挥发性萜类物质的形成。茶树在正常生长环境条件下,体内活性氧的产生与清除处于动态平衡,叶片自身含有的萜类物质种类和含量较少,当处于逆境胁迫时,动态平衡遭到破坏,萜类物质大量合成与增加[27]。ABA、SA、MEJA等物质已被证明在植物非生物胁迫和生物胁迫等防御过程中发挥重要的作用。在ABA和SA的处理下,CsDXS1的表达水平均在短时间内被诱导并显著上调表达。已有报道表明,ABA和SA能够协同诱导植物产生抗逆性,抵制不良因素造成的伤害[28]。我们推测,ABA和SA可能通过提高CsDXS1的表达水平,影响萜类物质的合成,进而提高其抗性。而在MEJA的诱导下,CsDXS1 表达水平与SA和ABA呈现相反的趋势,推测其调控CsDXS1表达水平的机理与二者不同。
4 结论茶树CsDXS1基因含有长为2 154 bp的开放读码框,编码717个氨基酸残基。茶树CsDXS1与已知葡萄和杨树的DXS序列相似性最高。qRT-PCR分析表明,CsDXS1基因在茶树嫩叶中的表达量最高,并受到多种激素的诱导。
| [1] |
张正竹, 施兆鹏, 宛晓春. 萜类物质与茶叶香气(综述)[J]. 安徽农业大学学报, 2000, 27: 51-53. DOI:10.3969/j.issn.1672-352X.2000.01.013 |
| [2] |
袁海波, 尹军峰, 叶国柱, 等. 茶叶香型及特征物质研究进展[J]. 中国茶叶, 2009, 31(8): 14-15. |
| [3] |
金蓉, 朱长青, 徐昌杰. 1-脱氧木酮糖-5-磷酸合成酶(DXS)及其编码基因[J]. 细胞生物学杂志, 2007, 29: 706-712. |
| [4] |
李莉, 高凌云, 董越, 等. 植物类异戊二烯生物合成相关酶基因研究进展[J]. 浙江师范大学学报:自然科学版, 2008, 31(4): 461-466. |
| [5] |
张冬姚, 孙君, 叶乃兴, 等. 茶树萜烯类香气物质合成相关酶研究进展[J]. 茶叶学报, 2015, 56(2): 68-79. |
| [6] |
赵飞. 茶树品种及加工工艺对茶叶中糖苷类香气前体的影响[D]. 杭州: 浙江大学, 2012. http://cdmd.cnki.com.cn/Article/CDMD-10335-1013187132.htm
|
| [7] |
王道平, 甘秀海, 等. 固相微萃取法与同时蒸馏萃取法提取茶叶香气成分[J]. 西南农业学报, 2013, 26(1): 131-135. |
| [8] |
程波, 杨伟俊, 何江, 等. 10种药用植物萜类合酶(DXS)生物信息学分析[J]. 中国农学通报, 2015, 31(2): 146-152. DOI:10.11924/j.issn.1000-6850.2014-1653 |
| [9] |
Cordoba E, Salmi M, León P. Unravelling the regulatory mechanisms that modulate the MEP pathway in higher plants[J]. J Exp Bot, 2009, 60(10): 2933-2943. DOI:10.1093/jxb/erp190 |
| [10] |
Xiang S, Usunow G, Lange G, et al. Crystal structure of 1-deoxy-D-xylulose 5-phosphate synthase, a crucial enzyme for isoprenoids biosynthesis[J]. J Biol Chem, 2007, 282(4): 2676-2682. DOI:10.1074/jbc.M610235200 |
| [11] |
Battilana J, Costantini L, Emanuelli F, et al. The 1-deoxy-D-xylulose 5-phosphate synthase gene co-localizes with a major QTL affecting monoterpene content in grapevine[J]. Theor Appl Genet, 2009, 118: 653-669. DOI:10.1007/s00122-008-0927-8 |
| [12] |
Estévez JM, Cantero A, Romero C, et al. Analysis of the expression of CLA1, a gene that encodes the 1-deoxyxylulose 5-phosphate synthase of the 2-C-methyl-D-erythritol-4-phosphate pathway in Arabidopsis[J]. Plant physiology, 2000, 124(1): 95-104. DOI:10.1104/pp.124.1.95 |
| [13] |
Muñoz-Bertomeu J, Arrillaga I, Ros R, et al. Up-regulation of 1-Deoxy-D-Xylulose-5-Phosphate synthase enhances production of essential oils in transgenic spike lavender[J]. Plant Physiology, 2006, 142: 890-900. DOI:10.1104/pp.106.086355 |
| [14] |
Peebles CA, Sander GW, Hughes EH, et al. The expression of 1-deoxy-D-xylulose synthase and geraniol-10-hydroxylase or anthranilate synthase increases terpenoid indole alkaloid accumulation in Catharanthus roseus hairy roots[J]. Metab Eng, 2011, 13: 234-240. DOI:10.1016/j.ymben.2010.11.005 |
| [15] |
Khemvong S, Suvachittanont W. Molecular cloning and expression of a cDNA encoding 1-deoxy-D-xylulose-5-phosphate synthase from oil palm Elaeis guineensis Jacq[J]. Plant Science, 2005, 169(3): 571-578. DOI:10.1016/j.plantsci.2005.05.001 |
| [16] |
Rodríguez-Concepción M, Ahumada I, Diez-Juez E, et al. 1-Deoxy-d-xylulose 5-phosphate reductoisomerase and plastid isoprenoid biosynthesis during tomato fruit ripening[J]. Plant J, 2001, 27(3): 213-222. DOI:10.1046/j.1365-313x.2001.01089.x |
| [17] |
Lois LM, Rodríguez-Concepción M, Gallego F, et al. Carotenoid biosynthesis during tomato fruit development:regulatory role of 1-deoxy-d-xylulose 5-phosphate synthase[J]. The Plant Journal, 2000, 22(6): 503-513. DOI:10.1046/j.1365-313x.2000.00764.x |
| [18] |
刘晶晶, 王富民, 刘国峰, 等. 茶树萜类香气物质代谢谱与相关基因表达谱时空变化的关系[J]. 园艺学报, 2014, 41(10): 2094-2106. |
| [19] |
Cordoba E1, Porta H, Arroyo A, et al. Functional characterization of the three genes encoding 1-deoxy-D-xylulose 5-phosphate synthase in maize[J]. J Exp Bot, 2011, 6: 2023-2038. |
| [20] |
Kim BR, Kim SU, Chang YJ. Differential expression of three 1-deoxy-D-xylulose-5-phosphate synthase genes in rice[J]. Biotechnology Letters, 2005, 27: 991-1001. DOI:10.1007/s10529-005-7847-3 |
| [21] |
Florence B, Alain H, Claud S, et al. Dedicated roles of plastid transketolases during the early onset of isoprenoid biogenesis in pepper fruits[J]. Plant Physiology, 1998, 117: 1423-1431. DOI:10.1104/pp.117.4.1423 |
| [22] |
Cordoba E, Porta H, Arroyo A, et al. Functional characterization of the three genes encoding 1-deoxy-D-xylulose 5-phosphate synthase in maize[J]. J Exp Bot, 2011, 62(6): 2023-2038. DOI:10.1093/jxb/erq393 |
| [23] |
岳川, 曹红利, 曾建明, 等. 茶树中植物激素研究进展[J]. 茶叶科学, 2012, 32(5): 382-392. |
| [24] |
林坤律, 高锦华. 赤霉素对茶树新梢生长, 茶叶品质和产量的影响[J]. 植物生理学通讯, 1981, 3: 22-27. |
| [25] |
Kim YB, Kim SM, Kang MK, et al. Regulation of resin acid synthesis in Pinus densiflora by differential transcription of genes encoding multiple 1-deoxy-D-xylulose 5-phosphate synthase and 1-hydroxy-2-methyl-2-(E)-butenyl 4-diphosphate reductase genes[J]. Tree Physiology, 2009, 29: 737-749. DOI:10.1093/treephys/tpp002 |
| [26] |
Cho JY, Mizutani M, Shimizu B, et al. Chemical profiling and gene expression profiling during the manufacturing process of Taiwan oolong tea "oriental beauty"[J]. Biosci Biotechnol Biochem, 2007, 71(6): 1476-1486. DOI:10.1271/bbb.60708 |
| [27] |
陈寿松, 林宏政, 孙云, 等. 乌龙茶萜类物质及其代谢调控研究进展[J]. 中国农业科技导报, 2016, 18(5): 72-80. |
| [28] |
彭浩, 宋文路, 王晓强. 水杨酸, 脱落酸对盐胁迫下玉米种子萌发和幼苗生长的影响[J]. 玉米科学, 2016, 6: 013. |




