2. 浙江理工大学建筑工程学院,杭州 310018
2. College of Civil Engineering and Architecture, Zhejiang Sci-Tech University, Hangzhou 310018
类胡萝卜素是由异戊二烯骨架构成的C40或C30萜类化合物,是一类重要的天然色素的总称,在可见光下呈红色、橙色或黄色[1],是果实和花的重要呈色物质之一。番茄红素环化是类胡萝卜素代谢中的一个重要分支点,植物中存在两种番茄红素环化酶(LCYB和LCYE)。LCYB能对称地催化番茄红素两端各生成1个β环,只有一端被环化时,生成γ-胡萝卜素,另一端进一步被环化后则生成β-胡萝卜素; LCYE仅能催化番茄红素的一端生成ε环,即δ-胡萝卜素,另一端再由LCYB进一步催化生成α-胡萝卜素[2]。氨基酸序列分析表明拟南芥中的LCYB和LCYE同源性为36%,可能有共同的起源[3]。LCYB和LCYE基因表达的相对水平决定了下游由β-胡萝卜素代谢生成的β-隐黄质、玉米黄质、新黄质以及由α-胡萝卜素代谢生成的α-隐黄质和叶黄素等在类胡萝卜素总量中的比例[4-5]。果实中有大量的类胡萝卜素积累,目前克隆出的LCYB和LCYE基因大多为果实和作物中分离出来的。在番茄果实中克隆得到番茄红素-β-环化酶-CrtL-b(LCYB)[6]、番茄红素-ε-环化酶-CrtL-e(LCYE)[7]; 玉米中克隆和鉴定的LCYB和LCYE基因[8-9]; 甘薯中分离出了LCYE基因[10]和LCYB基因等[11]。
桂花(Osmanthus fragrans Lour.)隶属于木犀科木犀属(Osmanthus),是我国十大传统名花之一,也是重要的园林绿化树种。根据开花特性不同,可分为秋桂和四季桂,秋桂品种按照花色不同又分为金桂品种群(黄色至金黄色系)、银桂品种群(黄白色至黄色系)和丹桂品种群(橙色至橙红色系)[12]。桂花花瓣中含有类黄酮化合物和类胡萝卜素两大类色素成分,在黄酮类化合物形成基本浅黄色系的基础上,决定不同品种间花色变化的主要成分是类胡萝卜素,且类胡萝卜素种类及其含量的变化决定不同品种花色的差异[13]。前期研究发现,OfLCYB1、OfLCYE1等基因的差异表达决定了类胡萝卜素代谢分支下游产物的含量。本研究克隆OfLCYB和OfLCYE基因启动子序列,分析顺式作用元件,构建其植物表达载体并进行瞬时表达分析,以期为明确OfLCYB和OfLCYE基因参与类胡萝卜素代谢及其调控机制奠定基础。
1 材料与方法 1.1 材料实验材料为6-8年生的丹桂品种‘堰虹桂’(Osmanthus fragrans ‘Yanhong Gui’),种植于浙江农林大学桂花资源圃。
DNA限制性内切酶、LA Taq酶、核酸分子量标准(DNA marker ladder)、T4-DNA连接酶、克隆载体pMD18-T、大肠杆菌感受态DH5α以及琼脂糖凝胶DNA回收试剂盒、普通质粒小提试剂盒、In-Fusion HD Cloning Kit、XbaⅠ和Hind Ⅲ等均购自TaKaRa公司,染色用X-gluc(5-溴-4-氯-3-吲哚基-beta-D-葡糖苷酸环己胺盐)购于上海生工,pBI121由本实验室保存,其他常规试剂采用进口分装或国产分析纯。
1.2 方法 1.2.1 桂花启动子的克隆及序列分析基因组DNA的提取采用CTAB法[14]。根据‘堰虹桂’LCYB和LCYE基因序列设计引物,由生工生物工程(上海)有限公司合成(表 1)。用限制性内切酶DraⅠ、StuⅠ、Pvu Ⅱ和EcoR Ⅴ分别对桂花基因组DNA进行酶切并连接接头,进行巢式PCR扩增。第二轮反应模板为第一轮反应产物1 µL与49 µL ddH2O混合产物。50 µLPCR反应体系为:模板DNA 1 µL,AP1/AP2 1 µL,GSP1/GSP2 1 µL,10×La PCR buffer 5 µL,dNTP 5 µL,Mg2+ 3.75 µL,LA Taq 1 µL,ddH2O 32.5 µL。第一轮PCR反应条件为:94℃ 25 s,72℃ 3 min,7个循环; 94℃ 25 s,67℃ 3 min,32个循环; 67℃ 7 min。第二轮PCR反应条件为:94℃ 25 s,72℃ 3 min,5个循环; 94℃ 25 s,67℃ 3 min,20个循环; 67℃,7 min。PCR产物经1.2%琼脂糖凝胶电泳检测后,切下目的条带,使用凝胶回收试剂盒回收并纯化。将纯化产物与pMD18-T载体连接,再转化DH5α感受态细胞,接种到含Amp(50 mg/L)的LB平板上37℃培养14-16 h,挑取单菌落进行PCR,测序。用Plantcare(http://bioinformatics.psb.ugent.be/webtools/plantcare/html/)对启动子序列结果进行顺式作用元件预测。
根据上述研究中克隆出的OfLCYB和OfLCYE启动子设计引物(表 2),使用In-Fusion HD Cloning Kit进行表达载体的构建。表达载体pBI121用XbaⅠ和Hind Ⅲ双酶切,10 µL连接体系为2 µL 5× In-Fusion HD Enzyme Premix,2 µL pBI121纯化产物,6 µL目的片段。将连接产物转化大肠杆菌DH5α感受态细胞。挑取单菌落摇菌后进行PCR检测,测序。
制备农杆菌感受态,将构建好的载体转化到根癌农杆菌GV3101中[15],将烟草叶片剪成切成0.5 cm×0.5 cm的叶块,在农杆菌菌液浓度OD600为0.6的侵染液中浸染10 min,用无菌滤纸吸干叶片表面的菌液,将侵染的外植体移至于无菌水浸润的滤纸上培养24 h并进行GUS染色,37℃下保温16-24 h。用乙酸:乙醇(3:1)的混合液脱色后取出观察染色结果[16]。
2 结果 2.1 OfLCYB和OfLCYE启动子的克隆以‘堰虹桂’基因组DNA为模板通过两轮PCR扩增分别获得OfLCYB和OfLCYE启动子片段大约1 kb和900 bp(图 1)。将此片段回收,与pMD18-T载体连接,经菌落PCR验证后,证明该启动子片段已克隆到pMD18-T载体上。阳性克隆测序结果表明,OfLCYB序列长度为1 028 bp,OfLCYE序列长度904 bp。
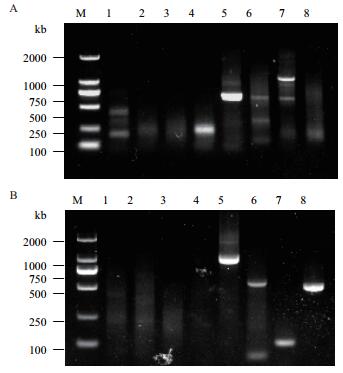
|
| 图 1 ‘堰虹桂’OfLCYB(A)和OfLCYE(B)启动子扩增图谱 M:2000 DNA Marker; 1-4:分别为DraⅠ、StuⅠ、Pvu Ⅱ、EcoR Ⅴ酶切产物1stPCR; 5-8:分别为DraⅠ、StuⅠ、Pvu Ⅱ、EcoR Ⅴ酶切产物2ndPCR) |
通过Plantcare对OfLCYB和OfLCYE启动子进行序列分析发现,OfLCYB启动子在起始密码子上游-156 bp处发现核心元件TATA-box,且多处发现CAAT-box,同时还有光响应元件ACE、Box 4、GATT-motif、Sp1,脱落酸响应元件ABRE,赤霉素响应元件P-box,水杨酸响应元件TCA-element,高转录水平顺式作用元件5' UTR Py-rich stretch,参与昼夜控制的顺式作用调节元件circadian,MYB结合位点MBS以及防御和应激反应中的元件TC-rich repeats等(图 2)。OfLCYE启动子中TATA-box位于起始密码子上游-295 bp处,同时还有两个光响应元件AE-box、G-box,赤霉素响应元件GARE-motif,水杨酸响应元件TCA-element,热击响应元件HSE,参与蛋白代谢调节的顺式调控原件O2-site,厌氧诱导必需的调控元件ARE,胚乳表达所需的调控元件Skn-1_motif等(图 3)。
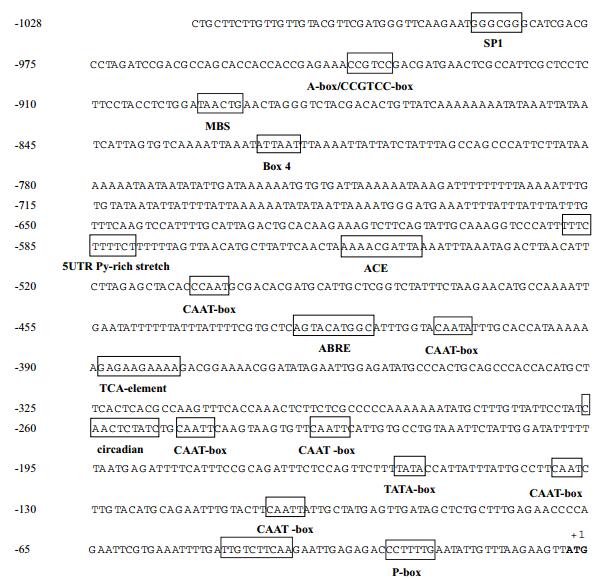
|
| 图 2 OfLCYB启动子中相关顺式作用元件预测分析 |

|
| 图 3 OfLCYE启动子中相关顺式作用元件预测分析 |
构建OfLCYB和OfLCYE启动子表达载体经菌落PCR鉴定准确无误后命名为PBI121-LCYB、PBI121-LCYE。以烟草的叶为受体材料,以含pBI121载体的菌株为阳性对照,以GV3101空菌株为阴性对照,采用农杆菌介导的瞬时表达法对OfLCYB和OfLCYE启动子表达特性进行分析。图 4显示,在农杆菌侵染后的烟草叶片中除了GV3101外均检测到GUS基因的产物,表明所克隆的桂花基因OfLCYB和OfLCYE启动子序列具有启动子功能,同时也表明这两个启动子均具有驱动下游GUS报告基因表达的能力。但由图中结果可以看出,OfLCYB启动子驱动报告基因在烟草叶片中只是少量表达(图 4-C)。
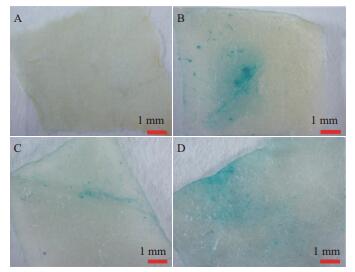
|
| 图 4 OfLCYB和OfLCYE启动子瞬时表达检测 A:阴性对照; B:阳性对照; C:OfLCYB启动子; D:OfLCYE启动子 |
目前在花中LCYB和LCYE基因已从菊花(Chrysanthemum moriflium)[17]、黄花龙胆(Gentiana lutea)[5]、金花茶(Camellia nitidissima)[18]、鹤望兰(Strelitzia reginae)[19]等植物中分离出来。‘堰虹桂’花瓣中的类胡萝卜素主要为α-胡萝卜素和β-胡萝卜素。对类胡萝卜素合成途径中的相关基因进行qRT-PCR分析,在铃梗期到初开期的过程中OfLCYE表达量上升,到盛开期下降[20]。
植物启动子在调控基因表达过程中起关键作用,关于LCYB和LCYE启动子的研究较少,目前仅在番茄(Solanum habrochaites)[21]、杧果(Mangifera indica)[22]、西瓜(Citrullus lanatus)[23]等作物上有报道。李静[24]在研究黄瓜和西瓜基因组中类胡萝卜素合成相关基因的比较分析中将3种葫芦科植物的LCYB和LCYE启动子序列进行比较,发现LCYB的启动子序列是高度保守的,而LCYE启动子序列不同物种间会有一段序列的插入或缺失,但这并不是造成番茄红素积累差异的原因。柑橘CsLCYb1启动子长度为1 584 bp,含有大量激素响应元件如赤霉素响应元件GARE-motif、水杨酸响应元件the TCA motif和生长素响应元件TGA motif等,并通过相应的激素诱导说明其能提高CsLCYb1启动子活性[25]。外源GA3处理抑制番茄成熟过程中各部位类胡萝卜素和番茄红素含量,对β-胡萝卜素含量的影响表现为先抑制后促进的作用; 外源ABA处理増加了番茄果实中类胡萝素和β-胡萝卜素的含量[26]。OfLCYB和OfLCYE启动子都具有多个激素响应元件。OfLCYB启动子中包含一个脱落酸响应元件ABRE,水杨酸响应元件TCA-element和一个赤霉素响应元件P-box; OfLCYE启动子中包含一个赤霉素响应元件GARE-motif和3个水杨酸响应元件TCA-element,推测这两个启动子的转录水平应该受到ABA、赤霉素和水杨酸等激素的影响。有研究表明植物基因5' UTR区对基因的表达调控起着重要作用[27],水稻中的5' UTR的内含子可使rubi3的转录水平大幅度提升[28]。在OfLCYB启动子-585 bp处有一个5' UTR区,可能对该基因的表达起重要的调控作用。在OfLCYB启动子-896 bp处发现一个MYB的结合位点MBS,推测MYB也可能对LCYB的表达起调控作用。OfLCYE启动子-520 bp处含有一个热激响应元件HSE,表明该基因表达可能受温度调控。除此之外,OfLCYB和OfLCYE启动子含有多个不同类型的光响应元件,如ACE、Box 4、GATT-motif、Sp1、AE-box和G-box,推测OfLCYB和OfLCYE启动子的表达可能受光信号的调控。在不同的光周期和不同的光质条件下,越桔(Vaccinium myrtillus L.)果实中包括LCYB和LCYE在内的类胡萝卜素代谢途径中的相关基因表达水平不同,说明光照对LCYB和LCYE的表达可能有一定的影响[29]。
瞬时表达结果表明OfLCYB和OfLCYE启动子可以驱动GUS基因在烟草叶片中的表达,但OfLCYB启动子驱动基因表达较少,这可能是由于OfLCYB启动子活性较低或具有组织表达特异性所致。前期研究发现在不同温度处理下‘堰虹桂’OfLCYB和OfLCYE的表达量随温度变化有明显变化,尤其是OfLCYB基因。本研究对OfLCYB和OfLCYE启动子中的元件预测发现仅OfLCYE启动子中含与温度相关的元件HSE,而OfLCYB启动子中大多数为激素相关元件。在用25 mg/L和50 mg/L的水杨酸对红潮球菌(Haematococcus pluvialis)进行处理发现包括LCY基因在内的部分类胡萝卜素代谢相关基因的转录水平得到明显提高[30]。因此推测在桂花中这些激素先与温度相互作用,而后进一步共同调控基因的表达。相关结果有待进一步实验加以验证。
4 结论本实验克隆了桂花番茄红素环化酶基因OfLCYB和OfLCYE启动子,并通过瞬时表达分析证明了这两个启动子具有活性。这两个启动子都含有一些水杨酸、赤霉素等激素响应元件,推测对这两个基因的表达起了一定作用。
| [1] |
Hirschberg J. Carotenoid biosynthesis in flowering plants[J]. Curr Opin Plant Biol, 2001, 4(3): 210-218. DOI:10.1016/S1369-5266(00)00163-1 |
| [2] |
高慧君, 明家琪, 张雅娟, 等. 园艺植物中类胡萝卜素合成与调控的研究进展[J]. 园艺学报, 2015, 42(9): 1633-1648. |
| [3] |
Jr CF, Pogson B, Sun Z, et al. Functional analysis of the beta and epsilon lycopene cyclase enzymes of Arabidopsis reveals a mechanism for control of cyclic carotenoid formation[J]. Plant Cell, 1996, 8(9): 1613-1626. |
| [4] |
Harjes CE, Rocheford TR, Bai L, et al. Natural genetic variation in lycopene epsilon cyclase tapped for maize biofortification[J]. Science, 2008, 319(5861): 330-333. DOI:10.1126/science.1150255 |
| [5] |
Zhu C, Yamamura S, Nishihara M, et al. cDNAs for the synthesis of cyclic carotenoids in petals of Gentiana lutea and their regulation during flower development[J]. Biochimica Et Biophysica Acta, 2003, 1625(3): 305-308. DOI:10.1016/S0167-4781(03)00017-4 |
| [6] |
Pecker I, Gabbay R, Cunningham FX, et al. Cloning and characterization of the cDNA for lycopene β-cyclase from tomato reveals decrease in its expression during fruit ripening[J]. Plant Molecular Biology, 1996, 30(4): 807-819. DOI:10.1007/BF00019013 |
| [7] |
Ronen G, Cohen M, Zamir D, et al. Regulation of carotenoid biosynthesis during tomato fruit development:expression of the gene for lycopene epsilon-cyclase is down-regulated during ripening and is elevated in the mutant Delta[J]. Plant Journal, 1999, 17(4): 341-351. DOI:10.1046/j.1365-313X.1999.00381.x |
| [8] |
Singh M, Brutnell TP. Activator mutagenesis of the pink scutellum1/viviparous7 locus of maize[J]. Plant Cell, 2003, 15(4): 874. DOI:10.1105/tpc.010249 |
| [9] |
Bai L, Kim EH, Dellapenna D, et al. Novel lycopene epsilon cyclase activities in maize revealed through perturbation of carotenoid biosynthesis[J]. Plant Journal for Cell & Molecular Biology, 2009, 59(4): 588-599. |
| [10] |
Ling YU, Hong Z, Wei C, et al. Cloning and Functional Analysis of Lycopene ε-Cyclase(IbLCYe)Gene from Sweetpotato, Ipomoea batatas(L.)Lam[J]. Journal of Integrative Agriculture, 2013, 12(5): 773-780. DOI:10.1016/S2095-3119(13)60299-3 |
| [11] |
Sun HK, Jeong JC, Park S, et al. Down-regulation of sweetpotato lycopene β-cyclase gene enhances tolerance to abiotic stress in transgenic calli[J]. Mol Biol Rep, 2014, 41(12): 8137-8148. DOI:10.1007/s11033-014-3714-4 |
| [12] |
向其柏, 刘玉莲. 中国桂花品种图志[M]. 杭州: 浙江科学技术出版社, 2008.
|
| [13] |
王艺光. 桂花花瓣类胡萝卜素的呈色作用及其响应温度变化的机制[D]. 杭州: 浙江农林大学, 2016.
|
| [14] |
王关林, 方宏筠. 植物基因工程[M]. 第2版. 北京: 科学出版社, 2002.
|
| [15] |
An G. Binary ti vectors for plant transformation and promoter analysis[J]. Methods in Enzymology, 1987, 153(153C): 292-305. |
| [16] |
李孟娇. 柑橘果实成熟特异启动子的分离与功能初步分析[D]. 杭州: 浙江农林大学, 2013. http://www.wanfangdata.com.cn/details/detail.do?_type=degree&id=Y2365164
|
| [17] |
Kishimoto S, Ohmiya A. Regulation of carotenoid biosynthesis in petals and leaves of chrysanthemum(Chrysanthemum moriflium)[J]. Physiol Plant, 2006, 128(3): 436-447. DOI:10.1111/ppl.2006.128.issue-3 |
| [18] |
周兴文, 康梅生, 冯晓娟, 孙迎坤. 金花茶CnLCYE基因cDNA克隆及表达载体构建[J]. 分子植物育种, 2017, 15(7): 2556-2562. |
| [19] |
樊荣辉, 黄敏玲, 钟淮钦, 林兵. 鹤望兰番茄红素β-环化酶基因SrLCYB的克隆及表达分析[J]. 中国细胞生物学学报, 2016, 38(4): 382-388. DOI:10.11844/cjcb.2016.04.0376 |
| [20] |
Zhang C, Wang Y, Fu J, et al. Transcriptomic analysis and carotenogenic gene expression related to petal coloration in Osmanthus fragrans, 'Yanhong Gui'[J]. Trees, 2016, 30(4): 1207-1223. DOI:10.1007/s00468-016-1359-8 |
| [21] |
Dalal M, Chinnusamy V, Bansal KC. Isolation and functional characterization of lycopene beta-cyclase(CYC-B)promoter from Solanum habrochaites[J]. Bmc Plant Biology, 2010, 10(1): 1-15. DOI:10.1186/1471-2229-10-1 |
| [22] |
许文天, 马小卫, 武红霞, 等. 杧果MiLCYB2基因启动子的克隆与序列分析[J]. 果树学报, 2015, 32(4): 561-566. |
| [23] |
Bang H, Yi G, Kim S, et al. Watermelon lycopene-β-cyclase:promoter characterization leads to the development of a PCR marker for allelic selection[J]. Euphytica, 2014, 200(3): 363-378. DOI:10.1007/s10681-014-1158-5 |
| [24] |
李静. 黄瓜和西瓜基因组中类胡萝卜素合成相关基因的比较分析[D]. 泰安: 山东农业大学, 2014. http://www.wanfangdata.com.cn/details/detail.do?_type=degree&id=Y2587708
|
| [25] |
Lu S, Yin Z, Zheng X, et al. Isolation and functional characterization of a lycopene β-cyclase gene promoter from citrus[J]. Frontiers in Plant Science, 2016, 7(1367): 1-14. |
| [26] |
于洋. 外源GA3和ABA对番茄果实主要色素形成的影响及生理机制研究[D]. 沈阳: 沈阳农业大学, 2016. http://cdmd.cnki.com.cn/Article/CDMD-10157-1017017310.htm
|
| [27] |
Karthikeyan AS, Ballachanda DN, Raghothama KG. Promoter deletion analysis elucidates the role of cis elements and 5' UTR intron in spatiotemporal regulation of AtPht1;4 expression in Arabidopsis[J]. Physiol Plant, 2009, 136(1): 10-18. DOI:10.1111/ppl.2009.136.issue-1 |
| [28] |
Samadder P, Sivamani E, Lu J, et al. Transcriptional and post-transcriptional enhancement of gene expression by the 5' UTR intron of rice rubi3, gene in transgenic rice cells[J]. Mol Genet Genomics, 2008, 279(4): 429-439. DOI:10.1007/s00438-008-0323-8 |
| [29] |
Katja K, Laura Z, Marian S, et al. Carotenoid metabolism during bilberry(Vaccinium myrtillus L.)fruit development under different light conditions is regulated by biosynthesis and degradation[J]. Bmc Plant Biology, 2016, 16(1): 1-16. DOI:10.1186/s12870-015-0700-5 |
| [30] |
Gao Z, Meng C, Zhang X, et al. Induction of salicylic acid(SA)on transcriptional expression of eight carotenoid genes and astaxanthin accumulation in Haematococcus pluvialis[J]. Enzyme & Microbial Technology, 2012, 51(4): 225-230. |






