2. 玉林师范学院生物与制药学院,玉林 537000
2. College of Biology and Pharmacy, Yulin Normal University, Yulin 537000
铁皮石斛(Dendrobium officinale)是兰科石斛属多年生附生草本植物,不仅有观赏价值,而且具有滋阴补肾、生津益胃、润肺止咳等功效,被称为“中华九大仙草”之首。多糖是其主要药理活性物质之一,也是目前评判铁皮石斛品质的主要指标(中国药典一部,2015)。蔗糖是多糖合成前体物质,它只有分解为葡萄糖和果糖,才能进入下游各种代谢途径,因此研究蔗糖代谢相关酶活性是研究铁皮石斛多糖积累的重要组成部分。转化酶(Invertase,INV)是调节蔗糖代谢的关键酶之一,能不可逆地催化蔗糖水解成葡萄糖和果糖,在蔗糖的转运、贮藏、分配、以及作物经济产量形成与果实品质改良中发挥重要作用[1]。INV基因的表达受转录和翻译水平的双重调控,转化酶抑制子(Invertase inhibitor,InvInh)是转化酶翻译后酶活性的重要调节因子[2]。该类蛋白属于非糖基化蛋白; 具有热稳定性,短时高温仍具有抑制转化酶活性的作用; 对转化酶的抑制作用具有交叉抑制现象; 不受低温、盐胁迫和成熟等的诱导[3]。
InvInh在转化酶翻译后水平起调节作用,它通过与转化酶结合,而使转化酶失去活性。与酸性转化酶分类相对应,InvInh家族基因也分为液泡转化酶抑制子(Vacuolar invertase inhibitors of β-fructosidase,VIF))和细胞壁结合转化酶抑制子(Cell wall invertase inhibitors of β-fructosidase,CIF),属于INV/PMEI(Invertase and pectin methylesterase inhibitors)家族成员[4]。InvInh对细胞壁结合转化酶(Cell wall invertase,CIN)活性的调节是通过碳源实现的。当碳源有限时,InvInh能抑制CIN酶活性,此时蔗糖合成酶主要起分解蔗糖作用。当蔗糖浓度充足时,CIN才被激活。InvInh只与“空闲”的CIN结合,可保护“空闲”的CIN免遭降解,具有分子伴侣的功能[5]。番茄CIN(LIN5)和CIF基因存在于筛管的细胞壁上[6]。InvInh和INV以离子键相结合,将InvInh酶加入烟草悬浮培养细胞中,该酶可以在细胞壁上自由移动,能与CIN酶结合形成InvInh/CIN复合物,从而抑制CIN酶活性。在pH 4.5时,拟南芥AtCIF与CIN的结合量最大。在该pH值条件下,CIF与蔗糖竞争INV的同一结合位点,CIF能与CIN紧密结合,使CIN失去酶活性[7]。InvInh酶活性具有剂量依赖型的抑制作用,其使转化酶酶活性降低50%的Ki值为3.82×10-5 mol/L[8]。此外,InvInh基因在马铃薯“低温糖化”过程中也发挥重要作用。在4℃低温胁迫下,马铃薯StINV1/StInvInh2基因的相对表达量与块茎中还原糖的积累呈显著的相关性,StInvInh2通过抑制StINV1酶活性,调节块茎中还原糖的含量变化,以适应低温环境[9]。在低温储藏过程中过量表达StInvInh2基因,能增加冷敏感型马铃薯块茎中InvInh酶活性,降低液泡转化酶活性,降低还原糖含量[10]。
本研究根据课题组前期构建的铁皮石斛转录组数据库,从中筛选到3个InvInh基因,采用RT-PCR和RACE方法克隆其全长cDNA序列(分别命名为DoInvInh1、DoInvInh2和DoInvInh3)。同时,利用生物信息学软件分析该蛋白家族基因的理化特性和蛋白结构,采用实时荧光定量PCR方法分析DoInvInh家族基因成员在铁皮石斛不同组织部位中的表达,旨为研究InvInh家族基因对转化酶的抑制机理奠定理论基础。
1 材料与方法 1.1 材料 1.1.1 实验材料铁皮石斛取自玉林师范学院生物与制药学院观赏经济植物培育基地。以铁皮石斛幼嫩叶片cDNA为材料进行基因克隆。于2016年5月10日分别取2年生的铁皮石斛根、茎、叶和花,以及1-3年生铁皮石斛的茎为材料。液氮速冻后,用于RNA提取的材料置-80℃保存,用于酶活性测定的材料置于-20℃保存。
1.1.2 试剂RNA提取Trizol试剂盒购于天根生化科技(北京)有限公司; 5¢RACE试剂盒购于Invitrogen公司; RNA反转录试剂盒、Ex Taq酶、dNTPs、pMD18-T载体、PrimeScript RT reagent Kit With gDNA Eraser、Genome Walking Kit、SYBR Premix Ex Tap Ⅱ购自TaKaRa宝生物工程(大连)公司。本试验所用特异引物由上海生工生物工程技术服务有限公司合成。实时荧光定量PCR采用ABI Stepone Plus型荧光定量PCR仪。
1.2 方法 1.2.1 RNA提取和cDNA合成以铁皮石斛幼嫩叶为材料提取总RNA,RNA提取采用天根Trizol-A+提取液,具体提取过程参照Trizol试剂盒说明书。利用琼脂糖凝胶电泳检测总RNA完整性,利用Thermo Scientific Nanodrop 2000c检测总RNA浓度及纯度。反转录按照ReverAid First Strand cDNA Synthesis Kit试剂盒说明书反转录成cDNA第一链。
1.2.2 铁皮石斛InvInh基因克隆和拼接验证从铁皮石斛叶片转录组数据库中筛选到3个 InvInh基因核苷酸序,DoInvInh1、DoInvInh2和DoInvInh3序列大小分别为928 bp、722 bp和488 bp,经NCBI ORF Finder在线预测和同源性比对分析,发现DoInvInh1和DoInvInh2基因已经获得全长基因序列,而DoInvInh3基因在3'片段还缺少大约90 bp核苷酸序列,通过设计引物,采用3'RACE技术进行基因克隆。
依据DoInvInh3基因中间片段的核苷酸序列,设计用于3'端扩增的2条特异上游引物:XYF1和XYF2(表 1)。以提取的铁皮石斛叶总RNA为模板,按照ReverAidTM First Strand cDNA Synthesis Kit试剂盒说明书,以GZS(5'-GGCCACGCGTCGACTAGTACTTTTTTTTTTTTTTTTTT-3')作为反转录引物,反转录合成cDNA第一链。用XYF1和XYR1引物进行第1轮PCR扩增,PCR产物稀释20倍后作为引物XYF2和XYR1的模板,进行第2轮PCR扩增。PCR反应程序:94℃ 5 min; 94℃ 50 s,57℃ 30 s,72℃ 1.30 min,35个循环; 72℃ 10 min。产物经胶回收纯化后克隆到T载体并测序,测序结果246 bp。利用ContigExpress软件将3'序列和中间片段核苷酸序列进行拼接后,获得了DoInvInh3全长cDNA序列。在DoInvInh1、DoInvInh2和DoInvInh3基因的编码区序列两端,分别设计引物:F1和R1、F2和R2、F3和R3进行PCR扩增验证,引物序列如表 1所示。扩增体系为25 µL(下同):Ex Taq酶0.25 µL、2×GC Buffer Ⅱ 12.5 µL、2.5 mmol L-1 dNTPs 1.5 µL、10 mmol/L上下游引物各1 µL,模板cDNA 1 µL和ddH2O 7.75 µL。DoInvInh1 PCR反应体系:94℃ 5 min; 94℃ 50 s,58℃ 30 s,72℃ 1min,35个循环; 72℃延伸10 min。DoInvInh2和DoInvInh3 PCR扩增时的退火温度分别为57℃和56℃。PCR产物经胶回收纯化后克隆到T载体,转入感受态细胞DH5α中,经菌液PCR检测正确后送深圳华大测序。
利用http://web.expasy.org/protparam分析编码蛋白的氨基酸组成、理论分子量和等电点; 利用http://www.ch.embnet.org/software/TMPRED_form.html分析跨膜结构; 利用MEGA6.0软件构建基因系统进化树; 利用http://www.cbs.dtu.dk/services/TargetP分析蛋白的亚细胞定位; 利用http://smart.embl-heidelberg.de进行保守结构域预测; 利用Vector NTI Advance 11.0进行氨基酸序列同源性比对分析; 利用http://www.cbs.dtu.dk/services/SignalP分析蛋白信号肽; 利用http://hits.isb-sib.ch/cgi-bin/motif_scan分析蛋白的活性位点。
1.2.4 基因表达、转化酶酶活性和还原糖含量的测定依据3个DoInvInh基因的全长cDNA核苷酸序列,设计用于实时荧光定量PCR的引物:TF1和TR1、TF2和TR2、TF3和TR3(表 1)。以持家基因Actin为内参基因,引物序列参照蒋园等[11]的方法。利用荧光染料法进行实时荧光定量表达分析,反应参数:95℃ 30 s,一个循环; 95℃ 5 s,60℃ 20 s,共45个循环。采用2-ΔΔCT法分析数据,分析基因的相对表达量。茎中还原糖含量的测定,采用硫酸蒽酮法。可溶性酸性转化酶(Soluble acid invertase,SAI)和细胞壁结合转化酶(Cell wall invertase,CIN)酶活性的提取和测定参照牛俊奇等[12]的方法。利用SPSS19.0进行数据分析,采用Duncan新复极差法,显著水平为0.05。采用Pearson相关系数法分析相关性。
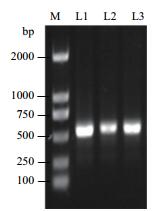
2 结果 2.1 铁皮石斛InvInh家族基因的克隆和序列分析DoInvInh1、DoInvInh2和 DoInvInh3基因的编码区引物的PCR扩增产物,经1%琼脂糖凝胶电泳检测(图 1)。其序列测序结果分别为531 bp、534 bp和537 bp,与预测的大小相符,与从转录组数据中筛选出的InvInh基因的同源性都在99.5%以上,说明拼接结果正确。DoInvInh1基因cDNA序列全长928 bp,包含6 bp的5'非翻译区(Untranslated Regions,UTR),391 bp的3'UTR和1个531 bp开放阅读框(Open reading frame,ORF),编码176个氨基酸。DoInvInh2基因cDNA序列全长722 bp,包含84 bp的5'UTR,104 bp的3'UTR和1个534 bp的ORF,编码177个氨基酸。DoInvInh3基因cDNA序列全长674 bp,包含32 bp的5'UTR,105 bp的3'UTR和1个534 bp的ORF,编码178个氨基酸。这3个DoInvInh基因已在GenBank数据库注册,其注册号为KY947274-KY947276(表 2)。
|
| 图 1 铁皮石斛3个DoInvInh基因ORF序列的PCR扩增产物的电泳检测 M:DL2000 DNA ladder; 泳道L1、L2和L3分别代表DoInvInh1、DoInvInh2和DoInvInh3基因 |
利用ProtParam对3个DoInvInh蛋白的理化性质进行分析,预测分子量在18.38-18.84 kD,等电点在4.4-6.25。DoInvInh2蛋白和DoInvIn3蛋白的等电点比较接近,都在6.0以上,而DoInvInh1蛋白的等电点较低,为4.4。3个DoInvInh基因核苷酸序列同源率在49%-60%之间,氨基酸序列同源性在28%-41%之间,其中DoInvInh2蛋白的氨基酸与DoInvIn3蛋白的氨基酸序列同源性比较高,为41%,而DoInvInh2和DoInvIn3之间氨基酸序列同源性较低,为28%(表 2)。3个DoInvInh蛋白的亲水性指数为0.06-0.121,为疏水性蛋白; 不稳定指数在30.49-48.01之间,为不稳定蛋白; 都具有2个跨膜结构和PMEI蛋白的保守结构域。在N端都具有一个1-23 bp信号肽序列; Target P1.1在线软件预测3个DoInvInh蛋白都属于分泌型蛋白,其可能性为分别为0.931、0.712和0.959;利用Motif Scan Results进行蛋白活性位点的分析,3个DoInvInh蛋白都具有糖基化位点、络蛋白激酶Ⅱ磷酸化位点、豆蔻酰化位点和蛋白激酶C磷酸化位点。
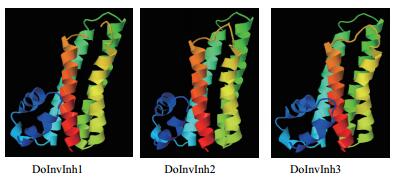
2.3 DoInvInh家族蛋白的二级和三级结构预测分析利用http://bioinf.cs.ucl.ac.uk/psipred分析蛋白的二级结构,结果(图 2)显示3个DoInvInh蛋白都含有7个α-螺旋,不含β-折叠。在DoInvInh1、DoInvInh2和DoInvInh3蛋白二级结构中,α-螺旋分别占80%,79%和79%,无规则卷曲分别占23%、21%和20%,跨膜螺旋分别占9%、10%和9%,且3个跨膜螺旋都位于第7个α-螺旋上。利用Phyre2预测三级结构,3个DoInvInh蛋白的具有相似的三级空间结构。
|
| 图 2 DoInvInh蛋白的三级结构预测 |
运用Vector NTI Advance 11软件上的AlignX对10种(铁皮石斛、拟南芥、甜瓜、黄瓜、马铃薯、大麦、水稻、高粱、甘蔗和玉米)植物的12个InvInh蛋白的氨基酸序列进行同源性比对分析(图 3)。InvInh蛋白的氨基酸序列在不同植物间保守性较差,不同物种间氨基酸序列的同源性在20%-50%之间。但所选的InvInh蛋白都具有10个保守的氨基酸,分别是1个丙氨酸Ala、1个络氨酸Tyr、2个赖氨酸Leu、4个保守的半胱氨酸Cys位点和1个保守SP位点(丝氨酸Ser和脯氨酸Pro)。结合DoInvInh蛋白的二级结构分析,4个Cys位点分别位于第2,第3,第5和第6个α-螺旋上。

|
| 图 3 DoInvInh蛋白与其他植物InvInh蛋白的多序列比对 进行多重比对的氨基酸序列为:AtInvInh1(NP199505),CmInvInh1(XP008465919),CsInvInh1(XP004173644),StInvInh1(XP006354680),HvInvInh1(AK375354),OsInvInh1(Os02g46360),SbInvInh1(XP002447003),SoInvInh1(KF575175),ZmInvInh1(XP008668976) |
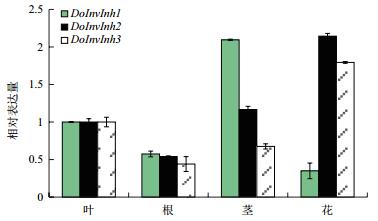
荧光定量PCR分析表明,DoInvInh1、DoInvInh2和DoInvInh3基因在铁皮石斛根、茎、叶和花中均有表达,且具有一定的组织表达特异性(图 4)。DoInvInh1基因在茎中表达量最高,叶中次之,在花中最低,其中该基因在茎中表达量分别是叶和花中基因表达量的2.09倍和5.99倍。DoInvInh2和DoInvInh3基因在铁皮石斛不同部位表达模式相似,都是在花中表达量最高,根中表达量最低。DoInvInh2和DoInvInh3在花中基因的表达量分别是根中基因表达量的3.97倍和4.07倍。DoInvInh2基因在茎中基因表达量高于叶中基因表达量,而DoInvInh3基因则相反。
|
| 图 4 三个DoInvInh基因在铁皮石斛不同部位中的表达分析 |
在3年生铁皮石斛植株中,DoInvInh1和DoInvInh3基因在茎中的表达模式相同,其基因表达量都呈“1年生茎>2年生茎>3年生茎”(图 5),DoInvInh1和DoInvInh3基因在1年生茎中基因表达量分别是3年生茎中基因表达量的3.84和3.55倍。DoInvInh2基因在2年生茎中基因表达量最高,1年生茎中次之,3年生茎中最低。其中2年生茎中基因表达量分别是1年生茎和3年生茎中基因表达量的1.79倍和3.40倍。
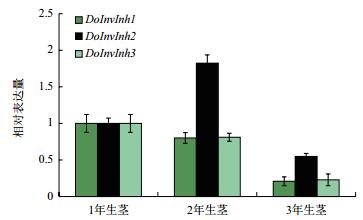
|
| 图 5 铁皮石不同生长年限茎中InvInh基因的表达分析 |
1年生茎中可溶性糖含量显著高于2年生和3年生茎中的可溶性糖含量(图 6),而2年生茎与3年生茎中可溶性糖含量差异不显著。SAI酶活性在铁皮石斛不同生长年限的茎中表达模式呈“ 1年生茎>2年生茎>3年生茎”(图 7),其中1年生茎中SAI酶活性是3年生茎中的1.43倍,达到差异显著水平。而CIN酶活性则相反,呈“ 3年生茎>2年生茎>1年生茎”,CIN酶在3年生茎中的酶活性分别是1年生茎和2年生茎中酶活性的4.69和1.57倍,且酶活性均达到差异显著水平(图 8)。相关性分析表明,茎中可溶性糖与SAI酶活性呈显著正相关,其相关系数分别为0.944。CIN与SAI酶活性呈显著负相关,相关系数为-0.997。DoInvInh1和DoInvInh3基因表达量与CIN酶活性呈显著负相关,相关系数分别为-0.948和-0.946。
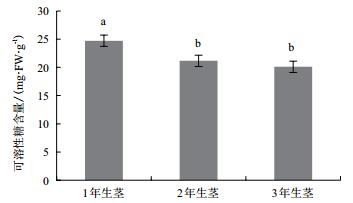
|
| 图 6 铁皮石斛不同生长年限茎中可溶性糖含量分析 |
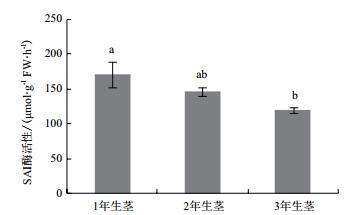
|
| 图 7 铁皮石不同生长年限茎中SAI酶活性分析 |
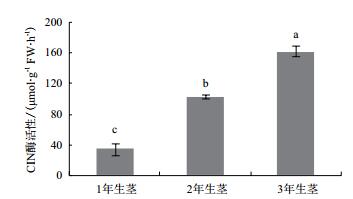
|
| 图 8 铁皮石不同生长年限茎中CIN酶活性分析 |
随着核苷酸测序技术的不断发展,植物转录组成为一个新的研究热点。基于高通量转录组数据的分析研究,将有助于获得新的功能基因,为种质资源鉴定、保存、扩大与优良种质选育奠定分子基础。本研究在铁皮石斛叶片转录组数据分析的基础上,采用PCR技术首次从铁皮石斛中克隆出3个DoInvInh基因,它们所编码蛋白都具有保守的PMEI结构域,都属于INV/PMEI家族基因成员。3个DoInvInh蛋白N端都具有4个不对称的α-螺旋结构和4个保守的Cys位点,它们在稳定InvInh蛋白构型和功能中起作用。4个α-螺旋在维持InvInh蛋白结构的完整性中起重要作用,而4个α-螺旋结合区是与酸性转化酶结合的重要区域[13]。不同物种InvInh蛋白的氨基酸序列差异较大,即使在同一物种内其氨基酸序列也不保守,但都包含4个保守的Cys[14]。3个DoInvInh蛋白推测的三级结构相似,其中第1和第2个Cys形成分子内第1个二硫键,第3和第4个Cys形成分子内第2个二硫键。二硫苏糖醇(DTT)能破坏分子内二硫键,使InvInh失去抑制作用。烟草抑制子在高温和低pH值下能保持稳定,就是由于Cys间形成了分子内结构稳定的二硫桥的缘故[15]。
基因的表达模式分析可为基因功能的揭示提供重要线索。通过RNAi沉默大豆GmCIF基因的表达,能提高CIN酶活性,增加种子重量,同时能提高成熟种子中己糖、淀粉和蛋白质的含量[16]。番茄(SiVIF)通过与液泡转化酶(SiVI)相互作用,来调节蔗糖代谢过程,进而影响果实成熟。采用RNAi技术沉默番茄SlVIF基因的表达,番茄果实成熟延迟,而过表达SlVIF可以加速番茄果实成熟[17]。拟南芥AtCIF1基因定位于非原质体,在CIF缺少的突变体中,种子萌发后的24 h内CIN酶活性和己糖含量都显著升高。而在过表达AtCIF1的拟南芥植株中,CIN酶活性受到抑制,能推迟种子萌发。AtCIF1在翻译后水平调节CIN酶活性,通过调节蔗糖水解和糖信号,促进拟南芥种子萌发和早期生长[18]。本研究结果也表明,铁皮石斛茎中DoInvInh1和DoInvInh3基因表达量与CIN酶活性呈显著负相关,说明这2个基因可能具有抑制CIN酶活性的作用。而通过上述转基因实验也证明过量表达InvInh基因,能抑制转化酶活性,进而调节蔗糖代谢和库强。
在拟南芥保卫细胞中过量表达烟草CIF基因,与野生型相比保卫细胞液泡转化酶酶活性、气孔和电导度都降低了,但抗旱能力提高了[19]。同时,RNAi抑制烟草CIN酶活性,能促进碳水化合物的消耗,降低合成次级代谢产物的能力[20]。以上实验均表明InvInh在对转化酶酶活性调节中发挥重要作用,因此从分子水平上对InvInh基因研究的不断深入,能使人们逐渐从本质上了解该基因的组成、结构及调控机理,为更好的调节其在植物中的表达和酶活性,改变库组织的蔗糖输入速率及同化物的分配和改善品质提供依据和技术支持。
4 结论本研究从铁皮石斛中克隆到3个InvInh基因,它们编码的蛋白都具有1个信号肽、2个跨膜结构和PMEI蛋白的保守结构域。DoInvInh蛋白都具有4个保守的Cys位点和SP位点,氨基酸序列同源性较低。3个DoInvInh基因在根、茎、叶和花均有表达,且表达模式不同。铁皮石斛不同生长年限茎中DoInvInh1和DoInvInh3基因的表达模式相似,在1年生茎中表达量最高,2年生茎中次之,3年生茎中最低。DoInvInh1和DoInvInh3基因表达量与CIN酶活性都呈显著负相关,推测这2个基因可能在调节茎中CIN酶活性中起作用。
| [1] |
Sturm A. Invertases:primary structures, functions and roles in plant development and sucrose partitioning[J]. Plant Physiol, 1999, 121(1): 1-8. DOI:10.1104/pp.121.1.1 |
| [2] |
Jin Y, Ni DA, Ruan YL. Posttranslational elevation of cell wall invertase activity by silencing its inhibitor in tomato delays leaf senescence and increases seed weight and fruit hexose level[J]. Plant Cell, 2009, 21(7): 2072-2089. DOI:10.1105/tpc.108.063719 |
| [3] |
成善汉, 柳俊, 谢从华, 等. 植物转化酶抑制子及其分子生物学的研究进展[J]. 海南大学学报:自然科学版, 2007, 25(1): 83-87. |
| [4] |
Rausch T, Greiner S. Plant protein inhibitors of invertases[J]. Biochim Et Biophys Acta, 2004, 1696(2): 253-261. DOI:10.1016/j.bbapap.2003.09.017 |
| [5] |
Krausgrill S, Greiner S, Köster U, et al. In transformed tobacco cells the apoplasmic invertase inhibitor operates as a regulatory switch of cell wall invertase[J]. Plant J, 1998, 13(2): 275-280. DOI:10.1046/j.1365-313X.1998.00026.x |
| [6] |
Palmer W, Ru L, Jin Y, et al. Tomato ovary-to-fruit transition is characterized by a spatial shift of mRNAs for cell wall invertase and its Inhibitor with the encoded proteins localized to sieve elements[J]. Mol Plant, 2015, 8(2): 315-328. DOI:10.1016/j.molp.2014.12.019 |
| [7] |
Hothorna M, Ende WVD, Lammens WL, et al. Structural insights into the pH-controlled targeting of plant cell-wall invertase by a specific inhibitor protein[J]. Proc Nati Acad Sci USA, 2010, 107(40): 17427-17432. DOI:10.1073/pnas.1004481107 |
| [8] |
Huang GJ, Sheu MJ, Chang YS, et al. Isolation and characterisation of invertase inhibitor from sweet potato storage roots[J]. J Sci Food Agr, 2008, 88(15): 2615-2621. DOI:10.1002/jsfa.v88:15 |
| [9] |
Liu X, Song BT, Zhang HL, et al. Cloning and molecular characterization of putative invertase inhibitor genes and their possible contributions to cold-induced sweetening of potato tubers[J]. Molecular Genetics Genomics, 2010, 284(3): 147-159. DOI:10.1007/s00438-010-0554-3 |
| [10] |
Mckenzie MJ, Chen RKY, Harris JC, et al. Post-translational regulation of acid invertase activity by vacuolar invertase inhibitor affects resistance to cold-induced sweetening of potato tubers[J]. Plant Cell Environ, 2013, 36(1): 176-185. DOI:10.1111/pce.2013.36.issue-1 |
| [11] |
蒋园, 朱玉球, 高燕会, 等. 铁皮石斛WRKY5基因的克隆与表达分析[J]. 中草药, 2016, 47(2): 301-308. DOI:10.7501/j.issn.0253-2670.2016.02.020 |
| [12] |
牛俊奇, PhanThi Thu, 邵敏, 等. 甘蔗工艺成熟期转化酶及其抑制子与蔗糖积累的相关性研究[J]. 西南农业学报, 2015, 28(4): 1606-1611. |
| [13] |
Greiner S, Krausgrill S, Rausch T. Cloning of a tobacco apoplasmic invertase inhibitor. Proof of function of the recombinant protein and expression analysis during plant development[J]. Plant Physiol, 1998, 116(2): 733-742. DOI:10.1104/pp.116.2.733 |
| [14] |
牛俊奇, 黄静丽, 张琨琨, 等. 甘蔗转化酶抑制子(SoInvInh1)基因克隆和表达分析[J]. 中国农业大学学报, 2015, 20(3): 38-45. |
| [15] |
Hothorn M, Wolf S, Aloy P, et al. Structural insights into the target specificity of plant invertase and pectin methylesterase inhibitory proteins[J]. Plant Cell, 2014, 16(12): 3437-3447. |
| [16] |
Tang X, Tao S, Mei H, et al. Suppression of extracellular invertase inhibitor gene expression improves seed weight in soybean(Glycine max)[J]. J Exp Bot, 2017, 68(3): 469-482. |
| [17] |
Qin G, Zhu Z, Wang W, et al. A tomato vacuolar invertase inhibitor mediates sucrose metabolism and influences fruit ripening[J]. Plant Physiol, 2016, 172(3): 1596-1611. DOI:10.1104/pp.16.01269 |
| [18] |
Su T, Wolf S, Han M, et al. Reassessment of an Arabidopsis cell wall invertase inhibitor AtCIF1 reveals its role in seed germination and early seedling growth[J]. Plant Mol Biol, 2016, 90(1): 137-155. |
| [19] |
Chen SF, Liang K, Yin DM, et al. Ectopic expression of a tobacco vacuolar invertase inhibitor in guard cells confers drought tolerance in Arabidopsis[J]. J Enzyme Inhib Med Ch, 2016, 31(6): 1381-1385. DOI:10.3109/14756366.2016.1142981 |
| [20] |
Ferrieri AP, Arce CC, Machado RA, et al. A Nicotiana attenuata cell wall invertase inhibitor(NaCWII)reduces growth and increases secondary metabolite biosynthesis in herbivore-attacked plants[J]. New Phytol, 2015, 208(2): 519-530. DOI:10.1111/nph.2015.208.issue-2 |