2. 海南师范大学,海口 570228;
3. 贵州省亚热带作物研究所,兴义 562400
2. College of Agriculture, Hainan University, Haikou 570228;
3. Guizhou Subtropical Crops Research Institute, Xingyi 562400
木薯(Manihot esculenta Crantz)是世界上重要的粮食及经济作物之一。作为热带经济作物的典型材料,获得高产、高抗性的木薯新品种是育种的主要目标。作物产量主要来源于光合作用的产物,提高光合效率是作物增产的有效途径。源是光合产物的生产和供应者,对大多数作物来说,源主要指的是叶源。光合作用同叶片结构有着非常紧密的联系[1]。植物器官、组织和细胞的形态结构及其生理功能都与生长环境有着密切的关系。在长期的进化过程中,不同环境下的植物逐渐形成了与其相适应的结构类型,而植物这种应对生长环境的能力很大程度上反映在植物的叶片结构上[2]。在应对各种环境变化时,高等植物叶片表现出相对的适应性结构[3]。根据碳同化途径可以将高等植物分为C3类植物、C4类植物和景天酸代谢植物,对应每类植物有着相应的碳同化途径即C3途径、C4途径和景天酸代谢(CAM)途径[4]。目前,有关木薯为C3植物还是C4植物还未有准确的定论。因此,从显微水平了解其叶片结构特征,对揭示木薯高光效的机理具有一定的指导意义。Calatayud等[5]采用同位素(13C)检测20种野生树薯(包括木薯栽培种的祖先M. flabellifolia)的磷酸烯醇式丙酮酸羧化酶(PEPCase)和磷酸乙醇酸磷酸酶(PGP)(属C4关键酶)的活性,研究结果表明所有的野生树薯都属于C3植物。虽然木薯栽培品种和野生树薯的叶片拥有提高C4磷酸烯醇丙酮酸(PEP)羧化酶的活力,但缺少C4植物叶片Kranz花环结构的解剖学特性[6]。木薯栽培种属C3植物,有比较明显的绿色维管束鞘细胞,也有比较广幅的光合作用温度(20-45℃),其光合效率特征和C4植物相似。这些特性推测木薯栽培种可能从拥有C4光合作用特性的野生种进化而来[7]。有研究表明木薯体内同时存在C3和C4两种酶系,当温度低时为C3途径,温度高时为C4途径,但木薯的C4酶活性,比典型的C4植物(如玉米)的低。当木薯表现为C3植物时,光合效率比普通植物高;当表现为C4植物时,在高光照下,光合作用不会出现饱和,增产潜力大[5, 8-12]。在植物的生长发育过程中,叶绿素是光合作用中最重要的色素分子,植物功能叶片的叶绿素含量直接影响光合作用速率和光合产物形成[13],而叶绿素荧光可作为光合作用的探针[14]。本研究从木薯叶片的解剖结构出发,结合其叶片叶绿素荧光参数揭示野生种与栽培种在进化角度上的差异,旨为进一步解释其光合效率的差异提供参考依据。
1 材料与方法 1.1 材料本研究选用的材料橡胶木薯(巴西引进资源)、野生近缘种W14(国际热带农业中心(CIAT)引进资源)、华南205(SC205)来自中国热带农业科学院热带作物品种资源研究所国家木薯种质资源圃,植后3个月选取完好的功能叶片进行实验。
1.2 方法参照余炳生等[15]方法(稍有改动)制作木薯功能叶石蜡切片,叶片经过固定、脱水、透明、浸蜡、包埋、切片、贴片、染色后,选用Leica正置金相显微镜观察切片并拍照。
参照孔祥生[16]95%乙醇直接提取法提取叶绿素。按公式计算叶绿素a、叶绿素b及总叶绿素含量。
叶绿素a的含量(mg/g)=13.95×OD665-6.8×OD649
叶绿素b的含量(mg/g)=24.96×OD649-7.32×OD665
总叶绿素含量(mg/g)=18.16×OD649+6.63×OD665
采用叶绿素荧光仪PAM-2500,于上午10:00测定叶片光系统Ⅱ(PS Ⅱ)叶绿素荧光动力学参数:最大光合效率Fv/Fm,实际光合效率ΦPS Ⅱ、非光化学淬灭系数NPQ/4。
利用Excel 2013和DPS v7.05统计软件对数据进行分析,差异显著性标准采用新复极差法(Duncan)。
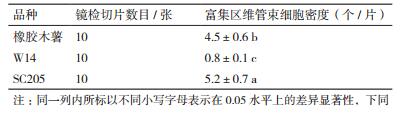
2 结果 2.1 叶片显微结构观察使用光学显微镜对橡胶木薯、W14和SC205叶片石蜡切片的观察,发现3种木薯叶片的显微结构存在一定的差异,结果如图 1-图 3所示。
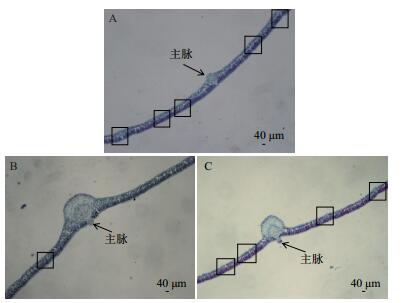
|
| 图 1 三种木薯叶片横切面解剖图(5×) A:橡胶木薯;B:W14;C:SC205(图中方框内为维管束细胞富集区) |

|
| 图 2 三种木薯叶片横切面解剖图(20×) A:橡胶木薯;B:W14;C:SC205 |
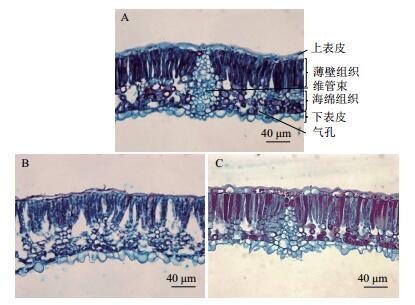
|
| 图 3 三种木薯叶片横切面解剖图(40×) A:橡胶木薯;B:W14;C:SC205 |
观察显微镜(5×)下(图 1)叶片维管束结构并统计叶主脉附近维管束细胞富集区密度,结果(表 1)显示,维管束细胞富集区密度从大到小依次为SC205 > 橡胶木薯 > W14,SC205与橡胶木薯相近,而W14明显小于SC205与橡胶木薯。
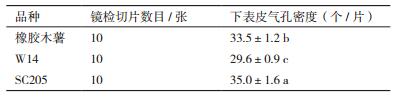
气孔是叶片进行气体和水分交换的主要通道,对植物的光合、呼吸、蒸腾等生理活动起着重要的调节作用。统计显微镜(20×)下叶片下表皮气孔密度(图 2),结果(表 2)显示,3种木薯气孔密度从大到小依次为SC205 > 橡胶木薯 > W14。因此推测栽培种SC205光合作用等生理活动强度比橡胶木薯要高,3者中W14最低。
观察显微镜(40×)下叶片维管束细胞富集区的维管束细胞,发现橡胶木薯的维管束细胞较发达,且部分细胞已延伸至栅栏组织区域;SC205与橡胶木薯相比,两者维管束富集区细胞发达程度相似,而W14的维管束富集区细胞没有橡胶木薯发达,仅分布于栅栏组织和下表皮叶肉细胞之间(图 3)。观察3种木薯栅栏组织叶肉细胞,发现SC205和橡胶木薯叶肉细胞均略大且排列紧密;W14细胞大小与橡胶木薯比无明显差异,但细胞排列略显稀疏。观察维管束周围的海绵组织叶肉细胞排列情况,发现SC205和橡胶木薯的叶肉细胞较小且排列较疏松,而W14的海绵组织叶肉细胞明显围绕在维管束鞘细胞周围,形似“花环”,但整个“花环结构”并没有典型C4植物的明显,即W14的维管束细胞发达程度及海绵组织叶肉细胞排列紧密程度均较低。
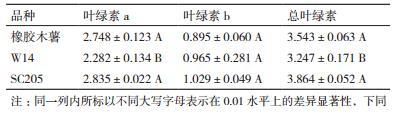
2.2 叶绿素含量及叶绿素荧光参数比较橡胶木薯、W14和SC205叶片叶绿素含量如表 3所示,结果显示叶绿素a和总叶绿素含量含量从大到小均为SC205 > 橡胶木薯 > W14;SC205和橡胶木薯叶片的叶绿素a含量均较高,但彼此间未达显著差异,W14叶片叶绿素a含量明显比橡胶木薯低,且达到极显著差异;总叶绿素含量的差异规律与叶绿素a一致;但3个木薯品种叶片叶绿素b含量彼此间未达显著差异。
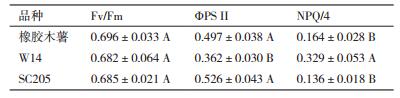
3种木薯叶片叶绿素荧光参数测定结果见表 4,Fv/Fm是指PS Ⅱ最大光化学量子产量,反映植物潜在最大光合能力。上午10:00时,3种木薯Fv/Fm值均在0.60-0.85间,且均未达显著差异。ΦPS Ⅱ是指PS Ⅱ实际量子产量,反映植物的实际光合能力。3种木薯ΦPS Ⅱ值从大到小依次为SC205(0.526) > 橡胶木薯(0.497) > W14(0.362),其中SC205叶片ΦPS Ⅱ值比橡胶木薯略高,彼此间未达到显著差异,但W14叶片ΦPS Ⅱ值低于橡胶木薯和SC205,且达到极显著差异。NPQ是植物光保护能力的一个指标,橡胶木薯和SC205叶片的NPQ值分别为0.164和0.136,均低于W14(0.329),这表明3种木薯中,W14的光保护能力最强。
本实验所用野生木薯种质分别是巴西及CIAT引进的橡胶木薯和野生近缘种W14,木薯栽培品种选用华南205。石蜡切片镜检结果显示,3种木薯叶片维管束鞘细胞显示不同程度的绿色,说明其维管束细胞存在不同数量的叶绿体,进一步观察发现SC205和橡胶木薯叶片维管束鞘细胞发达程度明显高于W14,同时叶片中也不存在典型C4植物的“花环结构”。由此推测橡胶木薯和SC205均不是典型的C3植物,而是拥有独特维管束结构的C3植物。这与Angelov等[7]关于木薯栽培种叶片显微结构研究的结果以及Calatayud等[5]通过13C同位素标记检测叶片PEPC和PGP来研究野生树薯的结果类似。与Kennedy等[17]关于种棱粟米草叶片显微结构研究的结果相似。
气孔是高等植物用来与外界交换气体和水的器官,气孔密度、大小和空隙等因素会影响气孔扩散阻力,进而影响植物的光合作用[18]。海绵组织叶肉细胞间隙常通向气孔,可以让CO2在叶肉细胞中扩散,因此,较大体积的叶肉细胞间隙利于植物光合作用。曹兵[19]通过对灵武长枣的光合作用研究印证了这一规律。本实验中SC205与橡胶木薯的海绵组织排列疏松,而W14的海绵组织叶肉细胞围绕其维管束鞘细胞排列,较为紧密;并且SC205叶片下表皮气孔密度略大于橡胶木薯,显著大于W14叶片气孔密度。综合上述规律,将3种木薯叶片气孔密度和海绵组织叶肉细胞排列方式的差异与它们光合作用实际速率的差异进行比较可以推断:3种木薯叶片气孔和海绵组织叶肉细胞排列的差异特征与本实验3种木薯光合作用的强弱是相适应的。
大量研究表明,光合作用的产物积累超过植物的利用能力时,植物就会对此做出反馈并抑制光合速率的持续增强,达到降低光合速率至平衡的目的[20-23]。高等植物叶片中的维管束组织通过叶脉与茎中的维管束相连接,有运输光合产物和支持叶片的作用。因此,维管束鞘细胞组织发达程度及维管束细胞富集区密度大小将影响植物的光合作用强度。本试验中SC205和橡胶木薯均含发达的维管束组织,可使它们拥有比W14更通畅的光合产物运输通道,同时还可以降低因叶肉细胞内光合产物积累而对光合作用产生的反馈抑制作用。这与张杨等[24]对木薯栽培种与野生种叶片光合器官结构和酶学差异研究的结果相一致;同时与华鹤良等[25]对玉米棒3叶光合性状的相关性研究的结果相似。
刘周莉等[26]、张耀文等[27]研究证明叶绿素含量与光合速率呈正相关,叶绿素含量越高,光合作用越强。本研究中,W14叶片叶绿素a和总叶绿素含量均低于橡胶木薯和SC205,且差异水平达到显著。这与W14叶片实际光合速率均低于岩生木薯和SC205的结果一致。3种木薯间叶绿素荧光参数也存在明显差异,这与米国全等[28]对番茄叶绿素荧光参数的研究结论一致,表明基因型是造成不同品种(系)间叶绿素荧光参数差异的主要因素。ΦPS Ⅱ结果显示W14叶片的实际光合效率最低,SC205最高,这与对木薯野生及栽培种叶片光合速率的测定结果相似[29-30]。同等条件下,较高的NPQ值会导致较多的光能耗散,从而在一定程度上降低植物的光合能力。反之,则增强植物的光合能力[31-32]。本研究也发现NPQ值较低的木薯栽培种SC205具有较强光合性能,而NPQ值较高的W14叶片光合性能较弱。
4 结论橡胶木薯和SC205叶片拥有绿色维管束鞘细胞结构,但没有C4植物典型的“花环结构”;W14叶片海绵组织叶肉细胞围绕维管束鞘细胞排列,但发达程度略低,整体形状略似“花环结构”,但没有典型的C4植物明显。橡胶木薯和SC205均属于C3植物,W14是一种介于C3和C4之间的木薯种质。
| [1] |
胡宝忠, 胡国宣. 植物学[M]. 北京: 中国农业出版社, 2004.
|
| [2] |
陈雪梅, 王友保. 浅谈叶片结构对环境的适应[J]. 安徽农学通报, 2007, 13(19): 80-81. DOI:10.3969/j.issn.1007-7731.2007.19.039 |
| [3] |
季子敬, 全先奎, 王传宽. 兴安落叶松针叶解剖结构变化及其光合能力对气候变化的适应性[J]. 生态学报, 2013, 33(21): 6967-6974. |
| [4] |
Farquhar GD, Ehleringer JR, Hubick KT. Carbon isotope discrimination and photosynthesis[J]. Annual Review of Plant Physiology and Plant Molecular Biology, 1989(40): 503-537. |
| [5] |
Calatayud PA, Baron CH, Velasquez H, et al. Wild Manihot species do not possess C4 photosynthesis[J]. Annals of Botany, 2002, 89: 125-127. DOI:10.1093/aob/mcf016 |
| [6] |
El-Sharkawy MA. Cassava biology and physiology[J]. Plant Molecular Biology, 2004, 56: 481-501. DOI:10.1007/s11103-005-2270-7 |
| [7] |
Angelov MN, Sun J, Byrd GT, et al. Novel characteristics of cassava, Manihot esculenta Crantz, a reputed C3-C4 intermediate photosynthesis species[J]. Photosynthesis Research, 1993, 38: 61-72. DOI:10.1007/BF00015062 |
| [8] |
张振文, 李开绵, 叶剑秋. 木薯光合作用特性研究[J]. 云南大学学报:自然科学版, 2007, 29(6): 628-632. |
| [9] |
张振文, 郑永清, 叶剑秋, 李开绵. 木薯叶片光合特性研究[J]. 西南农业学报, 2009, 22(2): 300-303. |
| [10] |
黄洁. 木薯丰产栽培技术[M]. 海口: 三环出版社, 2007.
|
| [11] |
严良政, 张琳, 王士强, 胡林. 中国能源作物生产生物乙醇的潜力及分布特点[J]. 农业工程学报, 2008, 24(5): 213-216. |
| [12] |
姚庆荣, 郭运玲, 郭安平, 等. 木薯基因工程育种研究现状与展望[J]. 安徽农业科学, 2007, 35(6): 1636-1637. |
| [13] |
徐娟, 黄洁. 木薯苗期叶绿素含量及荧光动力学参数与抗旱指数的灰色关联度分析[J]. 西南农业学报, 2013, 26(5): 1833-1837. |
| [14] |
Krause GH, Weis E. Chlorophyll fluorescence and photosynthesis:the basics[J]. Annual Review of Plant Physiology and Plant Molecular Biology, 1991(42): 313-349. |
| [15] |
余炳生, 张仪. 生物学显微技术[M]. 北京: 北京农业大学出版社, 1989.
|
| [16] |
孔祥生. 植物生理学实验技术[M]. 北京: 中国农业出版社, 2008.
|
| [17] |
Kennedy RA, Laetsch WM. Plant species intermediate for C3, C4 photosynthesis[J]. Science, 1974(4141): 1087-1089. |
| [18] |
吴冰洁. 叶片生长过程中气孔发育状态对光合作用气孔限制和叶温调节的影响[D]. 北京: 北京林业大学, 2015.
|
| [19] |
曹兵, 江莉, 李银娣, 等. 灵武长枣光合作用研究初报[J]. 北方园艺, 2012(11): 11-14. |
| [20] |
Drake BG, Gonzàlez-Meler MA, Long SP. More efficient plants:a consequence of rising atmospheric CO2[J]. Annual Review of Plant Physiology and Plant Molecular Biology, 1997(48): 609-639. |
| [21] |
刘晓聪, 董家华, 欧英娟. 大气中CO2与O3浓度升高对植物光合作用影响研究[J]. 环境科学与管理, 2016, 41(3): 152-155. |
| [22] |
许金铸, 白芳, 杨燕君, 吴忠兴. CO2浓度变化对拟柱胞澡生长与光合作用的影响[J]. 水生生物学报, 2016, 40(6): 1221-1226. DOI:10.7541/2016.159 |
| [23] |
潘璐, 刘杰才, 李晓静, 等. 高温和加富CO2温室中黄瓜Rubisco活化酶与光合作用的关系[J]. 园艺学报, 2014, 41(8): 1591-1600. |
| [24] |
张杨, 卢诚, 王文泉. 木薯栽培种与野生种叶片光合器官结构和酶学差异[J]. 中国农学通报, 2012, 28(25): 144-149. DOI:10.3969/j.issn.1000-6850.2012.25.028 |
| [25] |
华鹤良, 赵青, 周宇, 等. 玉米棒三叶光合性状对茎秆糖含量的影响[J]. 玉米科学, 2016, 24(3): 92-98. |
| [26] |
刘周莉, 赵明珠, 秦娇娇, 等. 三种木质藤本植物光合特性比较研究[J]. 生态环境学报, 2015, 6(24): 952-956. |
| [27] |
张耀文, 赵小光, 田建华, 等. 甘蓝型油菜正反交后代叶片净光合效率合叶绿素含量的比较[J]. 华北农学报, 2015, 30(5): 135-140. DOI:10.7668/hbnxb.2015.05.023 |
| [28] |
米国全, 程志芳, 王晋华, 等. 利用叶绿素荧光参数评价番茄耐低温弱光能力的研究[J]. 河南农业科学, 2015, 44(1): 94-97. |
| [29] |
陈霆. 木薯野生种与栽培种光合特性及蛋白质组学分析[D]. 海口: 海南大学, 2014.
|
| [30] |
宋红艳, 安飞飞, 杨龙, 吕亚. 木薯野生近缘种W14与栽培种SC8的光合参数及相关蛋白质表达水平分析[J]. 热带作物学报, 2015, 36(5): 933-936. |
| [31] |
朱亚红, 孙存举, 朱铭强, 等. 河北杨与沙棘的光合生理特性及叶绿素荧光参数比较[J]. 中南林业科技大学学报, 2015, 35(2): 26-31. |
| [32] |
何淼, 刘洋, 焦宏斌, 等. 神农香菊不同株系间光合特性及叶绿素荧光特性比较分析[J]. 上海农业学报, 2017, 33(2): 13-18. |