2. 湖南省人民医院社会医学部,长沙 410002
2. Department of Social Medicine, Hunan Province People's Hospital, Changsha 410002
乳腺癌是严重危害女性健康的主要恶性肿瘤,发病率占全身各种恶性肿瘤的7%-10%,几乎每8例女性中就有1例会罹患此病[1]。研究表明,乳腺癌的发生与机体免疫应答反应相关,在乳腺癌组织内,程序性死亡因子配体PD-L1和CD28分子家族的抑制性受体在肿瘤免疫特异性T细胞上表达上调[2-4]。程序性死亡因子配体1(Programmed death ligant 1,PD-L1),是一种免疫抑制分子,它是程序性死亡因子(Programmed death 1,PD-1) 的配体之一,它们共同组成的信号通路能传导抑制性信号给T细胞,从而阻断正常免疫应答的发生[5-6]。研究表明[7-8],PD-1/PD-L1通路的激活是肿瘤免疫逃逸的一个重要机制。PD-L1与PD-1的结合可产生多种生物学作用,例如能够抑制淋巴细胞的增殖和活化、抑制CD4+T细胞向Th1和Th17细胞分化、抑制炎性细胞因子的释放,这些都起到免疫负调控作用[9-10]。为探讨乳腺癌中PD-L1免疫应答、细胞增殖与凋亡等相关通路机制以及特异性抑制肿瘤细胞PD-1/PD-L1通路的靶点,本研究拟在乳腺癌细胞中,通过表达RNA干扰的慢病毒系统,建立PD-L1表达下调的稳定细胞株和阴性对照细胞株,旨为后续研究奠定基础。
1 材料与方法 1.1 材料 1.1.1 细胞系人乳腺癌细胞株MDA-MB-231细胞、BT549细胞、MCF-7细胞来自实验室储存;人胚肾细胞293T来自湖南大学生物学院谭拥军教授实验室;DH5α感受态大肠杆菌由本实验室自制;慢病毒载体pMAGic7.1、包装质粒△8.91、包装膜蛋白颗粒质粒pVSVG来自湖南大学生物学院谭拥军教授实验室。
1.1.2 主要试剂RPMI1640培养基、DMEM培养基和胰酶购自GIBCO公司;胎牛血清购自Hyclone公司;Trizol购自Ambion公司;2×power Taq PCR Master Mix购自Bioteke Corporation公司;2×SYBR Green Mix购自TaKaRa公司;PD-L1引物和GAPDH内参引物由上海生物工程有限公司合成;PEI转染试剂为ALDRICH公司产品;蛋白裂解液和BCA法蛋白浓度检测试剂盒购自Sangon Biotech公司;PVDF膜购自Millipore公司;兔抗人PD-L1一抗购自Abcam公司;鼠抗人β-actin一抗购自Promega公司;兔二抗和鼠二抗购自GE公司;ECL化学发光显影液购自Thermo公司;淋巴细胞分离液Histopaque-1077购自Sigma公司;丝裂霉素A购自Sigma公司;Con A(刀豆球蛋白A)购自Sigma公司;CCK8试剂盒。
1.2 方法 1.2.1 检测3种乳腺癌细胞中PD-L1的表达量取生长状态良好处于对数生长期的MDA-MB-231,BT549和MCF-7细胞,冷PBS洗涤2次,加入TRIzol提取总RNA,取1 μg总RNA逆转录合成cDNA,以cDNA为模板进行PCR反应。Real-time PCR以人GAPDH作为内参,按Quant SYBR Green PCR试剂盒说明书操作,实时荧光定量基因扩增仪上扩增,反应结束后,用Bio-Rad CFX Manager 3.0软件对数据进行分析。反应条件:95℃变性5 min;95℃ 10 s,60℃ 30 s,72℃ 20 s,40个循环。PD-L1和GAPDH引物序列,见表 1。
通过免疫印迹杂交(Western blot,WB)检测感染细胞中PD-L1蛋白水平上的表达。RIPA裂解液和PMSF蛋白酶抑制剂按100:1混合后的试剂裂解乳腺癌MD-MBA-231细胞,冰上裂解30 min,超声破碎2 min,12 000 r/min 4℃离心30 min吸取上清提取蛋白,用BCA法测定蛋白浓度。配制聚丙烯酰胺凝胶,以总蛋白量50 μg/孔进行电泳分离蛋白,恒流300 mA湿转PVDF膜,5%脱脂牛奶封闭,加一抗PD-L1(1:1 000)、β-actin(1:10 000),室温孵育2 h,加HRP标记的二抗(1:10 000),室温孵育1 h,ECL化学发光显影。
1.2.2 三质粒体系的构建及鉴定对照PD-L1基因序列,设计多个RNA干扰靶点序列以及阴性对照序列(NG),分别设计并合成shRNA寡聚单链DNA,oligo序列见表 2。
将合成好的引物用1×TE buffer溶解成20 μmol/L,互补的单链混合后在水浴锅中95℃加热5 min,自然冷却,退火形成带黏性末端的双链DNA片段;用限制性内切酶Age Ⅰ and EcoR Ⅰ酶切pMAGic7.1质粒载体,用T4 DNA连接酶将上述DNA片段连接至pMAGic 7.1表达载体,连接产物转化感受态大肠杆菌DH5α,同时设立空白对照。转化菌液涂布平板,37℃过夜培养。次日从大肠杆菌平板挑取3-5个单克隆进行扩增培养,用表达载体通用引物5'-AGCGGATCTGACGGTTCACT-3'和shRNA 5'端引物进行菌落PCR鉴定目的片段。鉴定成功的菌液用QIAGEN公司质粒小量提取试剂盒提取质粒,酶切鉴定后,送至长沙擎科生物有限公司进行测序。
1.2.3 慢病毒干扰载体的包装及纯化应用QIAGEN公司无内毒素的质粒小量提取试剂盒提取pMAGic 7.1、△8.91和pVSVG用于转染。转染前24 h选择生长状态良好的293T细胞按1:4传代至100 mm细胞培养皿,24 h后细胞生长达到70%左右的生长密度时,用PEI转染试剂进行转染。用1 mL Opti-MEM培养基稀释总共16 μg质粒(目的质粒pMAGic 7.1,△8.91、pVSVG按照4:3:2的比例),并另取1 mL Opti-MEM培养基稀释48 μL PEI转染试剂,然后将稀释好的PEI试剂加入到质粒中,立即吸打混匀。室温放置20 min后,将混匀的转染液逐滴均匀加入293T细胞中,轻轻摇晃至混匀,5% CO2、37℃细胞培养箱中培养4 h后,去除所有细胞上层液体,重新在培养皿中加入DMEM(含10% FBS)完全培养基,于5% CO2、37℃细胞培养箱中继续培养。在换液48 h和96 h后,两次收取细胞上层液体,0.22 μm滤头过滤,即为病毒原液。
1.2.4 慢病毒感染乳腺癌231细胞实验人乳腺癌细胞MDA-MB-231培养于含RPMI 1640(10% FBS)完全培养基,37℃、5%CO2的细胞培养箱中培养。转染前一天选用对数生长期、生长状态良好的细胞,取1×105个细胞/孔接种于24孔板中,使细胞覆盖率达30%。第2天,弃去24孔板上清,按(1:2)-(1:3) 的比例分别加入新鲜培养基和病毒液;空白对照只添加新鲜培养基。每组设置3个复孔,摇匀后置于37℃、5%CO2的细胞培养箱中孵育。48 h后弃去细胞上清,更换为RPMI 1640(含10% FBS)完全培养基。
1.2.5 感染细胞中PD-L1干扰效果的鉴定通过RT-PCR检测感染细胞中PD-L1 mRNA水平上的表达,通过Western Blot检测感染细胞中PD-L1蛋白水平上的表达,具体实验操作及数据处理步骤同1.2.1。
1.2.6 干扰病毒对乳腺癌细胞增殖的影响取生长状态良好、对数生长期的MDA-MB-231细胞,以5×103个细胞/孔接种于96孔板,37℃、5%CO2的细胞培养箱中继续培养。第2天,弃去上清,按1:2的比例加入新鲜培养基和病毒液;空白对照只添加新鲜培养基。每组设置3个复孔,摇匀后继续培养。第3天分别加入20 μL MTT溶液(5 mg/mL),继续培养4 h后,吸除原有培养液,加入150 μL二甲亚砜DMSO,摇床上温和震荡10 min,酶标仪490 nm波长下测量每孔吸光度。接连检测3 d。最后绘制细胞生长曲线图。
1.2.7 干扰PD-L1稳转细胞株对T淋巴细胞活化与功能影响根据淋巴细胞分离液说明书提取T淋巴细胞并计数;此节用干扰效果最好的sh-1组稳转细胞株和正常乳腺癌MDA-MB-231细胞作为研究材料。(1) CCK8法检测T淋巴细胞的肿瘤杀伤能力。在96孔板上分别种干扰PD-L1稳转细胞株和正常乳腺癌MDA-MB-231细胞5×103个细胞,用丝裂霉素C(终浓度为100 μg/mL)37℃处理45 min,再加入5×104个T淋巴细胞,共培养24 h、72 h后弃上清重新加入完全培养基用CCK8法检测OD值;以上实验分组为:干扰组;干扰组+T淋巴细胞;正常组;正常组+T淋巴细胞。(2) CCK8法检测T淋巴细胞活性。用干扰sh-1组稳转细胞株和正常乳腺癌细胞株以1×105铺板24孔板,丝裂霉素C处理后加入1×106个T淋巴细胞,共培养24 h,取含T淋巴细胞的上清计数,以1×105铺板96孔板,每组分刺激组与非刺激组两组,刺激组用Con A(终浓度为25 μg/mL)于细胞培养箱中孵育72 h,非刺激组不加Con A,72 h后用CCK8试剂盒在450 nm处测OD值。结果以增生指数(Proliferation index,PI)表示,PI=刺激细胞的OD值/未刺激细胞的OD值[11];以上实验分组为干扰组;正常组。
1.2.8 统计分析采用SPSS13.0统计软件,两个独立样本组件比较用t检验,P < 0.05为差异有统计学意义。
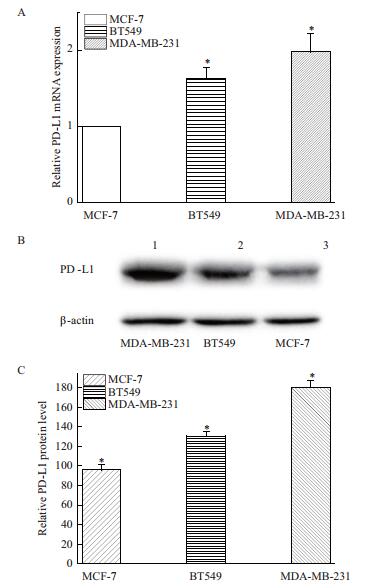
2 结果 2.1 PD-L1在人乳腺细胞及3种乳腺癌细胞的表达情况对人乳腺细胞、人乳腺癌细胞MDA-MB-231细胞、BT549、MCF-7进行荧光定量PCR分析(图 1-A)和Western Blot分析(图 1-B),结果表明,PD-L1在乳腺癌MDA-MB-231中表达最高。
|
| 图 1 PD-L1在3种乳腺癌细胞中的表达水平(*P<0.05) A:Relative PD-L1 mRNA level;B:Western Blot of PD-L1;C:Relative PDL1 protein level |
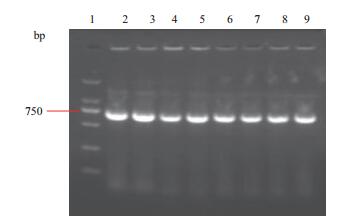
由4组转化子涂平板挑单菌落进行菌落PCR鉴定(图 2),条带明亮清晰无杂带,从每组干扰转化菌分别挑取两对送去长沙擎科生物有限公司进行测序,经比对,重组克隆中插入的片段序列与所设计的oligo完全一致,表明目的条带已成功插入,4个慢病毒载体构建成功。
|
| 图 2 4个质粒载体菌落PCR结果 1:DNA DL 2000maker;2、3:pMAGic-sh1;4、5:pMAGic-sh2;6、7:pMAGic-sh3;8、9:pMAGic-NG |
用构建好的4个质粒载体(3个干扰和1个阴性对照)分别转染293T细胞,24 h后可观察到荧光,48 h后荧光加强(90%以上),结果见图 3。收集转染293T细胞48 h和96 h的滤后病毒原液感染正常的MDA-MB-231细胞,48 h后换为新鲜完全培养基,观察并继续培养,结果见图 4,显微镜用蓝光激发后,可观察到绿色荧光(约20%),表明慢病毒感染成功。

|
| 图 3 四种质粒载体转染293T细胞48 h的荧光显微镜观察(×100) A:pMAGic-sh1绿色荧光;B:pMAGic-sh1白光;C:pMAGic-sh2绿色荧光;D:pMAGic-sh2白光;E:pMAGic-sh3绿色荧光;F:pMAGic-sh3白光;G:pMAGic-NG绿色荧光;H:pMAGic-NG白光 |

|
| 图 4 四种慢病毒感染MDA-MB-231细胞48 h的荧光显微镜观察(×100) A:pMAGic-sh1绿色荧光;B:pMAGic-sh1白光;C:pMAGic-sh2绿色荧光;D:pMAGic-sh2白光;E:pMAGic-sh3绿色荧光;F:pMAGic-sh3白光;G:pMAGic-NG绿色荧光;H:pMAGic-NG白光 |
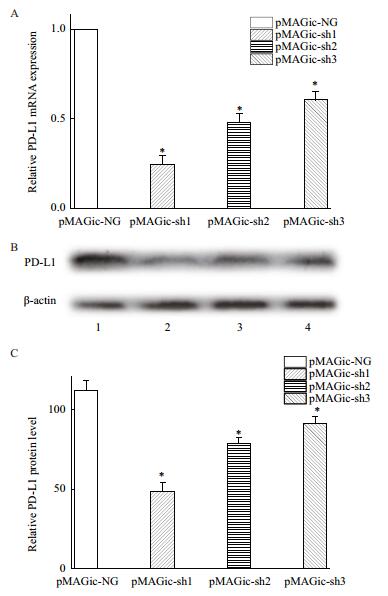
收集4种病毒感染的MD-MBA-231细胞,进行qPCR检测(图 5-A)和Western Blot检测(图 5-B),结果表明,干扰组MDA-MB-231细胞中PD-L1在mRNA水平和Western Blot中的表达均有明显下降。
|
| 图 5 PD-L1在干扰组及阴性对照组细胞中的表达情况(*P<0.05) A:Relative PD-L1 mRNA level;B:Western Blot of PD-L1;C:Relative PDL1 protein level;1:pMAGic-NG;2:pMAGic-sh1;3:pMAGic-sh2;4:pMAGic-sh3 |
分别用4种慢病毒感染正常生长良好的MDA-MB-231乳腺癌细胞,以MTT法在酶标仪上测量细胞3 d的增殖情况,结果见图 7,其中第7天pMAGic-NG组的OD值为(0.721±0.001 9),pMAGic-sh1组的OD值为(0.467±0.002 0),pMAGic-sh2组的OD值为(0.553±0.002 1) pMAGic-sh3组的OD值为(0.578±0.001 6)。其中,pMAGic-sh1抑制癌细胞增殖的效率最高,此组细胞存活率为阴性对照组的64.77%。

|
| 图 6 四种慢病毒对MDA-MB-231细胞增殖的影响(*P<0.05) |
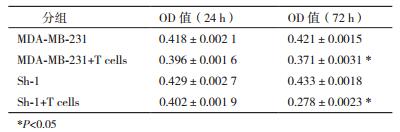
淋巴混合实验24 h和72 h后,用酶标仪测试各组OD值,实验结果如表 3所示,MDA-MB-231+T cells组与MDA-MB-231组相比具有显著性差异(P < 0.05);sh-1组与sh-1+T cells组相比具有显著性差异(P < 0.05)。实验数据处理由肿瘤细胞抑制率表示,肿瘤细胞抑制率=(肿瘤细胞OD值-相应加入T细胞组OD值)/肿瘤细胞OD值×100%。数据处理显示,乳腺癌MDA-MB-231在24 h后的抑制率为5.26%,72 h后的抑制率为11.7%;sh-1乳腺癌稳转细胞株在24 h后的抑制率为6.29%,与正常细胞的抑制率差别小;72 h后的抑制率为35.8%,为正常细胞抑制率的3.06倍,具有显著性差异(P < 0.05)。
混合淋巴实验24 h,Con A刺激72 h后,测试各组OD值,干扰组和正常组的T淋巴细胞增殖反应比较如表 4所示。
程序性死亡因子配体1(Programmed death receptor 1 ligand 1,PD-L1),也被称为CD274,属于B7家族,可表达于T细胞、B细胞、巨噬细胞、树突状细胞、血管内皮细胞和胎盘合体滋养层细胞等多种细胞[12]。PD-L1是负性免疫调节分子中的一员,在特异性肿瘤免疫应答中起重要的负性调控作用,其高表达促使肿瘤细胞逃脱机体免疫系统监视,从而造成免疫逃逸[13]。关于PD-1/PD-L1在肿瘤免疫逃逸中的机制研究已成为肿瘤免疫研究中的热点。然而,PD-L1在不结合PD-1的情况下,可以诱导初始CD4+T细胞向Foxp3+感应T细胞转变,这是外周免疫中抑制效应T细胞作用的关键所在。Addio等[14]发现,PD-L1能够促进CD4+Foxp3-T细胞向CD4+Foxp3+ Treg的转变。Liu等[15]发现,CD4+CD25+Foxp3+ Treg的分化依赖于PD-L1所介导的信号途径,肝树突状细胞表达的PD-L1水平越高,就能诱导出更多的Treg,从而维持机体对移植物的耐受作用。用单克隆抗体或siRNA特异性阻断PD-L1,可减少CD4+CD25+Foxp3+ Treg的产生,并诱导Treg凋亡[16-17]。这些研究表明,PD-L1通过增强Tregs上的Foxp3的表达来诱导Treg细胞的分化和维持其功能。
慢病毒(Lentivirus)载体是以HIV-1(人类免疫缺陷Ⅰ型病毒)为基础发展起来的基因治疗载体。目前,它被广泛应用于表达RNAi、基因治疗等研究中,相对于腺病毒而言,无论细胞是否处于分裂期,慢病毒都对细胞具有较强的感染能力[18-19]。对于一些较难转染的细胞,如原代细胞、干细胞和非分裂细胞等,使用慢病毒载体能大大提高目的基因或目的shRNA的转导效率,且目的基因或目的shRNA整合到宿主细胞基因组的几率大大增加,能够比较方便快捷地实现目的基因或目的shRNA在细胞中的长期、稳定表达[20-21]。在慢病毒载体的安全性方面,目前最新一代(第三代)慢病毒载体是一种自我失活的HIV-1来源载体,只含有HIV-1中的gag、pol、rev三个基因,由于去除了其余60%HIV-1基因组成分,因此父代病毒无法复制,载体本身只能将目的基因转移给靶细胞,转移完成后,病毒载体便丧失了病毒长末端重复的转录能力,减少了产生重组病毒的机会[22]。鉴于慢病毒载体的以上优点以及良好的安全性,该研究应用慢病毒载体干扰技术,成功构建了沉默PD-L1的慢病毒表达载体,并筛选出稳定表达的乳腺癌MDA-MB-231细胞株。在包装病毒过程中,聚乙烯亚胺(Polyethylenimine,PEI)转染293T细胞比实验前期应用传统的磷酸钙法和脂质体Lipofectamine 2000转染293T细胞效率更高,因此,本研究最终选用PEI转染试剂包装慢病毒。PEI是一种阳离子聚合物,除具有转染效率高的优点外,还具有价格低廉、操作简单、适用范围广、重复性好及细胞毒性低等特点。
本实验结果显示,将具有高侵袭能力的乳腺癌MDA-MB-231细胞培育成沉默PD-L1的稳转细胞株后,细胞增殖能力明显下降;淋巴细胞增殖活性增强,肿瘤细胞活性收到抑制。如果患有肿瘤的机体(高表达PD-L1) 能够降低PD-L1的表达,那么PD-1/PD-L1信号通路将被抑制,机体将扭转肿瘤细胞逃脱免疫监视的局面,最终使得肿瘤细胞被免疫系统识别并消除。然而,PD-1/PD-L1通路在正常机体运行中的负性调节作用在机体外周免疫中发挥重要作用,可防止机体自身免疫性疾病的发生,且该通路对器官移植病人也起到避免移植物发生免疫排斥的关键性作用,那么,如何特异性靶向肿瘤细胞的PD-1/PD-L1通路将成为一大难题。
4 结论本研究检测了PD-L1在3种乳腺癌细胞中的表达情况,确定以表达量最高的乳腺癌MDA-MB-231细胞作为研究材料,通过双酶切构建pMAGic目的质粒,与质粒△8.91和pVSVG用PEI转染试剂共转染293T细胞包装病毒,并用此病毒感染并筛选得到稳转MDA-MB-231细胞,检测细胞增殖情况以及PD-L1在mRNA水平和蛋白水平的表达情况,并通过肿瘤细胞于T淋巴细胞的混合淋巴实验检测T淋巴细胞活性与肿瘤细胞增殖活性,最终成功获得了有效干扰PD-L1表达量的慢病毒体系和可稳定低表达PD-L1、细胞增殖能力明显降低、可增强T淋巴细胞增殖活性的乳腺癌MDA-MB-231细胞系。
| [1] | Ferlay J, Steliarova-Foucher E, Lortet-Tieulent J, et al. Cancer incidence and mortality patterns in Europe:estimates for 40 countries in 2012[J]. Eur J Cancer, 2013, 49 (6): 1374–1403. DOI:10.1016/j.ejca.2012.12.027 |
| [2] | Mauricio Z, Baptista D, et al. Prognostic significance of PD-L1 and PD-L2 in breast cancer[J]. Human Pathlogy, 2016, 47 (1): 78–84. DOI:10.1016/j.humpath.2015.09.006 |
| [3] | Li B, VanRoey M, Wang C, et al. Anti-programmed death-1 synergizes with granulocyte macrophage colony-stimulating factor-secreting tumor cell immunotherapy providing therapeutic benefit to mice with established tumors[J]. Clin Cancer Res, 2009, 15 (5): 1623–1634. DOI:10.1158/1078-0432.CCR-08-1825 |
| [4] | Cimino-Mathews A, Thompson E, Taube JM, et al. PD-L1(B7-H1) expression and the immune tumor microenvironment in primary and metastatic breast carcinomas[J]. Human Pathology, 2016, 47 (1): 52–63. DOI:10.1016/j.humpath.2015.09.003 |
| [5] | Dai S, Jia R, Zhang X, et al. The PD-1/PD-Ls pathway and autoimmune diseases[J]. Cellular Immunology, 2014, 290 (1): 72–79. DOI:10.1016/j.cellimm.2014.05.006 |
| [6] | Gianchecchi E, Delfino DV, Fierabracci A. Recent insights into the role of the PD-1/PD-L1 pathway in immunological tolerance and autoimmunity[J]. Autoimmunity Reviews, 2013, 12 (11): 1091–1100. DOI:10.1016/j.autrev.2013.05.003 |
| [7] | Iwai Y, Ishida M, Tanaka Y, et al. Involvement of PD-L1 on tumor cells in the escape from host immune system and tumor immunotherapy by PD-L1 blockade[J]. Proc Natl Acad Sci USA, 2002, 99 (19): 12293–12297. DOI:10.1073/pnas.192461099 |
| [8] | Dong H, Strome SE, Salomao DR, et al. Tumor-associated B7-H1 promotes T-cell apotosis:a potential mechanism of immune evasion[J]. Nat Med, 2008, 8 (8): 793–800. |
| [9] | Dulos J, Carven GJ, van Boxtel SJ, et al. PD-1 blockade augments Th1 and Th17 and suppresses Th2 responses in peripheral blood from patients with prostate and advanced melanoma cancer[J]. J Immunother, 2012, 35 (2): 169–178. DOI:10.1097/CJI.0b013e318247a4e7 |
| [10] | Marzec M, Zhang Q, Goradia A, et al. Oncogenic kinase NPM/ALK induces through STAT3 expression of immunosuppressive protein CD274(PD-L1, B7-H1)[J]. Proc Natl Acad Sci USA, 2008, 105 (52): 20852–20857. DOI:10.1073/pnas.0810958105 |
| [11] | Tuchscherer M, Kanitz E, Otten W, et al. Effects of prenatal stress on cellular and humoral immune responses in neonatal pigs[J]. Veterinary Immunology and Immunopathology, 2002, 86 (3): 195–203. |
| [12] | Okudaira K, Hokari R, Tsuzuki Y, et al. Blockade of B7-H1 or B7-DC induces an anti-tumor effect in a mouse pancreatic cancer model[J]. Int J Oncol, 2009, 35 (4): 741–749. |
| [13] | Ghebeh H, Mohammed S, Al-Omair A, et al. The B7-H1(PD-L1) T lymphocyte-inhibitory molecule is expressed in breast cancer patients with infiltrating ductal carcinoma:correlation with important high-risk prognostic factors[J]. Neoplasia, 2006, 8 (3): 190–198. DOI:10.1593/neo.05733 |
| [14] | D'Addio F, Riella LV, Mfarrej BG, et al. The link between the PD-L1 costimulatory pathway and Th17 in fetomaternal tolerance[J]. J Immunol, 2011, 187 (9): 4530–4541. DOI:10.4049/jimmunol.1002031 |
| [15] | Liu H, Bakthavatsalam R, Meng Z, et al. PD-L1 signal on liver dendritic cells is critical for Foxp3+CD4+CD25 + Treg and liver tolerance induction in mice[J]. Transplant Proc, 2013, 45 (5): 1853–1855. DOI:10.1016/j.transproceed.2013.03.015 |
| [16] | Franceschini D, Paroli M, Francavilla V, et al. PD-L1 negatively regulates CD4+ CD25+Foxp3+Tregs by limiting STAT-5 phosphorylation in patients chronically infected with HCV[J]. J Clin Invest, 2009, 119 (3): 551–564. DOI:10.1172/JCI36604 |
| [17] | Beswick EJ, Pinchuk IV, Das S, et al. Expression of the programmed death ligand 1, B7-H1, on gastric epithelial cells after Helicobacter pylori exposure promotes development of CD4+CD25+Foxp3+ regulatory T cells[J]. Infect Immune, 2007, 75 (9): 4334–4341. DOI:10.1128/IAI.00553-07 |
| [18] | Sumimoto H, Kawakami Y. Lentiviral vector-mediated RNAi and its use for cancer research[J]. Future Oncol, 2007, 3 (6): 655–664. DOI:10.2217/14796694.3.6.655 |
| [19] | Katayama K, Koichiro W, Miyoshi H, et al. RNAinterfering approach forclarifying the PPAR pathway using lentiviral vectors expressing short hairpin RNA[J]. FEBS Letters, 2004, 560 (3): 178–182. |
| [20] | 李跃萍, 宋丽萍, 邱曙东, 等. 慢病毒载体在肿瘤基因治疗中的应用[J]. 现代肿瘤医学, 2006, 14(12): 1615–1617. |
| [21] | Naldini L, Blomer U, Gallay P, Ory D, Mulligan R, et al. In vivo gene delivery and stable transduction of nondividing cells by a lentiviral vector[J]. Science, 1996, 272 (5259): 263–267. DOI:10.1126/science.272.5259.263 |
| [22] | 罗望, 张泓, 许淼, 顾林, 等. 慢病毒——基因转移的潜在新载体[J]. 江苏药学与临床研究, 2006, 14(6): 366–371. |