2. 厦门万泰凯瑞生物技术有限公司,厦门 361003
2. Xiamen WANTAI Inndox Biotechnology Co., Ltd., Xiamen 361003
鳞状上皮细胞癌抗原(Squamous cell carcinoma antigen,SCCAg)最早发现于子宫颈癌组织,包括两种同源分子SCCA1和SCCA2,二者具有92%的氨基酸同源性和高度相似的抗原表位特征,均属于丝氨酸蛋白酶抑制剂家族[1-4]。研究显示,SCCAg是一种重要的肿瘤标记物,与多种器官的鳞状上皮细胞癌有较密切关系[5-8]。血清SCCAg水平可用于有效辅助宫颈癌、头颈部癌、肺非小细胞肺癌、结直肠癌等多种鳞状上皮细胞癌的临床诊断、病情监测和预防判断[5-13]。获得较高纯度和活性的SCCAg抗原是建立临床检测方法及开展相关基础研究的重要基础。
目前,SCCAg抗原主要通过天然提取和重组表达两种方式获得。天然提取方法是从人源组织中进行分离和纯化,该方法需要使用较大量的人源样品,有伦理限制,成本高,难于获得较大量的抗原。重组表达方法目前较多使用真核表达系统,尽管真核表达系统解决了伦理限制和部分降低了生产成本,但存在表达量偏低、耗时长、表达和纯化方法较为复杂等特点[14-15]。大肠杆菌原核表达系统具有操作简便和表达量较高的优点,在基因工程中具有突出优势。目前,虽然已有应用大肠杆菌表达系统开展SCCAg抗原表达的研究,但多以包涵体的表达形式为主,缺乏可溶性表达的报道[16-17]。研究显示,包涵体是一种错误折叠的蛋白形式,重组抗原可溶性表达可更有利于保持抗原的天然构象。因此,本研究拟探索建立基于大肠杆菌表达系统的SCCAg抗原可溶性表达和纯化方法。选择有利于目标抗原可溶性表达的表达载体和表达菌株是探索实现重组抗原可溶性表达的重要方法。多项研究已显示,携带GST(谷胱甘肽S转移酶)融合表达标签的pGEX-6P-1载体与E. coli ER2566菌株在重组抗原可溶性表达方面具有较好的表现[18-24],但尚没有研究将两者联合应用于SCCAg抗原表达。为此,本研究即探索将pGEX-6P-1载体和E. coli ER2566菌株应用于建立重组SCCAg抗原可溶性表达和纯化方法的可行性,开展抗原活性比较及筛选检测抗体并应用于建立SCCAg管式化学发光检测方法。
1 材料与方法 1.1 材料限制性内切酶、T4 DNA连接酶、Taq DNA聚合酶和pMD18-T载体购自TaKaRa公司。弗式完全佐剂和不完全佐剂购自Sigma公司。RPMI1640培养基购自GIBCO公司。胎牛血清(FBS)购自PAA公司。表达载体质粒pGEX-6P-1、大肠杆菌表达菌株E.coli DH5α和E. coli ER2566为本实验室保存,小鼠骨髓瘤细胞SP2/0亦为本实验室保存。SPF级BABL/c小鼠和F1小鼠购自上海斯莱克实验动物有限公司,饲养于厦门大学实验动物中心。其他常规药品试剂购于国药集团。分别携带有全长SCCA1与SCCA2基因序列的pFB质粒由本实验室构建及保存[25]。美国雅培公司的SCCAg抗原检测试剂(批号:62111LP06)、人源SCCAg抗原标准品和SCCAg阳性血清盘由厦门万泰凯瑞生物技术有限公司提供。抗HIS标签的鼠单克隆抗体(HT501-02) 购自北京全式金生物技术有限公司。
1.2 方法 1.2.1 重组SCCAg抗原表达载体构建分别以携带有全长SCCA1与SCCA2基因序列的pFB质粒为模板,以引物(pGEX-SCCAg-SalI-F:5'-ACGCGTCGACAATTCACTCAGTGAAGCCAAC-3';PGEX-SCCAg-XhoI-HIS-R:5' -ATACCGTCTAAGAGTAGGGGCGTGGTAGTAGTAGTAGTAATTGAGCTCGCC-3')分别扩增获得SCCA1与SCCA2全长基因,PCR产物经回收后分别连接pMD18-T载体,经限制性内切酶Sal Ⅰ/ Xho Ⅰ处理后连接到已经用相同限制性内切酶处理的pGEX-6P-1载体中,经测序鉴定后,分别获得SCCA1和SCCA2抗原的重组表达载体pGEX-SCCA1和pGEX-SCCA2。
1.2.2 重组SCCAg抗原的表达与纯化重组表达载体转化E. coli ER2566感受态菌株,37℃扩增至OD600为1.5,之后将培养温度降至特定温度并添加IPTG(0.2-0.6 mmol/L)进行5-8 h的诱导表达。离心(7 000×g,10 min)收集菌体,以缓冲液(30 mmol/L咪唑,20 mmol/L Tris)重悬菌体,在冰水浴条件下使用超声破碎仪对菌体进行破碎。破碎后的菌液离心(25 000×g,20 min)取上清。利用Ni+亲和层析柱对超声上清进行亲和层析纯化(平衡缓冲液:30 mmol/L咪唑,20 mmol/L Tris;核酸冲洗液:1 mol/L NaCl,20 mmol/L Tris;洗脱液:250 mmol/L咪唑,20 mmol/L Tris),收集洗脱峰并透析至PBS中。使用PreScission蛋白酶切掉重组抗原上的GST标签,过GST亲和层析柱,收集穿透峰并透析至PBS中。纯化抗原经SDS-PAGE鉴定后保存于-20℃中。
1.2.3 单克隆抗体制备将纯化的重组SCCA1和SCCA2抗原以1:1质量比例混合,以弗式完全佐剂乳化后采用皮下多点注射方式免疫6-8周龄的SPF级雌性BALB/c小鼠5只(总剂量100 µg/只),分别于第2、4周进行加强免疫。初次免疫采用完全弗氏佐剂,加强免疫采用不完全弗氏佐剂。每次免疫前和免疫全部完成后2周采集血清用间接ELISA方法检测抗体滴度。应用常规的小鼠杂交瘤制备单克隆抗体技术,以PEG 4000为融合剂,将小鼠脾脏细胞与SP2/0骨髓瘤细胞按5:1比例融合,在含HAT的1640选择培养基中培养。以纯化的重组SCCAg抗原作为包被抗原,辣根过氧化物酶(HRP)标记的羊抗鼠抗体为二抗,应用间接ELISA方法检测融合细胞培养上清。通过有限稀释法对阳性克隆孔进行多轮克隆化。将单克隆抗体细胞注射入F1小鼠腹腔诱导腹水,使用硫酸铵盐析法和Protein A亲和层析法对小鼠腹水进行纯化。纯化后的单克隆抗体测定浓度后保存于-20℃。
1.2.4 间接ELISA方法将重组SCCAg用CB缓冲液(pH9.6) 进行稀释,按100 ng/孔包被在96孔微孔板上,放置于37℃温箱中孵育2 h;每孔加入200 µL含有2%明胶的PB缓冲液并放置于37℃温箱中孵育2 h,甩干后真空密封保存备用。检测时每孔加入50 µL杂交瘤细胞上清,放置于37℃温箱中孵育30 min,经1×PBST清洗5次,吸干多余的液体后加入100 µL HRP标记的羊抗鼠抗体(1:5 000) 作为二抗并放置于37℃中孵育,30 min后用1×PBST清洗5次,吸干多余的液体后加入100 µL显色液于37℃温箱中孵育15 min,加入50 µL终止液后在微孔酶标仪上读值。
1.2.5 化学发光免疫分析方法(CLIA)按照文献报道方法将单克隆抗体分别标记磁珠和吖啶酯[26]。将50 µL的检测样品和50 µL标记了抗体的磁珠缓冲液加入U型微孔板中,贴上封板膜并放至37℃恒温箱内孵育15 min,之后用磁力板架吸附微孔板中的磁珠,PBST清洗3遍后加入吖啶酯标记的抗体缓冲液50 µL,37℃孵育10 min后用PBST清洗3遍,将磁珠转移至发光管中并加入100 µL的激发液A,加入100 µL激发液B后上机(全自动微粒子化学发光免疫分析仪)检测发光值。
1.2.6 配对实验将单克隆抗体标记辣根过氧化酶(HRP),同时将单克隆抗体包被到96孔ELISA微孔板上,人源SCCAg稀释至浓度为1 ng/mL。单克隆抗体两两配对对稀释好的人源SCCAg抗原进行检测,将OD读值大于1的单克隆抗体配对组合定为高反应配对,将OD读值介于0.1和1之间的单克隆抗体配对组合定为中等反应配对,将OD读值小于0.1的单克隆抗体配对组合定义为低反应配对。
1.2.7 检测灵敏度的分析依照《体外诊断试剂分析性能评估系列指导原则》中的方法对检测试剂进行检测灵敏度分析。检测试剂对梯度稀释的SCCAg标准品进行检测并绘制剂量反应曲线,对0水平校准品进行20次重复测定计算检测灵敏度。
1.2.8 SDS-PAGE方法配制12%的聚丙烯酰胺凝胶,凝固后放入电泳槽中加满电泳液,取50 µL的样品加入10 µL的6×含有还原剂的样品缓冲液,沸水浴10 min后上样,电泳结束后用考马斯亮蓝染色液染色15-30 min,经KCl溶液脱色后进行样品分析。
1.2.9 Western-blot方法取50 µL样品进行SDS-PAGE分析,电泳结束后通过电转仪将重组抗原转至硝酸纤维素膜上,5%脱脂奶封闭2 h后加入抗HIS标签的鼠抗(1:1 000) 室温孵育1 h,TNT漂洗5遍后加入GAM-HRP(1:5 000) 作为二抗,室温孵育45 min后用TNT漂洗5遍并进行化学发光显色。
2 结果 2.1 重组SCCAg抗原可溶性表达与纯化方法建立将SCCA1和SCCA2全长基因分别克隆入pGEX-6P-1载体构建获得重组表达质粒pGEX-SCCA1和pGEX-SCCA2。将重组表达质粒分别转化E. coli ER2566感受态菌株,并分别在不同的温度条件下进行诱导表达。SDS-PAGE显示,在不同诱导温度条件下SCCA1和SCCA2的表达菌株在75 kD的位置均有目的表达条带,其分子量与预期的融合有GST标签的SCCAg抗原的大小相符,并且均能够以可溶性形式存在于超声裂解上清中,不同诱导温度的抗原表达量无显著差异。该结果说明,采用pGEX-6P-1载体和E. coli ER2566菌株可实现SCCA1和SCCA2抗原的可溶性表达。通过进一步优化IPTG溶度、诱导温度和诱导时间,本研究获得了较优的诱导可溶性表达SCCA1和SCCA2抗原的条件为0.2 mmol/L IPTG和37℃下诱导表达8 h。本研究应用亲和层析纯化方法获得了纯化的SCCA1和SCCA2重组抗原,SDS-PAGE和Western blot分析(图 1)显示,纯化的SCCA1和SCCA2重组抗原具有较好的纯度,其分子量约为48 kD,与预期大小相符。
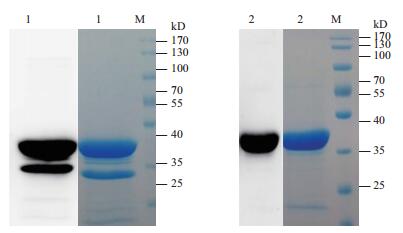
|
| 图 1 重组SCCAg的SDS-PAGE和Western Blot分析 1:重组SCCA1;2:重组SCCA2;M:Protein Mark |
本研究应用目前临床上主要使用的SCCAg检测试剂对比了本研究表达纯化获得重组抗原与人源SCCAg抗原的反应活性,分别将表达纯化获得SCCA1抗原、SCCA2抗原和人源SCCAg抗原进行系列梯度稀释,用SCCAg检测试剂分别检测其反应活性。结果(图 2)显示,本研究获得的重组SCCA1抗原、SCCA2抗原与对照的人源SCCAg抗原均具有良好的反应性,检测试剂对其的检测灵敏度分别为2.14 ng/mL、1.06 ng/mL和1.40 ng/mL。本研究获得的重组SCCAg抗原具有与人源抗原相当的反应活性。
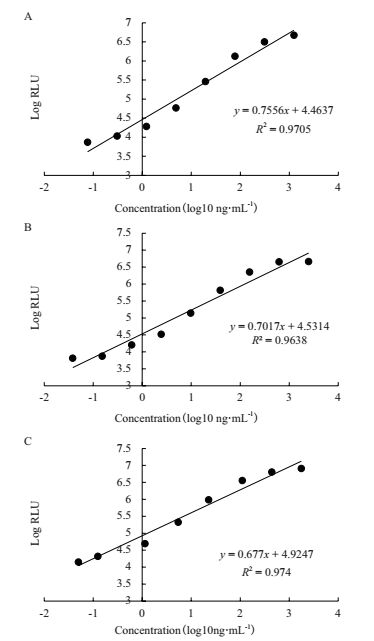
|
| 图 2 雅培试剂检测SCCAg标准品和重组SCCAg A:SCCAg标准品的剂量反应曲线;B:重组SCCA1的剂量反应曲线;C:重组SCCA2的剂量反应曲线 |
本研究利用纯化的重组SCCA1和SCCA2抗原免疫免疫BALB/c小鼠5只,并进一步制备了抗SCCAg的特异性单克隆抗体。应用间接ELISA方法分别检测免疫后不同时间点小鼠多抗血清与重组SCCA1和SCCA2抗原的反应活性。结果(图 3)显示,小鼠血清对重组SCCA1和SCCA2抗原均具有较好的反应活性,免疫程序完成后血清的反应活性均在1:50 000以上。该结果显示了本研究获得的重组SCCAg抗原具有良好的免疫原性。本研究进一步筛选获得了80株同时对SCCA1和SCCA2抗原具有反应活性的单克隆抗体。
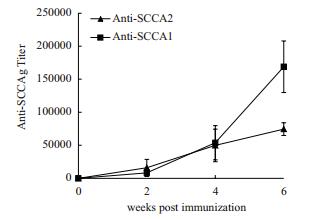
|
| 图 3 SCCAg免疫小鼠多抗血清监测 |
通过配对实验检测人源SCCAg抗原获得29组OD值读值较高的单克隆抗体配对组合(图 4-A),其中两组单克隆抗体配对(7F10/4H8-HRP和12F6/7E2-HRP)的检测灵敏度较优(图 4-B)。进一步应用17份确证阳性人血清标本对上述两种配对方法进行评价,结果(图 4-C)显示,单克隆抗体7F10与SAE标记的单克隆抗体4H8的组合具有更优的检测性能。本研究即以之为基础初步建立了SCCAg抗原的管式化学发光检测方法。

|
| 图 4 SCCAg管式化学发光检测方法的建立 A配对实验;B单克隆抗体配对的筛选;C小量血清相关性评价 |
对新建立的检测方法的性能进行了初步评价。结果(图 5-A)显示,该检测方法对人源SCCAg抗原的检测灵敏度为0.15 ng/mL,达到现有临床主流SCCAg检测试剂水平;对20份确证阴性人血清标本均检出阴性,特异性为100%。本研究同时应用该方法与对照试剂平行对30份确证阳性人血清标本进行了检测,结果(图 5-B)所示,上述两种检测方法获得的检测结果具有良好的相关性(R2=0.9953)。上述结果说明,本研究建立的SCCAg检测方法性能较好,与对照主流试剂相当。
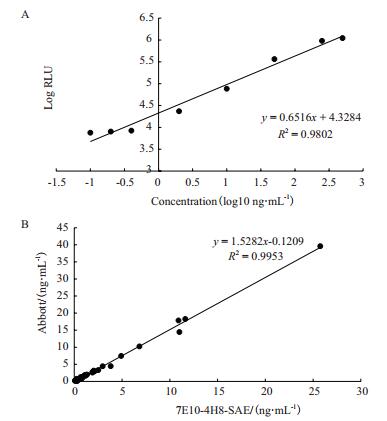
|
| 图 5 SCCAg管式化学发光检测方法的初步评价 A:本研究建立检测方法的剂量反应曲线;B:本研究建立的检测方法与雅培试剂的相关性评价 |
本研究以pGEX-6P-1载体和E. coli ER2566菌株为基础建立了重组SCCAg抗原的原核表达纯化方法,该方法可实现重组SCCAg在原核表达系统中的可溶性表达,且制备获得的重组SCCAg抗原具有较好的纯度和活性。在已报道的应用原核系统表达SCCAg抗原的研究中,SCCAg抗原主要以包涵体形式表达[16, 17]。对比分析显示,本研究方法与已报道方法在目标抗原基因序列和总体表达策略上并无显著差别,较主要的差别在于表达菌株和表达载体。此前研究中使用的菌株均为E. coli BL21,表达载体包括pGEX-4T-1[16]、pET-32a[16]和pET-28b[17];本研究采用的菌株为E. coli ER2566,表达载体为pGEX-6P-1。其中,pET-32a为6×His-Trx(6组氨酸-硫氧还蛋白)标签,pET-28b为6×His标签,pGEX-4T-1与本研究使用的pGEX-6P-1类似均为GST标签,但此前研究显示pGEX-4T-1载体在E. coli BL21中也未能实现SCCAg抗原的可溶性表达[16]。因此分析显示,采用GST为融合表达标签并以E. coli ER2566为表达菌株是本研究实现可溶性表达SCCAg抗原的重要特征。其详细机制有待后续研究进一步揭示。本研究建立的SCCAg抗原原核表达方法有利于避免天然提取抗原方法存在的人组织来源问题,进而降低原料制备成本。同时原核表达系统具有扩增速度快、培养操作简单等特点,因此相比真核表达系统和天然提取抗原,使用原核表达系统制备重组SCCAg可较方便、快捷地获取大量抗原,从而为SCCAg检测试剂的研发奠定良好基础。
化学发光检测技术具有检测范围广、检测灵敏度高、无放射性废物以及容易自动化等优点,已被广泛应用于常规的临床检测以及医疗和生化研究中。目前使用的主流SCCAg化学发光检测试剂多为雅培、罗氏等进口试剂,因此研制具有自主产权的SCCAg化学发光检测试剂对于降低国民医疗费用,提高诊断试剂的市场竞争力具有较为重要的意义。本研究从6 400组单克隆抗体配对组合中筛选获得了一组对血清SCCAg具有良好检测性能的单克隆抗体配对7F10和4H8。该配对的检测灵敏度与目前临床上应用较广的雅培SCCAg检测试剂相当,且二者检测结果具有良好的相关性。
4 结论本研究首次将pGEX-6P-1载体和E. coli ER2566菌株联合应用重组SCCAg抗原的表达与纯化,应用原核表达系统高效表达了全长、可溶的重组SCCAg抗原,经验证其具有纯度较高、活性较好的优点,并应用于SCCAg诊断试剂研发获得了检测性能与国外试剂盒水平相当的单克隆抗体配对。
| [1] | Kato H, Torigoe T. Radioimmunoassay for tumor antigen of human cervical squamous cell carcinoma[J]. Cancer, 1977, 40 (4): 1621–1628. DOI:10.1002/(ISSN)1097-0142 |
| [2] | Schneider SS, Schick C, Fish KE, et al. A serine proteinase-inhibitor locus at 18q21. 3 contains a tandem duplication of the human squamous-cell carcinoma antigen gene[J]. Proc Natl Acad Sci USA, 1995, 92 (8): 3147–3151. DOI:10.1073/pnas.92.8.3147 |
| [3] | Schick C, Kamachi Y, Bartuski AJ, et al. Squamous cell carcinoma antigen 2 is a novel serpin that inhibits the chymotrypsin-like proteinases cathepsin G and mast cell chymase[J]. Journal of Biological Chemistry, 1997, 272 (3): 1849–1855. DOI:10.1074/jbc.272.3.1849 |
| [4] | Schick C, Pemberton PA, Shi GP, et al. Cross-class inhibition of the cysteine proteinases cathepsins K, L, and S by the serpin squamous cell carcinoma antigen 1:a kinetic analysis[J]. Biochemistry, 1998, 37 (15): 5258–5266. DOI:10.1021/bi972521d |
| [5] | Eibling DE, Johnson JT, Wagner RL, et al. SCC-RIA in the diagnosis of squamous cell carcinoma of the head and neck[J]. Laryngoscope, 1989, 99 (2): 117–124. |
| [6] | Sanchez De Cos J, Masa F, de la Cruz JL, et al. Squamous cell carcinoma antigen(SCC Ag)in the diagnosis and prognosis of lung cancer[J]. Chest, 1994, 105 (3): 773–776. DOI:10.1378/chest.105.3.773 |
| [7] | Williams M, Swampillai A, Osborne M, et al. Squamous cell carcinoma antigen:a potentially useful prognostic marker in squamous cell carcinoma of the anal canal and margin[J]. Cancer, 2013, 119 (13): 2391–2398. DOI:10.1002/cncr.28055 |
| [8] | Yamanaka N, Himi T, et al. Soluble immune complexes and squamous cell carcinoma-related antigens in patients with head and neck cancer[J]. Cancer, 1988, 62 (9): 1932–1938. DOI:10.1002/(ISSN)1097-0142 |
| [9] | Kato H, Tamai K, Morioka H, et al. Tumor-antigen TA-4 in the detection of recurrence in cervical squamous cell carcinoma[J]. Cancer, 1984, 54 (8): 1544–1546. DOI:10.1002/(ISSN)1097-0142 |
| [10] | Brioschi PA, Bischof P, Delafosse C, et al. Squamous-cell carcinoma antigen(SCC-A)values related to clinical outcome of pre-invasive and invasive cervical carcinoma[J]. Int J Cancer, 1991, 47 (3): 376–379. DOI:10.1002/(ISSN)1097-0215 |
| [11] | Kato H, Miyauchi F, Morioka H, et al. Tumor antigen of human cervical squamous cell carcinoma. Correlation of circulating levels with disease progress[J]. Cancer, 1979, 43 (2): 585–590. DOI:10.1002/(ISSN)1097-0142 |
| [12] | Kato H, Morioka H, Tsutsui H, et al. Value of tumor-antigen(TA-4) of squamous cell carcinoma in predicting the extent of cervical cancer[J]. Cancer, 1982, 50 (7): 1294–1296. DOI:10.1002/(ISSN)1097-0142 |
| [13] | Kato H, Tamai K, Nagaya T, et al. The use of a tumor antigen TA-4 for the management of squamous cell carcinoma[J]. Cancer Detection & Prevention, 1985, 8 (1-2): 155. |
| [14] | 范翠英, 冯利兴, 樊金玲, 等. 重组蛋白表达系统的研究进展[J]. 生物技术, 2012, 22(2): 76–80. |
| [15] | 陈晓娟, 闫少春, 邵国. 蛋白表达系统的研究进展[J]. 包头医学院学报, 2014(3): 142–143. |
| [16] | 于华实, 孙晓琳, 等. 鳞状细胞癌抗原SCCA基因的构建、表达及鉴定[J]. 现代生物医学进展, 2013, 13(18): 3420–3423. |
| [17] | Butvilovskaya VI, Tsybulskaya MV, Tikhonov AA, et al. Preparation of recombinant serpins B3 and B4 and investigation of their specific interactions with antibodies using hydrogel-based microarrays[J]. Molecular Biology, 2015, 49 (5): 705–713. DOI:10.1134/S0026893315050040 |
| [18] | de Almeida Ramos D, Miani M, et al. Production and characteriz-ation of a Brazilian candidate antigen for Hepatitis E Virus genotype 3 diagnosis[J]. FEMS Microbiol Lett, 2016, 363 (5): fnw021. DOI:10.1093/femsle/fnw021.Epub2016Jan31 |
| [19] | Li X, Xu J, et al. Vaccination with recombinant flagellar proteins FlgJ and FliN induce protection against Brucella abortus 544 infec-tion in BALB/c mice[J]. Vet Microbiol, 2012, 161 (1-2): 137–144. DOI:10.1016/j.vetmic.2012.07.016 |
| [20] | Lin CC, Liu TT, Kan SC, et al. Production of D-hydantoinase via surface display and self-cleavage system[J]. J Biosci Bioeng, 2013, 116 (5): 562–566. DOI:10.1016/j.jbiosc.2013.05.002 |
| [21] | Ren LQ, Liu W, Wi WB, et al. Peptidylprolyl cis/trans isomerase activity and molecular evolution of vertebrate Cyclophilin A[J]. Yi Chuan, 2016, 38 (8): 736–745. |
| [22] | Wu X, Liu Q, He J, et al. Preparation and characterization of a monoclonal antibody against the core protein VP7 of the 25th serotype of bluetongue virus[J]. Monoclon Antib Immunodiagn Immunother, 2015, 34 (2): 116–121. |
| [23] | Xiong D, Song L, Zhai X, et al. A porcine reproductive and respiratory syndrome virus(PRRSV)vaccine candidate based on the fusion protein of PRRSV glycoprotein 5 and the Toll-like Receptor-5 agonist Salmonella Typhimurium FljB[J]. BMC Vet Res, 2015, 11 : 121. DOI:10.1186/s12917-015-0439-0 |
| [24] | Maseko SB, Natarajan S, Sharma V, et al. Purification and characterization of naturally occurring HIV-1(South African subtype C)protease mutants from inclusion bodies[J]. Protein Expression & Purification, 2016, 122 : 90–96. |
| [25] | Chen M, Cheng T, Xu CY, et al. Hydrophobicity of reactive site loop of SCCA1 affects its binding to hepatitis B virus[J]. World J Gastroenterol, 2005, 11 (19): 2864–2868. DOI:10.3748/wjg.v11.i19.2864 |
| [26] | 陈鹭颖, 林海军, 翁祖星, 等. 基于全自动管式化学发光免疫检测系统的人结核感染T细胞检测方法的建立[J]. 分子诊断与治疗杂志, 2015, 7(5): 296–301. |




