假单胞菌生长速度快、环境适应能力强,在抑制植物病害、促进植物生长[1-6]、污染物降解[7-10]等方面具有重要的作用和应用前景,但其对极端环境(高温、低温、干燥、缺营养等)抵抗能力较差,干燥保藏存活率低,低存活率制约了假单胞菌的工程应用,因此提高假单胞菌制剂收率对假单胞菌的实际应用有重要的现实意义。
真空冷冻干燥技术在微生物保藏方面得到了广泛的应用,是目前适应性最广的菌剂制备技术,在低温、真空条件下,微生物的生理活动停止,细胞活力不易受损,特别适合热敏性、氧敏性的微生物干燥制备,且菌剂保藏中不易受污染,易于分装运输。然而,由于各类微生物菌株的生境条件、营养需求、培养方法等存在较大差异,造成了不同微生物菌株的冻干保护剂和冻干方法也不尽相同。因此,制备假单胞菌菌粉的关键在于保护剂的使用。本研究旨在通过正交试验对保护剂进行筛选和优化,得到最佳的保护剂配方,提高菌粉的存储期。
1 材料与方法 1.1 材料实验所用的假单胞菌为本课题组选育出来的降解酚类化合物的菌种[11](CCTCC No.M2014400);脱脂乳粉和食用级购自内蒙古伊利集团;麦芽糊精和食用级购自山东西王糖业有限公司;甘油、甘露醇和AR购自国药试剂集团化学试剂有限公司;葡聚糖和BR购自国药试剂集团化学试剂有限公司;胰蛋白胨、酵母粉和BR购自OXOID LTD公司;氯化钠和AR购自国药试剂集团化学试剂有限公司。
Free Zone 2.5L冷冻干燥机,美国LABCONCO公司;SHP-350生化培养箱,上海精宏实验设备有限公司;DW-86L388医用低温冰箱,青岛海尔公司;3K-15高速离心机,德国SIGMA公司;YXQ-LS-100G高压灭菌锅,上海博迅实业有限公司;HZP-250全温摇床,上海精宏实验设备有限公司;SW-CJ-2FD超净工作台,上海博迅实业有限公司;AL204-IC电子天平,梅特勒公司。
1.2 方法 1.2.1 假单胞菌的培养及菌悬液制备LB液体培养基:胰蛋白胨10 g/L,酵母粉5 g/L,NaCl 10 g/L,5 mol/L NaOH溶液调节pH至7.0。LB固体培养基:胰蛋白胨10 g/L,酵母粉5 g/L,NaCl 10 g/L,琼脂粉15 g/L,5 mol/L NaOH溶液调节pH至7.0。
培养方法:将假单胞菌菌液于LB固体培养基上划线,30℃倒置过夜培养,检验菌株纯度合格后,挑取单菌落接种到液体LB培养基中(50 mL/250 mL),在30℃、150 r/min条件下培养24 h,得到种子液。将种子液按2%接种于液体LB培养基中(100 mL/500 mL)培养48 h,在5 000 r/min条件下离心15 min,去除上清液,用无菌生理盐水将菌泥配制成菌悬浊液。
1.2.2 冷冻干燥保护剂的筛选选取脱脂乳粉、葡聚糖、甘油、β-环糊精、山梨醇、抗坏血酸钠6种保护剂[12-15]作为假单胞菌冷冻干燥保护剂的筛选对象,通过单因素实验及正交试验,选出最佳保护剂组合。
1.2.3 冷冻干燥方法将保护剂加入装有菌悬浊液的冻干瓶中,用匀浆机将菌液与保护剂混合均匀,于-80℃超低温冰箱中预冻3 h,确认样品预冻完全,待真空冷冻干燥机冻干舱温度降至-80℃时,放入预冻完全的样品,开始抽真空,真空冷冻干燥24-48 h后取出,获得冻干菌粉。
1.2.4 假单胞菌存活率的测定方法以细菌存活率表征保护剂对的保护效果,通过梯度稀释平板计数法测定假单胞菌活菌数,然后根据以下公式计算假单胞菌的存活率:
存活率(%)=冻干后样品总活菌数/冻干前样品总活菌数×100%。
2 结果 2.1 单一保护剂对假单胞菌存活率的影响保护剂种类及浓度见表 1。6种保护剂分别以不同的量添加到假单胞菌悬浊液中,混合均匀,预冻后进行真空冷冻干燥,菌粉存活率结果见图 1。与空白组相比,加入保护剂后,随着保护剂浓度的提高,菌体存活率均有不同程度的提升,到达一定浓度后,过多保护剂的加入会对菌体存活率产生负面影响。在最佳浓度条件下,保护剂对菌粉保护效果为:抗坏血酸钠>脱脂乳粉>山梨醇>甘油>β-环糊精>葡聚糖,上述保护剂的最优添加量分别为:2 wt%、10 wt%、5 wt%、1 wt%、5 wt%和4 wt%,对应的菌粉活菌收率分别为:55%、47%、40%、30%、27%和25%。后续实验选择保护效果较好的抗坏血酸钠、脱脂乳粉、山梨醇及甘油作为假单胞菌冻干保护剂进行优化研究。
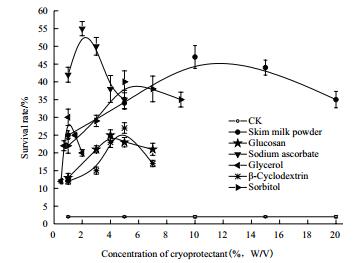
|
| 图 1 单一保护剂对假单胞菌存活率的影响 |
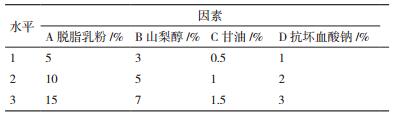
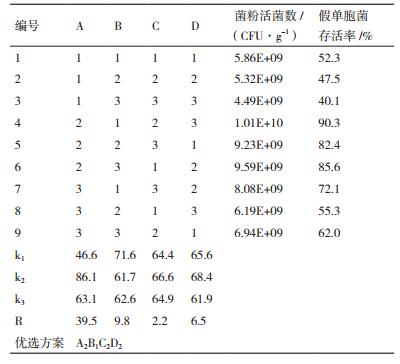
采用L9(34)正交实验设计筛选最佳保护剂配方,正交实验影响因素及水平见表 2,正交实验结果见表 3。从表 2可知,各因素对对假单胞菌冻干后的存活率影响次序为:脱脂乳粉>山梨醇>抗坏血酸酸钠>甘油,最优保护剂组合为A2B1C2D2,即脱脂乳粉10%、山梨醇3%、甘油1%和L抗坏血酸钠2%,此时活菌菌粉存活率为90%,采用优化后的复合保护剂配方制备的菌粉活菌存活率,明显高于单因素保护剂制备菌粉活菌存活率。后续实验采用最优保护剂组合为A2B1C2D2作为假单胞菌菌粉冻干保护剂进行研究。
最优保护剂组合为A2B1C2D2作为假单胞菌菌粉冻干保护剂,实验选取4℃和25℃两种温度条件考察菌粉贮存稳定性,实验结果见表 4。随着贮存时间的延长,菌粉活菌数及存活率呈现下降的趋势,25℃贮存比4℃贮存菌粉活菌数下降快,贮存6个月后,菌粉存活率分别为:50.2%和96.5%,实验结果表明,冻干菌粉更适合在4℃条件下贮存。
假单胞菌在真空冷冻干燥过程中,主要受到冷冻伤害和干燥伤害[16],前者主要与“胞内冻结”有关,后者主要与细胞过度失水有关。为提高假单胞菌的冻干存活率,通常采用加入保护剂的方式,提高细胞的活性[17]。就保护剂系统而言,通常加入多种物质,协同强化保护效果。保护剂按不同方式可分为渗透型、非渗透型、大分子、小分子等类型。渗透型保护剂可进入细胞,易与水分子结合,水合作用使溶液的黏性增大,从而弱化了水的结晶过程;非渗透型保护剂不能进入细胞内部,可在特定温度降低溶质浓度(使溶液呈现过冷状态);大分子保护剂通过“包裹”形式保护菌体,使细胞表面免受伤害,单独使用效果并不明显,通常与小分子保护剂共同使用,可强化小分子保护剂的保护作用;小分子保护剂发挥主要保护作用,一些亲水且能透过细胞膜的小分子,其含有的羟基在冻干过程中可取代水分子与菌体细胞膜磷脂中的磷酸基团或与菌体蛋白质极性基团形成氢键,减缓和抑制冰晶的生长,保护细胞膜和蛋白质结构与功能的完整性[13, 16, 18, 19]。
本工作结合保护剂作用机制及前期研发经验,选择脱脂乳粉、葡聚糖、甘油、β-环糊精、山梨醇、抗坏血酸钠作为冻干保护剂,筛选得到选择保护效果较好的抗坏血酸钠、脱脂乳粉、山梨醇、甘油进行优化研究,在最优条件下,假单胞菌冻干后的存活率可达90.3%,说明选择的保护剂起到较好的保护效果。但真空冷冻干燥过程中,干燥工艺条件不仅影响菌的冻干存活率,还影响菌的贮存稳定性,整个干燥过程中涉及的影响因素较多,如前期菌株生长条件、预冻条件、细胞含水量、保护剂等。有关工艺条件与假单胞菌存活率、贮存稳定性的关系,将作进一步研究。
4 结论保护剂的添加对提高假单胞菌在冷冻干燥过程中的存活率有明显效果,在添加优化的复合保护剂(脱脂乳粉10%、山梨醇3%、甘油1%和L抗坏血酸钠2%)条件下,假单胞菌冻干后的存活率可达90.3%,菌粉在4℃、25℃条件下贮存6个月的活菌存活率分别为96.5%和50.2%。
| [1] | Glick BR, Karaturovíc DM, Newell PC. A novel procedure for the rapid isolation of plant growth-promoting Pseudomonas[J]. Canadian Journal of Microbiology, 1995, 41 (6): 533–536. DOI:10.1139/m95-070 |
| [2] | Albano LJ, Macfie SM. Investigating the ability of Pseudomonas fluorescens UW4 to reduce cadmium stress in Lactuca sativa via an intervention in the ethylene biosynthetic pathway[J]. Canadian Journal of Microbiology, 2016, 62 (12): 1057–1062. DOI:10.1139/cjm-2016-0315 |
| [3] | Nadeem SM, Zahir ZA, Naveed M, et al. Rhizobacteria containing ACC-deaminase confer salt tolerance in maize grown on salt-affected fields[J]. Can J Microbiol, 2009, 55 (11): 1302–1309. DOI:10.1139/W09-092 |
| [4] | Ahmad M, Zahir ZA, Asghar HN, et al. Inducing salt tolerance in mung bean through coinoculation with rhizobia and plant-growth-promoting rhizobacteria containing 1-aminocyclopropane-1-carboxylate deaminase[J]. Canadian Journal of Microbiology, 2011, 57 (7): 578–589. DOI:10.1139/w11-044 |
| [5] | Manikandan R, Raguchander T. Fusarium oxysporum f. sp. lycopersici retardation through induction of defensive response in tomato plants using a liquid formulation of Pseudomonas fluorescens(Pf1)[J]. Eur J Plant Pathol, 2014, 140 (3): 469–480. DOI:10.1007/s10658-014-0481-y |
| [6] | Khan MR, Anwer MA, Shahid S. Management of gray mold of chickpea, Botrytis cinerea with bacterial and fungal biopesticides using different modes of inoculation and application[J]. Biological Control, 2011, 57 (1): 13–23. DOI:10.1016/j.biocontrol.2011.01.004 |
| [7] | 张书景, 李坚, 李依丽, 等. 恶臭假单胞菌生物滴滤塔净化甲苯废气的研究[J]. 环境科学, 2007, 28(8): 1866–1872. |
| [8] | Mishra S, Singh SN. Microbial degradation of n-hexadecane in mineral salt medium as mediated by degradative enzymes[J]. Bioresource Technology, 2012, 111 : 148–154. DOI:10.1016/j.biortech.2012.02.049 |
| [9] | Shi GY, Yin H, Ye JS, et al. Aerobic biotransformation of decabromodiphenyl ether(PBDE-209) by Pseudomonas aeruginosa[J]. Chemosphere, 2013, 93 (8): 1487–1493. DOI:10.1016/j.chemosphere.2013.07.044 |
| [10] | Srivastava AK, Singh T, et al. Induced resistance and control of charcoal rot in Cicer arietinum(chickpea)by Pseudomonas fluorescens[J]. Can J Bot, 2001, 79 (7): 787–795. |
| [11] | 朱希坤, 彭湃, 李小明, 等. 假单胞菌及其用途: 中国, CN201410665101. 0[P]. 2015-02-18. |
| [12] | Palmfeldt J, Rådström P, Hahn-Hägerda B. Optimisation of initial cell concentration enhances freeze-drying tolerance of Pseudomonas chlororaphis[J]. Cryobiology, 2003, 47 (1): 21–29. DOI:10.1016/S0011-2240(03)00065-8 |
| [13] | Costa E, Usall J, Teixido N, et al. Effect of protective agents, rehydration media and initial cell concentration on viability of Pantoea agglomerans strain CPA-2 subjected to freezedrying[J]. Journal of Applied Microbiology, 2006, 89 (5): 793–800. |
| [14] | Clement MT. Effects of freezing, freeze-drying, and storage in the freeze-dried and frozen state on Viability of Escherichia coli Cells[J]. Can J Microbiol, 1961, 7 (1): 99–106. DOI:10.1139/m61-012 |
| [15] | Stephan D, Silva APMD, Bisutti IL. Optimization of a freeze-drying process for the biocontrol agent Pseudomonas sp. and its influence on viability, storability and efficacy[J]. Biological Control, 2016, 94 : 74–81. DOI:10.1016/j.biocontrol.2015.12.004 |
| [16] | Souzu H. Basic aspects and industrial strategies for the preservation of microorganisms by freezing and drying in "Freeze-drying/lyophilization of pharmaceutical and biological products"[M]. New York: Marcel Dekker, 1999: 22-35. |
| [17] | Prakash O, Nimonkar Y, et al. Practice and prospects of microbial preservation[J]. FEMS Microbiol Lett, 2013, 339 (1): 1–9. DOI:10.1111/fml.2013.339.issue-1 |
| [18] | Hubálek Z. Protectants used in the crypreservation of microorganisms[J]. Cryobiology, 2003, 46 (3): 205–229. DOI:10.1016/S0011-2240(03)00046-4 |
| [19] | 山丽杰, 田洪涛, 等. 浓缩型乳酸菌发酵剂制备中几个技术关键问题的探讨[J]. 中国乳品工业, 2002, 30(5): 66–69. |