近年来,随着广谱抗生素的广泛滥用,耐甲氧西林金黄色葡萄球菌(MRSA)已经成为全球社区和医院感染的重要病原菌之一。每年数百万人遭受感染,并且出现的频率越来越高,在2011年至2014年间,美国医院从患者的鼻孔和血液培养中收集了516种MRSA分离物[1, 2]。由于MRSA具有多部位感染和多重耐药性,已被公认为世界三大最难解决的感染性疾病之一[3, 4]。目前,用于临床的药物主要是万古霉素、去甲基万古霉素、替考拉宁、达托霉素和利奈唑胺等。万古霉素、去甲基万古霉素虽然治疗效果好,抗菌谱广,但是对肾、耳有一定的毒性[5],且已经出现了多种万古霉素耐药菌株[6]。替考拉宁虽然肾毒性比万古霉素低,但与其他糖肽类药物有交叉耐药性;达托霉素很难引起和其他抗生素发生交叉耐药的问题,能达到比万古霉素更好的治疗效果[7],但其诸如胃肠道反应、发热、头疼等不良反应较多[8];在中国已经发现利奈唑胺耐药菌株,并且有血小板减少、导致视神经和周围神经病变等副作用[9-12]。因此,研究和筛选更加安全、有效、稳定的抗MRSA的抗生素,对于控制感染流行和临床治疗有着重要的意义。解淀粉芽孢杆菌(Bacillus amyloliquefacien)是一种与枯草芽孢杆菌亲缘性很高的细菌,在自然界分布广泛,易分离培养,对人畜无毒无害,不污染环境。解淀粉芽孢杆菌在其生长过程中可以产生一系列能够抑制真菌和细菌活性的代谢物。目前研究较多的是其对植物病原菌的抑制作用,被广泛应用于花卉、水果以及各种农作物病害防治[13-19]。但是,解淀粉芽孢杆菌用于临床治疗的研究尚不多。本研究主要对实验室分离的一株解淀粉芽孢杆菌[20]的抗菌活性和抗MRSA机理进行初步探究,以期为解淀粉芽孢杆菌的抗MRSA活性物质的进一步研究和开发提供参考。
1 材料与方法 1.1 材料 1.1.1 菌种AF1,重庆理工大学生物工程实验室分离。病原指示菌(1) 病原细菌:WHO2、252、SA44、SA45、SA46、SA47、SA48、SWSA58、SWSA59、SWSA60、SWSA61、SWSA62、35218、SWEC41、SWEC44、SWEC45、SWEC46、SWEC47、SWKP41、SWKP42、SWKP43、SWKP44、SWKP45、SWKP46、SWKP47和KP42(由第三军医大学基础部药理学教研室提供)。(2) 植物病原菌:柑橘绿霉、枯萎、疫霉、蕃茄早疫、花生黑斑、棉立枯、稻瘟、烟草赤星、黄瓜灰霉(由本校余瑛老师提供)。
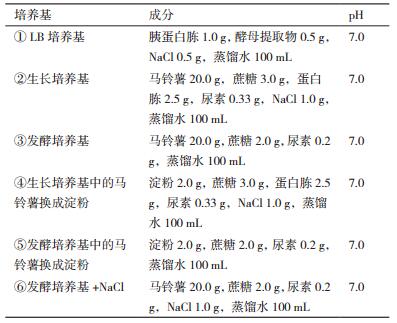
1.1.2 培养基抗菌活性筛选培养基,如表 1。
将斜面菌种挑取1环接种到装有50 mL生长培养基的250 mL三角瓶中,37℃,200 r/min培养,待OD600值达到5.0时,按1%接种量接入发酵培养基中,37℃,200 r/min培养24 h,发酵液于12 000 r/min离心10 min,取上清液,用0.22 μm膜过滤,收集滤液备用。
1.2.1.2 对病原细菌的处理分别将各斜面病原菌种,接种至装有30 mL新鲜液体LB培养基的100 mL三角瓶中,37℃,200 r/min培养20 h。然后,采用平板倾注法,把各个病原菌液分别接种至LB固体培养基,再在每个病原菌的LB固体平板上分别均匀打孔,孔径为8 mm,每孔接入200 µL上述发酵滤液,37℃培养24 h,用游标卡尺测量抑菌圈大小。
1.2.1.3 对植物病原真菌的处理采用平板对峙法,在PDA平板中,将直径约0.3 cm的两块指示病原菌琼脂块接种在距平板中央3 cm处的直线上两点处,平板中央打孔,孔径为8 mm,接入1.2.1.1制备好的发酵滤液200 μL,置于28℃培养箱培养5 d,测量抑菌圈直径(中心至两病原菌菌落菌丝边缘的距离)的大小作为抑菌活性指标。
1.2.2 不同培养基发酵液对耐药金葡菌SA46的抗菌活性将斜面菌种挑取1环接种到装有50 mL生长培养基的250 mL三角瓶中,37℃,200 r/min培养,待OD600值达到5.0时,按1%接种量分别接入1.1.2中6种不同的培养基中,37℃,200 r/min培养24 h,发酵液于12 000 r/min离心10 min,取上清液,用0.22 μm膜过滤,收集滤液。以耐药金葡菌SA46为指示菌,采用1.2.1.2相同的平板倾注法,测定每种发酵培养基发酵液的抑菌圈大小。
1.2.3 AF1发酵液活性稳定性研究 1.2.3.1 pH值对发酵液活性的影响取27支洁净试管,每支分别取1.2.1.1制备好的发酵液10 mL,其中3支对照原液组保持自然pH值,其余用少量盐酸溶液和NaOH溶液分别调pH为2.0、4.0、5.0、6.0、7.0、8.0、9.0和11.0。每个pH分别处理30、60、90和120 min,处理后的样品调回原来的自然pH值,再用0.22 μm滤膜过滤各样品,收集滤液,每个pH处理重复3次。再用耐药金葡菌SA46为指示菌,参考1.2.1.2测定各样品的抑菌圈大小。以处理时间为横坐标,以相对活性为纵坐标,绘制曲线。以对照原液组的抑菌圈大小为活性100%,计算各pH组的相对活性。
1.2.3.2 温度对发酵液活性的影响取18支洁净离心管,每支分别取1.2.1.1制备好的发酵液30 mL,其中3支对照组放置室温,其余分别放置冰箱和水浴锅保持4℃、30℃、60℃、80℃和100℃。每个温度分别处理30、60、90和120 min,处理完毕后每支离心管补加去离子水至原来的刻度线,再用0.22 μm滤膜过滤各样品,收集滤液,每个温度处理重复3次。再用耐药金葡菌SA46为指示菌,参考1.2.1.2测定各样品的抑菌圈大小。以处理时间为横坐标,以相对活性为纵坐标,绘制曲线。以对照组的抑菌圈大小为活性100%,计算各温度的相对活性。
1.2.3.3 蛋白酶对发酵液活性的影响取12支洁净试管,每支分别取1.2.1.1制备好的发酵液10 mL,其中3支为对照组,不加任何蛋白酶,其余9支,分别加入蛋白酶K、胃蛋白酶和胰蛋白酶,使酶的终浓度为1 mg/mL,每处理重复3次。其中,胃蛋白酶组调pH为2.0,蛋白酶K和胰蛋白酶组pH值为7.0,于37℃,处理2 h,处理完毕后,再把各滤液pH调至原发酵液pH,用0.22 μm滤膜过滤各样品,收集滤液。再用耐药金葡菌SA46为指示菌,参考1.2.1.2测定各样品的抑菌圈大小。以对照组的抑菌圈大小为活性100%,计算各蛋白酶处理组的相对活性。
1.2.4 AF1发酵液对耐药金葡菌SA46抗菌机理初步研究 1.2.4.1 最低抑菌浓度测定[21]按最低抑菌浓度(Minimal inhibitory concentration,MIC)测定法测定上述制备的AF1菌的发酵滤液对耐药金葡菌SA46的MIC值。将培养至对数生长期的SA46菌液加入96孔细胞培养板,每孔50 μL,在向各孔中加入50 μL经倍比稀释的AF1菌的发酵滤液,阴性对照为加入无菌水。37℃培养6 h,酶标仪在λ=630 nm检测OD值,与初始值相比,OD值未有显著变化的最小浓度定义为AF1发酵滤液对该菌的最低抑菌浓度。
1.2.4.2 发酵液对耐药金葡菌SA46菌株细胞壁的影响按5%的接种量将对数期的SA46菌分别接种至30 mL液体LB培养基中,分别记作实验组和对照组,按最低抑菌浓度稀释比分别向实验组和对照组中加入10 mL 1.2.1.1制备好的发酵滤液和10 mL无菌水,然后将其在37℃,200 r/min条件下,培养12 h。将实验组和对照组中的SA46菌液,分别取5 mL,经5 000 r/min离心10 min,菌体用生理盐水洗涤1遍,分别加入蒸馏水5 mL,待作用15 min后,终止反应,革兰氏染色,用油镜观察结果。另分别取实验组和对照组中的SA46菌液于5 000 r/min下离心10 min,去上清液,收集菌体于1.5 mL EP管,沿管壁缓慢加入戊二醛固定液,并保持不破坏细菌团块,送至重庆医科大学透镜室处理,切片,观察,拍片。
1.2.4.3 对耐药金葡菌SA46菌株基因组DNA和蛋白质渗漏的影响取对数期的SA46菌液10 000 r/min离心10 min,然后用生理盐水洗涤2次,收集菌体。分为实验组和对照组,实验组加入100 μL的AF1发酵滤液后加入300 μL无菌水,使其浓度为MIC,对照组加入400 μL水,每个组作两个平行组,37℃作用90 min后,5 000 r/min离心10 min,取上清液进行0.7%琼脂糖凝胶电泳30 min,观察SA46基因组DNA的渗漏情况。同时,另取上清液中加入2×SDS上样缓冲液,沸水浴15 min,5 000 r/min离心10 min,取上清液进行SDS-PAGE凝胶电泳。实验用浓缩胶浓度为5.0%,分离胶浓度为15%,考马斯亮蓝染色后脱色,观察SA46的蛋白质渗漏情况。
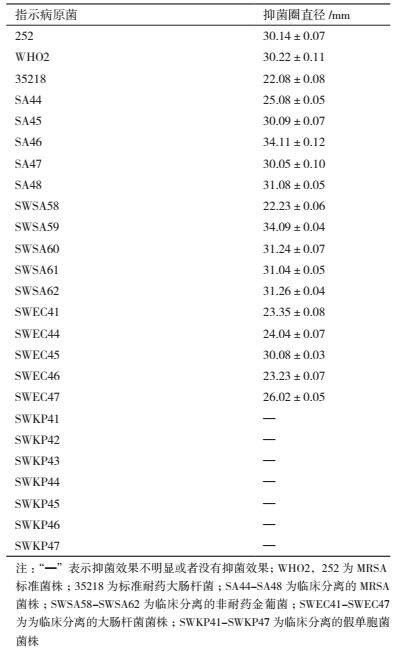
2 结果 2.1 发酵液抗菌谱 2.1.1 发酵液对病原细菌的抗菌活性以不同病原细菌为指示菌、测定发酵液对各病原菌的抑菌圈大小(表 2),发现AF1发酵液不仅对标准耐药金黄色葡萄球菌(MRSA)有较强的抑菌活性,同时对临床MRSA的抑菌作用也很强。对临床大肠杆菌和普通金葡菌均有抑菌作用,但是其对临床的假单胞菌株却没有任何活性。
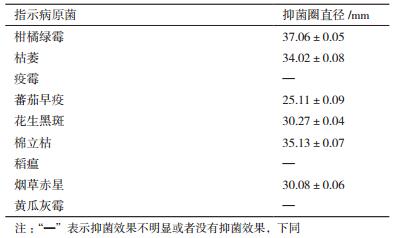
以不同植物病原菌为指示菌,测定发酵液对各病原菌的抑菌圈大小,结果(表 3)表明AF1发酵液对大部分试验菌株有强抑菌活性,特别是柑橘绿霉和棉立枯等菌效果明显。
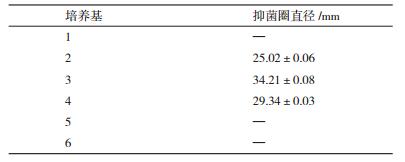
把AF1接种6种不同的培养基进行发酵,以耐药金葡菌SA46为病原指示菌,分别测定每种发酵培养基发酵液的抑菌圈大小,结果如表 4所示。AF1在LB发酵培养基① 中不能产生抗SA46活性物质,同时把发酵培养基中的马铃薯换成淀粉后培养基⑤ 也不能产生抗菌活性,所以肯定马铃薯汁中的某些成分是抗菌化合物的合成的必要成分。另外在发酵培养基中加入NaCl的培养基⑥ 无抗菌活性,可见NaCl的添加抑制了活性化合物的生成。
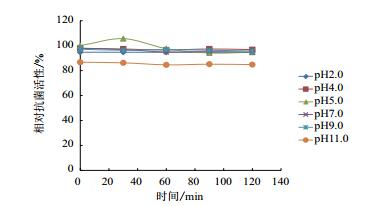
对AF1发酵液抗SA46活性的pH稳定性研究结果(图 1)表明,发酵液在pH 2.0-9.0放置120 min均稳定,抗菌活性保留95%以上,只有pH 11.0活性有所下降,但也保持在85%以上。
|
| 图 1 不同pH值对发酵液活性的影响 |
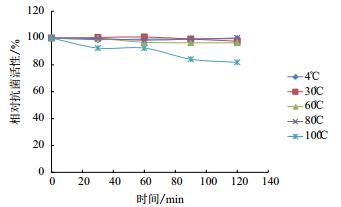
在不同温度下处理AF1发酵液后,测定其抗SA46活性,发现在4-80℃,经过120 min后抗菌活性仍保持95%以上,只有100℃煮沸后,活性有所下降,但也有原活性的80%(图 2)。
|
| 图 2 温度对发酵液活性的影响 |
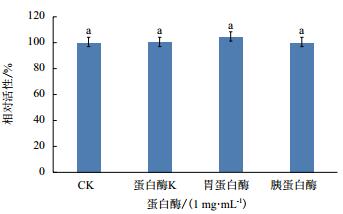
用蛋白酶K处理AF1发酵滤液2 h后,其抗SA46活性保持不变(图 3),可见发酵液中的抗SA46活性物质为非蛋白类化合物,或者化合物中不包含脂族氨基酸和芳香族氨基酸的羧基端肽键;用胃蛋白酶处理AF1发酵上清液后,抑菌活性也没有降低,可见发酵液中的抗菌化合物为非蛋白类化合物,或者其不含疏水残基肽键;用胰蛋白酶处理后,活性也无降低,说明发酵液中的抗菌化合物为非蛋白类化合物,或者不含有赖氨酸、精氨酸。因此,AF1发酵液具有非常好的蛋白酶稳定性。
|
| 图 3 不同蛋白酶对发酵液活性的影响 |
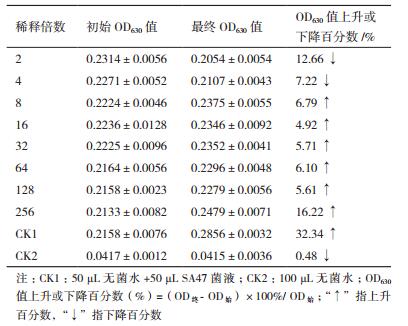
由表 5可知,稀释倍数为2和4的处理组处理6 h后与其初始相比,OD630值有所下降,但从稀释倍数8开始直到256倍,与其初始相比,OD630值开始有所上升,并且随着稀释倍数增加到256时,OD630值上升非常明显,增加了16.22%,而阴性对照CK1上升了32.34%。与初始值相比,把OD630值未有显著变化的最小浓度定义为AF发酵滤液对该菌的最低抑菌浓度,因此选择稀释倍数为4的AF1发酵液浓度为最低抑菌浓度MIC。
通过革兰氏染色镜检观察发现(图 4),不加AF1发酵液处理的正常SA46为紫色葡萄球状,而经AF1发酵液处理后的SA46的菌株,细胞形态由原来的球状变为长杆状,且细胞体积明显增大。由此说明,在AF1发酵液的最低抑菌浓度(MIC)下,SA46菌株细胞壁受到一定程度的破坏。
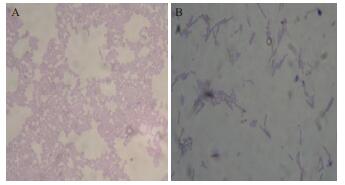
|
| 图 4 MRSA菌株细胞形态 A:MRSA经生理盐水处理后正常细胞形态(×100);B:MRSA经AF1发酵液处理后的细胞形态(×100) |
采用透射电镜法观察,结果(图 5)表明,经AF1发酵液处理后的SA46菌株,出现了一些异形(杆状)菌,并且这些菌的细胞壁出现凹凸不平的松散状,进一步验证了耐药金葡菌SA46在AF1发酵液的作用下,细胞壁受到破坏。
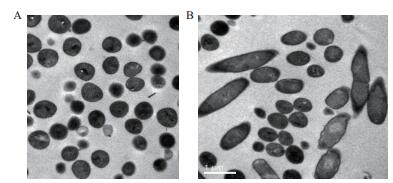
|
| 图 5 SA46菌株透射电镜图 A:MRSA经生理盐水处理后正常细胞形态(×20 000);B:MRSA经AF1发酵液处理后细胞形态(×20 000) |
采用琼脂糖凝胶电泳分析,SA46菌株经MIC浓度下的AF1发酵液作用后的DNA渗漏情况。结果如图 6,用生理盐水处理的对照组SA46和AF1发酵液样品均没有条带出现,而实验组的SA46的DNA条带却很清晰。
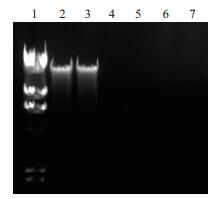
|
| 图 6 用AF1发酵液处理后的SA46的DNA电泳图 1:Marker;2,3:试验组;4,5:对照组;6,7:AF1发酵液 |
SDS-PAGE凝胶电泳(图 7)显示,用MIC浓度的发酵液处理的实验组有大量明显的蛋白质条带,而用生理盐水处理的对照组的SA46却无任何条带出现,而AF1发酵液样品出现少量蛋白质条带。
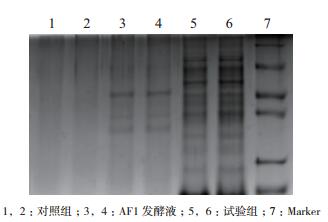
|
| 图 7 用AF1发酵液处理后的SA46蛋白质电泳图 1,2:对照组;3,4:AF1发酵液;5,6:试验组;7:Marker |
综上证明,试验组处理时其细胞壁遭到破坏,导致胞内DNA和蛋白质渗漏。因此,进一步推断AF1发酵液对耐药金葡菌SA46的抗菌机理是破坏病原菌的细胞壁来抑制细胞生长,其具体分子机制还有待进一步研究。
3 讨论目前,对解淀粉芽孢杆菌研究主要集中在生防领域,用于植物病原真菌和细菌的防治[22, 23]。近年来,随着进一步深入研究,其作为食品防腐剂和益生菌开发也在不断受到重视[24, 25]。其抑菌物质主要包括3大类即多肽类、脂肽类及抑菌蛋白类,对植物病原真菌和细菌有较好抑制作用,但并未见文献报道它们对MRSA有抑制作用。除了这3类化合物外,仅有几篇文献报道解淀粉芽孢杆菌还可以产生羊毛硫抗生素[26]、大环内酯类抗生素[27, 28]、酚类化合物[29]及聚酮类抗生素[30]。除聚酮类外,其他3种均有对MRSA有抑制作用的报道。
本实验中初步确定AF1产生的抗耐药金葡菌SA46化合物并不是文献报道的其他3种化合物即羊毛硫抗生素[26]、大环内酯类抗生素[27, 28]和酚类化合物[29]。首先,根据AF1发酵液的抗SA46化合物的pH和热稳定性研究结果表明,其pH和热稳定性都非常好,与文献[25]报道的羊毛硫抗生素相似,但经过发酵培养基筛选实验,我们认为AF1发酵的抗MRSA化合物和文献[25]报道的羊毛硫抗生素不是同一个化合物,因为文献报道的羊毛硫抗生素化合物可以用LB培养基大量发酵生产,而我们的AF1菌经LB发酵以后,发酵液根本就没有抗耐药金葡菌SA46的活性;其次,由于大环内酯类抗生素化学性质不稳定,酸性条件下易发生苷键水解,碱性条件下内酯环易破裂,而根据上述实验结果AF1发酵液在酸性和碱性均较稳定,因此AF1产生的抑菌物质也不是文献所报道的大环内酯类化合物;最后,根据本实验结果,AF1不能用LB培养基发酵产生抗SA46物质,培养基中NaCl的添加将完全抑制抗SA46物质的产生,这与Jeyanthi[29]报道的产生酚类抑菌化合物的培养基添加12%的NaCl有助于提高抗MRSA活性物的产量完全不同。可见,AF1菌产生的抗MRSA活性化合物也并非是文献报道的酚类化合物。因此,初步推断AF1菌发酵的抗MRSA化合物不是现有文献报道的化合物,很可能是一种或多种新化合物。
随着基因组、蛋白质组学和生物信息学迅猛发展和对微生物细胞结构与分子机制的深入认识,抗生素筛选靶点不断涌现,增强了新型抗生素筛选的特异性、安全性和高效性。同时,在细胞壁、蛋白质生物合成和DNA复制与修复过程的传统药物靶点也找到不少新靶点,引起了研究者们的高度兴趣[31],尤其是对细菌细胞壁合成抑制剂的筛选。由于人体细胞无细胞壁,用于临床的抗生素中,抑制细菌细胞壁合成的抗生素有很好的“选择性毒性作用”,即对人体无毒或毒副作用甚微。因此,筛选抑制细胞壁合成的抗生素最具有实用意义。
本实验初步探讨了AF1菌发酵液的抗菌机理,用AF1发酵液处理耐药金葡菌SA46后,无论是对SA46的形态观察,还是对SA46的蛋白质和DNA的渗漏情况检测,均表明SA46经AF1发酵液处理后,其细胞壁遭到破坏。初步推断AF1发酵液对MRSA的抗菌机理是破坏病原菌的细胞壁来抑制细胞生长。此外,AF1菌发酵的抗MRSA化合物很有可能是一种或多种作用于病原菌细胞壁的新化合物,其对人体毒害性较小,具有一定的研究价值。我们将对其抗菌化合物的分离纯化、结构确证以及抗菌分子机制进行进一步的研究。
4 结论经抗菌谱测定表明解淀粉芽孢杆菌AF1发酵液具有广谱抗菌活性,尤其对临床MRSA抗菌活性很强。AF1发酵液稳定性实验表明AF1发酵液具有很好的温度、pH和蛋白酶稳定性。临床耐药金葡菌SA46经AF1发酵液的最低抑菌浓度(MIC)处理后,用显微镜和透射电镜观察,均发现其细胞壁受到不同程度的破坏;同时采用SDS-PAGE和琼脂糖凝胶电泳分析,SA46的DNA和蛋白质发生渗漏。初步推断AF1对MRSA的抗菌机理是破坏病原菌的细胞壁来抑制细胞生长。
| [1] | Marklevitz J, Harris LK. Improved annotations of 23 differentially expressed hypothetical proteins in methicillin resistant S. aureus[J]. Bioinformation, 2017, 13 (4): 104–110. DOI:10.6026/bioinformation |
| [2] | Tickler IA, Goering RV, Mediavilla JR, et al. Continued expansion of USA300-like methicillin-resistant Staphylococcus aureus(MRSA)among hospitalized patients in the United States[J]. Diagn Microbiol Infect Dis, 2017 (in press). |
| [3] | 李海清, 王凤玲, 刘静. 骨外系感染患者金黄色葡萄球菌耐药性分析[J]. 国际检验医学杂志, 2013, 34(13): 1765–1767. DOI:10.3969/j.issn.1673-4130.2013.13.069 |
| [4] | 马翔宇, 易龙, 宋治远. 医源性MRSA感染及其防治研究进展[J]. 临床医学, 2003, 23(5): 53–54. |
| [5] | Ping L, Blair C, Amy S, et al. El-Solh Clinical outcomes of linezolid and vancomycin in patients with nosocomial pneumonia caused by methicillin-resistant Staphylococcus aureus stratified by baseline renal function:a retrospective, cohort analysis[J]. BMC Nephrology, 2017, 18 : 168–177. DOI:10.1186/s12882-017-0581-y |
| [6] | Suresh P, Hiroshi H, Atmika P, et al. Genomic analysis of vancomycin-resistant Staphylococcus aureus VRS3b and its comparison with other VRSA isolates[J]. Drug Discov Ther, 2017, 1 : 1–6. |
| [7] | 赵博, 陈取, 杜志成, 等. 万古霉素、替考拉宁、利奈唑胺、达托霉素对耐甲氧西林金黄色葡萄球菌抗菌活性及药物优弊的研究[J]. 中国实用医药, 2011, 6(18): 242–243. DOI:10.3969/j.issn.1673-7555.2011.18.195 |
| [8] | Darren C, Kenneth C L, Min JY, et al. Duration of prior vancomycin therapy and subsequent daptomycin treatment outcomes in methicillin-resistant Staphylococcus aureus bacteremia[J]. Diagnostic Microbiology and Infectious Disease, 2015, 83 (2): 193–197. DOI:10.1016/j.diagmicrobio.2015.06.003 |
| [9] | Gerson SL, Kaplan SL, Bruss JB, et al. Hematologiceffects of linezolid:Summary of clinical experience[J]. Antimicrob Agents Chemother, 2002, 46 (8): 2723–2726. DOI:10.1128/AAC.46.8.2723-2726.2002 |
| [10] | Rao N, Hamilton CW. Efficacy and safety of linezolid for Gram-positive orthopedic infections:A prospective case series[J]. Diagn Microbiol Infect Dis, 2007, 59 (2): 173–179. DOI:10.1016/j.diagmicrobio.2007.04.006 |
| [11] | Bishop E, Melvani S, Howden BP, et al. Good clinical outcomes but highrates of adverse reactions during linezolidtherapy for serious infection:A proposed protocol for monitoring therapy in complex[J]. Antimicrob Antimicrob Agents Chemother, 2006, 50 (4): 1599–1602. DOI:10.1128/AAC.50.4.1599-1602.2006 |
| [12] | 杨元勋, 李刚, 钱正刚. 利奈唑胺不良反应文献分析[J]. 实用药物与临床, 2013, 16(7): 621–623. |
| [13] | Shahzad R, Khan AL, Bilal S, et al. Plant growth-promoting endophytic bacteria versus pathogenic infections:an example of Bacillus amyloliquefaciens RWL-1 and Fusarium oxysporum f. sp. lycopersici in tomato[J]. Peer J, 2017, 5 : e3107. DOI:10.7717/peerj.3107 |
| [14] | Vinodkumar S, Nakkeeran S, et al. Biocontrol potentials of antimicrobial peptide producing bacillus species:multifaceted antagonists for the management of stem rot of carnation caused by Sclerotinia sclerotiorum[J]. Front Microbiol, 2017, 8 : 446. |
| [15] | Masmoudi F, Ben Khedher S, Kamoun A, et al. Combinatorial effect of mutagenesis and medium component optimization on Bacillus amyloliquefaciens antifungal activity and efficacy in eradicating Botrytis cinerea[J]. Microbiol Res, 2017, 197 : 29–38. DOI:10.1016/j.micres.2017.01.001 |
| [16] | Gotor-Vila A, Teixidó N, Di Francesco A, et al. Antifungal effect of volatile organic compounds produced by Bacillus amyloliquefaciens CPA-8 against fruit pathogen decays of cherry[J]. Food Microbiol, 2017, 64 : 219–225. DOI:10.1016/j.fm.2017.01.006 |
| [17] | 关晓欢, 姜华. 解淀粉芽孢杆菌研究进展[J]. 生物技术世界, 2013(1): 4, 9. |
| [18] | Lee HA, Kim JH. Isolation of Bacillus amyloliquefaciens strains with antifungal activities from Meju[J]. Preventive Nutrition & Food Science, 2012, 17 (1): 64–70. |
| [19] | Ji SH, Paul NC, Deng JH, et al. Biocontrol activity of Bacillus amyloliquefaciens CNU114001 against fungal plant diseases[J]. Mycobiology, 2013, 41 (4): 234–242. DOI:10.5941/MYCO.2013.41.4.234 |
| [20] | 杨艳红, 李世川, 兰世玉, 等. 一株产耐酸性α—淀粉酶菌株的鉴定及其酶学性质研究[J]. 天然产物研究与开发, 2015(9): 1544–1549. |
| [21] | 董文波. 细菌药敏最低抑菌浓度微孔检测板的研制[J]. 中南医学科学杂志, 2000(2): 47–48, 50. |
| [22] | 出晓铭, 林毅雄, 张珅, 等. 生防菌解淀粉芽孢杆菌抗菌蛋白的研究进展[J]. 包装与食品机械, 2014, 32(6): 49–54. |
| [23] | Pretorius D, Van RJ, et al. Enhanced production of antifungal lipo-peptides by Bacillus amyloliquefaciens for biocontrol of postharvest disease[J]. New Biotechnology, 2015, 32 (2): 243–252. DOI:10.1016/j.nbt.2014.12.003 |
| [24] | Kadaikunnan S, Rejiniemon TS, Khaled JM, et al. In-vitro antibacterial, antifungal, antioxidant and functional properties of Bacillus amyloliquefaciens[J]. Annals of Clinical Microbiology and Antimicrobials, 2015, 14 (9): 1–11. |
| [25] | 张娟, 杨彩梅, 曹广添, 等. 解淀粉芽孢杆菌及其作为益生菌的应用[J]. 动物营养学报, 2014, 26(4): 863–867. |
| [26] | Arias AA, Ongena M, Devreese B, et al. Characterization of amylolysin, a novel lantibiotic from Bacillus amyloliquefaciens GA1[J]. PLoS One, 2013, 8 (12): 1–10. |
| [27] | 杨桥, 瀚文菊, 张文俊, 等. 一株新型大环内酯抗生素海洋解淀粉芽孢杆菌的分离鉴定[J]. 中华航海医学与高气压医学杂志, 2009, 16(2): 92–95. |
| [28] | Ravut RR, Jacobt MR, Chent XL, et al. Bacillusin A, antibacterial macrodiolide from Bacillus amyloliquefaciens AP 183[J]. Journal of Natural Products, 2015, 78 (4): 924–928. DOI:10.1021/np500911k |
| [29] | Jeyanthi V, Velusamy P. Anti-methicillin resistant Staphylococcus aureus compound isolation from halophilic Bacillus amyloliquefaciens MHB1 and Determination of its mode of action using electron microscope and flow cytometry analysis[J]. Indian Journal of Microbiology, 2016, 56 (2): 148–157. DOI:10.1007/s12088-016-0566-8 |
| [30] | Arguelles-Arias A, Ongena M, Halimi B, et al. Bacillus amyloliquefaciens GA1 as a source of potent antibiotics and other secondary metabolites for biocontrol of plant pathogens[J]. Microbial Cell Factories, 2009, 8 : 63. DOI:10.1186/1475-2859-8-63 |
| [31] | 谢练武, 李翔, 欧阳永长, 等. 抗生素作用新靶点的发掘策略[J]. 中国抗生素杂志, 2007, 32(11): 641–646. DOI:10.3969/j.issn.1001-8689.2007.11.001 |