葡萄皮薄肉软、水分含量多,营养价值高,深受国内外消费者喜爱[1]。但贮运过程中易受到损伤,引起病原菌入侵导致腐烂,造成巨大经济损失[2, 3]。据报道,每年我国由于采收、包装、贮藏等技术原因,葡萄烂果损失率高达总产量的20%[4]。葡萄灰霉病是葡萄果实采后最大的病害之一[5],目前采用的防治方法多为化学类抗菌剂,但随着灰霉菌抗药性的增强,防效有所下降,加之化学防治对环境和人体健康存在潜在危害,寻找安全、高效的防治方法已势在必行。
生物防治因其低污染、低残留、环境友好、安全性高等明显优于化学防治的优势,已成为果蔬采后病害防治的研究热点,其中拮抗酵母菌具有适应果蔬采后贮藏条件、不产生抗菌素等优势,近20年来生防酵母菌的研究日益受到国内外学者的关注[6]。Wisniewski等[7]认为理想的拮抗酵母菌应满足以下需求:能稳定遗传,对病原菌有广谱抑菌作用,在逆境下能良好生存,对营养物质要求简单,易于配制,对寄主及人体健康无危害等。至今已有多种拮抗酵母菌应用于桃、番茄、葡萄等果蔬病害的防治。如季也蒙毕赤酵母(Pichia guilliermondii)可防治葡萄灰霉病[8]、番茄根腐病[9];季也蒙假丝酵母(Candida guilliermondi)可防治油桃灰霉病、桃灰霉病[10];罗伦隐球酵母(Ctyptoccus laurentii)可防治灰霉病、褐腐病、桃根腐病、樱桃褐腐病[11-12]。研究表明,目前,拮抗酵母的主要抗菌机理包括分泌抗菌素[13]、营养和空间竞争[14-16]、重寄生作用[17, 18]及诱导作用[19]。
本实验菌株为从新疆红提葡萄中筛选出一株内生生防菌株——毕赤酵母G5,前期拮抗实验证明其对葡萄灰霉病有抑制作用。为明晰其拮抗葡萄灰霉病的机理,从拮抗菌对病原菌孢子萌发,拮抗菌与病原菌的营养竞争关系,重寄生作用及诱导酶活性等方面进行研究,旨为生防制剂的开发、研制、使用及提高生物防效等奠定基础。
1 材料与方法 1.1 材料 1.1.1 供试材料与试剂红提葡萄:新疆石河子143团采摘的红提葡萄(Red Grape),大小成熟度一致、颗粒饱满、无病虫害。供试生防菌株:毕赤酵母G5(Pichia),分离自新疆红提葡萄。供试病原菌株:葡萄灰霉菌(Botrytis cinerea),由北京市农林科学院提供。化学试剂均为分析纯,购自天津市富宇精细化工有限公司。
1.1.2 仪器与设备LDZX-30KBS型立式压力蒸汽灭菌器(上海申安医疗器械有限公司);MJX-1500型智能霉菌培养箱(上海博讯实业有限公司);THZ-98型恒温振荡器(太仓市华美生化仪器厂);G560E型通用漩涡混匀器(北京科技有限公司);OLRMPUSCX41型显微镜(北京悦驰恒业仪器科技有限公司);SW-CG-1C V型微生物洁净工作台(苏净集团安泰公司)。
1.1.3 培养基营养琼脂培养基(NA):蛋白胨10 g,牛肉膏3 g,氯化钠5 g,琼脂15 g,pH 7.2,蒸馏水1 000 mL;营养肉汤培养基(NB):蛋白胨10 g,牛肉膏3 g,氯化钠5 g,pH 7.2,蒸馏水1 000 mL;马铃薯葡萄糖琼脂培养基(PDA):马铃薯200 g,葡萄糖20 g,琼脂15 g,蒸馏水1 000 mL。
1.2 方法 1.2.1 拮抗酵母菌发酵液的制备将拮抗酵母菌活化后挑取一环,接种于无菌的NB培养液中,28℃、170 r/min条件下振荡培养48 h,所得菌液即为发酵液。
1.2.2 病原菌孢子悬浮液的制备用接种环在培养好的葡萄灰霉菌试管斜面上刮取适量孢子,转移到0.85%的无菌生理盐水中,用血球计数板计数,并用无菌生理盐水调整至所需浓度,备用。
1.2.3 营养与空间竞争葡萄灰霉菌菌丝生长抑制率的测定:采用生长速率法[20]检测毕赤酵母菌G5对灰霉菌菌丝生长的影响。取毕赤酵母菌G5的发酵液、和空白NB培养液,用无菌水分别稀释至5倍、50倍、500倍系列梯度浓度。然后每个梯度各取1 mL于平皿内,倒入9 mL融化好的无菌PDA培养基,待凝固后在平板中央接种葡萄灰霉病菌菌饼(6 mm),将加入等量无菌水的培养基作为空白对照组,每处理重复3次。25℃培养7 d后测量菌落直径,计算不同浓度的G5发酵液对葡萄灰霉菌菌丝的生长抑制率。

葡萄灰霉菌孢子萌发抑制率的测定:取酵母菌G5的发酵液,用无菌水分别稀释至5倍、50倍、500倍系列梯度浓度。再取葡萄灰霉病菌孢子悬浮液(孢子浓度1×106 CFU/mL)及上述不同浓度供试发酵液各10 μL,滴于凹玻片中,以5%葡萄糖溶液作为对照,混匀后25℃培养,每个处理重复3次,8 h后于光学显微镜下观察孢子萌发及萌发后芽管生长情况。

平板对峙实验:采用平板对峙法[21],同时以单独接种灰霉菌菌饼的平板为对照,25℃培养7 d,测定菌落直径[22]。每组3个,重复3次。
PDA混菌培养:将毕赤酵母菌G5和葡萄灰霉菌孢子分别制成浓度为104 CFU/mL的菌悬液。分别吸取1 mL混合涂布于PDA平板上,25℃培养7 d后观察平板内菌落生长情况。
抑菌圈实验[23]:用无菌打孔器在PDA培养基中心打一个孔,接入毕赤酵母菌,以中心线为轴,毕赤酵母菌两边分别打一个孔接入葡萄灰霉菌。25℃下培养5 d后观察,以不接种毕赤酵母菌的平板为对照,每组3个,重复3次。
1.2.4 重寄生作用将直径6 mm的灰霉菌菌饼放于PDA平板中央,然后等距离3 cm处接毕赤酵母菌,25℃培养7 d,挑取病菌菌落边缘的菌丝置于事先滴有无菌水的载玻片上,压片后在显微镜下观察菌丝形态。以只接灰霉病菌的作对照,每组3个,重复3次。
1.2.5 拮抗酵母菌处理对葡萄果实中酶活性的影响 1.2.5.1 红提葡萄果实的处理与取样将毕赤酵母菌G5和葡萄灰霉菌分别制成108 CFU/mL和106 CFU/mL的菌悬液。选择新鲜饱满无病害的红提葡萄果粒作为试验材料,洗净并吸干多余水分后放入2%次氯酸钠溶液中浸泡2 min,用无菌水清洗2遍,常温晾干,备用。每组40粒。用灭过菌的打孔器在葡萄果实中间部位打一宽3 mm、深4 mm的孔,形成一个伤口,常温下放置2 h自然晾干。将拮抗菌菌悬液分别接入不同组葡萄的伤口中,每孔注入20 μL,以接入20 μL无菌水作为对照组,放置2 h自然晾干后再各接入20 μL病原菌孢子悬浮液,放置2 h自然晾干后置于25℃条件下贮藏。
处理后分别在第1、2、3、4、5天取果实果肉进行相关酶活性的检测。取果肉样品时,应先轻轻刮去果实伤口,取病斑与完好组织交接部位的果肉。
1.2.5.2 拮抗酵母菌处理对葡萄果实中酶活性的影响参照《植物生理生化实验》中所述方法进行酶液的制备[24]。取1 g果肉样品,加入6 mL经4℃预冷的0.05 mol/L磷酸缓冲液(pH 6.8,含1%PVP),在冰浴条件下研磨成匀浆,于4℃,10 000 r/min离心20 min。收集上清液作为粗酶液,置于4℃冰箱中保存备用。
过氧化物酶(POD):采用愈创木酚法[25]。多酚氧化酶(PPO):采用邻苯二酚比色法[26]。苯丙氨酸解氨酶(PAL):参考刘邮洲[27]和申宏波等[28]的方法对葡萄果实的PAL活性进行测定。几丁质酶(CHI):采用DNS法[28-30]。β-1,3-葡聚糖酶(GLU):采用3,5-二硝基水杨酸法[31]。
2 结果 2.1 营养与空间竞争通过对灰霉菌菌丝及其孢子萌发的研究,探讨毕赤酵母菌G5对灰霉菌的抑制效果并判断其拮抗机理是否包含分泌抑菌物质。
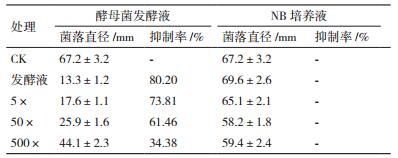
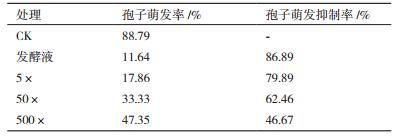
通过表 1、表 2可看出,各梯度浓度的发酵液对葡萄灰霉菌的菌丝生长以及分生孢子的萌发和芽管的生长均有不同程度的抑制作用。对灰霉菌丝的抑制率最高至80.20%,对灰霉孢子抑制率达到86.89%。尽管随着稀释倍数的增大,抑制作用逐渐减弱,但是将发酵液原液浓度稀释500倍时对灰霉菌菌丝仍有34.38%的抑制率,对分生孢子的抑制率达到46.67%。由此可见,拮抗酵母菌对葡萄灰霉孢子的萌发有着明显的抑制作用。
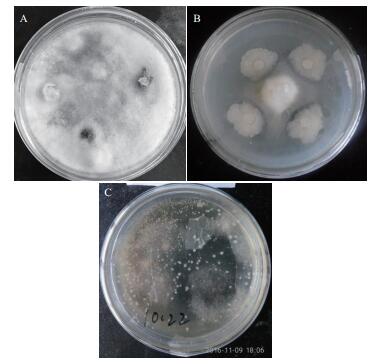
毕赤酵母对葡萄灰霉菌抑制效果明显(图 1),能有效的限制病原菌的生长蔓延。但是在PDA混菌培养过程中两种微生物皆可在培养基上正常生长,两种菌落之间没有明显的交界。可推测,毕赤酵母能通过与病原菌竞争并消耗有限的营养来抑制病原菌生长,但是在营养充分的条件下并不能有效发挥抑制作用。抑菌圈实验中无抑菌圈产生,说明产生抑菌物质并不是毕赤酵母拮抗葡萄灰霉病菌的机理。
|
| 图 1 毕赤酵母菌G5对葡萄灰霉菌的抑制作用 A:对照组;B:毕赤酵母G5拮抗葡萄灰霉菌;C:PDA混菌培养 |
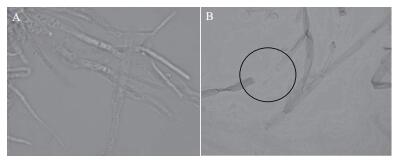
图 2显示,对照组葡萄灰霉菌菌落边缘圆滑而整齐,菌落边缘新生的菌丝比较稀疏,内部的菌丝生长较茂密。实验组葡萄灰霉菌菌落的边缘同对照组一样,圆滑而整齐,但菌丝的生长速度明显变缓,生长量也明显减少,而菌落较对照组厚且密。挑取两组病原菌菌落边缘的菌丝置于显微镜下观察发现,对照组的菌丝粗细均匀、舒展而饱满,而实验组的菌丝则粗细不均匀,部分菌丝有膨大、变形甚至出现断裂的现象,发生了畸变。推测拮抗酵母菌能够向体外分泌胞外水解酶,发生了重寄生现象,导致菌丝变形。
|
| 图 2 毕赤酵母菌G5对葡萄灰霉菌的重寄生作用 A:光学显微镜40倍镜下对照组灰霉菌菌丝形态;B:光学显微镜下10倍镜经毕赤酵母菌G5处理后葡萄灰霉菌的菌丝发生断裂现象 |
图 3是经毕赤酵母菌诱导处理后的红提葡萄果实及对照组的各类活性变化趋势。可以看出,葡萄灰霉菌单独接种的果实与诱导处理后的果实均可使酶活性提升。对照组果实的酶活性在贮藏前期略微上升,上升后活性开始呈下降趋势。而经过处理后的果实酶活性变化趋势大体上与对照组一致,但其酶活性明显始终高于对照组。果实在内生拮抗酵母菌G5的诱导下,POD、PPO、PAL、GLU活性在第2天时达到酶活高峰,分别高于对照组29.32%、27.50%、51.57%、61.72%;CHI活性在第3天达到酶活高峰,高于对照组121%。说明毕赤酵母菌G5可以诱导葡萄果实内酶活性的提升。
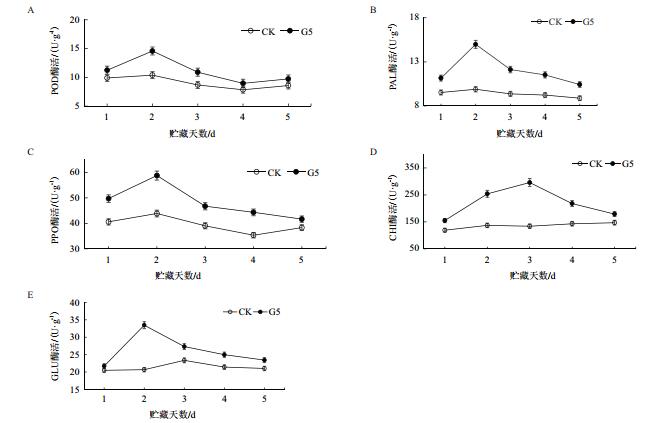
|
| 图 3 贮藏期间红提葡萄果实各种酶活性的变化 A:过氧化物酶活性的变化;B:多酚氧化酶活性的变化;C:苯丙氨酸解氨酶活性的变化;D:几丁质酶活性的变化;E:β-1,3-葡聚糖酶活性的变化 |
通过研究毕赤酵母对葡萄灰霉菌菌丝生长的影响、孢子萌发的影响、抑制作用、重寄生作用以及诱导果实酶活性5个方面的实验,初步探讨了酵母菌的拮抗机理。其中,毕赤酵母菌G5对葡萄灰霉菌的菌丝生长、孢子的萌发以及芽管的伸长具有强烈的抑制作用,使其发生形态上的畸变,证明毕赤酵母能有效抑制葡萄灰霉菌的生长。抑制实验发现,毕赤酵母能通过营养竞争拮抗葡萄灰霉菌,但在营养充分的条件下其毕赤酵母不能很好的抑制葡萄灰霉菌的生长。且毕赤酵母不通过分泌抗菌物质对葡萄灰霉菌进行拮抗,抑菌圈实验中并无抑菌圈生成。
过氧化物酶是植物细胞内的重要组成部分,对真菌病原菌孢子的萌发有直接抑制作用,并能诱导宿主植物产生一系列的防卫反应。多酚氧化酶可以催化宿主植物细胞中木质素及醌类物质的形成,构成保护性屏蔽使植物细胞免受病原菌的侵害,从而提高宿主植物的抗性。苯丙氨酸解氨酶是苯丙烷类代谢途径的关键酶,参与植物细胞中木质素与植保素的合成,这二者均可对植物病原菌的入侵形成屏障,增加植物的抗病性。几丁质酶可以催化植物病原真菌细胞壁中的几丁质,使其水解生成N-乙酰葡萄糖胺,从而抑制植物病原真菌的生长,提高宿主植物抗病的能力。β-1,3-葡聚糖酶是植物过敏反应中合成的重要酶类,可以催化分解植物病原真菌菌丝尖端裸露的β-1,3-葡聚糖,使菌丝壁降解,从而使植物免受病原真菌的侵害。Droby等[32]研究发现假丝酵母在拮抗葡萄采后青霉菌过程中,可以使几丁质酶和β-1,3-葡聚糖的活性提升,进而诱导宿主产生抗性。Ippllito等[33]发现拮抗酵母菌可以诱导苹果中几丁质酶、β-1,3-葡聚糖酶和过氧化物酶活性的增加。已有研究表明拮抗酵母菌可以提高酶的活性,从而诱导宿主产生抗性[34]。本研究中关于酶的结论与前人研究结果基本一致。
4 结论分离自红提葡萄表面的内生拮抗毕赤酵母菌G5拮抗葡萄灰霉病的主要机理包括营养竞争、诱导抗性,是否发生重寄生作用还需要进一步实验去证明。该菌株在拮抗过程中可以有效抑制葡萄灰霉孢子、菌丝的萌发和生长,提高葡萄果实内酶的活性。
| [1] | 黄琼. 鲜食葡萄生产现状与发展趋势[J]. 现代农业科技, 2015(17): 132, 135. |
| [2] | 秦丹, 石雪晖, 林亲录, 等. 葡萄采后病害生物防治研究进展[J]. 食品与机械, 2007, 23(6): 142–144. |
| [3] | Zhang H, Zheng X, et al. Effect of yeast antagonist in combination with hot water dips on postharvest Rhizopus rot of strawberries[J]. Journal of Food Engineering, 2007, 78 (1): 281–287. DOI:10.1016/j.jfoodeng.2005.09.027 |
| [4] | 李强, 张红印, 等. 一株生防酵母菌的筛选鉴定及对葡萄采后病害的生防效果[J]. 食品工业科技, 2014, 35(14): 182–185. |
| [5] | 宋开艳. 葡萄采后病害病原菌致病特点及拮抗菌的筛选[D]. 阿拉尔: 塔里木大学, 2011. http://cdmd.cnki.com.cn/Article/CDMD-10757-1011079351.htm |
| [6] | 王友升. 拮抗酵母菌与果蔬菜后病害防治[M]. 北京: 知识产权出版社, 2012: 8-12. |
| [7] | Wisniewski ME, Wilson CL. Biological control of postharvest diseases of fruits and vegetables:recent advances[J]. HortScience, 1992, 27 (2): 94–98. |
| [8] | 秦丹. 生防制剂在葡萄保鲜中的应用与抑菌机理研究[D]. 长沙: 湖南农业大学, 2007. http://cdmd.cnki.com.cn/article/cdmd-10537-2008048472.htm |
| [9] | Zhao Y, Tu K, Shao X, et al. Effects of the yeast Pichia guilliermo-ndii against Rhizopus nigricans on tomato fruit[J]. Postharvest Biology and Technology, 2008, 49 (1): 113–120. DOI:10.1016/j.postharvbio.2008.01.001 |
| [10] | Tian SP, Fan Q, et al. Effect of biocontrol antagonists applied in combination with calcium on the control of postharvest diseases in different fruit[J]. Bulletin-OILB/SROP, 2201, 25 (10): 193–196. |
| [11] | Zhang H, Zheng X, Yu T. Biological control of postharvest diseases of peach with Cryptococcus laurentii[J]. Food Control, 2007, 18 (4): 287–291. DOI:10.1016/j.foodcont.2005.10.007 |
| [12] | Yao HJ, Tian SP. Effects of a biocontrol agent and methyl jasmonate on postharvest diseases of peach fruit and the possible mechanisms involved[J]. Journal of Applied Microbiology, 2005, 98 (4): 941–950. DOI:10.1111/jam.2005.98.issue-4 |
| [13] | 姚红杰. 拮抗菌和化学物质的抑病机理及果实抗病相关基因的克隆[D]. 北京: 中国科学院研究生院, 2005. |
| [14] | Filonow AB, Vishniac HS, Anderson JA, et al. Biological control of Botrytis cinerea in apple by yeasts from various habitats and their putative mechanisms of antagonism[J]. Biological control, 1996, 7 (2): 212–220. DOI:10.1006/bcon.1996.0086 |
| [15] | Chalutz E, Ben-Arie R, Droby S, et al. Yeasts as biocontrol agents of postharvest diseases of fruits[J]. Phytoparasitica:Israel journal of plant protection sciences, 1988 . |
| [16] | Saravanakumar D, Ciavorella A, et al. Metschnikowia pulcherrima strain MACH1 outcompetes Botrytis cinerea, Alternaria alternata and Penicillium expansum in apples through iron depletion[J]. Postharvest Biology and Technology, 2008, 49 (1): 121–128. DOI:10.1016/j.postharvbio.2007.11.006 |
| [17] | Arras G. Mode of action of an isolate of Candida famata in biolo-gical control of Penicillium digitatum in orange fruits[J]. Posth-arvest Biology and Technology, 1996, 8 (3): 191–198. DOI:10.1016/0925-5214(95)00071-2 |
| [18] | Fan Q, Tian S, Liu H, et al. Production of β-1, 3-glucanase and chitinase of two biocontrol agents and their possible modes of action[J]. Chinese Science Bulletin, 2002, 47 (4): 292. DOI:10.1360/02tb9070 |
| [19] | Guetsky R, Shtienberg D, et al. Improving biological control by com-bining biocontrol agents each with several mechanisms of disease suppression[J]. Phytopathology, 2002, 92 (9): 976–985. DOI:10.1094/PHYTO.2002.92.9.976 |
| [20] | 洪坚平, 来航线. 应用微生物学[M]. 北京: 中国林业出版社, 2011. |
| [21] | 李雁津, 邱服斌, 陈美娟, 等. 骏枣内生生防细菌的分离, 筛选与鉴定[J]. 微生物学通报, 2011, 38(7): 1031–1035. |
| [22] | 程凯, 江欢欢, 沈标, 等. 棉花黄萎病拮抗菌的筛选及其生物防治效果[J]. 植物营养与肥料学报, 2011, 1: 166–174. DOI:10.11674/zwyf.2011.0123 |
| [23] | 周海莲, 汪敏, 许皎姣, 等. 季也蒙毕赤酵母对草莓采后灰葡萄孢霉的抑制机理[J]. 食品科学, 2011, 32: 6–11. DOI:10.3969/j.issn.1671-1513.2011.01.002 |
| [24] | 王学奎. 植物生理生化试验原理和技术[M]. 北京: 高等教育出版社, 2006: 197. |
| [25] | 陈育红. 大豆种皮过氧化物酶活力的测定方法[J]. 农产品加工.学刊(中), 2013(3): 64–65. |
| [26] | 李合生. 植物生理生化试验原理和技术[M]. 北京: 高等教育出版社, 2000: 198. |
| [27] | 刘邮洲, 张磊, 钱国良, 等. 生防菌sf628对梨叶片苯丙氨酸解氨酶和过氧化物酶活性的影响[J]. 江苏农业学报, 2014(2): 268–274. |
| [28] | 申宏波, 胡志凤, 丁俊杰, 等. Harpins诱导苯丙氨酸解氨酶(PAL)活性防治大豆疫霉根腐病研究[J]. 大豆科学, 2011, 30(3): 526–528. |
| [29] | 苏畅, 夏文水, 姚惠源. 氨基葡萄糖和乙酰氨基葡萄糖的测定方法[J]. 食品工业科技, 2003, 24(6): 74–75. |
| [30] | 朱旭芬, 平装. 基因工程实验指导[M]. 北京: 高等教育出版社, 2010. |
| [31] | 张永勤, 曾凡伟. β-葡聚糖酶活力测定方法的研究进展[J]. 食品科学, 2011, 32(19): 316–320. |
| [32] | Droby S, Vinokur V, et al. Induction of resistance to Penicillium digitatum in grapefruit by the yeast biocontrol agent Candida oleophila[J]. Phytopathology, 2002, 92 (4): 393–399. DOI:10.1094/PHYTO.2002.92.4.393 |
| [33] | Ippolito A, El Ghaouth A, Wilson C L, et al. Control of postharvest decay of apple fruit by Aureobasidium pullulans and induction of defense responses[J]. Postharvest Biology and Technology, 2000, 19 (3): 265–272. DOI:10.1016/S0925-5214(00)00104-6 |
| [34] | 范青, 田世平, 刘海波, 等. 拮抗菌膜醭毕赤酵母和季也蒙假丝酵母产生的β-1, 3-葡聚糖酶和几丁酶对软腐病菌的协同抑制[J]. 科学通报, 2001, 46: 1713–1717. DOI:10.3321/j.issn:0023-074X.2001.20.011 |