2. 中国科学院系统微生物工程重点实验室,天津 300308;
3. 中国科学院天津工业生物技术研究所,天津 300308
2. Key Laboratory of Systems Microbial Biotechnology, Chinese Academy of Sciences, Tianjin 300308;
3. Tianjin Institute of Industrial Biotechnology, Chinese Academy of Sciences, Tianjin 300308
O-乙酰高丝氨酸(O-acetyl-homoserine,OAH)经水解可以产生高丝氨酸,而高丝氨酸可以作为L-高丝氨酸内酯、γ-丁内酯、1,4-丁二醇等平台化合物[1]以及农药草铵膦[2]合成的原料。另外,OAH可以与甲硫醇反应生成蛋氨酸和乙酸[3, 4],是蛋氨酸合成的前体[5]。蛋氨酸广泛用作动物饲料[6, 7]、食品[8]和医药[9]等多种领域,年需求量达160万t[10]。由此可见,OAH是一种具有潜在工业应用价值的前体化合物。
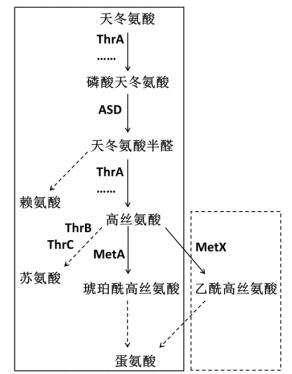
大肠杆菌(Escherichia coli)作为一种化学品生产的模式菌株,具有代谢调控机制研究清晰[11]、遗传操作简便快捷等特点,因此是OAH生产的合适出发菌株。但E. coli菌株并无OAH合成途径,目前也尚无文献报道。一些革兰氏阳性菌株,如谷氨酸棒状杆菌(Corynebacterium glutamicum)中存在由metX基因编码的高丝氨酸乙酰基转移酶(homoserine O-acetyltransferase,MetX),该酶能够将高丝氨酸乙酰化为OAH。如图 1所示,如在E. coli体内中过表达该metX基因则可利用体内存在的高丝氨酸为前体,实现OAH的合成。
|
| 图 1 E. coli及C. glutamicum合成赖氨酸、苏氨酸和蛋氨酸途径 实线方格内为E. coli代谢途径,虚线方格内为C. glutamicum代谢途径;实线箭头代表一步反应,虚线箭头代表多步反应;省略号代表此反应步骤有同工酶存在,同工酶省略;ThrA:天冬氨酸激酶Ⅰ/高丝氨酸脱氢酶Ⅰ,ASD:天冬氨酸半醛脱氢酶,ThrB:高丝氨酸激酶,ThrC:苏氨酸合成酶,MetA:高丝氨酸琥珀酰基转移酶,MetX:高丝氨酸乙酰基转移酶 |
L-高丝氨酸作为合成OAH的重要前体,是实现OAH体内积累的关键。但高丝氨酸同时也是多种氨基酸合成的前体,因此,OAH生产菌株的构建中,旁路氨基酸合成途径的弱化与改造是必须的。如图 1所示,高丝氨酸参与苏氨酸的合成,高丝氨酸上游前体物质天冬氨酸经过天冬氨酸激酶Ⅰ/高丝氨酸脱氢酶Ⅰ(Aspartokinase Ⅰ/homoserine dehydrogenase Ⅰ,ThrA)和天冬氨酸半醛脱氢酶(Aspartate-semialdehyde dehydrogenase,ASD)的作用被转化为高丝氨酸,再经过高丝氨酸激酶(Homoserine kinase,ThrB)和苏氨酸合成酶(Threonine synthase,ThrC)的作用产生苏氨酸。因此,苏氨酸合成途径中的thrB与thrC基因的弱化改造是关键。另外,高丝氨酸的前体天冬氨酸半醛同时是赖氨酸合成的前体,因此,从天冬氨酸半醛到赖氨酸的途径弱化也是必要的。虽然高丝氨酸也可在高丝氨酸琥珀酰基转移酶(Homoserine O-succinyltransferase,MetA)的作用下转化为O-琥珀酰高丝氨酸(O-succinyl-homoserine,OSH),进而合成蛋氨酸,但这与OAH到蛋氨酸合成的目标一致,因此对蛋氨酸合成途径无需改造。
由于OAH合成途径的构建中涉及较为复杂的途径调控的问题,因此选择合适的出发菌株与各关键基因的协同转录调控较为重要。OAH可由L-高丝氨酸乙酰化而来,L-高丝氨酸是E. coli合成苏氨酸的重要中间代谢物,因此苏氨酸产生菌具有被改造用于生产OAH的潜力。由于苏氨酸高产菌体内苏氨酸代谢途径经过优化,赖氨酸途径被弱化,减少了天冬氨酸半醛流向赖氨酸合成途径,可以实现高丝氨酸前体天冬氨酸半醛的积累。通过弱化其体内苏氨酸合成途径中的高丝氨酸下游代谢途径,以及通过过表达thrA提高天冬氨酸半醛转化为高丝氨酸的含量,可以进一步提高胞内高丝氨酸积累量。另一方面,由于OAH的前体物质天冬氨酸半醛和高丝氨酸在胞内的积累会对细胞的生长产生抑制[12],考虑到胞内代谢平衡的问题,因此对thrA和metX表达强度进行调控显得很有必要。
针对上述旁路氨基酸合成途径的改造问题,本研究前期已将自主拥有的一株苏氨酸产生菌E. coli ThrH[13]改造为出发菌株,利用E. coli ThrH自身基因组上的赖氨酸等其他氨基酸合成已弱化的特性,再通过将E. coli ThrH体内含有的一个携带苏氨酸代谢关键酶基因簇thrABC的质粒丢失后,获得无苏氨酸积累的中间菌株E. coli ThrL。在前期研究基础上,本研究将以E. coli ThrL作为出发菌株,通过过表达thrA基因和metX基因来构建OAH的产生菌株,并采用启动子组合对thrA基因和metX基因的协同表达水平进行优化,然后经过发酵测试对一系列OAH产生菌株的发酵性能进行评价比较。
1 材料与方法 1.1 材料 1.1.1 菌株、质粒信息以及引物、启动子序列本研究所用的菌株、质粒、引物与启动子信息见表 1。
PCR产物纯化试剂盒购自北京全式金生物技术有限公司;质粒提取试剂和琼脂糖凝胶DNA回收试剂盒购自天根生化科技(北京)有限公司;一步法无缝克隆试剂盒(ClonExpress®CE Ⅱ)购自南京诺唯赞生物科技公司;限制性内切酶、PCR扩增使用的phusion DNA polymerase购自Thermo Fisher Scientific公司;酵母粉购自英国Oxoid公司;苏氨酸购自索莱宝生物公司;氨苄青霉素,2,4-二硝基氟苯购自Sigma公司;其他试剂均为国产或进口分析纯。
1.1.3 仪器与设备PCR扩增仪(Applied Biosystems);DNA凝胶电泳槽(Baygene);高速冷冻离心机(Sigma);分光光度计及高效液相色谱仪(日本岛津公司);电击转化仪(梅特勒-托利多仪器有限公司);Nano drop(美国Thermo公司);高通量振荡培养箱(INFORS Multitron Pro);24深孔板(常州英德生物有限公司);葡萄糖检测器所用SBA-40D生物传感分析仪(山东省科学院)。
1.1.4 培养基LB培养基成分:胰化蛋白胨10 g/L,酵母提取物5 g/L,NaCl 10 g/L。
发酵培养基成分[1, 14]:葡萄糖50 g/L,(NH4)2SO4 10 g/L,酵母粉(根据需要添加),苏氨酸(根据需要添加),KH2PO4 2 g/L,3-(N-吗啡啉)丙磺酸(MOPS)80 g/L,MgSO4·7H2O 0.5 g/L,FeSO4·5H2O 0.1 g/L,MnSO4·5H2O 0.1 g/L。
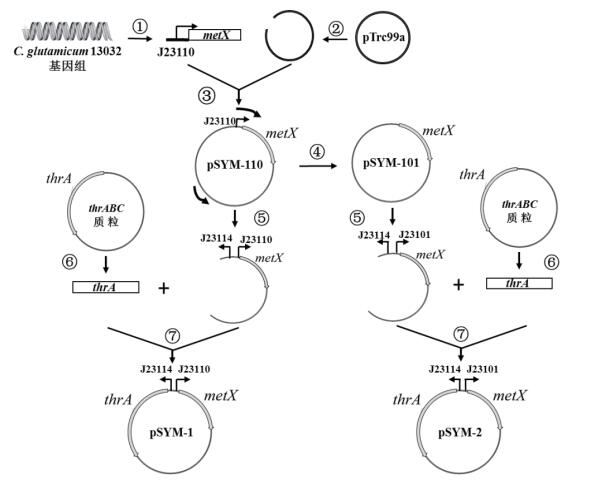
1.2 方法 1.2.1 thrA和metX表达质粒和菌株的构建为了达到协同调节thrA和metX表达强度的目的,构建不同启动子组合的thrA和metX协同表达质粒,流程如图 2。以C. glutamicum 13032基因组为模板,使用引物metX110-F/R扩增出带有J23110启动子的metX片段(步骤①),命名为J23110-metX(其他片段命名规则与此相同);使用pTrc99a-F/R扩增出载体片段步骤②,使用一步法无缝克隆试剂盒将2条片段进行同源重组,获得质粒pSYM-110(步骤③)。以质粒pSYM-110为模板,分别使用引物J23101pTMX-F/R,J23100pTMX-F/R进行PCR扩增,扩增片段使用BamH Ⅰ酶切后自身连接,获得质粒pSYM-101(步骤④)和pSYM-100。分别以质粒pSYM-110、pSYM-101和pSYM-100为模板,分别利用thrA114-F、thrA110-F、thrA101-F和thrA100-F为上游引物,利用ptmx-R为下游引物进行PCR扩增,通过3种模板与4对引物的12种不同组合,获得12种质粒片段,其中启动子J23114分别与J23110-metX、J23101-metX组合的2条片段获得过程如步骤⑤ 所示;以ThrH体内携带的苏氨酸代谢关键酶基因簇thrABC的质粒为模板,使用引物thrA-F/R扩增获得不带有启动子的thrA片段(步骤⑥)。利用一步法无缝克隆试剂盒,分别将这12条片段与不带有启动子的thrA基因进行同源重组,获得表 1中所示pSYM-1到pSYM-12共12种质粒如步骤⑦。
|
| 图 2 部分pSYM系列质粒构建示意图 thrA:天冬氨酸激酶Ⅰ/高丝氨酸脱氢酶Ⅰ基因,metX :高丝氨酸乙酰基转移酶基因;序号表示各个片段和质粒构建步骤;弧形箭头表示引物J23101pTMX-F和J23101pTMX-R |
经过上述方法,将构建的pSYM-1到pSYM-12共12种质粒分别采用电转化方式转化到ThrL中,获得12株菌株,分别命名为:E. coli OAH1、E. coli OAH2、E. coli OAH3、E. coli OAH4、E. coli OAH5、E. coli OAH6、E. coli OAH7、E. coli OAH8、E. coli OAH9、E. coli OAH10、E. coli OAH11和E. coli OAH12。
1.2.2 菌株培养常规的菌株培养在LB培养基中进行,进行发酵培养时,吸取5 μL甘油保存菌株接入到5 mL LB液体培养基过夜培养作为种子液;测量OD600在4-5之间时,按1%接种量进行接种。发酵培养使用24深孔板进行,装液量为500 μL,在高通量震荡摇床中培养,培养温度为37℃,转速为800 r/min,湿度为90%,培养时间为50 h。如菌株携带表 1所示质粒,则培养基中加入终浓度为100 mg/L的氨苄霉素。
1.2.3 培养基优化 1.2.3.1 菌株生长必需氨基酸优化以不含苏氨酸含酵母粉为3 g/L的发酵培养基为基础,分别测定1 g/L的苏氨酸、异亮氨酸和蛋氨酸对菌株生长的影响,每组3个平行。培养50 h后测定菌体生长情况(OD600)。
以不含苏氨酸含酵母粉为3 g/L的发酵培养基为基础,测定菌株生长所需的最适苏氨酸浓度。苏氨酸添加量分别为0、0.5、1、1.5、2、2.5、3、3.5、4、4.5和5 g/L,每组3个平行。培养结束后,检测菌体生长情况(OD600)。
1.2.3.2 菌株发酵产OAH培养基优化首先以含苏氨酸为2 g/L不含酵母粉的发酵培养基为基础,优化酵母粉的浓度,添加量分别为1、2、2.5、3、3.5、4、4.5、5、5.5、6、7和8 g/L,每组3个平行。发酵结束后,检测菌体生长情况(OD600)和上清液中OAH浓度。
其次以不含苏氨酸不含酵母粉的发酵培养基为基础,组合优化苏氨酸和酵母粉的浓度对发酵产OAH的影响,如表 2所示,共16组不同的苏氨酸和酵母粉浓度组合,每组3个平行。发酵50 h后,检测上清液中OAH浓度以及计算葡萄糖转化为OAH的转化率(OAH产量与葡萄糖消耗量的质量百分比)。
取1 mL发酵液于1.5 mL微量离心管中,12 000 r/min离心5 min;取10 μL上清,加入200 μL衍生缓冲液(0.5 mol/L碳酸氢钠溶液)、200 μL衍生剂(含量为1%的2,4-二硝基氟苯乙腈溶液),迅速混匀并置于60℃水浴避光反应1 h;衍生结束后,每个样品体系中再加入390 μL定容缓冲液(50 mmol/L磷酸二氢钾溶于29.1 mmol/L NaOH溶液),定容至800 μL;利用0.22 μm滤膜过滤处理。HPLC检测所用色谱柱为岛津Inertsil® ODS分析色谱柱,柱温箱保持36℃,检测波长360 nm;流动相A相为50 mmol/L无水醋酸钠,冰醋酸调节pH至6.4;B相为50%乙腈溶液。流动相总流量1 mL/min,采用梯度洗脱,A相比例分别为:0 min 16%、0.3 min 16%、4 min 30%、7 min 34%、12 min 43%、22 min 55%、25 min 55%、34 min 98%和35.5 min 16%。
葡萄糖分析方法:采用山东省科学院生产的SBA-40D生物传感器进行检测。
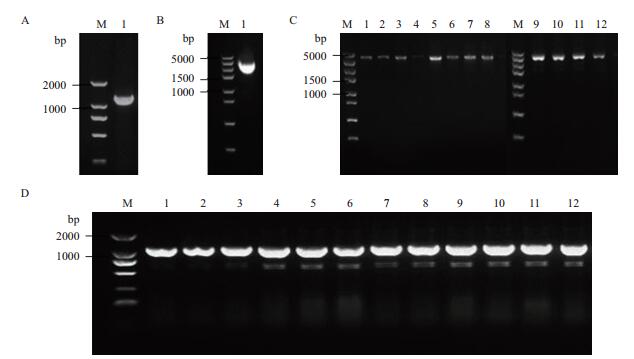
2 结果 2.1 不同thrA和metX表达强度质粒的构建为实现thrA和metX基因表达的组合调控,本实验中利用不同表达强度的启动子J23114、J23110、J23101和J23100(J23110、J23101和J23100启动子强度分别约为J23114的3.3倍、7.0倍和9.9倍,http://parts.igem.org/Part:BBa_J23100),对thrA和metX基因的表达进行了优化。构建的12种组合中thrA基因和metX基因启动子的强度比例最高为3倍(J23100强度/J23110强度,pSYM-10),最低为0.1倍(J23114强度/J23100强度,pSYM-3)。通过PCR扩增获得的J23110-metX片段,PCR结果(图 3-A)显示,片段长度为1 191 bp,目的条带大小与预期正确;PCR扩增获得的thrA基因片段,PCR结果(图 3-B)显示,片段长度为1 819 bp,目的条带大小与预期正确;带有thrA基因的4种启动子J23114、J23110、J23101、J23100分别与J23110-metX、J23101-metX、J23100-metX组合的12条片段PCR结果(图 3-C)显示,长度为3 579 bp,目的条带大小与预期正确。构建获得的12种质粒分别利用引物testptmx-F和testptmx-R进行PCR扩增,理论上PCR产物长度为1 120 bp,扩增出的产物通过琼脂糖凝胶电泳验证大小正确(图 3-D),进一步通过DNA测序进行了证实。最终获得的12个启动子组合质粒命名如表 1中质粒pSYM-1至pSYM-12所示。
|
| 图 3 pSYM系列质粒构建过程中相关电泳验证结果 A:metX基因片段使用引物metX-F/R PCR扩增结果,M:Trans 2K DNA marker,1:metX基因片段。B:thrA基因片段使用引物thrAF/R PCR扩增结果,M:Trans 5K DNA marker,1:thrA基因片段。C:12种启动子组合片段PCR扩增结果,M:Trans 5K DNA marker,1-4:分别带有thrA 4个启动子的J23110-metX片段,5-8:分别带有thrA 4个启动子的J23101-metX片段,9-12:分别带有thrA 4个启动子的J23100-metX片段。D:12个启动子组合质粒转化子菌落PCR验证结果,M:Trans 2K DNA marker,1-12:pSYM-1至pSYM-12转化子 |
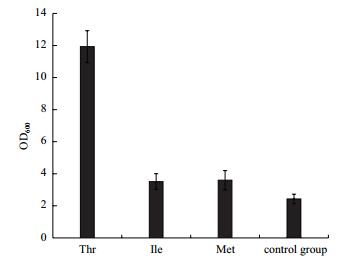
利用E.coli OAH9菌株测试了苏氨酸、异亮氨酸和蛋氨酸对其生长的影响。结果显示,培养50 h后OD600,如图 4所示,不添加任何氨基酸的对照组的OD600为2.43,添加异亮氨酸和蛋氨酸组中,菌株E.coli OAH9的OD600分别为3.51和3.60,而添加苏氨酸后菌株OD600显著提高为11.93。
|
| 图 4 菌株E. coli OAH9在含有不同氨基酸的发酵培养基中的生长 |
不同浓度的苏氨酸对菌株生长的影响,其结果如图 5所示。随着苏氨酸浓度从0 g/L到2 g/L逐渐升高,OD600也逐渐增加,苏氨酸浓度为2 g/L时达到最大,继续增加苏氨酸浓度,反而OD600有下降趋势。说明2 g/L的苏氨酸添加到发酵培养基中能够满足菌株的生长需求。

|
| 图 5 菌株E. coli OAH9在含有不同浓度的苏氨酸发酵培养基中的生长 |
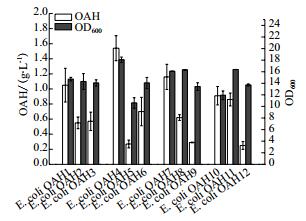
为了对12株不同thrA和metX基因表达强度的E. coli OAH菌株产OAH的能力进行评价,利用含有3 g/L酵母粉和2 g/L苏氨酸的发酵培养基发酵50 h后,检测发酵液OD600和OAH含量,结果如图 6所示。结果显示,E. coli OAH5的OD600最低(10.60),E. coli OAH4的OD600最高(18.07),可见thrA和metX基因的表达强度对菌株的生长具有明显的影响。但是菌株的生长和产OAH的能力却不呈现正相关,如E. coli OAH9与E. coli OAH12的OD600分别为13.43和13.71,生长水平相当,两者OAH的产量分别为0.66 g/L和0.19 g/L,前者OAH产量约为后者3.5倍。基本上,当thrA表达强度固定时,OAH的产量随metX的表达增强呈下降趋势。当thrA基因的启动子为J23110,metX基因的启动子为J23110时,即菌株E. coli OAH4产OAH的能力最强,产量为1.54 g/L,是产量最低的菌株E. coli OAH12的5倍。
|
| 图 6 不同thrA和metX表达强度的E.coli OAH菌株生长和产OAH情况 |
为了考察酵母粉浓度对菌株合成OAH的影响,利用含有2 g/L苏氨酸的发酵培养基,检测E. coli OAH4在不同酵母粉浓度条件下发酵产OAH的情况。分别检测发酵终点时的OAH含量和葡萄糖转化为OAH的转化率,结果如图 7所示。酵母粉浓度为1 g/L时菌株OD600为3.63,OAH产量为0.32 g/L,可见此时菌株无法正常生长。浓度处于2 g/L-5.5 g/L之间时,OAH产量处于1.2 g/L-1.4 g/L之间,转化率处于2.49%-2.69%之间,OAH产量和转化率基本没有差别。酵母粉浓度增加到6 g/L时,OAH产量提高到1.92 g/L,转化率提高到3.85%,随着酵母粉浓度增加,OAH与转化率并未提升,反而有不利影响。因此,在发酵培养基中,苏氨酸为2 g/L酵母粉的浓度为6 g/L时对于菌株E. coli OAH4产OAH最有利。

|
| 图 7 菌株E. coli OAH4在不同酵母粉浓度的发酵培养基中生长及产OAH情况 空白柱代表OAH产量;浅灰柱代表转化率;黑色柱代表OD600 |
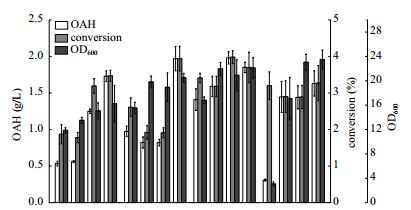
测试了不同的苏氨酸和酵母粉浓度组合(表 2)对E. coli OAH4发酵产OAH的影响,结果如图 8所示。在苏氨酸浓度固定时,随着酵母粉浓度的增加,OAH产量、OD600和转化率基本呈现出上升趋势。其中苏氨酸2.5 g/L,酵母粉1 g/L时,OD600为3.07,此时菌株无法正常生长。另外,苏氨酸浓度为1 g/L时,酵母粉从3 g/L增加至7 g/L时OAH产量、OD600及转化率均无明显变化,当酵母粉浓度增加至9 g/L时三者才显著增加。而苏氨酸浓度为2 g/L时,OAH产量在1.41 g/L至1.98 g/L范围类,与其他组相比,该组酵母粉含量变化对OAH的产量变化影响更小,此时酵母粉为6 g/L时,OAH产量为1.98 g/L,转化率为3.98%,均为最高水平。确定苏氨酸为2 g/L,酵母粉为6 g/L为发酵培养基最佳组合方式。
|
| 图 8 菌株E. coli OAH4在不同苏氨酸和酵母粉浓度的发酵培养基中生长及产OAH情况 空白柱代表OAH产量;浅灰柱代表转化率;深灰柱代表OD600。1-16序号代表不同苏氨酸和酵母粉组合浓度下发酵产OAH、转化率和生长情况。1-4:苏氨酸0.5 g/L条件下,酵母粉依次为4 g/L、6 g/L、8 g/L和10 g/L;5-8:苏氨酸1 g/L条件下,酵母粉依次为3 g/L、5 g/L、7 g/L和9 g/L;9-12:苏氨酸2 g/L条件下,酵母粉依次为2 g/L、4 g/L、6 g/L和8 g/L;13-16:苏氨酸2.5 g/L条件下,酵母粉依次为1 g/L、3 g/L、5 g/L和7 g/L |
本研究中thrA和metX基因的表达强度对E. coli OAH系列菌株产OAH的水平起着重要影响。在出发菌株ThrL中过表达thrA,可以使菌株获得生产高丝氨酸的能力,进一步引入C. glutamicum来源的metX后,可以将高丝氨酸乙酰化生成OAH。然而,高丝氨酸同时也是菌株生长所需的多种氨基酸代谢途径中的前体物质[15-18],在胞内的含量水平会对菌株生长及OAH的生产造成影响;另外,由于ThrH的苏氨酸代谢途径得到过优化,可以推测改造自ThrH的ThrL体内代谢葡萄糖生成天冬氨酸半醛的速度较快,而中间物天冬氨酸半醛和高丝氨酸对菌株具有潜在的毒性[12],大量积累对菌株生理造成影响。考虑到以上两点,调节thrA和metX的表达强度以改善菌株的代谢、生长以及提高OAH的产量显得很有必要,在此之前也没有利用E. coli生产OAH的详细报道,可以借鉴的经验较少。因此,改造ThrL生产OAH也面临很大挑战。
在遗传操作系统中,启动子是一个重要的调控转录元件,可以实现关键酶的精确表达。已有研究证明,代谢途径中关键酶基因的过强表达会对菌株的生长产生抑制或由于代谢物的积累带来的毒性作用[19, 20],相关研究采用了强度不同的启动子对代谢途径中多个基因的表达进行调节,从而对菌株的生长及目标产物的产量起到了调节作用[21, 22]。本研究通过启动子组合实现thrA和metX的表达调节,启动子本身的强度相差将近10倍,12种组合中thrA基因和metX基因启动子强度比例变化范围为0.1-3之间,强度跨度较大,能够对OAH的合成途径进行一定浮动范围内的调控。对12种组合表达的菌株进行发酵测试发现,菌株E. coli OAH4的OAH产量最高(1.54 g/L),是最低产量菌株的5倍,推测代谢过程中高丝氨酸积累程度和高丝氨酸乙酰化程度是影响菌株生长和生产的重要因素,充分说明了调节thrA和metX的表达强度对于OAH的合成具有重要影响,合适的thrA和metX表达强度可以提高OAH的产量。
苏氨酸是E. coli OAH系列菌株合成OAH的必需营养因子。出发菌ThrL改造自苏氨酸产生菌ThrH,实验结果显示,E. coli OAH系列菌株需要外源添加苏氨酸以维持正常生长,推测其基因组上苏氨酸代谢途径中thrB和thrC可能发生了一些复杂突变使其丧失了合成能够维持自身生长所需的苏氨酸的能力。构建产OAH的E. coli的改造重点是使高丝氨酸代谢生成OAH,在一定程度上也导致了高丝氨酸流向苏氨酸的流量减少。由于OAH产生菌只是在ThrL的基础上进一步实现了thrA和metX的协同表达,没有针对其生长缺乏苏氨酸的现象进行相应改造。因此,对E. coli OAH体内的苏氨酸代谢途径进行改造可能是进一步研究的重点,今后可以通过进一步探索在E. coli OAH体内重新过表达thrB和thrC,对其表达水平以及根据其对OAH代谢途径的影响效果进行不断地调节,使其自身能够合成满足生长所需的苏氨酸。
酵母粉同样是E. coli OAH系列菌株合成OAH的必需营养因子。由于酵母粉含有氨基酸、肽类、维生素、生长因子及微量元素等丰富的营养物质[23],已有研究表明酵母粉与不同浓度的氨基酸混合添加到培养基中会对目标产物合成的代谢途径产生复杂影响从而影响菌株生长状态和产量[24]。针对本研究的OAH产生菌,考察了酵母粉和苏氨酸浓度配比对菌株的生长和OAH产量的影响。实验结果显示,在不含苏氨酸,酵母粉3 g/L时,菌株E. coli OAH9无法生长,可见酵母粉中营养成分及其含有的苏氨酸并不能完全满足菌株生长对苏氨酸的需求。另外,苏氨酸2.5 g/L,酵母粉1 g/L时菌株E. coli OAH4无法正常生长,推测酵母粉中除苏氨酸外的其他营养成分可能对菌株的生长具有重要作用。针对苏氨酸2 g/L,酵母粉6 g/L时OAH产量与转化率最高,确定了该组合为最优配比方式。
对于利用微生物生产工业化学品来说,产物浓度和转化率是两个重要指标[25]。因此,利用这两个指标对苏氨酸和酵母粉添加量进行了评价。优化后,菌株E. coli OAH4的产量从1.54 g/L提高到1.98 g/L,此时转化率也最高(3.98%)。由于菌株代谢本身的复杂性,消耗葡萄糖进行生长时,其葡萄糖有可能被菌体吸收则表现为OD600的增长,有可能转化为OAH则表现为OAH产量提高,也有可能产生大量的副产物或被最终降解为CO2产生能量从而影响转化率。因此,菌株的生长、OAH产量以及OAH转化率三者之间不一定完全关联,本研究中OAH产量和转化率之间并不总是正相关。因此,优化培养基时需要综合考虑产量和转化率指标。
4 结论OAH是一种潜在的重要工业化学品,本文通过启动子组合优化关键酶的基因thrA和metX在E. coli ThrL中的表达,实现了OAH的合成,并通过发酵培养基的初步优化进一步提高了OAH的产量。本研究首次证明了在E. coli中合成OAH的可行性,并通过发酵测试确定了OAH的最优发酵条件。
| [1] | Hong KK, Kim JH, Yoon JH, et al. O-Succinyl-L-homoserine-based C4-chemical production:succinic acid, homoserine lactone, gamma-butyrolactone, gamma-butyrolactone derivatives, and 1, 4-butanediol[J]. Journal of Industrial Microbiology & Biotechnology, 2014, 41 (10): 1517–1524. |
| [2] | 曾凡亮, 王宇, 杜升华, 等. 高丝氨酸的合成研究[J]. 精细化工中间体, 2016, 46(2): 17–21. |
| [3] | Bolten CJ. Towards methionine overproduction in Corynebacterium glutamicum-methanethiol and dimethyldisulfide as reduced sulfur sources[J]. Journal of Microbiology and Biotechnology, 2010, 20 (8): 1196–1203. DOI:10.4014/jmb |
| [4] | CJ-第一制糖株式会社. 使用甲硫醇和二甲硫醚的混合物增加蛋氨酸产率的方法: 中国201080009632. 4[P]. 2014-03-12. |
| [5] | Ferla MP, Patrick WM. Bacterial methionine biosynthesis[J]. Microbiology, 2014, 160 (8): 1571–1584. |
| [6] | 容庭, 陈庄, 何前, 等. 蛋氨酸在肉、蛋鸡生产中的应用研究进展[J]. 饲料博览, 2008, 20(1): 19–22. |
| [7] | 李戍江, 杨开伦, 禚梅, 等. 包被蛋氨酸和赖氨酸对奶牛产奶性能的影响[J]. 草食家畜, 2009, 29(1): 47–49. |
| [8] | Solberg J, Buttery P, Boorman K. Effect of moderate methionine deficiency on food, protein and energy utilization in the chick[J]. British Poultry Science, 1971, 12 (3): 297–304. DOI:10.1080/00071667108415885 |
| [9] | Townsend D, Tew K, Tapiero H. Sulfur containing amino acids and human disease[J]. Biomedicine & Pharmacotherapy, 2004, 58 (1): 47–55. |
| [10] | 马桂燕. 2010年蛋氨酸市场回顾及2011年展望[J]. 饲料广角, 2011, 33(2): 13–16. |
| [11] | G uo, A C, Jewison T, Wilson M, et al. ECMDB:the E. coli Metabolome Database[J]. Nucleic Acids Research, 2013, 41 (Database issue): 625–630. |
| [12] | Zakataeva NP, Aleshin VV, Tokmakova IL, et al. The novel transmembrane Escherichia coli proteins involved in the amino acid efflux[J]. Febs Letters, 1999, 452 (3): 228–232. DOI:10.1016/S0014-5793(99)00625-0 |
| [13] | Liu Y, Li Q, Zheng P, et al. Developing a high-throughput screening method for threonine overproduction based on an artificial promoter[J]. Microbial Cell Factories, 2015, 14 : 121. DOI:10.1186/s12934-015-0311-8 |
| [14] | 刘亚男. 苏氨酸高产菌株高通量筛选体系的构建和应用[D]. 天津: 天津科技大学, 2015. |
| [15] | Park J, Lee S. Metabolic pathways and fermentative production of L-aspartate family amino acids[J]. Biotechnology Journal, 2010, 5 (6): 560–577. DOI:10.1002/biot.201000032 |
| [16] | Park J, Oh J, Lee K, et al. Rational design of escherichia coli for L-isoleucine production[J]. Acs Synthetic Biology, 2012, 1 (11): 532–540. DOI:10.1021/sb300071a |
| [17] | Ferla MP, Patrick WM. Bacterial methionine biosynthesis[J]. Microbiology, 2014, 160 (8): 1571–1584. |
| [18] | Velasco AM, Leguina JI, Lazcano A. Molecular evolution of the lysine biosynthetic pathways[J]. Journal of Molecular Evolution, 2002, 55 (4): 445–459. DOI:10.1007/s00239-002-2340-2 |
| [19] | Chao YP, Patnaik R, Roof WD, et al. Control of gluconeogenic growth by pps and pck in Escherichia coli[J]. Journal of Bacteriology, 1993, 175 (21): 6939–6944. DOI:10.1128/jb.175.21.6939-6944.1993 |
| [20] | Zakataeva NP, Aleshin VV, Tokmakova IL, et al. The novel transmembrane Escherichia coli proteins involved in the amino acid efflux[J]. Febs Letters, 1999, 452 (3): 228–232. DOI:10.1016/S0014-5793(99)00625-0 |
| [21] | Lu C, Jeffries T. Shuffling of promoters for multiple genes to optimize xylose fermentation in an engineered Saccharomyces cerevisiae strain[J]. Applied & Environmental Microbiology, 2007, 73 (19): 6072–6077. |
| [22] | 唐玮, 李键, 陈军, 等. 大肠杆菌异源生产丁醇途径组装及启动子优化[J]. 生物工程学报, 2012, 28(11): 1328–1336. |
| [23] | 王宁宁, 吴振, 江建梅, 等. 酵母粉有机氮源及其在发酵行业的应用[J]. 产业与科技论坛, 2014, 13(2): 69–70. |
| [24] | 司马迎春. 酵母粉的作用及氮源对Bacillus subtilis 24/pMX45核黄素发酵的影响[D]. 天津: 天津大学, 2004. http://d.wanfangdata.com.cn/Thesis/Y849973 |
| [25] | Wang Y, Li Q, Zheng P, et al. Evolving the L-lysine high-producing strain of Escherichia coli using a newly developed high-throughput screening method[J]. Journal of Industrial Microbiology & Biotechnology, 2016, 43 (9): 1–9. |






